七味通痹口服液对类风湿性关节炎模型大鼠肠道菌群的调节作用
2024-03-25童孝宇王佳佳陈夏霖李吉峰章晨峰王振中
童孝宇,高 霞,2#,王佳佳,2,陈夏霖,2*,唐 明,曹 亮,2,李吉峰,3,章晨峰,王振中,2,肖 伟,2*
(1.江苏康缘药业股份有限公司,中药制药过程控制与智能制造技术全国重点实验室,江苏 连云港 222001; 2.南京中医药大学,江苏 南京 210000; 3.江苏康缘阳光药业有限公司,江苏 南京 210046)
类风湿性关节炎(rheumatoid arthritis,RA) 是一种常见的全身性慢性免疫疾病,其损害性主要由关节滑膜炎症和血管翳形成引起,从而引发关节软骨、软骨下骨和韧带等损伤,最终导致关节变形、僵直和功能丧失[1-2]。目前RA 的发病仍未被明确,遗传因素、环境因素和免疫因素可能是其主要发病机制[3-5]。随着16S 核糖体RNA (16S ribosomal RNA,16S rRNA) 高通量检测技术的发展,肠道菌群作为影响类风湿性关节炎的重要因素之一,也逐渐被研究者们重视。研究表明,肠道微生物组对类风湿性关节炎、银屑病关节炎和脊柱关节炎疾病的产生和治疗存在一定影响[6]; 同时另一项报道表明,某些肠道菌群的存在可能影响自身免疫系统的功能,诱导炎症细胞分化,分泌炎症因子[7-8],从而可能影响对自身免疫性疾病的易感性。七味通痹口服液是由蚂蚁、青风藤、鸡血藤、鹿衔草、石楠藤、千年健和威灵仙提炼制成的口服液,是临床上有效治疗肝肾亏虚、风湿阻络引起的类风性关节炎的中药复方口服液[9-10]。本研究旨在探讨七味通痹口服液对类风湿性关节炎大鼠肠道菌群的影响,为基于肠道菌群治疗类风湿性关节炎提供理论依据。
1 材料
1.1 试剂与药物 七味通痹口服液(批号20180505) 由江苏康缘阳光药业有限公司提供。完全弗氏佐剂(complete Frund’s adjuvant,CFA,货号F5881)、不完全弗氏佐剂(incomplete Frund’s adjuvant,IFA,货号F5506) 均购自美国Sigma 公司; 牛Ⅱ型胶原(bovine type Ⅱcollagen,CⅡ,批号180559) 购自美国Chondrex 公司; 生理盐水(批号1710240907) 购自华润双鹤药业股份有限公司; 大鼠IL-17F (批号 68214951016)、IL-6 (批号 13314991016)、TNF-α (批号24014931016)、IL-1β (批号115141021016)ELISA 试剂盒均购自武汉博士德生物工程有限公司。
1.2 动物 SD 清洁级大鼠50 只,雌雄各半,体质量约200 g,购自南京市江宁区青龙山动物繁殖场[实验动物生产许可证号SCXK (苏) 2017-0001],饲养于江苏康缘药业股份有限公司[实验动物使用许可证号SYXK (苏) 2018-0026],实验过程符合江苏康缘药业股份有限公司实验动物伦理委员会伦理要求(伦理号2018081403)。
2 方法
2.1 CⅡ-CFA 和CⅡ-IFA 乳剂制备 将牛Ⅱ型胶原溶解于0.1 mol/L 醋酸溶液中,制成4 mg/mL 的溶液,并置于4 ℃冰箱过夜。实验当日使用研钵将CFA 或者IFA 与牛Ⅱ胶原等体积在冰上充分研磨使2 种溶液完全乳化,即得CⅡ-CFA 乳剂和CⅡ-IFA 乳剂,临用前配制。
2.2 模型复制及给药干预 随机选择10 只大鼠作为空白组,其余40 只大鼠用微量注射器于尾根部进行多点皮下注射CⅡ-CFA 乳剂,注射量为0.2 mL。于第1 次刺激7 d 后,在相同部位多点皮下注射CⅡ-IFA 乳剂加强免疫1 次,注射量为0.15 mL[11],建立胶原诱导的关节炎 (collagen induced arthritis,CIA) 模型,距离第1 次免疫2 周后,关节炎评分≥4 分则认为模型建立成功。造模成功的大鼠随机分为模型组和七味通痹口服液低、中、高剂量组,每组6 只,七味通痹口服液低、中、高剂量组大鼠灌胃给予2.7、5.4、10.8 mL/kg 七味通痹口服液,正常组和模型组大鼠灌胃给予等体积生理盐水,连续给药21 d。给药结束后,采集粪便样品,每组随机选取5 个样本进行肠道微生物组学的16S rRNA 基因测序; 末次灌胃给药1 h 后,解剖并获取大鼠左右后足关节滑膜。
2.3 关节炎评价 第1 次免疫第7、11、14、21、28、34天对大鼠关节炎进行评分,检测并记录关节炎分值。采用0~4 级关节评分法,0 分为脚爪正常或无炎症; 1 分为趾关节肿胀或轻度发红; 2 分为趾关节和足跖发红并且肿胀; 3分为踝关节以下的整个脚爪全部发红并且肿胀; 4 分为踝关节严重发红且肿胀,关节有变形迹象。
2.4 足趾容积检测 以第1 次加强免疫当天为第0 天,于第7、11、14、21、28、34 天用大鼠趾体积测量仪测量大鼠左右足跖体积并记录。计算其关节肿胀度,左右关节肿胀度的平均值作为大鼠的足肿胀度。
2.5 ELISA 法检测大鼠关节腔滑膜组织中炎症因子水平 滑膜组织加提取液后匀浆,离心取上清液,适当稀释后,经上样、孵育、洗板、封板,加入各底物显色剂、终止液后上机检测,按标准曲线法计算TNF-α、IL-17F、IL-6 及IL-1β 水平。
2.6 肠道微生物组学的16S rRNA 基因测序 大鼠粪便样品提取的DNA 进行聚合酶链式反应(PCR) 扩增与产物纯化,并进行PCR 产物定量与均一化,构建先导编辑文库,进行测序。测序工作委托上海美吉生物医药科技有限公司完成。基于OTU 聚类分析结果进行多样性指数分析、测序深度的检测,基于分类学信息在各个分类水平上进行群落结构的统计分析。
2.7 统计学分析 通过SPSS 24.0 软件进行处理,数据以(±s) 表示,多组间比较采用单因素方差分析,组间两两比较采用最小显著性差异检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 七味通痹口服液对CIA 大鼠关节炎评分及足肿胀度的影响 与空白组比较,模型组大鼠关节炎评分及足肿胀度水平升高(P<0.05); 与模型组比较,七味通痹口服液高剂量组大鼠在给药1 周后关节炎评分及足肿胀度水平降低(P<0.05),对关节炎严重程度及足肿胀度具有改善效果,见图1。

图1 七味通痹口服液对CIA 大鼠关节炎评分及足肿胀度的影响(±s,n=5~10)
3.2 七味通痹口服液对CIA 大鼠滑膜组织IL-17F、IL-1β、IL-6、TNF-α 水平的影响 与正常组比较,模型组大鼠滑膜组织IL-17F、IL-1β、IL-6、TNF-α 水平升高(P<0.05,P<0.01); 与模型组比较,七味通痹口服液各剂量组大鼠滑膜组织IL-17F、IL-1β、IL-6、TNF-α 水平降低(P<0.05,P<0.01),见图2。结果表明,七味通痹口服液能够调节CIA大鼠体内炎症因子水平,从而发挥良好的疗效。
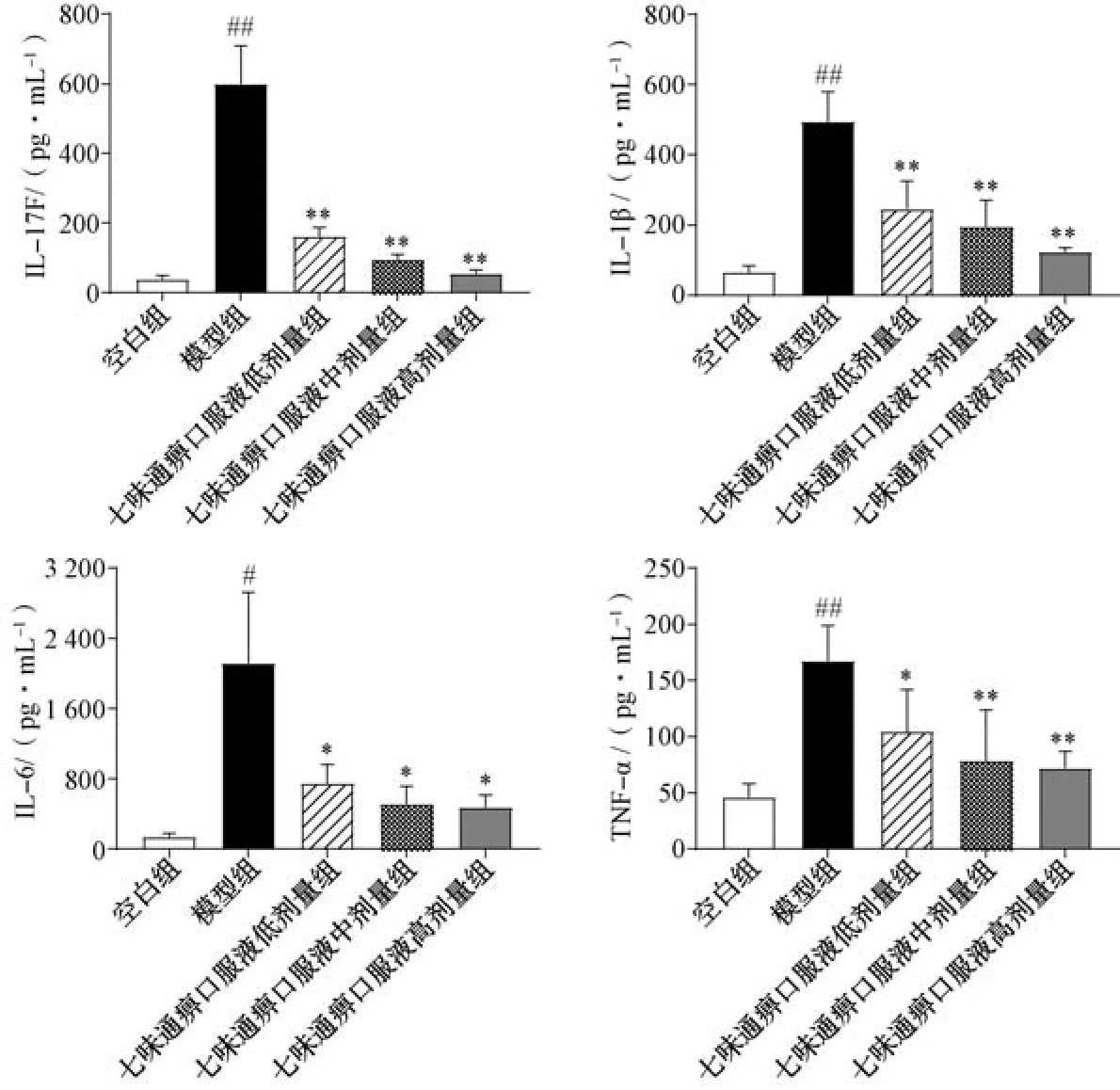
图2 七味通痹口服液对大鼠滑膜组织IL-17F、IL-1β、IL-6、TNF-α 水平的影响(±s,n=5~10)
3.3 七味通痹口服液对CIA 大鼠肠道菌群的影响
3.3.1 肠道菌群稀释曲线和等级丰度线分析 样本的稀释性曲线趋于平缓,表明样本所含OTU 数量趋于稳定,测序数据量合理,见图3a; 各样本Rank-Abundance 曲线的宽度较大且形状较平缓,说明所测样本的物种丰度较高,物种分布均匀,见图3b。

图3 各组大鼠肠道菌群的稀释曲线(a) 及等级丰度线(b) (n=5)
3.3.2 肠道菌群主坐标分析(PCoA) 及偏最小二乘法判别分析(PLS-DA) 在PCoA 分析结果中,各组组间聚合度相对较差,但模型组与空白组分开度较好,七味通痹口服液各剂量组也逐渐趋于正常组,见图4a; 在PLS-DA 分析结果中,空白组与模型组明显分开,七味通痹口服液各剂量组更靠近正常组,说明七味通痹口服液给药后菌群结构与正常大鼠更相近,见图4b。结果表明七味通痹口服液能够改善CIA 大鼠紊乱的肠道菌群结构。

图4 各组大鼠肠道菌群PCoA (a) 和PLS-DA (b) 分析(n=5)
3.3.3 肠道菌群组成分析 在菌门水平上,丰度>0.1%的门有7 个,其中拟杆菌门 (Bacteroidota)、厚壁菌门(Firmicutes)、变形菌门 (Proteobacteria)、脱硫杆菌门(Desulfobacterota)、迷踪菌门(Elusimicrobiota)、蓝藻菌门(Cyanobacteria)、疣微菌门(Verrucomicrobiota) 所占比例大于99%,其中拟杆菌门、厚壁菌门、变形菌门是最为丰富的门,见图5a。厚壁菌门在模型组中最为丰富(丰度58.37%),但其在七味通痹口服液低、中、高剂量组中丰度降低(丰度27.99%、38.86%、42.28%),且逐渐接近空白组(丰度31.92%); 拟杆菌门为模型组中第二丰富的菌门(丰度36.38%),在空白组和七味通痹口服液低、中、高剂量组中丰度为55.14% 及58.83%、47.22%、47.72%;变形菌门在空白组、模型组和七味通痹口服液低、中、高剂量组中的丰度分别为8.31%、0.49%、4.66%、6.77%、2.82%。在菌属水平上,丰度>0.1% 的属有39 个,见图5b。结果表明,七味通痹口服液能够改善CIA 大鼠紊乱的肠道微生物组成。
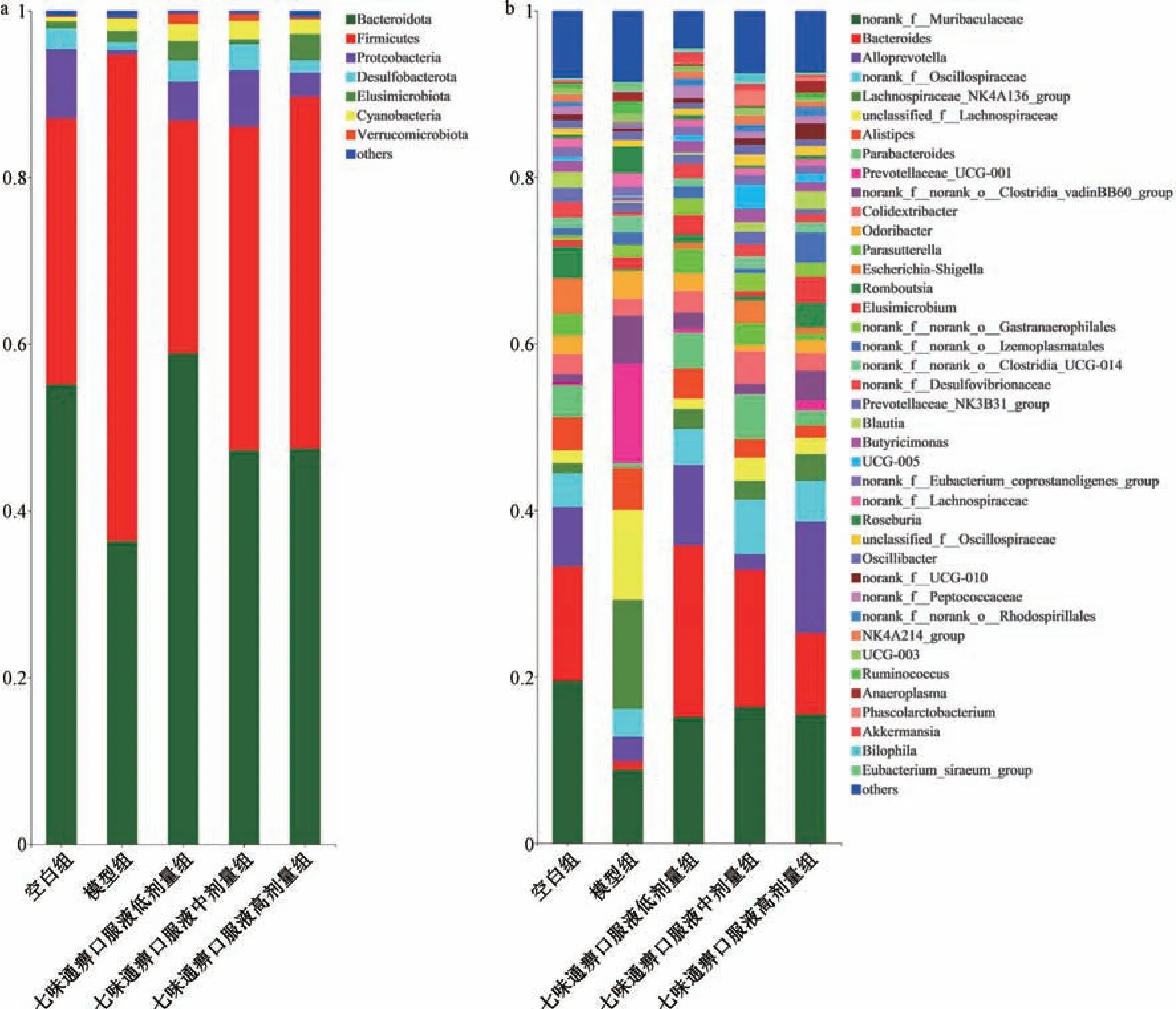
图5 各组大鼠在门水平(a) 和属水平(b) 上的肠道菌群组成(n=5)
3.3.4 肠道菌群的物种差异分析 本研究使用效应大小线性判别分析效应量(LEfSe) 来确定对观察结果影响最大的分类群,将线性判别分析(LDA) 得分大于4 的菌群分类群定义为影响该组的重要物种,在各组样本中共有25 种肠道菌分类群。在属水平上,LEfSe 分析确定了毛螺菌属(Lachnospiraceae) 是模型组大鼠肠道菌群中最重要的分类菌群,普雷沃氏菌属(Prevotellaceae) 和梭状芽孢杆菌属(Clostridia) 是模型组大鼠肠道菌群中主要的分类菌群; 拟杆菌属(Bacteroides) 是七味通痹口服液各剂量组大鼠肠道菌群中重要的分类菌群,见图6。

图6 各组大鼠肠道菌群LEfSe 多级物种层级树图(a) 及LDA 判别柱形图(b) (n=5)
如图7 所示,与空白组比较,模型组大鼠与毛螺菌科相关的2 个菌属Lachnospiraceae_NK4A136_group、unclassified_f_Lachnospiraceae及梭状芽孢杆菌类(norank_f_norank_o_Clostridia_vadinBB60_group)、普雷沃氏菌类(Prevotellaceae_UCG-001) 丰度均升高(P<0.01),拟杆菌属及异拟杆菌属(Parabacteroides) 丰度均降低(P<0.05); 与模型组比较,七味通痹口服液低、中剂量组Lachnospiraceae_NK4A136_group、unclassified_f_Lachnospiraceae及norank_f_norank_o_Clostridia_vadinBB60_group丰度均降低(P<0.05,P<0.01),拟杆菌属及异拟杆菌属丰度均升高(P<0.01),高剂量组Lachnospiraceae_NK4A136_group、unclassified_f_Lachnospiraceae及普雷沃氏菌类丰度降低(P<0.01)。
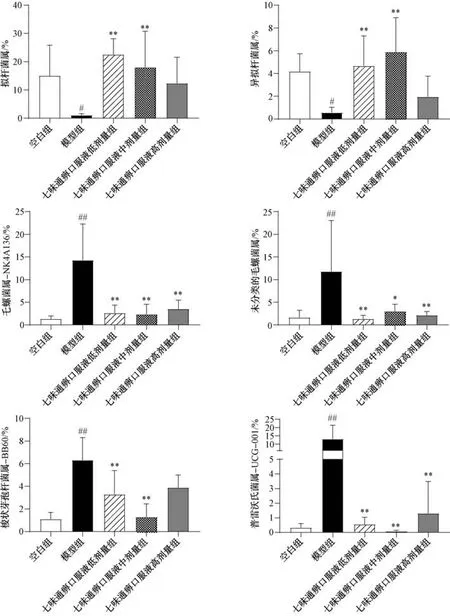
图7 各组大鼠属水平上肠道菌群差异性分析(±s,n=5)
对上述6 种菌属和大鼠炎症因子水平进行Pearson 相关分析,见图8。由此可知,大鼠炎症因子的产生与毛螺菌属、梭状芽孢杆菌属及普雷沃氏菌属的相对丰度呈现正相关性,表明这3 个菌属主要参与了炎症因子的产生; 同时也与拟杆菌属及异拟杆菌属的相对丰度呈现负相关性,表明炎症因子的增加对两者产生了抑制作用。

图8 关键菌属相对丰度与炎症因子水平之间的相关性分析
4 讨论
目前治疗类风湿性关节炎主要使用缓解疾病的抗风湿药物(DMARDS)、非甾体抗炎药(NSAIDs)、糖皮质激素和生物制剂[12-15],这些药物主要作用于RA 的炎症反应和免疫反应,但同时也具有选择性低和相关不良反应的特点,所以开发新的治疗方案成了当下关注的重点。肠道菌群是一个复杂的生态系统,具有极高的细菌密度和多样性[16]。有报道表明,肠道菌群的失调是导致RA 在内的多数免疫性疾病发病的诱因[17-18]; 同时部分肠道菌可诱导细胞因子产生免疫反应,引起肠道炎症[19]。
本研究结果表明,CIA 大鼠给予七味通痹口服液后,大鼠关节炎评分、足肿胀度均降低,表明七味通痹口服液可以缓解类风湿性关节炎所引起的关节损伤; 同时CIA 大鼠关节腔滑膜组织中IL-17F、IL-1β、IL-6、TNF-α 水平升高,这与之前的报道一致[20],在给予七味通痹口服液后,CIA 大鼠关节腔滑膜组织中IL-17F、IL-1β、IL-6、TNF-α 水平降低,表明七味通痹口服液可以有效改善类风湿性关节炎所引起的炎症反应。
本研究肠道菌群分析表明,在门水平上,CIA 大鼠肠道菌群中拟杆菌门和变形菌门丰度水平降低,厚壁菌门丰度水平升高。拟杆菌门和厚壁菌门被认为是类风湿性关节炎主要的相关菌,其中厚壁菌门中链球菌属、芽孢杆菌属及梭菌属由于产生毒素、促进体内炎症形成,被认为是主要的致病菌[17,19,21-22]; 同时毛螺菌科的丰度增加,可能引起其靶向噬菌体的过度增长,导致体内抗环瓜氨酸肽抗体水平提升,从而增加患类风湿性关节炎的风险[23]; 拟杆菌门中拟杆菌属被认为是肠道菌中的益生菌,可以改善类风湿性关节炎引起的肠道损伤和菌群失调[24]。在CIA 大鼠肠道菌群中,拟杆菌属丰度受到抑制,而厚壁菌门中毛螺菌属丰度上升; 七味通痹口服液能使拟杆菌门和变形菌门丰度水平上升,厚壁菌门丰度水平下降,拟杆菌属丰度水平上升,毛螺菌属、梭状芽孢杆菌属及普雷沃氏菌属丰度水平下降,表明七味通痹口服液能够有效抑制致病菌,保护益生菌,从而改善肠道菌群的生态环境。
综上所述,七味通痹口服液可以抑制炎症因子分泌,改善肠道菌群生态环境,有效缓解类风湿性关节炎。
