基于细胞焦亡及中性粒细胞胞外诱捕网探讨刺梨根对溃疡性结肠炎大鼠的影响
2024-03-25晏一平陈云志陈波洋范志梁柴艺汇
晏一平,陈云志,李 倩,陈波洋,范志梁,陈 帅,柴艺汇,秦 忠
(贵州中医药大学,贵州 贵阳 550025)
溃疡性结肠炎(ulcerative colitis,UC) 是一种以反复腹痛、腹泻、脓血便及体质量减轻为主要临床表现的自身免疫性炎症疾病,主要病理表现为结肠炎症和黏膜损伤[1]。我国UC 的患病率急剧上升[2]。UC 发病机制至今尚不明确,可能与遗传易感性、肠黏膜屏障受损、黏膜免疫应答失调和环境因素有关[3]。临床治疗UC 常用药物有氨基水杨酸类、类固醇、免疫抑制剂、生物制剂等,虽能缓解临床症状,但增加了感染和患癌的风险[4]。因此,研究UC 的发病机制和药物开发具有重要意义。
细胞焦亡是近年来发现的一种由炎症小体引发的裂解性程序性细胞死亡形式,在组织稳态及免疫调节中充当重要角色。适度的细胞焦亡可保护机体免受病原体及微生物感染,但其过度激活可引起组织损伤促进炎症反应,在UC 发病机制中发挥重要作用[5-6]。中性粒细胞胞外诱捕网 (neutrophil extracellular traps,NETs) 是中性粒细胞释放其细胞外染色质、核蛋白和丝氨酸蛋白酶形成一种以DNA 为框架的网状纤维结构,其作为一种免疫监管行为,可通过诱捕作用防御病原体感染,但过量的NETs 可导致UC 病理性炎症[7]。研究显示,细胞焦亡可引发NETs 放大炎症反应,NETs 亦可诱导细胞焦亡[8]。可见,细胞焦亡与NETs 相互影响并在UC 的发生发展中起关键作用。
刺梨为蔷薇科蔷薇属植物缫丝花Rosa roxburghiiTratt,是贵州资源丰富的民族药材,其性味甘、酸,归脾、胃、肾经,民间多用于治疗食积腹胀、泄泻、痢疾、肠炎等疾病[9]。刺梨根是刺梨的干燥根茎,现代研究表明刺梨根可有效改善UC 炎症[10]。课题组前期研究发现,刺梨根可通过改善UC 大鼠肠道病理结构起到干预UC 的作用[11],但其对UC 的作用机制是否与调节细胞焦亡及NETs 相关,至今未见明确报道。因此,本研究基于细胞焦亡及NETs 探讨刺梨根干预溃疡性结肠炎的作用机制,以期为刺梨根治疗UC 的临床应用提供实验依据。
1 材料
1.1 动物 SPF 级SD 大鼠48 只(雌雄各半),体质量(200±20) g,购自贵州中医药大学实验动物中心 [实验动物生产许可证号SCXK (黔)2021-0003],饲养于本校实验动物中心SPF 级动物房,温度22~24 ℃,相对湿度40% ~60%。动物实验获得贵州中医药大学伦理委员会批准(伦理号20210101)。
1.2 药物 刺梨根(批号20190501) 购自贵州德昌祥健康管理有限公司,经贵州中医药大学方药教研室蒋志滨副教授鉴定为蔷薇科植物缫丝花Rosa roxburghiiTratt 的干燥根。刺梨根用蒸馏水浸泡0.5 h,武火煮沸后转文火煎煮1 h,过滤,药渣加蒸馏水同法再次煎煮,合并2 次煎煮液,浓缩至生药量0.8 g/mL,置于4 ℃冰箱保存备用。
1.3 试剂 柳氮磺吡啶(批号s129986-25g,上海阿拉丁生化科技股份有限公司); 三硝基苯磺酸(批号P2297,美国Sigma 公司); 粪便隐血定性检测试剂盒(批号206A21,北京雷根生物技术有限公司); 山羊抗兔二抗、消皮素D (gasdermin D,GSDMD) 抗体、髓过氧化物酶(myeloperoxidase,MPO) 抗体 ( 批号 SA00001-2、20770-1-AP、22225-1-AP,武汉三鹰生物技术有限公司); 活化半胱天冬氨酸酶-1 (cysteinyl aspartate specific proteinase 1,caspase-1)、NOD 样受体蛋白 3(NOD-like receptor protein3,NLRP3)、中性粒细胞弹性蛋白酶(neutrophil elastase,NE)、GAPDH 抗体(批号AF5418、DF7438、AF0010、AF7021,美国Affinity 公司); 白细胞介素-1β (interleukin-1β,IL-1β)、IL-18、MPO ELISA 试剂盒 (批号JM-01454R2、JM-01601R2、JM-01744R2,江苏晶美生物科技有限公司)。
1.4 仪器 BMJ-A 型组织包埋机(常州郊区中威电子仪器厂); 转轮式切片机(德国徕卡公司);JT-12S 自动脱水机 (武汉俊杰电子有限公司);PHY-Ⅲ病理组织漂烘仪(常州市中威电子仪器有限公司); LISKANMK3 酶标仪 (美国 Thermo Fisher Scientific 公司); HI650 型离心机(湖南湘仪实验室仪器开发有限公司); DYCZ-24DN 垂直电泳槽(北京六一生物科技有限公司)。
2 方法
2.1 分组、造模与给药 将48 只SD 大鼠(雌雄各半) 适应性喂养1 周后,随机分为正常组(8只) 和造模组(40 只)。造模前大鼠禁食24 h,腹腔注射3%戊巴比妥钠(30 mg/kg) 麻醉后,将三硝基苯磺酸(TNBS) 与0.25 mL 50%乙醇混合溶液(100 mg/kg) 经灌肠软管缓慢注入距大鼠肛门约8 cm 处深的结肠部位,随即倒置5 min,谨防药液流出[12]; 正常组大鼠同法灌注生理盐水。将造模成功的40 只大鼠随机分为模型组、柳氮磺吡啶组(0.3 g/kg) 和刺梨根低、中、高剂量组(2、4、8 g/kg),每组8 只。正常组和模型组均灌胃生理盐水,各给药组灌胃相应剂量药物,每天1 次,连续给药21 d。
2.2 样本采集 末次给药后禁食24 h,大鼠腹腔注射3%戊巴比妥钠(30 mg/kg) 麻醉后,腹主动脉取血,静置0.5 h 后3 000 r/min 离心10 min,分离采集血清,置于-80 ℃冰箱保存备用; 处死大鼠后,取距离肛门(8±2) cm 结肠组织,一部分置于4%多聚甲醛中固定,另一部分置于-80 ℃冰箱保存备用。
2.3 大鼠一般情况观察及疾病活动指数(DAI)评分 每天观察各组大鼠精神状态、毛发光泽、活动体态、大便性状等变化,记录大鼠体质量、大便性状,通过邻联甲苯胺法检测大鼠大便隐血情况(2 min 内显蓝色则提示隐血阳性,根据其颜色深浅判断阳性的强弱,在2 min 内不显色为阴性),根据Okayasu 等[13]报道的评分标准记录各组大鼠疾病活动指数(disease aetivity index,DAI) 得分,DAI 评分标准见表1。

表1 DAI 评分标准Tab.1 DAI scoring standards
2.4 HE 染色观察大鼠结肠组织病理变化 取于4%多聚甲醛中固定的结肠,常规包埋,连续切片,苏木素染色,伊红复染,脱水,透明,封片后于显微镜下观察。
2.5 ELISA 法检测大鼠血清IL-1β、IL-18、MPO水平 取各组大鼠血清,按照ELISA 试剂盒说明书进行操作,检测各组大鼠血清IL-1β、IL-18、MPO 水平。
2.6 免疫组化法检测大鼠结肠组织NE、MPO、caspase-1、NLRP3、GSDMD 蛋白表达 取结肠组织切片,脱腊至水,抗原修复,阻断内源性过氧化物酶,正常血清封闭,一抗4 ℃孵育过夜,次日PBS 洗涤3 次,滴加二抗,37 ℃孵育30 min,PBS洗涤3 次后,复染细胞核,脱水、封片,采集染色切片图像,使用Halo 数据分析系统计算NE、MPO、caspase-1、NLRP3、GSDMD 阳性染色面积占比。
2.7 Western blot 法检测大鼠结肠组织NE、MPO、caspase-1、NLRP3、GSDMD 蛋白表达 取少量结肠组织,剪碎后匀浆,于冰上裂解30 min,离心取上清,BCA 法测定样品蛋白浓度。将提取的蛋白上清与5×蛋白上样缓冲液混匀,于沸水中加热10 min 进行变性。蛋白样品上样后电泳、转膜,加封闭液室温摇床封闭2 h,加入一抗GAPDH (1 ∶1 000)、NE (1 ∶1 000)、caspase-1 (1 ∶1 000)、NLRP3 (1 ∶1 000)、MPO (1 ∶2 000)、GSDMD(1 ∶3 000) 4 ℃孵育过夜,洗膜后加入二抗IgG(1 ∶600) 室温摇床孵育2 h,洗膜3 次,曝光、显影,使用BandScan 软件分析条带灰度值,以GAPDH 为内参计算目的蛋白相对表达。
2.8 统计学分析 通过SPSS 26.0 软件进行处理,数据以(±s) 表示,多组间比较采用单因素方差分析,两两比较采用LSD 检验及Dunnett’s T3 检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 刺梨根对UC 大鼠一般情况的影响 正常组大鼠精神状态正常,活动灵敏,毛发光亮顺滑,大便正常; 模型组大鼠体质量下降,精神萎靡,弓背,活动迟缓,毛发枯燥无光泽,伴有稀便、血便; 与模型组比较,刺梨根中、高剂量组及柳氮磺吡啶组大鼠症状日渐好转,体质量回升,精神状态渐佳、活动增多、毛发色泽渐好、大便成形且未见明显血便。
3.2 刺梨根对UC 大鼠体质量及DAI 评分的影响 给药前,与正常组比较,各造模组大鼠体质量均降低(P<0.01),DAI 评分均升高(P<0.01)。给药21 d 后,与正常组比较,模型组大鼠体质量降低(P<0.01),DAI 评分升高(P<0.01); 与模型组比较,柳氮磺吡啶组和刺梨根中、高剂量组大鼠体质量升高 (P<0.01),DAI 评分降低 (P<0.05,P<0.01),刺梨根低剂量组大鼠体质量升高(P<0.05),DAI 评分无明显变化(P>0.05),见表2~3。
表2 刺梨根对UC 大鼠体质量的影响(g,±s,n=8)Tab.2 Effects of R.roxburghii Radix on body weight of UC rats (g,x ±s,n=8)

表2 刺梨根对UC 大鼠体质量的影响(g,±s,n=8)Tab.2 Effects of R.roxburghii Radix on body weight of UC rats (g,x ±s,n=8)
注: 与正常组比较,**P <0.01; 与模型组比较,#P <0.05,##P<0.01。
组别给药前体质量给药21 d 后体质量正常组210.5±8.38251.13±9.23模型组191.5±10.62**213.88±11.32**柳氮磺吡啶组191.13±13.70**237.25±8.84##刺梨根低剂量组193.13±8.36**224.88±11.31#刺梨根中剂量组193.38±10.34**230.25±6.04##刺梨根高剂量组191.88±17.53**234.38±8.26##
表3 刺梨根对UC 大鼠DAI 评分的影响(分,±s,n=8)Tab.3 Effects of R.roxburghii Radix on DAI score of UC rats (score,±s,n=8)
注: 与正常组比较,**P <0.01; 与模型组比较,#P <0.05,##P<0.01。
组别给药前DAI 评分给药21 d 后DAI 评分正常组00模型组2.29±0.79**1.88±0.25**柳氮磺吡啶组2.42±0.53**0.54±0.18##刺梨根低剂量组2.63±0.74**1.29±0.45刺梨根中剂量组2.62±0.38**0.96±0.49#刺梨根高剂量组2.33±0.53**0.58±0.35##
3.3 刺梨根对UC 大鼠结肠组织病理学的影响正常组大鼠结肠组织黏膜层、黏膜下层、肌层及浆膜层形态结构完整,未见明显病理改变; 模型组大鼠结肠组织黏膜层大面积变性坏死、肠腺结构消失并见大量的纤维组织增生,同时伴有大量炎性细胞浸润并累及黏膜下层、肌层和浆膜层; 柳氮磺吡啶组和刺梨根高剂量组大鼠结肠组织黏膜层、黏膜下层、肌层及浆膜层结构较完整,炎性细胞浸润较模型组明显减少; 刺梨根中剂量组黏膜层局部区域变性坏死,较模型组稍改善,见图1。

图1 刺梨根对UC 大鼠结肠组织病理学变化的影响(HE,×100)Fig.1 Effects of R.roxburghii Radix on histopathological changes of colon in UC rats (HE,×100)
3.4 刺梨根对UC 大鼠血清IL-1β、IL-18、MPO水平的影响 与正常组比较,模型组大鼠血清IL-1β、IL-18、MPO 水平升高(P<0.01); 与模型组比较,柳氮磺吡啶组和刺梨根中、高剂量组大鼠血清IL-1β、IL-18、MPO 水平降低(P<0.01),刺梨根低剂量组大鼠血清IL-1β 水平降低(P<0.01),IL-18、MPO 水平无明显变化(P>0.05),见表4。
表4 刺梨根对UC 大鼠血清IL-1β、IL-18、MPO 水平的影响(pg/mL,±s,n=6)Tab.4 Effects of R.roxburghii Radix on serum IL-1β,IL-18 and MPO levels of UC rats (pg/mL,±s,n=6)
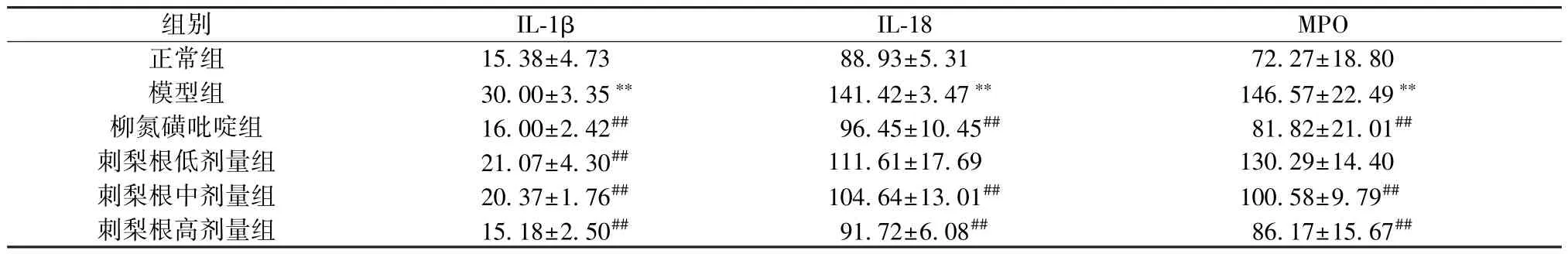
表4 刺梨根对UC 大鼠血清IL-1β、IL-18、MPO 水平的影响(pg/mL,±s,n=6)Tab.4 Effects of R.roxburghii Radix on serum IL-1β,IL-18 and MPO levels of UC rats (pg/mL,±s,n=6)
注: 与正常组比较,**P<0.01; 与模型组比较,##P<0.01。
组别IL-1βIL-18MPO正常组15.38±4.7388.93±5.3172.27±18.80模型组30.00±3.35**141.42±3.47**146.57±22.49**柳氮磺吡啶组16.00±2.42##96.45±10.45##81.82±21.01##刺梨根低剂量组21.07±4.30##111.61±17.69130.29±14.40刺梨根中剂量组20.37±1.76##104.64±13.01##100.58±9.79##刺梨根高剂量组15.18±2.50##91.72±6.08##86.17±15.67##
3.5 刺梨根对UC 大鼠结肠组织NE、MPO、caspase-1、NLRP3、GSDMD 蛋白表达的影响 免疫组化结果显示,与正常组比较,模型组大鼠结肠组织NE、MPO、NLRP3、caspase-1、GSDMD 蛋白表达升高(P<0.01); 与模型组比较,柳氮磺吡啶组和刺梨根中、高剂量组大鼠结肠组织NE、MPO、NLRP3、caspase-1、GSDMD 蛋白表达降低(P<0.01),低剂量组大鼠结肠组织NE、MPO、caspase-1 蛋白表达降低(P<0.05,P<0.01),NLRP3、GSDMD 蛋白表达无明显变化(P>0.05),见图2~6、表5。

图2 刺梨根对UC 大鼠结肠组织NE 蛋白表达的影响(免疫组化,×400)Fig.2 Effects of R.roxburghii Radix on NE protein expression in colon tissue of UC rats (IHC,×400)
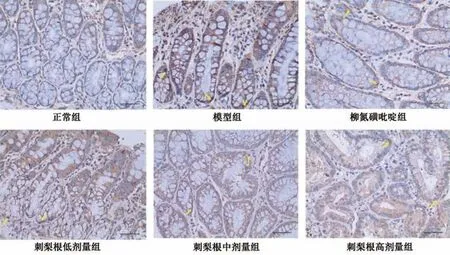
图3 刺梨根对UC 大鼠结肠组织MPO 蛋白表达的影响(免疫组化,×400)Fig.3 Effects of R.roxburghii Radix on MPO protein expression in colon tissue of UC rats (IHC,×400)

图5 刺梨根对UC 大鼠结肠组织NLRP3 蛋白表达的影响(免疫组化,×400)Fig.5 Effects of R.roxburghii Radix on NLRP3 protein expression in colon tissue of UC rats (IHC,×400)

图6 刺梨根对UC 大鼠结肠组织GSDMD 蛋白表达的影响(免疫组化,×400)Fig.6 Effects of R.roxburghii Radix on GSDMD protein expression in colon tissue of UC rats (IHC,×400)
表5 刺梨根对UC 大鼠结肠组织NE、MPO、caspase-1、NLRP3、GSDMD 蛋白阳性染色面积的影响(%,±s,n=3)Tab.5 Effects of R.roxburghii Radix on the positive staining area of NE,MPO,caspase-1,NLRP3 and GSDMD proteins in colon tissue of UC rats (%,±s,n=3)
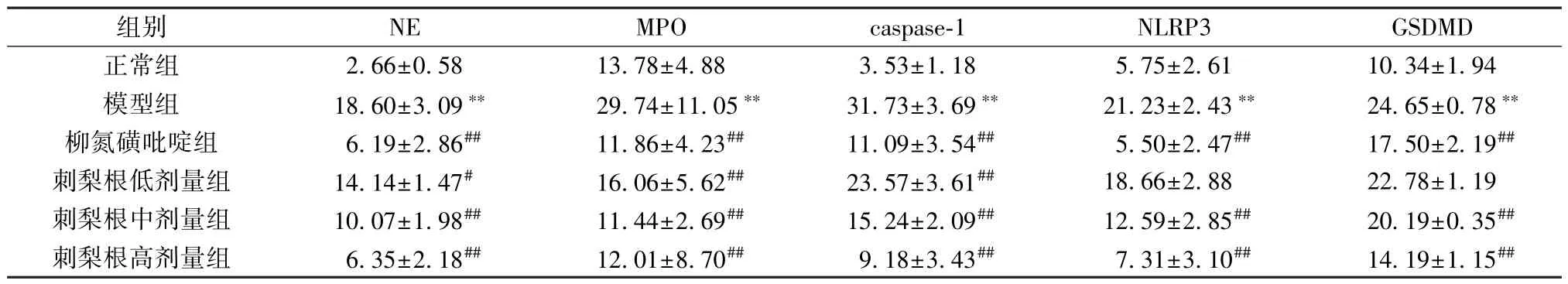
表5 刺梨根对UC 大鼠结肠组织NE、MPO、caspase-1、NLRP3、GSDMD 蛋白阳性染色面积的影响(%,±s,n=3)Tab.5 Effects of R.roxburghii Radix on the positive staining area of NE,MPO,caspase-1,NLRP3 and GSDMD proteins in colon tissue of UC rats (%,±s,n=3)
注: 与正常组比较,**P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别NEMPOcaspase-1NLRP3GSDMD正常组2.66±0.5813.78±4.883.53±1.185.75±2.6110.34±1.94模型组18.60±3.09**29.74±11.05**31.73±3.69**21.23±2.43**24.65±0.78**柳氮磺吡啶组6.19±2.86##11.86±4.23##11.09±3.54##5.50±2.47##17.50±2.19##刺梨根低剂量组14.14±1.47#16.06±5.62##23.57±3.61##18.66±2.8822.78±1.19刺梨根中剂量组10.07±1.98##11.44±2.69##15.24±2.09##12.59±2.85##20.19±0.35##刺梨根高剂量组6.35±2.18##12.01±8.70##9.18±3.43##7.31±3.10##14.19±1.15##
Western blot 结果显示,与正常组比较,模型组大鼠结肠组织NE、MPO、caspase-1、NLRP3、GSDMD 蛋白表达均升高(P<0.01); 与模型组比较,柳氮磺吡啶组及刺梨根中、高剂量组大鼠结肠组织NE、MPO、caspase-1、NLRP3、GSDMD 蛋白表达降低(P<0.05,P<0.01),刺梨根低剂量组大鼠结肠组织MPO、NLRP3 蛋白表达降低(P<0.05,P<0.01),NE、caspase-1、GSDMD 蛋白表达无明显变化(P>0.05),见图7、表6。

图7 各组大鼠结肠组织 NE、MPO、caspase-1、NLRP3、GSDMD 蛋白条带图Fig.7 Protein bands of NE,MPO,caspase-1,NLRP3 and GSDMD in colon tissues of rats in each group
表6 刺梨根对UC 大鼠结肠组织NE、MPO、caspase-1、NLRP3、GSDMD 蛋白表达的影响(±s,n=3)Tab.6 Effects of R.roxburghii Radix on the protein expressions of NE,MPO,caspase-1,NLRP3 and GSDMD in colon tissue of UC rats (±s,n=3)
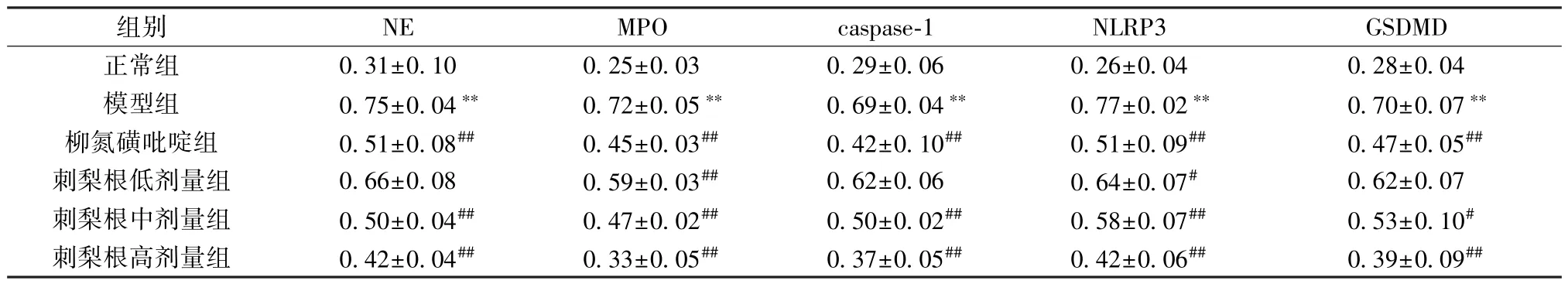
表6 刺梨根对UC 大鼠结肠组织NE、MPO、caspase-1、NLRP3、GSDMD 蛋白表达的影响(±s,n=3)Tab.6 Effects of R.roxburghii Radix on the protein expressions of NE,MPO,caspase-1,NLRP3 and GSDMD in colon tissue of UC rats (±s,n=3)
注: 与正常组比较,**P<0.01; 与模型组比较,#P<0.05,##P<0.01。
组别NEMPOcaspase-1NLRP3GSDMD正常组0.31±0.100.25±0.030.29±0.060.26±0.040.28±0.04模型组0.75±0.04**0.72±0.05**0.69±0.04**0.77±0.02**0.70±0.07**柳氮磺吡啶组0.51±0.08##0.45±0.03##0.42±0.10##0.51±0.09##0.47±0.05##刺梨根低剂量组0.66±0.080.59±0.03##0.62±0.060.64±0.07#0.62±0.07刺梨根中剂量组0.50±0.04##0.47±0.02##0.50±0.02##0.58±0.07##0.53±0.10#刺梨根高剂量组0.42±0.04##0.33±0.05##0.37±0.05##0.42±0.06##0.39±0.09##
4 讨论
UC 病程长、致癌风险高、治愈难度大,严重影响患者生活质量,故寻找高疗效、低不良反应率的药物治疗UC 是关键[14]。本实验基于祖国医学及目前相关研究对刺梨根的认识,发现刺梨根能有效改善UC 大鼠炎症、一般情况、DAI 评分、结肠组织病理情况。
NETs 是中性粒细胞经刺激活化后释放一种以DNA 为骨架,其间镶嵌有NE、MPO 等颗粒蛋白的网状结构[15]。研究发现,UC 中MPO、NE 高表达并与疾病严重程度呈正相关[16]。MPO 是一种主要在中性粒细胞中表达的过氧化物酶,可通过介导肠道炎性反应引发UC 的肠道菌群紊乱,可作为UC疾病活动度的评估指标[17],一定程度上反映UC的炎性反应状态[18]。NE 是中性粒细胞释放的主要炎症蛋白酶,可破坏紧密连接蛋白,损害UC 肠道通透性及肠道屏障功能[19]。本研究显示,UC 大鼠血清MPO 水平及结肠组织MPO、NE 蛋白表达升高,经刺梨根水煎液干预后以上指标降低,说明刺梨根可通过抑制NETs 过表达改善UC 大鼠炎症反应。
细胞焦亡是当机体受到内、外源性物质刺激后诱导形成NLRP3 炎症小体,caspase-1 继而促进IL-1β、IL-18 成熟并切割GSDMD 释放其N 端结构域的一种细胞死亡形式[20]。NLRP3 广泛分布于肠黏膜上皮细胞及巨噬细胞中,是肠道稳态的重要调节因子[21]。临床研究表明,抑制UC 患者结肠组织中NLRP3 活化可有效改善UC 临床表现[22]。GSDMD、caspase-1 可激活并加速IL-1β 与IL-18 的释放[23-24],引发肠道上皮内膜死亡[6]。抑制NLRP3、GSDMD 或caspase-1 除可阻碍NE、MPO释放、减少NETs 形成外[25-26],还能降低炎症结肠组织中MPO、IL-18 水平,减少中性粒细胞浸润,从而缓解肠道炎症改善UC 炎症反应及病理损伤[27-28]。而NE 亦可切割GSDMD 导致细胞膜破裂并释放NETs[29],NETs 激活caspase-1、NLRP3,释放IL-1β 及IL-18 产生自我延续循环,导致NETs与炎症介质加重UC 炎症反应[30]。由此可知,细胞焦亡除与UC 的发病机制密切相关外,还能与NETs 相互协同作用参与UC 的发病机制。本研究显示,UC 大鼠结肠组织 NLRP3、caspase-1、GSDMD 蛋白表达及血清IL-1β、IL-18 水平升高,经刺梨根水煎液干预后以上指标均降低,提示刺梨根可能通过抑制细胞焦亡与NETs 进而减轻UC 炎症反应。
综上所述,刺梨根可通过降低caspase-1、NLRP3、GSDMD 蛋白表达,减少IL-1β、IL-18 炎症因子释放,进而抑制细胞焦亡进展,并减少NETs 中NE、MPO 的生成以改善UC 大鼠炎症反应。本研究结果表明刺梨根在UC 的治疗上具有潜在临床价值,但现阶段对刺梨根干预UC 具体机制的研究方法较为单一,今后将在此基础上对刺梨根治疗UC 的具体分子机制进行深入研究,为刺梨根治疗UC 与进一步开发应用提供实验依据。
