降钙素基因相关肽在偏头痛中的作用及其靶向药物的研究进展
2024-03-25李雪戚微岩徐寒梅胡加亮
李雪,戚微岩,徐寒梅,胡加亮
(中国药科大学 江苏省合成多肽药物发现与评价工程研究中心,江苏 南京 211198)
偏头痛是一种复杂的神经系统性疾病,主要特征为发作性、中重度及单侧或双侧搏动性疼痛,并伴有恶心、呕吐、畏光、畏声等症状。由世界卫生组织推动的全球疾病负担(global burden of disease,GBD)研究的最新结果表明,偏头痛是最具致残性的神经系统疾病之一,也是全球残疾生活年数(years lived with disability,YLDs)的第二大原因[1]。偏头痛的高患病率和高致残率给患者造成了沉重的精神和经济负担。导致偏头痛的原因是多因素且复杂的,同时易受遗传因素和环境因素的影响,其具体机制目前尚未完全阐明。现阶段,对偏头痛的诊断和治疗尚不够充分,可用的药物和非药物的治疗方式只对部分类型的偏头痛有效,因此偏头痛的有效控制仍是目前亟待解决的重要问题。
1 降钙素基因相关肽与偏头痛
1.1 降钙素基因相关肽
降钙素基因相关肽(calcitonin gene related peptide,CGRP)是一种含有37个氨基酸的肽类神经递质,CGRP及其受体广泛分布于中枢神经系统(central nervous system,CNS)和外周神经系统(peripheral nervous system,PNS)[2]。CGRP有2种不同亚型,即αCGRP和βCGRP。其中,αCGRP是CNS和PNS的主要存在形式,而βCGRP主要存在于肠道神经和运动神经系统,且研究相对较少。αCGRP由11号染色体上的CALCA基因编码,在合成加工后储存在感觉神经末梢内致密的核心囊泡中,当神经元去极化后,CGRP通过经典的钙依赖性胞吐作用从神经元末端释放,作用到相应的突触后部位从而发挥生理作用[3]。
起初CGRP被认为是神经系统、肠道和心脏功能相关的潜在物质,随后又发现CGRP在外周血管和脑血管系统均是一种效强的血管扩张剂,这一研究发现也与CGRP的组织定位相关联。大量的基础科学和临床试验研究同样显示,外源性注入CGRP可诱发持久的偏头痛样头疼,表明CGRP在偏头痛发作中起关键作用,是疼痛信号传递的关键神经肽[4]。
1.2 偏头痛的发病机制
偏头痛的产生是复杂且多因素的,在其发病进程中涉及到调节自主神经、情感、认知和感觉功能的皮质、下丘脑、丘脑核和脑干区域及PNS的参与,但其具体的机制尚不完全清楚。在过去几十年的研究历程中出现了许多假说,其中三叉神经-血管反射学说占主导地位。三叉神经-血管系统构成了颅内血管及其三叉神经支配的功能单位,是头痛伤害性事件最主要的来源,也是目前临床前研究与偏头痛药物开发的基础。
1.2.1 偏头痛时外周与中枢神经系统的活动变化在约20% ~ 30%的偏头痛患者中会出现先兆症状,例如疲劳、注意力分散、颈部僵硬疼痛、对光和声音敏感、恶心、视力模糊、打哈欠和脸色苍白等,这些症状最早可能在偏头痛发作前72 h出现,这预示着CNS的早期变化[5]。早期使用正电子发射断层扫描(positron emission tomography,PET)和成像研究发现,脑干、丘脑和下丘脑在偏头痛发作过程中起突出作用。在偏头痛的前兆阶段,下丘脑活动增加,与外侧枕叶皮质有很强的相关性,也称为视觉先兆现象;而由从枕叶皮质扩散来的电波导致了神经元去极化,进而引起了偏头痛的先兆症状;偏头痛的头痛阶段则涉及三叉神经-丘脑上行通路的激活;在偏头痛发作期结束之后,有80%的偏头痛患者会出现后遗症(见图1A)。根据功能成像显示,偏头痛后遗症患者的脑血流普遍减少,但部分枕叶皮质仍持续性血流增加。这些研究表明,丘脑、下丘脑可通过改变与其他脑区的连接,进而改变偏头痛病理生理学区域的活动,可能起到促使偏头痛发生的作用[6]。
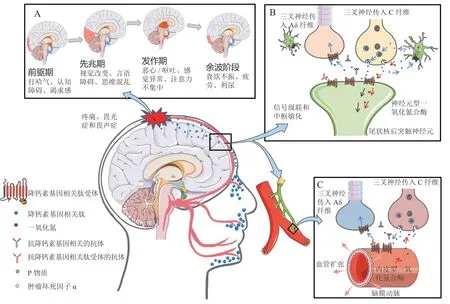
图1 CGRP介导的偏头痛发病机制Figure 1 CGRP-mediated pathogenesis of migraine
如上所述的这些CNS的变化会激活三叉神经-血管系统,将传入神经收到的刺激信号投射到脊髓,并将疼痛感传递到CNS。此外,在上述过程中三叉神经节通过激活血管周围纤维和释放与疼痛产生和血管调节有关的信使分子,如一氧化氮(nitric oxide,NO)、CGRP、5-羟色胺、P物质、神经激肽A、垂体腺苷酸环化酶激活肽(pituitary adenylate cyclase activating polypeptide,PACAP)等,进一步促使偏头痛的发生。
1.2.2 CGRP在三叉神经-血管系统血管细胞中的作用机制在触发偏头痛发作的因素中NO、CGRP均会引起血管状态的变化,例如血管过度扩张。其中,CGRP通过结合血管平滑肌细胞和血管内皮细胞表面的受体来发挥扩张血管的作用(见图1C)。在给偏头痛患者静脉注射CGRP或NO供体硝酸甘油后会刺激内皮依赖性舒张途径,如CGRP可以通过内皮受体发挥作用,导致环磷酸腺苷(cyclic adenosine monophosphate,cAMP)升高和NO的产生,从而引起血管扩张,并且NO将继续扩散到三叉神经末梢,从而诱发偏头痛[7]。然而当内皮细胞缺失时仍会引起血管舒张,这表明CGRP可以直接刺激平滑肌细胞中的腺苷酸环化酶(adenylyl cyclase,AC)以触发cAMP生成,促进CGRP地进一步释放。
1.2.3 CGRP在三叉神经-血管系统神经细胞中的作用机制CGRP主要在含无髓鞘伤害性C纤维的三叉神经元中表达,以响应偏头痛的触发因素。CGRP介导的神经元敏感化和谷氨酸介导的二级、三级神经元信号是偏头痛的重要组成部分[8],通过激活肥大细胞的生物功能、触发神经胶质细胞炎症反应和放大神经元痛觉信号等作用参与到偏头痛各项生理病理过程中。CGRP触发NO的产生,导致CGRP和神经元一氧化氮合酶的表达增加,形成正反馈回路,进而促进初级外周三叉神经纤维的敏化和中枢二级神经元的活动[9](见图1B)。这些介质进一步刺激周围的神经胶质细胞产生白细胞介素-1β(interleukin-1β,IL-1β),从而促进环氧合酶活性的增加。同样,CGRP刺激的神经胶质细胞还会释放肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),这也与驱动三叉神经元敏化的正反馈有关[10]。总之,由一种三叉神经元释放的CGRP作用到相邻神经胶质细胞或其他三叉神经元上,并诱导了促炎细胞因子的分泌和神经元敏化,最终增强疼痛信号的循环传递。
2 CGRP为靶点的偏头痛治疗药物
随着对偏头痛病理生理学的了解,越来越多针对性治疗偏头痛的药物被研发与应用,尤其是一些靶向神经递质类的药物。其中,CGRP在偏头痛病理生理学中表现出重要作用,是偏头痛治疗的重要靶点。CGRP及其受体拮抗剂作为临床治疗偏头痛的药物被陆续开发并投入临床应用。
以CGRP为靶点治疗偏头痛的药物分为2类:小分子拮抗剂和单克隆抗体[11](见表1和表2)。用于预防或治疗急性偏头痛的靶向CGRP及其受体的药物治疗作用机制可能不同,如erenumab和telcagepant的作用机制是通过结合CGRP受体从而拮抗CGRP与其受体的结合,并阻断cAMP信号传递。相比之下,fremanezumab是通过与CGRP结合来减少CGRP与CGRP受体的作用来阻断cAMP信号。药物不同的作用机制也会影响偏头痛患者的疗效、安全性和耐受性,下文将详细介绍这2类以CGRP为靶点的偏头痛治疗药物的疗效和安全性等问题。

表1 小分子CGRP受体拮抗剂类偏头痛药物Table 1 Small molecule CGRP receptor antagonists as migraine drugs

表2 CGRP单克隆抗体类偏头痛药物Table 2 CGRP monoclonal antibody as migraine drugs
2.1 小分子拮抗剂
Olcegepant是用于偏头痛急性治疗的首个非肽类CGRP受体拮抗剂(gepants)类药物。在2.5 mg静脉注射剂量下,olcegepant组头痛程度降低了66%,而安慰剂组仅降低27%,且olcegepant组2 h无痛率以及减少畏光、声音恐惧症和恶心的有效率也优于安慰剂组;但由于其生物利用度差,需要静脉注射给药等原因而导致的药物依从性差致使olcegepant地进一步开发受限而停产[12]。
此后,可通过口服起效的第1代gepants被开发,如telcagepant、MK-3207和BI44370TA。一项关于telcagepant的临床研究发现,在660名受试者中有7名偏头痛患者的天冬氨酸氨基转移酶显著升高,是正常值上限的3倍;天冬氨酸氨基转移酶的升高代表可能存在肝毒性,因此在安全监测委员会的建议下终止了telcagepant的临床试验[13]。此前,默沙东公司开发的另一种CGRP受体拮抗剂MK-3207,其200 mg剂量口服也有效,偏头痛患者疼痛缓解率为69%,但与telcagepant一样,由于对其肝脏的毒性考虑,该药物也被停止开发[14]。
上述数据表明,以CGRP为靶点的治疗药物在治疗偏头痛急性发作和预防等方面均具有很好的疗效。尽管第1代gepants有肝毒性的可能,但gepants类CGRP受体拮抗剂仍具有开发价值,这也推动了第1、2代无肝毒性gepants类药物的研发,如ubrogepant(1)、rimegepant(2)、atogepant(3)及zavegepant(4)。
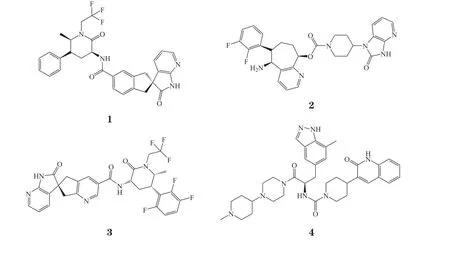
2.1.1 ubrogepant 2019年12月,美国食品和药品管理局(FDA)批准ubrogepant用于治疗成人有或无先兆偏头痛的急性发作。Ubrogepant口服后吸收迅速,以50或100 mg的剂量服用后约1.5 h达到血药浓度的峰值,且ubrogepant主要通过肝药酶CYP3A4进行肝脏代谢,出现线粒体功能障碍、氧化应激和胆汁酸转运蛋白破坏等引发肝毒性机制的可能性较低,消除途径主要是胆汁、粪便,因而对肝脏影响较小[15]。
一项随机安慰剂对照试验中,50和100 mg ubrogepant 2个治疗组与安慰剂组偏头痛患者的疼痛缓解率分别为19.2%、21.2%和11.8%,且均具有统计学意义[16]。Ubrogepant的安全性评估试验显示,偏头痛患者在服药后48 h内每个剂量组中约5%的受试者出现了恶心、口干、头晕和嗜睡等不良反应[17]。另外,一项体外研究调查了ubrogepant对CGRP诱导的人脑膜动脉和冠状动脉松弛的影响,结果表明ubrogepant可以更有效地抑制CGRP诱导的脑膜动脉的扩张效应,且不会引起血管的收缩作用[18]。由于Ⅲ期临床试验不包括严格的血压监测,因此需要继续研究评估ubrogepant的心血管安全性,尤其是长期和频繁给药方式的影响,这些更能反映偏头痛急性治疗的实际情况,有助于全面了解gepants类药物的安全性。
2.1.2 rimegepant2020年2月rimegepant作为偏头痛的急性治疗药物被FDA批准上市[19],并于2021年5月被批准用于偏头痛的预防性治疗。Rimegepant仅以75 mg的相同剂量强度就可以预防和治疗急性偏头痛[20]。Rimegepant也是目前所有已上市小分子拮抗剂类药物中唯一一种在预防偏头痛和治疗急性偏头痛中均显示出积极效果的药物[21]。总体而言,rimegepant是一种耐受性良好的药物,引发不良反应事件也相对较少。在2项rimegepantⅢ期试验中,恶心、尿路感染和头晕3种不良事件的发生率均小于2%。Rimegepant唯一列出的禁忌证是过敏反应,严重的超敏反应会引起呼吸困难和皮疹,这种情况在给药后数天可能出现[22]。
偏头痛在女性群体中更为常见,患病率约是男性的3倍[23]。由于某些偏头痛药物在哺乳期不可使用或尚未评估其不良反应,因此担心药物暴露可能会限制母乳喂养,从而避免使用偏头痛药物,导致病情愈发严重。一项单中心、开放性研究结果显示,健康哺乳期女性单次口服75 mg rimegepant后24 h内母乳中药物平均水平为34 μg · L-1,转化为相对婴儿剂量约为0.51%[24]。可见,母乳中该药物含量很低,预计不会对母乳喂养的婴儿造成不良影响,但在获得更多临床数据之前,在哺乳新生儿或早产儿时还应尽可能选择其他替代药物。
近几年,rimegepant在国内的临床研究也取得了新进展。2022年2月14日,Biohaven公司和辉瑞公布了rimegepant在中国和韩国等亚太地区开展的急性偏头痛治疗的Ⅲ期临床试验的积极结果[25]。该研究报告显示,在单剂量口服rimegepant 2 h后患者的头疼程度及恶心、畏声和畏光等相关症状得到显著缓解,患者能在2 h内恢复正常生活;同时,rimegepant表现出良好的安全性和耐受性,与国外临床试验结果一致。
2.1.3 atogepantAtogepant是目前唯一获批仅用于预防成人发作性偏头痛的口服小分子拮抗剂。Atogepant在结构上与ubrogepant相似,但由于atogepant结构中的苯基第2、3、6位含有氟,导致对CGRP受体的亲和力更大,因而具有更长的半衰期和更高的效力[26]。
2项为期12周的关键性试验对18 ~ 80岁有偏头痛病史的成年人进行了atogepant预防偏头痛发作的有效性评估。在第1阶段,患者被随机分配到安慰剂组、每天1次atogepant(10、30和60 mg)组或每天2次atogepant(30和60 mg)组中,与安慰剂相比,所有atogepant治疗组的每月偏头痛发作次数及每月头痛天数的减少均具有统计学意义[27];而在第2阶段,受试者仅接受每天1次的atogepant(10、30和60 mg),与安慰剂相比,所有atogepant组的每月偏头痛发作次数、每月头痛天数及急性药物使用天数均明显下降,显示出积极的预防效果[28]。
Atogepant常见的不良反应有恶心、便秘、疲劳、食欲下降和体质量减轻等;其中,恶心和疲劳的发生频率呈剂量依赖性,而便秘的发生受肠道中CGRP受体的阻断影响[27]。由于atogepant主要由经肝脏代谢,肝毒性是其首要考虑的问题。在临床开发的第1阶段,部分患者服用atogepant后出现转氨酶水平升高,但这种症状在停药后消失,未表现出严重的肝脏损伤,因而排除了atogepant具有肝毒性的可能性[29]。CGRP是一种有效的血管扩张剂,在调节血管阻力方面发挥关键作用。Atogepant通过阻断CGRP受体来抑制代偿性血管扩张,因此不会直接导致血管收缩,在正常心血管条件下服用atogepant产生血管方面副作用可能性较小[30]。
2.1.4 zavegepantZavegepant是一种高亲和力、高选择性和结构独特的第3代小分子拮抗剂,具有高水溶性和高游离分数的特性。Zavegepant的理化特性使其可以适用于多种给药途径,如鼻腔、吸入或口服给药,且该药物是临床开发中唯一兼具鼻内和口服制剂的CGRP受体拮抗剂[31]。
在Ⅰ期临床试验中,zavegepant鼻内制剂在血浆中达到最高浓度所需的时间明显缩短,具有良好的鼻腔生物利用度。该药物在使用后15 min内迅速起效,30 min即可使患者恢复正常功能,并且在48 h内具有持续缓解偏头痛的功效[26]。另外,一项安慰剂对照的Ⅱ/Ⅲ期研究评估了zavegepant用于治疗急性偏头痛的3种剂量:5、10和20 mg,结果显示,与安慰剂相比,给药后2 h内10和20 mg剂量的zavegepant具有超快的止痛效果,并表现出良好的耐受性,而不良事件仅表现为味觉障碍和鼻部不适,且任何剂量组均未见肝毒性反应[32]。随后对zavegepant的结构进行了修饰,旨在减少可旋转键数量的氮杂环酮以提高口服的生物利用度,并维持对受体的高亲和力[33]。口服zavegepant对偏头痛的预防性治疗的临床疗效、安全性和耐受性已进行了研究,Ⅱ/Ⅲ 期临床试验仍在进行中[32]。
2.2 CGRP单克隆抗体
靶向CGRP或其受体通路的人源化单克隆抗体是一类专门针对偏头痛的新型预防性疗法。与传统口服的偏头痛预防药物相比,CGRP或其受体为靶点的单克隆抗体药物具有显著优势,例如可避免宿主免疫反应,半衰期长,每月或每季度给药1次,且具有良好的安全性和依从性。截至目前已有4种以CGRP或其受体为靶点的单克隆抗体类药物获得FDA的批准上市。
2.2.1 erenumabErenumab是FDA批准的首个用于预防成人偏头痛的单克隆抗体药物,也是唯一针对CGRP受体胞外区融合蛋白的人源化单抗[34]。单克隆抗体的生物利用度和吸收率主要取决于给药途径。通过皮下注射erenumab,生物利用度可达到82%,在4~6天后达到最大血浆浓度[35],对偏头痛的改善作用通常可在3个月内实现。
一项临床对照研究以erenumab 70 或140 mg的月剂量,通过用皮下注射的方式进行偏头痛预防性治疗。该试验结果表明,在接受治疗的6个月内,与安慰剂相比,接受erenumab治疗的偏头痛患者的头痛天数、头痛发作频率以及其他偏头痛治疗药物的使用次数均明显减少[36]。Erenumab最常见的不良事件是注射部位疼痛、上呼吸道感染、恶心、鼻咽炎、便秘、肌肉痉挛等。在安慰剂组和erenumab组之间,不良事件的类型和发生频率无明显差异。值得注意的是,对erenumab上市后的调研报告显示共362例出现与erenumab相关的血压升高症状,其中有95例为严重高血压,占比26.2%。尽管如此,根据对erenumab长期监测发现,每年出现这种高血压不良反应的概率仅为0.144%[37]。总体而言,与安慰剂相比,erenumab表现出较好的安全性和有效性,且erenumab上市后再评价显示,出现高血压等不良反应的概率也普遍较低,对血管收缩无显著影响。关于erenumab作用的长期安全性仍需进一步研究。
2.2.2 fremanezumabFremanezumab是一种通过靶向CGRP来阻止其与CGRP受体结合的单克隆抗体[38]。Fremanezumab临床推荐剂量为每月1次(225 mg)或每3个月1次(675 mg)皮下注射[39]。Fremanezumab生物利用度为55% ~ 66%,在给药后的5 ~ 7天达到峰值浓度,而平均半衰期约为32 ~ 36天[40]。在合理的剂量下fremanezumab不易透过血脑屏障,其可能作用于PNS,不会对CNS造成消极影响[39]。
在一项随机、双盲、安慰剂对照Ⅲ期临床试验中,将接受fremanezumab的患者随机分至季度治疗组、月度治疗组及安慰剂组,药物干预的第12周对患者状况进行最终评估。评估结果表明,与安慰剂组相比,fremanezumab季度组和月度组每月平均偏头痛发作次数明显减少,且头痛持续的时长也明显降低;最常见的不良事件是注射部位疼痛,在上述3个试验组中发生率分别为30%、26%和28%,与安慰剂相比,fremanezumab治疗后注射部位的硬结和红斑更为常见[41]。Fremanezumab治疗尚未见严重的不良事件发生,即使在治疗期间发生了可能由该药物引起的肝损伤事件,但肝酶水平升高均是瞬时性的,且在未停止试验方案的情况下肝酶水平逐渐降低,数值可恢复到正常水平[42]。
2.2.3 galcanezumabGalcanezumab是一种用于偏头痛预防的人源化单克隆抗体注射制剂,其可选择性地与CGRP结合来阻止或中止偏头痛的发生[43]。研究显示,galcanezumab的预防作用起效较快,从注射后第1天起每天出现偏头痛的患者比例显著低于安慰剂[44]。
近期,一项临床试验评估了接受galcanezumab治疗的患者的治疗满意度(treatment satisfaction,TS),评估内容包括:有效性、副作用、依从性和总体满意度等4个方面的问题,并将其与其他预防性偏头痛药物进行了比较,大多数患者在服药12周时对以上4个方面均报告了积极的满意度[45]。几项临床试验和开放研究结果也表明,galcanezumab的安全性和耐受性良好,最常见的副作用是注射部位疼痛和红斑、便秘及鼻咽炎等[46]。此外,在偏头痛预防性治疗时,依从性是需要考虑的一个重要方面。Galcanezumab每月皮下注射给药1次,可进一步提高药物的依从性,从而有助于更好地控制头痛[47]。
2021年9月,礼来中国宣布,一项全球多中心Ⅲ期临床研究取得了积极的主要研究结果[48]。该临床研究的入组人群以中国患者为主,旨在评估galcanezumab对预防性治疗成人偏头痛的有效性和安全性。该研究显示,galcanezumab治疗组在主要研究终点每月头痛天数上显著优于安慰剂组,且对偏头痛缓解率也有很好的效果。上述数据与全球已完成的主要研究结果一致,galcanezumab已于2024年1月在中国获批上市。
2.2.4 eptinezumab2020年,FDA批准eptinezumab用于预防性治疗成年人频繁发作或严重的偏头痛[49]。Eptinezumab可有效且选择性地与αCGRP、βCGRP结合,以阻止CGRP受体的激活[50]。Eptinezumab通过每季度30 min静脉注射给药,其生物利用度可达100%,半衰期为27天[51]。由于eptinezumab需要通过输液治疗,因而易出现局部注射反应,如红肿、瘙痒等。此外,eptinezumab常见的不良反应还包括鼻咽炎、头晕、头痛和疲劳等以及非常见且通常为轻至中度的超敏反应,如血管性水肿[52]。在获批上市前的随机对照试验中,在接受eptinezumab的患者中报告了轻度至中度血清转氨酶升高的罕见情况,且均是短暂、无症状的,不需要停止eptinezumab的输注[49]。自eptinezumab获批上市使用以来,暂未见关于其使用引起的严重不良反应。
2.3 靶向CGRP及其受体药物的联合用药情况
近年来,在偏头痛的治疗方式及药物研发方面取得了重大突破,其中CGRP及其受体的药物联合治疗引起广泛关注。通过与靶向CGRP及其受体的药物联合使用,可以针对偏头痛发作的多个环节进行干预。在临床试验中,一些针对CGRP或其受体的单克隆抗体及小分子拮抗剂与其他偏头痛治疗药物的联合使用取得了显著疗效。最近多项研究结果显示,在erenumab和rimegepant与舒马曲坦联合使用时,具有显著的治疗作用,并对这2种药物的药代动力学未见明显影响[53-54]。然而在舒马曲坦联合使用ubrogepant和atogepant时,这2种gepants类药物的达峰时间均有延迟,同时平均最大血浆浓度也有所降低,舒马曲坦的药代动力学参数并未受到影响。第2、3代gepants均是口服的小分子拮抗剂,其中ubrogepant、rimegepant和atogepant具有极高的脂溶性,因此,推测该类药物吸收后主要分布于脂肪组织。由于脂肪积累,这些药物可以持续释放到血液中,导致药物的半衰期可能会超出预期[55]。因此,不能完全排除体质量指数(body mass index,BMI)对血浆浓度和临床反应的影响。此外,还需要注意的是联合用药并不适用于所有偏头痛患者的治疗。对于某些患者来说,这种联合治疗可能无效或产生严重的副作用。因此,在选择合适的治疗方案时,医生应综合考虑患者的具体情况,并根据其病史、症状和药物耐受性进行个体化的治疗决策。
综上所述,靶向CGRP及其受体的药物联合治疗可以提供更全面的治疗措施,针对不同阶段和症状进行综合干预,为偏头痛患者带来了新的治疗选择和希望。虽然仍在一些挑战和限制,但随着进一步的研究和临床实践,相信该联合治疗策略将在未来发挥更大的作用,并为偏头痛患者提供更有效和可靠的治疗手段。
3 结语与展望
偏头痛是一种常见的神经系统疾病,严重影响了患者的生活质量。近年来的多项研究揭示了偏头痛发病机制中涉及多个关键因素,其中,神经肽CGRP的释放在偏头痛的发作过程中发挥重要作用。PNS和CNS中CGRP的异常释放易导致出现偏头痛的症状。CGRP通过多种机制在偏头痛的病理生理过程中发挥核心作用,包括三叉神经的感受器敏化、局部炎症反应和神经元的活化等。
传统的偏头痛急性期治疗药物通过收缩血管和抑制炎症反应来减轻偏头痛发作,然而这些药物可能引发心血管系统异常、肝脏毒性等不良反应,影响患者用药的安全性和依从性。截至目前,有4种小分子CGRP拮抗剂和4种CGRP单克隆抗体获批上市,为偏头痛患者带来新的希望。然而,CGRP单克隆抗体类药物的治疗效果仅能持续1 ~ 3个月,其长效性仍有待提高。此外,CGRP单克隆抗体类药物需定期注射或静脉输液,可能影响患者用药的依从性,因此,亟需研发更便捷的给药方式,如口服制剂或鼻腔喷雾等。尽管靶向CGRP抗体和受体拮抗剂在临床试验中显示出较好的安全性,但仍有患者可能出现注射部位反应、感染等不良反应,因此,需要进一步监测和评估这类药物的安全性,确保其在临床应用中的合理性和可靠性。
CGRP靶向药物是偏头痛治疗领域的重要突破,未来的研究可聚焦于强化CGRP靶向药物的长期疗效,优化给药方式,提高患者依从性以及对药物的安全性进行评估,并制定个体化的治疗策略,以进一步提升偏头痛治疗效果,改善患者的生活质量。
