HER2低表达晚期乳腺癌抗体药物偶联物研究进展
2024-03-25瞿菲孙春晓李薇
瞿菲,孙春晓,李薇
(南京医科大学第一附属医院/江苏省人民医院肿瘤科,江苏 南京 210029)
研究显示,以曲妥珠单抗为代表的抗人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)驱动基因靶向药物可显著改善HER2阳性乳腺癌的预后,但其疗效仅限于免疫组化(immunohistochemistry,IHC)3+或IHC2+且荧光原位杂交(fluorescent in situ hybridization,FISH)有HER2基因扩增的患者[1]。HER2低表达(IHC1+和IHC2+/FISH阴性)乳腺癌人群约占乳腺癌总人群40% ~ 50%[2]。与HER2阴性的肿瘤患者相比,HER2低表达的乳腺癌患者激素受体(hormone receptor,HR)阳性比率更高,患者的无进展生存期(progress-free survival,PFS)和总生存期(overall survival,OS)也更长[3]。此外,HER2低表达状态是动态的,重复连续活检可增加三阴性乳腺癌(triple-negative breast cancer,TNBC)患者HER2低表达检出率,从而提供有意义的临床信息[4]。目前,对于HR阴性HER2低表达的晚期乳腺癌患者在既往治疗上属于传统TNBC的范畴,主要是以传统化疗、免疫治疗以及抗血管生成治疗为主,后线治疗选择有限;而HR阳性患者以内分泌治疗或内分泌联合靶向治疗为主,甚至在细胞周期蛋白依赖性激酶4/6(cyclin dependent kinase 4/6,CDK4/6)抑制剂治疗失败后,几乎面临无药可选的局面,这部分患者的治疗仍然是一个高度未满足的临床需求领域。抗体药物偶联物(antibody-drug conjugates,ADCs)的出现,使得HER2低表达亚型的治疗模式发生了显著的改变,且明显改善了患者预后[5]。
ADCs的概念源于Paul Ehrlich提出的“魔法子弹”,作为一种靶向性生物制剂,ADCs通过连接子将高效的细胞毒药物与可特异性识别肿瘤细胞和(或)微环境中靶点的抗体偶联,利用两者功能上的互补性,精准定位及特异性杀伤肿瘤细胞[6]。ADCs可直接靶向肿瘤细胞,因此其降低了对其他正常细胞的毒副反应,真正体现了高效低毒的治疗理念。药物/抗体比(drug to antibody ratio,DAR)可用来衡量附着在抗体上的有效载荷分子的平均数量,且可直接影响药物的安全性和疗效。高药物负载通常会导致药物聚集,影响血浆清除效率,而DAR较低的ADCs药物表现出较弱的活性[7]。
靶抗原是ADCs药物识别肿瘤细胞的重要因素,任何在肿瘤细胞和正常细胞之间有差异表达的表面抗原均可能成为ADCs合适的靶点[8]。靶抗原又可分为驱动基因靶点和非驱动基因靶点,靶抗原的生物学功能对ADCs活性的影响尚未完全阐明。从理论上讲,ADCs的主要作用机制是由细胞毒性载药介导且不依赖于靶标功能,因此靶标不需要发挥直接作用。目前,乳腺癌中以驱动基因HER2为靶点的ADCs开发为研究热点,目前有2种抗HER2的ADCs药物已被美国食品和药品管理局(Food and Drug Administration,FDA)正式批准用于晚期乳腺癌治疗,即恩美曲妥珠单抗(T-DM1)和德曲妥珠单抗(T-DXd)。此外,我国自主研发的ADCs也正在进行临床试验,在肿瘤治疗方面已显示出良好的临床应用前景。对于人表皮生长因子受体3(human epidermal growth factor receptor 3,HER3)和滋养层细胞表面抗原-2(trophoblast cell surface antigen 2,Trop-2)等非驱动基因靶点ADCs的开发也为抗肿瘤治疗提供了新的思路,以Trop-2为靶点的戈沙妥珠单抗(SG),是目前唯一被批准用于乳腺癌的非抗HER2的ADC药物。新型ADCs药物有望重构晚期乳腺癌靶向治疗格局,未来将改变乳腺癌现有分子分型治疗的模式。本文概述ADCs药物在治疗HER2低表达晚期乳腺癌中的应用进展,以期在HER2低表达的乳腺癌患者中获得更好的疗效。
1 抗体药物偶联物的作用机制
ADCs整合了特异性抗体和细胞毒性药物的精准杀伤作用,允许其偶联化合物在组织内特异性递送。ADCs通过特异性抗体介导途径和非特异性胞饮作用进入细胞内。溶酶体与晚期胞内体融合,通过化学或酶介导的方式释放的小分子细胞毒素以DNA插入或抑制微管合成等方式干扰关键的细胞机制,从而诱导细胞凋亡[9]。由于肿瘤微环境中低pH和高浓度的蛋白水解酶,部分ADCs具有可切割连接子和高度膜渗透性的有效载荷,可通过诱发“旁观者效应”攻击不表达ADCs靶点的邻近细胞和间质组织[10]。此外,与单克隆抗体的作用机制相同,针对驱动基因靶点的ADCs抗体的可变区可以与肿瘤细胞表面的抗原表位结合,通过竞争性阻断配体结合、干扰二聚化和(或)诱导靶蛋白的内吞和降解破坏靶蛋白功能。ADCs抗体的Fc段与杀伤性细胞[自然杀伤(natural killer,NK)细胞、巨噬细胞等]表面的Fc受体(Fc fragment receptor,FcR)结合,通过引发抗体依赖性细胞毒性作用(antibodydependent cell-mediated cytotoxicity,ADCC),使杀伤性细胞直接作用于癌细胞,并且抑制抗原受体下游信号传导和免疫激活,将癌细胞增殖阻滞在调定点,诱导癌细胞凋亡[11]。
2 乳腺癌中以驱动基因为靶点的抗体药物偶联物
HER2是一种受体酪氨酸激酶(receptor tyrosine kinase,RTK),由于其基因扩增、蛋白过表达和(或)激活突变,它的异常激活会驱动细胞转化和致瘤生长。HER2是所有的HER蛋白首选的二聚体伴侣,通过与表皮生长因子受体(epidermal growth factor receptor,EGFR)和HER3形成同源或异源二聚体,诱导并激活酪氨酸激酶胞内结构域发生自磷酸化,触发下游与细胞增殖有关的信号转导通路[如磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinosital 3- kinase/protein kinase B,PI3K/AKT)或促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)][12]。HER2在肿瘤细胞中的表达水平是正常细胞中的近100倍,其过表达被认为是乳腺癌的独立预后因素,与不良的临床结果和疾病进展密切相关[13]。因此,HER2一直是乳腺癌中ADCs开发的理想靶点。
2.1 恩美曲妥珠单抗
恩美曲妥珠单抗(ado-trastuzumab emtansine,又称T-DM1)是2013年于美国首次被批准用于乳腺癌的抗HER2 ADC药物。T-DM1用于HER2阳性转移性乳腺癌(metastatic breast cancer,MBC)的获批基于Ⅲ期临床试验EMILIA(二线治疗)和TH3RESA(三线治疗及以上)的研究证据[14-15]:前者对比了T-DM1与拉帕替尼联合卡培他滨在曲妥珠单抗为基础的一线治疗后的疗效差异,后者在更后线治疗的人群中比较T-DM1与医生选择的治疗方案(treatment of physician,s choice,TPC)的差异;这2项研究结果均证实了患者PFS和OS得到显著改善;然而,回顾性分析发现,T-DM1的治疗效果与HER2的表达水平有关,且T-DM1针对HER2低表达乳腺癌的治疗效果并不令人满意。在TDM4374gⅡ期临床研究中,HER2正常的乳腺癌患者与HER2阳性患者相比,中位PFS(2.8个月vs7.3个月)和客观缓解率(objective response rate,ORR)(20.0%vs41.3%)均差异显著[16]。在TDM4258g研究中,T-DM1治疗HER2低表达乳腺癌患者的ORR为4.8%,中位PFS仅为2.6个月[17]。以下两点原因限制了T-DM1在HER2低表达乳腺癌中的应用:1)T-DM1由不可裂解的硫醚连接子将曲妥珠单抗和微管抑制有效载荷DM1偶联,这使得T-DM1缺乏旁观者效应;2)T-DM1的DAR仅为3.5∶1,即相同剂量不同的ADCs,T-DM1达到肿瘤细胞的有效载荷较少,杀伤作用弱。
2.2 德曲妥珠单抗
德曲妥珠单抗(trastuzumab deruxtecan,又称T-DXd、DS-8201)是继T-DM1之后的第3代ADC药物。T-DXd与T-DM1相比较,优点在于其具有可切割连接子、新型高效能的细胞毒载荷(DXd)、更高的DAR(8∶1)和较短的半衰期(其在动物体循环中的半衰期约为1.37 h[18]),有助于T-DXd发挥旁观者效应,使其能够对异质性肿瘤有效并向癌细胞递送更多的有效载荷分子,且安全性可控。T-DXd在HER2低表达MBC中的治疗获益已通过多项早期临床试验的患者报告结果得到证实。一项Ⅰ期临床试验(NCT02564900)初步证实了T-DXd对HER2低表达经多线治疗(之前已接受的抗癌方案的中位数为7.5线)的MBC患者的抗肿瘤活性,ORR为44.4%,中位PFS为11.1个月[19]。2022年2月,美国临床肿瘤协会(American Society of Clinical Oncology,ASCO)大会公布了Ⅲ期临床DESTINYBreast04研究关键性结果[20]。该研究纳入557例既往接受过一线或二线化疗的HER2低表达MBC患者,其中HR阳性/HER2低表达MBC患者494例,与化疗相比,T-DXd治疗者中位PFS(10.1个月vs5.4个月)和中位OS(23.9个月vs17.5个月)均具有明显优势,T-DXd将HR阳性/HER2低表达MBC患者的疾病进展或死亡风险降低49%(风险比HR =0.51,P<0.001),T-DXd最常见的治疗相关的不良事件(treatment-related adverse event,TRAE)是间质性肺炎(10.2%)。T-DXd也填补了HER2低表达乳腺癌脑转移治疗空白,在伴有脑转移瘤(brain metastasis,BM)的MBC患者来源的异种移植模型中T-DXd显示出强效的颅内控制效果,特别是对T-DM1耐药的HER2阳性和低表达亚型,如在DESTINY-Breast04研究纳入的35例基线时临床稳定的脑转移患者中,TPC组和T-DXd组的颅内客观缓解率分别为0%和25.0%;临床获益率(clinical benefit rate,CBR)分别为18.2%和58.3%;T-DXd组中位中枢神经系统(central nervous system,CNS)-PFS为9.7个月,中位OS为16.7个月[21]。
此外,正在进行的DESTINY-Breast06研究进一步将T-DXd在HR阳性/HER2低表达患者中的应用前移至内分泌±靶向治疗后的一线化疗,并且拓展至HER2超低表达患者(0<IHC<1+);DESTINY-Breast08研究拟评估T-DXd联合治疗在HR阳性或HR阴性、HER2低表达MBC患者中的药代动力学,耐受性及疗效。2022年8月T-DXd获FDA批准用于治疗HER2低表达MBC,成为全球首个针对HER2低表达的MBC的靶向治疗药物。
2.3 维迪西妥单抗
维迪西妥单抗(ditamab vedotin,又称RC48)是中国原研的于2021年首个获准上市的ADCs药物,其通过可裂解的连接子将磺酰氨基甲酸乙酯(MMAE)与人源化的抗HER2单克隆抗体结合,DAR约为4∶1。RC48可通过有效的旁观者效应对HER2低表达的细胞产生细胞毒性[22-23]。2021年ASCO大会公布了一项关于RC48针对局部或转移性乳腺癌的Ⅰ期研究(C001和C003)的综合分析结果,共纳入接受RC48治疗的118例患者,HER2阳性亚组(70例)和HER2低表达亚组(48例)在相同治疗剂量(2.0 mg · kg-1)下显示相对一致且良好的疗效,ORR分别为42.9%和39.6%,中位PFS均为5.7个月,其中在IHC2+/FISH阴性的患者中ORR和中位PFS分别为42.9%和6.6个月,即使在HER2 IHC1+的患者中ORR和中位PFS仍可分别达30.8%和5.5个月[24];最常见的TRAE(发生率≥30%)包括肝酶活性升高、感觉减退、白细胞和中性粒细胞计数减少。此外,针对HER2低表达乳腺癌患者的Ⅲ期临床试验C012(NCT04400695)也在进行中。
2.4 曲妥珠单抗-多卡马嗪
曲妥珠单抗-多卡马嗪(trastuzumab duocarmazine,又称SYD985)是一种由曲妥珠单抗、杜卡霉素和可切割连接子组成的新型ADC,其DAR较低(2.8∶1)。临床前模型研究显示,在仅含20%HER2阳性细胞的情况下,SYD985对共培养细胞的杀死率为65%;与T-DM1相比,SYD985强大的旁观者效应在异种移植模型中得到验证[25]。根据第1阶段试验的初步结果,2018年FDA授予SYD985在HER2阳性不可切除局部晚期或转移性乳腺癌中的加速批准资格。一项针对HER2晚期乳腺癌的Ⅰ期剂量递增和扩大研究,32例HR阳性/HER2低表达和15例HR阴性/HER2低表达患者接受SYD985,ORR分别为28%和40%,中位PFS分别为4.1和4.9个月;最常见的副作用是疲劳、结膜炎和干眼症,眼部TRAE的发生率和严重程度通常随着暴露时间的延长而增加[26]。
2.5 A166
A166通过蛋白酶可裂解的缬氨酸-瓜氨酸连接子将新型毒素分子(Duo-5,微管蛋白抑制剂)定点偶联至曲妥珠单抗上。2022年ASCO年会上公布的KL166-I-01-CTP(CTR20181301)Ⅰ期临床研究结果,在纳入的4例可评估疗效的HER2低表达乳腺癌患者中,1例部分缓解(partial response,PR),2例疾病稳定(stable disease,SD),1例疾病进展(progressive disease,PD)[27]。目前有关A166的相关研究较少,虽然A166在HER2低表达乳腺癌患者可能会展现出一定的有效性,但尚需要更多的临床数据支撑。
2.6 ARX788
ARX788通过不可切割的接头偶联毒素AS269(微管蛋白抑制剂)和人源性HER2单克隆抗体,提高了药物的活性、安全性和稳定性,拓宽了药物的治疗窗口,平均DAR为1.9∶1[28]。ARX788的体内外活性普遍较强:在体外实验中,用ARX788和T-DM1分别处理HER2低表达的乳腺癌细胞株时,ARX788效价均高于T-DM1(JIMT-1:154倍、MDA-MB-453:30倍、MDA-MB-175:9倍);在应用JIMT-1制作的乳腺癌移植瘤模型中也获得了相似的结果,与T-DM1相比,应用ARX788后肿瘤生长受到显著抑制[29]。以上研究显示了ARX788在HER2低表达乳腺癌患者群体中有效的治疗潜力。目前一项针对HER2低表达晚期乳腺癌的Ⅱ期临床试验(ACE-Breast-07,NCT05018676)正在招募进行中,尚未见相关临床数据的报道。
2.7 PF-06804103
PF-06804103是一种处于临床开发早期阶段的新型ADC。PF-06804103以HER2为靶点利用一个可切割的连接子和新型微管抑制剂Aur0101相偶联,其DAR为4∶1。PF-06804103已被证实在各种HER2低至中度表达水平的肿瘤模型中具有优越的治疗效果[30]。在Ⅰ期临床试验(NCT03284723)中,共有21例HR阳性/HER2低表达MBC患者(既往接受过至少1种系统治疗)接受PF-06804103,3 mg · kg-1组(10例)和4 mg·kg-1组(11例)分别有4例(40%)和11例(100%)患者获得疾病控制,常见的不良反应为脱发、疲劳、肌痛和周围感觉神经病变[31]。
3 乳腺癌中以非驱动基因为靶点的抗体药物偶联物
3.1 以人表皮生长因子受体3为靶点的抗体药物偶联物
HER3是RTKs HER家族的另一成员,在乳腺癌中异常过表达(高达47%),约2%的乳腺癌会出现HER3的激活突变[32]。由于HER3缺乏功能完整的酪氨酸激酶结构域,其本身的致瘤能力较弱,在与其配体[神经调节蛋白 1(NRG1)或神经调节蛋白2(NRG2)]结合后,才能与其他HER家族成员(如EGFR和HER2)形成异源二聚体,强力诱导激活PI3K/AKT/mTOR通路,对乳腺癌细胞存活和增殖至关重要[33]。
此外,活化的雌激素受体(estrogen receptor,ER)与HER家族成员(HER2及HER3)可形成复合物,在多个信号传导通路环节上相互交叉,从而介导ER的磷酸化和HER家族的转录活性。有研究发现,在ER阳性/HER2低表达的人乳腺癌小鼠异种移植模型中,抗HER2单克隆抗体(帕妥珠单抗)、抗HER3单克隆抗体(lumretuzumab)和竞争性雌激素受体调节剂(氟维司群)的三联疗法可诱导肿瘤在体内持久消退及长期的抗肿瘤效应[34]。一项Ⅰb期临床研究(NCT01918254)评估了lumretuzumab、帕妥珠单抗和紫杉醇在HER3阳性、HER2低表达MBC中的临床活性和安全性,但这种组合具有较高的腹泻发生率和狭窄的治疗窗口,因此已被终止[35]。
U3-1402(patritumab deruxtecan,又称HER3-DXd)是一种以HER3为靶点的ADC,由针对HER3胞外区的全人单抗patritumab通过可切割四肽连接子与DXd偶联而成,DAR为7.8∶1[36]。2022年ASCO大会公布的Ⅰ/Ⅱ期临床研究U31402-A-J101(NCT02980341)初步结果显示,HER3-DXd在经多线治疗的晚期乳腺癌各亚型中均显示出持久的抗肿瘤活性,包括HR阳性/HER2阴性(HER3高或低表达,ORR为30%,中位PFS为7.4个月)和TNBC(均为HER3高表达,ORR为23%,中位PFS为5.5个月)[37]。在U3-1402不同剂量(4.8 或6.4 mg · kg-1)组观察到类似的安全性:64.6%的低剂量组患者经历了3级或以上的TRAE,主要是骨髓抑制和胃肠道毒性;约7%的患者出现治疗相关的间质性肺病,大多数为1级和2级[37]。在一项机会窗研究(SOLTI-1805 TOT-HER3)中,单剂量U3-1402(6.4 mg · kg-1)用于治疗初治HR阳性/HER2阴性的早期乳腺癌时ORR为45%。此外,U3-1402可诱导免疫相关基因[如程序性细胞死亡1(PD-1)、CD8a和CD19]的表达,并抑制增殖相关基因[38]。
3.2 以滋养层细胞表面抗原2为靶点的抗体药物偶联物
Trop-2是一种膜表面糖蛋白,作为调节因子,Trop-2主要参与非锚定依赖性细胞生长和肿瘤的干细胞样特征转化,在TNBC和HR阳性/HER2阴性乳腺癌亚群中过表达。Trop-2参与肿瘤进展,但并非显性致癌基因[39]。
戈沙妥珠单抗(SG,又称IMMU-132)是FDA于2020年批准的首款以Trop-2为靶点的ADC,可选择性递送伊立替康的活性代谢物SN-38,DAR为7.6∶1[40]。SG的可裂解连接子CL2A不依赖于特异性酶促裂解,在血液中可保持稳定;到达病灶后,SG在肿瘤细胞溶酶体作用下释放细胞毒药物,通过再透膜方式杀伤临近肿瘤细胞;SG与Trop-2受体结合后在酸性的肿瘤微环境中水解释放SN-38,通过双释放机制产生旁观者效应。IMMU-132-01研究的Ⅰ/Ⅱ期篮式试验首次验证了SG在经多线治疗的晚期TNBC患者中的阳性结果,共有108名转移性TNBC患者参与此项研究,1/3的患者达到了肿瘤缓解(3例完全缓解,33例部分缓解),CBR为45.4%,中位PFS为5.5个月,中位OS为12个月[41]。关键性的Ⅲ期临床试验ASCENT也显示SG在接受过二线以上系统化疗的TNBC患者中的积极结果,SG与TPC相比,可显著改善患者的ORR(35%vs5%),使得中位PFS延长到传统化疗的3倍以上(5.6个月vs1.7个月)、中位OS也延长到2倍以上(12.1个月vs6.7个月)[42],疾病进展和死亡风险分别降低61%和52%。通过回顾性评估和分析局部HER2 IHC状态,在123例HER2低表达MBC人群中,SG组的中位PFS(6.2个月vs2.9个月)和中位OS(14.0个月vs8.7个月)均优于TPC组[43]。基于上述研究结果,2021年4月,SG获得了FDA对既往至少接受2种治疗方案并发生转移的TNBC的完全批准[44]。随后,中国国家药品监督管理局(National Medical Products Administration,NMPA)也于2022年批准SG用于转移性TNBC二线及以上治疗。
Ⅲ期临床研究TROPiCS-02进一步探索SG在既往接受过至少二线、但不超过四线化疗且CDK4/6抑制剂经治的内分泌耐药的HR阳性/HER2阴性晚期乳腺癌患者中的疗效和安全性。在HER2低表达亚组中,与化疗组相比,SG组中位PFS延长1.6个月(5.8个月vs4.2个月),中位OS提高3.9个月(15.4个月vs11.5个月)[45]。在Trop-2高表达(H评分≥100)和Trop-2低表达(H评分<100)亚组之间,SG相比于TPC均有PFS和OS的生存结局获益,即Trop-2表达水平尚不能明确地预测SG的临床疗效。
4 抗体药物偶联物在乳腺癌中临床应用
ADCs的疗效和不良反应取决于多种因素,包括抗原靶标亲和力、细胞毒性有效载荷的效价和数量以及连接子的选择和偶联技术。然而,设计一个理想的ADC尚无明确的关键决定因素。以HER2为靶点的ADCs的开发在乳腺癌领域中开始时间更早,研发管线更多,但目前与生物标志物无关的抗原如Trop-2和HER3也成为ADCs研究的重要新靶点。ADCs在HER2低表达乳腺癌患者中相关临床研究较常见(见表1)。
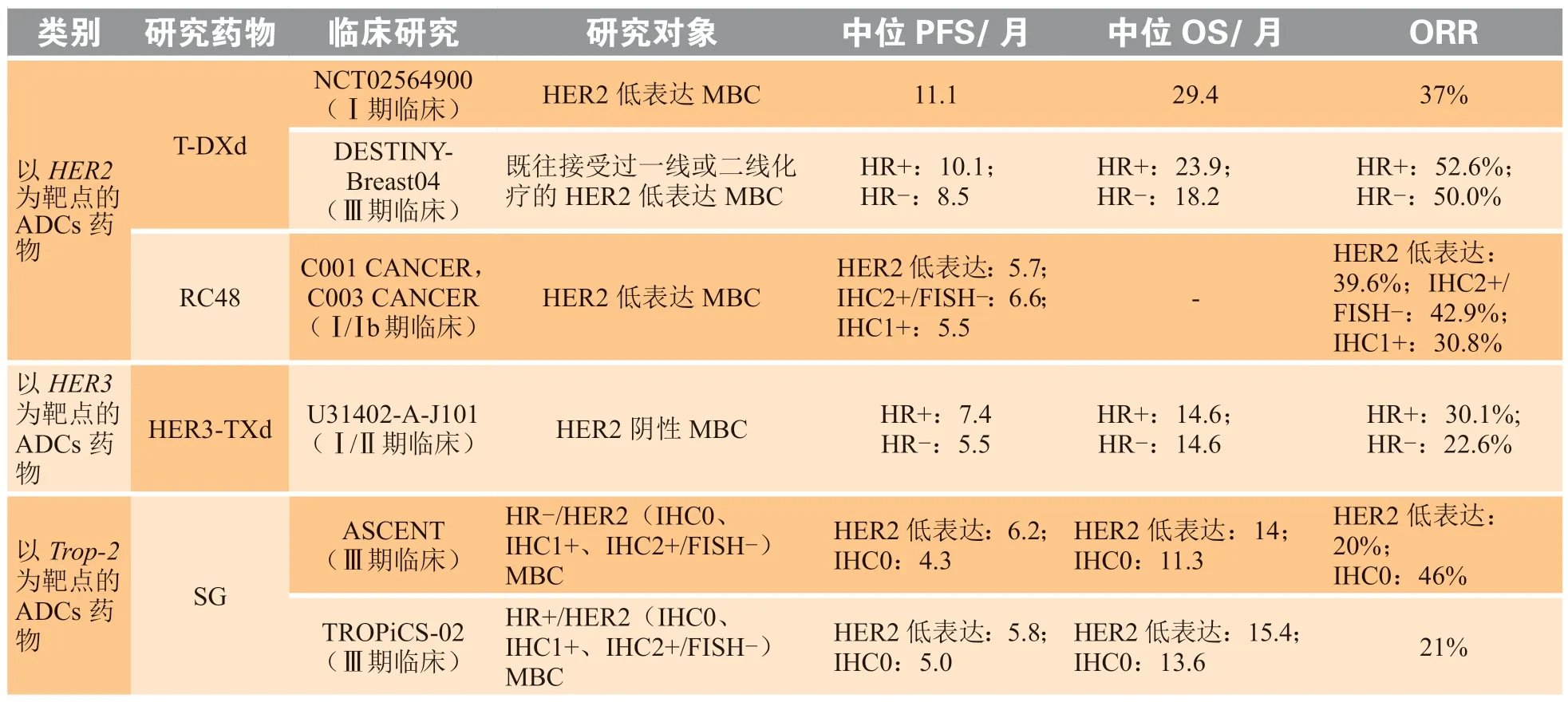
表1 抗体药物偶联物在HER2低表达晚期乳腺癌中研究情况Table 1 Progress of clinical research on ADCs in HER2-low metastatic breast cancer
目前,随着T-DXd获批用于HER2低表达MBC,以及SG获批用于HR阳性/HER2阴性和转移性TNBC,ADCs正在逐步扩大适应证患者群,显示了HER2低表达乳腺癌领域的重大进展,可能预示ADCs进入一个不依赖于传统生物标志物的新时代。随着越来越多的ADCs被开发和引入,考虑到基于抗体靶标与载荷的潜在交叉耐药性,ADCs的最佳用药顺序仍不确定,序贯使用不同的ADCs是否可以观察到类似水平的活性?不同靶点的ADCs能否做好排兵布阵,取得更好的疗效?2023年ASCO会议上一项来自美国哈佛医学院的单中心回顾性小样本研究纳入接受过2种ADCs(ADC1、ADC2)治疗的晚期乳腺癌患者,排除了HER2阳性患者,旨在评估在HR阳性/HER2阴性和转移性TNBC患者中接受一种ADC治疗后再次使用另一种ADC的有效性及安全性,结果显示,在抗体靶标改变时,交叉耐药率较低,且相比SG序贯T-DXd模式,T-DXd序贯SG模式的PFS整体获益更佳[46]。目前,关于T-DXd和SG在HR阳性/HER2低表达或阴性转移性乳腺癌治疗中的最佳选择策略尚缺乏实证研究。首先,对于晚期HR阴性/HER2低表达或TNBC患者,DESTINY-Breast04和ASCENT试验在具体临床实践中的实施值得进一步讨论。DESTINYBreast04试验仅包括63例HR阴性/HER2低表达患者,且既往仅接受过一线或二线化疗,而ASCENT试验中包括了235例HR阴性/HER2低表达和TNBC患者,且相较于DESTINY-Breast04中的入组患者接受了更多的预处理,既往中位治疗线数为四线。根据现有的证据,2023 ESMO低表达乳腺癌专家共识建议,在转移性HR阴性/HER2低表达和TNBC患者治疗中,在T-DXd之前给予SG更加有效,因此,SG应优先作为首选治疗方案。其次,考虑到HER2和ER信号传导通路的相互干扰,在HR阳性/HER2低表达或阴性MBC中的ADCs的应用似乎更为复杂。2023ESMO低表达乳腺癌专家共识建议,对于内分泌难治或有内脏危象的特定患者群体,在T-DXd和SG均可选的情况下,应优先考虑T-DXd。总之,以驱动基因和以非驱动基因为靶点的这2类ADCs相互补充,交叉验证。未来还需要进一步的研究来验证这些发现并识别临床耐药机制,以指导基于ADCs的治疗方案的最佳排序。
与大多数细胞毒性药物一样,由于耐药的出现,ADCs作为单一疗法的客观反应持续时间或临床获益是有限的。对于不同的细胞毒性药物,两者之间作用机制不同,可避免交叉耐药。ADCs与不同抗肿瘤机制的药物联用可以起到协同增效的作用[47]。与ADCs组合最有吸引力的“合作伙伴”是那些对肿瘤细胞或其微环境提供相加或协同作用而没有不可接受的重叠毒性的药物。其中,以免疫检查点抑制剂、酪氨酸激酶诱导剂及抗血管生成药物为代表[48],其组合治疗模式正在临床前模型和临床试验中积极探索,有利于整合和优化现有临床治疗选择,可能成为ADCs未来的发展方向。
5 结语与展望
HER2低表达定义的出现打破了传统的HER2非阳性即阴性的分类,HER2低表达乳腺癌已成为独立的治疗亚型。乳腺癌领域是ADCs药物研发的主战场,目前的循证证据尚不能确定HER2靶向ADCs和Trop-2、HER3靶向ADCs的最佳应用顺序,在临床实践中,需根据入组患者特征、ADCs的毒副反应和患者的耐受情况等因素,进行个体化治疗选择。然而,ADCs领域也存在亟待解决的问题,如部分ADCs的不良反应较化疗药物严重,探索ADCs预后预测的有效生物标志物,寻找乳腺癌患者中潜在的ADCs治疗获益者等,也均是未来临床应用中的重要研究方向。
