定量分析丝氨酸/甘氨酸转换影响胃癌细胞增殖的动力学机制*
2024-03-23樊军武朱晓梅范志远刘炳亚陈永聪
樊军武 朱晓梅 范志远 刘炳亚 敖 平 陈永聪**
(1)上海大学物理系,上海 200444;2)上海现代光学系统重点实验室,上海理工大学光电信息与计算机工程学院,上海 200093;3)同济大学医学院,同济大学附属第一妇婴保健院乳腺外科,上海 200092;4)上海交通大学医学院附属瑞金医院普外科,上海消化外科研究所,上海市胃肿瘤重点实验室,上海 200025;5)四川大学生物医学工程学院,成都 610065)
20 世纪20 年代,奥托·瓦伯格(Otto Warburg)开创性地发现了癌细胞的特殊代谢行为,即使在充足氧气供给的情况下,癌细胞仍然将葡萄糖转化为乳酸而不是进入三羧酸循环(tricarboxylic acid cycle,TCA cycle),该现象被称为Warburg 效应[1]。Warburg 效应被发现后近100年间,代谢与癌症的关系得到了广泛的研究。近十多年来,代谢改变已经被视为癌症的重要特征之一[2-3]。代谢改变可以提供大量的能量和代谢转换所需要的大分子物质,包括蛋白质、核苷酸、脂类以及重要的辅助因子,癌细胞通过代谢改变来维持生存和快速增殖。这也意味着,针对癌细胞所表现出的异常代谢途径可能是治疗癌症的有效手段,靶向癌症代谢的抗癌疗法是癌症治疗的重点研究之一[4]。
癌细胞通常通过糖酵解(glycolysis)来维持能量供应和物质需求,而丝氨酸/甘氨酸的生物合成是糖酵解的重要分支。糖酵解中间代谢产物3-磷酸甘油酸(3-phosphoglycerate,3PG)经三步酶促反应转化为丝氨酸(serine),丝氨酸在丝氨酸羟甲基 转 移 酶 (serine hydroxymethyltransferase,SHMT)作用下可逆转化为甘氨酸(glycine)并提供一个一碳单位参与一碳代谢。一碳代谢由叶酸循环(folate cycle) 和甲硫氨酸循环(methionine cycle)耦合形成,能为肿瘤生长提供必要的蛋白质、核酸和脂类等生物大分子。此外,一碳代谢还能够维持肿瘤微环境的氧化还原稳态并为甲基化反应提供底物[5]。上述一系列相互关联的代谢途径的中心是由SHMT催化的丝氨酸到甘氨酸的相互转化,该反应是一碳池(one-carbon pool)甲基的主要来源,也是细胞内核苷酸从头合成及DNA 甲基化所必需的。丝氨酸/甘氨酸的转化涉及一碳单位的供给和消耗,是影响癌细胞增殖的关键因素[6-7]。
癌症代谢的多项研究结果证实了丝氨酸/甘氨酸代谢对维持癌细胞存活和快速增殖具有重要意义。功能基因组学证据表明,丝氨酸/甘氨酸生物合成途径的过度激活在乳腺癌和黑色素瘤中推动了肿瘤的发生[8-9]。癌细胞系的初步分析描述了甘氨酸的消耗以及线粒体丝氨酸/甘氨酸生物合成途径中酶的表达都与癌细胞的增殖速率相关[10]。之后的相关研究表明,癌细胞增殖优先消耗丝氨酸而非甘氨酸,高水平的甘氨酸甚至可能会损害细胞增殖[11]。癌细胞优先消耗丝氨酸生成甘氨酸表明其用于增殖的一碳单位需求可能推动了丝氨酸到甘氨酸的转化。
胃癌(gastric cancer,GC)是世界范围内一种严重的消化道恶性肿瘤,2020 年全球新发胃癌病例超过100 万例,死亡病例达76.9 万例。在我国,胃癌发病率和死亡率均处于第3 位,造成沉重的疾病负担。胃癌的发生和发展是涉及多因素和多步骤的复杂病理过程,其发病和分子机制仍不明确[12-13]。胃癌代谢研究的最新进展突出了胃癌与丝氨酸/甘氨酸代谢的相关性。在胃癌组织中,丝氨酸和甘氨酸的总体水平较正常组织显著增高[14]。丝氨酸/甘氨酸生物合成途径中的磷酸甘油酸脱氢酶(phosphoglycerate dehydrogenase, PHGDH)、磷酸丝氨酸磷酸酶(phosphoserine phosphatase,PSPH) 和丝氨酸羟甲基转移酶2 (serine hydroxymethyltransferase 2,SHMT2)均与胃癌患者的不良预后显著相关[15-17]。癌症细胞增殖对于丝氨酸/甘氨酸的需求是明确的,实验结果和临床现象都表明了丝氨酸/甘氨酸代谢与胃癌有着紧密的联系。然而,胃癌细胞如何摄取和合成丝氨酸/甘氨酸以及其影响胃癌细胞增殖的分子机制仍不清晰[18-19]。
本研究采用一种基于随机和非梯度系统的势能景观所建立的自我调节算法,在代谢动力学参数不足的情况下,构建了一个稳定的胃癌细胞代谢动力学模型。本文的研究方法由生物学驱动,目的是找到活细胞能够在代谢物和酶均处于不断变化的情况下仍能保持代谢稳定的方法。模型的构建过程通过减少与随机波动相关的李雅普诺夫(Lyapunov)函数的变化,将酶参数引向能够使代谢网络稳定的空间。选择不同的反应初始值,对模型包含的代谢网络进行多次模拟计算,将计算结果与胃癌组织基因组学数据进行对比,验证了本文所构建的胃癌细胞代谢动力学模型的可靠性。在此基础上,改变模型中代谢网络的边界条件,模拟胃癌细胞对丝氨酸和甘氨酸的不同摄取情况进而调控丝氨酸/甘氨酸的转换方向。通过对比处于不同丝氨酸/甘氨酸转化速率下的模型代谢网络稳态通量,发现丝氨酸/甘氨酸转化对S-腺苷甲硫氨酸(S-adenosylmethionine,SAM) 和S- 腺苷同型半胱氨酸(S-adenosyl homocysteine,SAH)的生成具有重要影响,为靶向丝氨酸/甘氨酸的胃癌治疗提供了新的方向。
1 材料与方法
1.1 丝氨酸/甘氨酸的生物合成
丝氨酸/甘氨酸的生物合成途径是糖酵解过程的一个重要代谢分支。同时,其也与三羧酸循环以及一碳代谢(one-carbon metabolism)具有密切联系(图1)。丝氨酸和甘氨酸的生物合成包括两个过程:由葡萄糖从头合成丝氨酸以及丝氨酸和甘氨酸的可逆转化。在第一步中,葡萄糖(glucose)经多步酶促反应转化为糖酵解的中间产物3PG,其在PHGDH 和烟酰胺腺嘌呤二核苷酸(NAD+)的共同作用下被氧化为3- 磷酸羟基丙酮酸(3-phosphate hydroxypyruvate,3PHP)。其次,磷酸丝氨酸转氨酶(phosphoserine aminotransferase1,PSAT1)利用谷氨酸(glutamate,Glu)为氮供体,转氨生成3-磷酸丝氨酸(3-phosphoserine,3PSer)和α 酮戊二酸(alpha-ketoglutarate,α-KG),α-KG也是参与三羧酸循环的重要代谢物。最后,通过PSPH 去磷酸化生成丝氨酸。丝氨酸生成后,在SHMT 作用下实现丝氨酸和甘氨酸的相互转化。SHMT的两种同工酶SHMT1(细胞质)和SHMT2(线粒体)催化相同的反应。
1.2 一碳代谢

Fig. 1 An important branch of glycolysis:biosynthesis pathways of serine and glycine

Fig. 2 Overview of one-carbon metabolic pathway formed by the coupling of folate cycle and methionine cycle
一碳代谢是指叶酸循环和蛋氨酸循环耦合形成的双环途径(图2)。在叶酸循环中,叶酸(folic acid)被二氢叶酸还原酶(dihydrofolate reductase,DHFR) 还原两次, 最终生成四氢叶酸(tetrahydrofolate,THF)。THF 接受来自丝氨酸生成甘氨酸时提供的一碳单位形成5,10-亚甲基四氢叶酸(5,10-methylene-THF,me-THF)。此外,甘氨酸在甘氨酸脱氢酶(glycine dehydrogenase,GLDC)作用下也可生成me-THF。me-THF既可被5,10-亚甲基四氢叶酸还原酶(5,10-methylene-THF reductase,MTHFR) 还原生成5-甲基四氢叶酸(5-methyl-THF,mTHF),也可被亚甲基四氢叶酸脱 氢 酶 1/2/2L (methylene-tetrahydrofolate dehydrogenase1/2/2L,MTHFD1/2/2L)进一步氧化为10-甲酰四氢叶酸(10-formyl-THF,F-THF)。最后,mTHF 在甲硫氨酸合成酶(methionine synthase,MS)作用下去甲基化形成THF,同时将一碳单位转移至同型半胱氨酸(homocysteine)进而生成甲硫氨酸(methionine)。
mTHF的去甲基化标志着叶酸循环的完成和甲硫氨酸循环的开始。甲硫氨酸在甲硫氨酸腺苷转移酶(methionine adenosyltransferase,MAT)作用下生成SAM。组蛋白甲基转移酶(histone methyl transferase,HMT)进一步将SAM 去甲基化生成SAH。最后,SAH 被S-腺苷同型半胱氨酸水解酶(SAH hydrolase,SAHH)催化生成同型半胱氨酸,从而完成甲硫氨酸循环。
1.3 研究方法
本文通过将新陈代谢置于一个适应性过程中来研究代谢网络的动力学[20]。本方法参数空间中存在一种通用的“调节”动力学,其作用是提高代谢网络的稳定性。关键思想是采用动态景观及其相关的势函数来描述随机网络的稳定性。通过随机动力学分解,建立了非梯度系统中势函数的存在性和构造[21]。“调节”动力学能够将酶参数引向能够使代谢网络稳定的空间。此外,考虑到化学反应的热力学约束,进一步约束了酶参数空间的范围,从而提供一个真实的代谢模型。下面是本文研究方法的具体内容。
对于细胞内的化学反应,可表示为:
其中,S是反应的底物,P是反应的产物。m和n分别是底物和产物的数量。VF和VB分别为反应的正向和反向最大反应速率。
反应的通用速率方程[22]可写为:
其中,xi和yj分别是底物和产物的浓度。Ki和Kj'是每个底物的和产物的米氏常数(Michaelis-Menten constant)。f1和f2是由和给出的归一化因子,用来表示产物抑制作用。f1和f2满足如下关系:
方程(2)同时描述正向反应和逆向反应,表面上看与简单的米氏方程形式不同。在前期工作中[22-23],本课题组详细推导了对于典型的酶反应过程,包括单一底物Uni-Uni 机制、单一底物Uni-Bi机制、双底物随机序列Bi-Uni机制、双底物随机序列Bi-Bi机制、双底物顺规序列Bi-Bi机制以及双底物乒乓序列Bi-Bi 机制,通过适当的参数变换,其反应方程都能放到方程(2)的框架中。因此,该方程具有普适性。同时,对于大规模的代谢网络动力学建模,采用普适形象的酶反应速率形式能够处理任意数量的底物和产物,特别有利于大规模的计算。
对于方程(3),其表示酶反应可逆进行。当底物浓度xi和产物浓度yj很小时,方程(2)的分母可被归一化。对于方程(4),其表示酶反应逆向进行,此时VF= 0,反应速率和xi无关,方程(2)的分子和分母中的第一项可被消除。类似地,方程(5)表示酶反正向进行,此时VB= 0,方程(2)中的分子和分母等于零。
本文考虑一个由N个代谢物构成的代谢网络,网络代谢物浓度可表示为:
其中,T表示转置。对于这样的一个代谢网络,关于网络的动力学方程可写为:
其中,S是(N×M)的化学计量矩阵,连接化学反应和代谢物,M是代谢网络包含的化学反应总数。v(x)是(M× 1)的速度矩阵,其每个分量以式(2)形式表示。b(x,t)是(N× 1)的向量,表示进出代谢网络的通量,也是模型中代谢网络的边界条件。V为参数空间中覆盖网络上所有化学反应的向量,即所有反应的VF和VB。如果b(x,t)不是t的显函数,那么b(x,t)可以并入式(7)的第一项中。此后,假设b(x,t) =b(x),式(7)变为:
处于式(8)下的动力学系统通常是不稳定的,一些代谢物会迅速积累而另一些会快速消耗。在这里,相关的一个生物学问题是:活细胞如何在代谢物和酶浓度处于波动下调整其参数并保持代谢稳定性。为了找到在式(8)下调整参数以实现代谢网络稳定的方法,本文对式(8) 添加随机噪声ξ(x,V,t),其表示代谢网络上的随机波动,得到:
其中,D为随机噪声ξ的扩散矩阵,δ为随机噪声ξ的方差,T表示矩阵的转置。ξ的均值为0,方差如式(10)所示。值得注意的是,本方法中,系统的稳定性是指稳态解可以在随机扰动下保持稳定,而随机扰动存在于任何生物系统中。因此,让其参与“调节”的构建是合理的。
通过上文提及的随机动力学分解[21],识别出系统的势函数ϕ(x,V),即式(9)的Lyapunov 函数,其满足如下关系:
其中,∑(X,V)是一个非负对称矩阵,Ω(x,V)是一个反对称矩阵。∑(X,V)和Ω(x,V)均由扩散矩阵D决定。在本文的定义中,稳定的代谢网络解对应势ϕ(x,V)中的局部最小值。
进一步将一个非负代价函数ψ(x,V) 与Lyapunov 函数ϕ(x,V)的变化联系起来。ψ(x,V)为每个代谢物的变化速率F与∑的乘积,表示代谢网络的整体通量(flux)。
当V不变时,ψ(x,V)与ϕ(x,V)有如下关系:
由上式可知,当V不变时,ϕ(x,V)实际上是原始网络的Lyapunov 函数。在x(t)的轨迹上,作为Lyapunov 函数的一个性质,ϕ(x,V)随时间单调递减,这也被式(13)所证示。如果x接近稳态,则因此,“调节”的目的是改变V,使dϕ(x,V)/dt趋近0-。为此,本文对V加入了如下调节:
其中,W(x,V)是对称部分有正特征值的矩阵。我们考虑真实的代谢过程,确定了W(x,V)的具体形式,“调节”的最终形式为:
其中,τ是调节过程的特征时间尺度,NK是指受VK影响的代谢物总数,VK∈{VF,VB},cn是第n个代谢物的碳数。当给出VF和VB的初始值后,如果代谢网络不能达到稳定,则初始值能够在式(15)的作用下逐步增大并最终使代谢网络达到稳定状态。通过式(15)得到了一组可以满足系统达到稳定的{VF,VB}。注意,任何通量平衡解F(x,V) = 0 都是式(15)的解。因此,式(15)可以被视为是一种增强的通量平衡分析,其优势是可排除代谢网络的不稳定解。对于式(14)能够提高代谢网络稳定性的证明以及W(x,V)具体形式的确定,详见参考文献[20]。
本文进一步考虑热力学定律对代谢网络的影响,化学反应的平衡由生成物和反应物之间的吉布斯自由能差决定,这反过来又决定了每个反应的平衡常数Keq。因此,每个化学反应的热力学约束如下所示:
其中,ΔG是吉布斯自由能差,R为普适气体常数,T为热力学温度。 式 (16) 在准稳态(quasistationary)下成立,对于每组{VF,VB},式(16)给出了米氏常数{K,K'}的一组优化条件。对于满足式(16)的{K,K'},保持和的比值不变从而确定代谢物的最佳浓度。对于真实的代谢过程,{K,K'}的变化可能是代谢物抑制或激活的结果。
作为方法的一个应用,还可以计算出代谢网络的弛豫时间(relaxation time),即代谢网络中的代谢物浓度由偏离稳态恢复到稳定状态所用的时间,其可以用来评估代谢网络稳态解的稳定性以及代谢网络的动态特性。为了量化分析,将式(7)线性化。当式(7)处于稳态时,计算其雅可比矩阵(Jacobian matrix)的特征值λi。本文将弛豫时间定义为:
其中,N是非零特征值的个数。零特征值对应于线性化方程中的冗余自由度,因此它们被排除在计算之外。非零值的数量由式(7)中化学计量矩阵S的秩决定,当不存在负实部特征值时,证明了解的稳定性。
2 结果
2.1 胃癌细胞代谢动力学模型
本研究构建的胃癌细胞代谢动力学模型所包含的代谢途径包括糖酵解(glycolysis)、糖异生(gluconeogenesis)、丝氨酸和甘氨酸的生物合成(serine and glycine biosynthesis)、一碳代谢以及TCA 循环(图3)。模型代谢网络由61 个代谢物和50个化学反应构成,表1列出了代谢网络所包含的代谢物及相关参数信息。
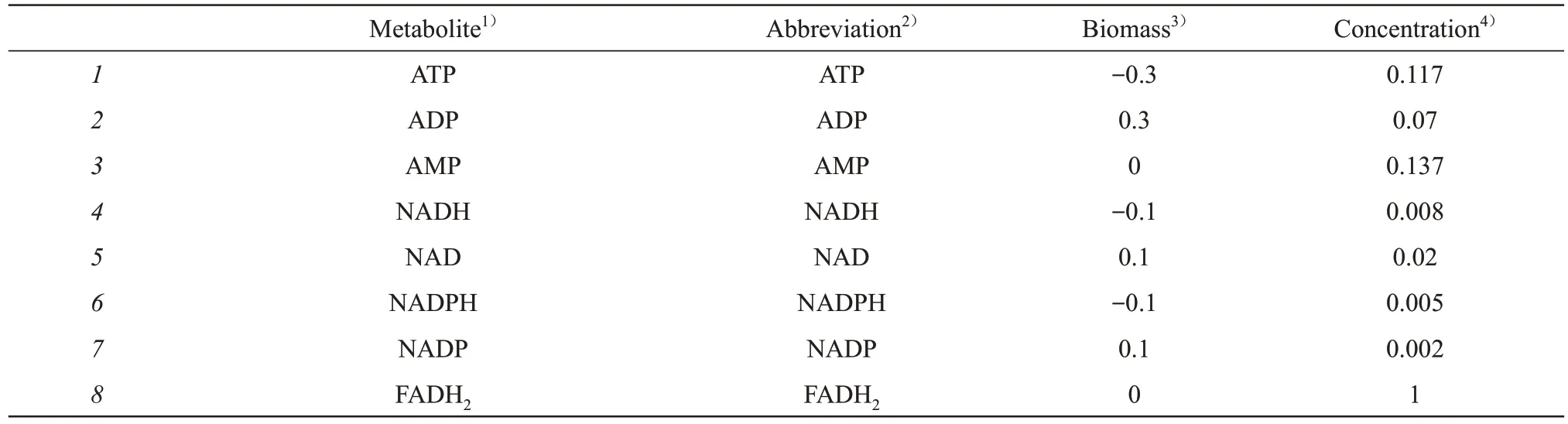
Table 1 Metabolites and related parameters contained in the metabolic kinetics model of gastric cancer cell

Continued to Table 1

Continued to Table 1
由式(15)可知,模型代谢网络的稳态通量与VF和VB的初始值有关。根据这一特点,我们可以通过改变VF和VB的初始值来对模型进行多次计算,从而得到具有一定统计学意义的模型稳态代谢网络通量,这有助于对模型可靠性和真实性的判断。因此,我们从小的初始值开始,逐步增大VF和VB的值(0.01~1,增幅0.01),对模型进行了100次模拟计算并得到其对应初始值的代谢网络稳态通量(模型100次模拟计算结果见表S1)。
对100 次代谢网络的稳态通量进行聚类分析,其稳态通量的整体水平如图4a 所示。之后,使用来自上海交通大学附属瑞金医院的胃癌组织RNA-seq数据,从中提取出图3所包含的酶基因数据并按照图4a 排序,接着采用主成分分析(principal component analysis,PCA)对其进行降维处理(图4b)。图4a 中43 个化学反应(总数为45)的稳态通量水平与图4b 中对应的酶基因表达水平一致,匹配率为95.6%。上述结果表明,模型计算结果与其对应的胃癌组织RNA-seq数据比对良好,证明了本文所构建的胃癌细胞代谢动力学模型的可靠性。关于模型构建及验证的更多细节见3.1。
2.2 丝氨酸/甘氨酸代谢转换的可控调节
为确定胃癌细胞对丝氨酸/甘氨酸的利用情况以及丝氨酸/甘氨酸摄入对胃癌细胞代谢网络的影响,本文通过改变胃癌细胞代谢网络的边界条件,即式(8)中的b(x),模拟了胃癌细胞的4 种摄入状态:不摄入丝氨酸和甘氨酸;只摄入丝氨酸;只摄入甘氨酸;丝氨酸和甘氨酸均摄入。丝氨酸/甘氨酸转化的稳态通量计算结果与丝氨酸/甘氨酸摄入的对应情况如表2所示。
由表2可知,丝氨酸/甘氨酸转换的稳态通量随着丝氨酸/甘氨酸摄入情况的不同,其计算结果存在符号的改变,表明丝氨酸/甘氨酸转化的方向发生了相应的变化。在胃癌细胞代谢动力学模型中,胞外丝氨酸的可用性决定了胞内丝氨酸/甘氨酸的转换方向。当胞外丝氨酸可用时,胞内由丝氨酸生成甘氨酸;当胞外丝氨酸不可用时,胞内由甘氨酸生成丝氨酸。这也意味着,通过改变模型的边界条件能够实现对丝氨酸/甘氨酸转换的可控调节。
2.3 模型代谢网络稳态通量变化
丝氨酸/甘氨酸转换提供的一碳单位能够参与多种可能的代谢途径影响细胞的增殖能力,包括核苷酸的生物合成、蛋白质的生物合成以及DNA 的甲基化[5](图5)。为确定丝氨酸/甘氨酸转化对胃癌细胞一碳代谢的动态影响,本文计算了不同丝氨酸/甘氨酸转换速率下胃癌细胞代谢动力学模型的代谢网络稳态通量。
当模型不能从胞外摄取丝氨酸和甘氨酸时,细胞内由甘氨酸转化为丝氨酸(表2)。在这种情况下,上调甘氨酸生成丝氨酸的VF和VB,来模拟增加其对应的酶(SHMT)活性。此时一碳单位的消耗速度增加,其能够影响一碳代谢中多个调控细胞增殖的关键代谢物(mTHF,SAM 等)的生成水平。这也意味着,通过计算模型处于不同SHMT活性下的一碳代谢稳态通量,能够确定一碳代谢中受丝氨酸/甘氨酸转化速率影响最显著的代谢反应。图6 展示了模型丝氨酸/甘氨酸转换处于VF,VB=1(图6a)和VF,VB=10(图6b)时一碳代谢途径的稳态通量计算结果(其他反应速率不变)。

Fig. 5 One-carbon unit from the serine/glycine conversion can be involved in several possible metabolic pathways to influence cell proliferation
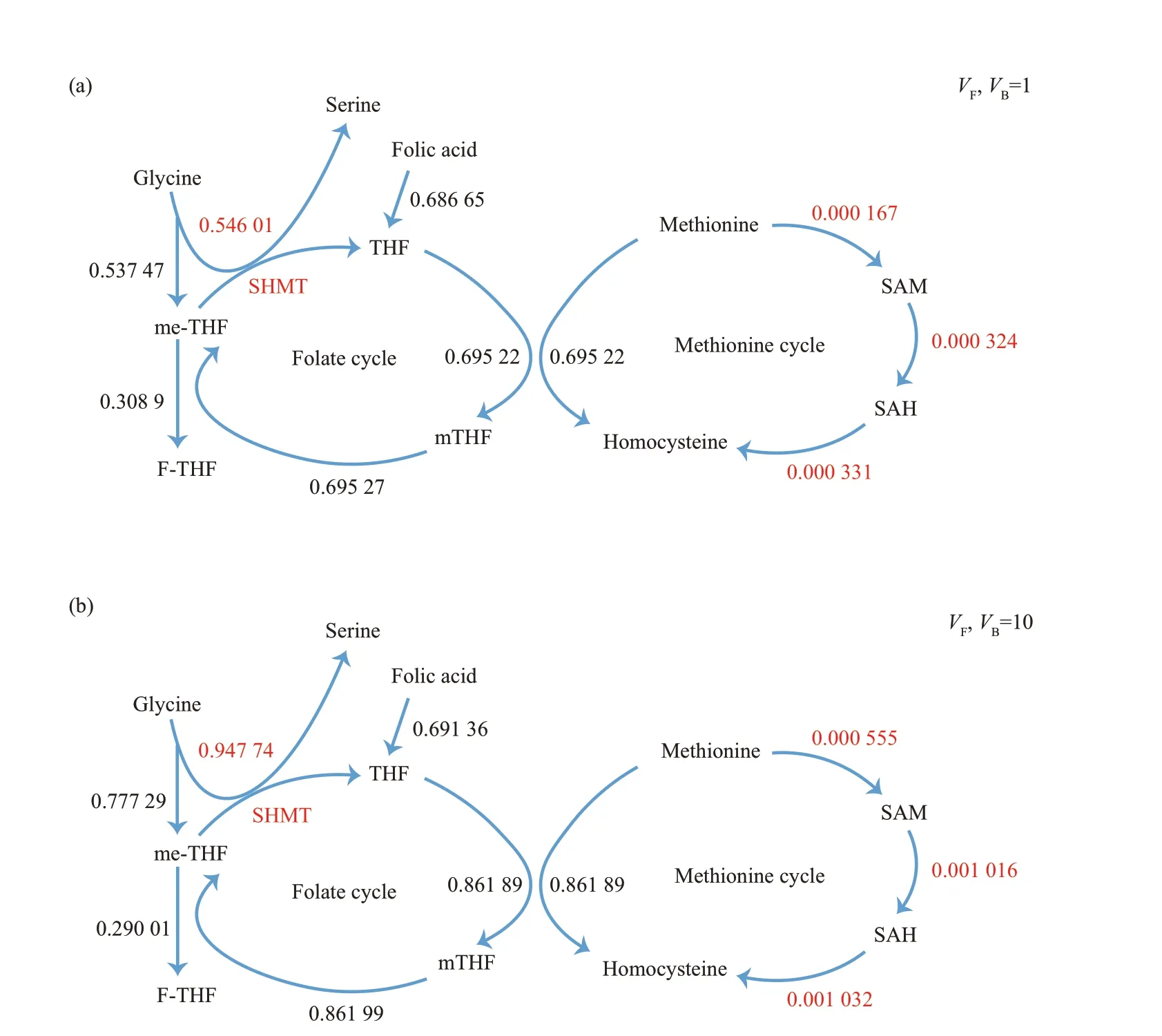
Fig. 6 Steady-state flux of one-carbon metabolism pathways in kinetics model of gastric cancer cells at conversion rate is equal to 1(a)and 10(b)
表3列出了一碳代谢中各个化学反应在甘氨酸生成丝氨酸的VF和VB由1 变为10 后的稳态通量增幅。由表3可知,当甘氨酸转化为丝氨酸的速率提高时,胃癌细胞代谢动力学模型显著增加生成SAM、SAH 和同型半胱氨酸的稳态通量,分别增加了231.58%、213.57%和212.23%。表明在胃癌细胞中,丝氨酸/甘氨酸转化速率显著影响一碳代谢中SAM、SAH和同型半胱氨酸的生成水平。

Table 3 The percentage increase of steady-state flux of one-carbon metabolism after VF and VB change from 1 to 10
3 讨论
3.1 胃癌细胞代谢动力学模型的构建及验证
3.1.1边界条件
在胃癌细胞代谢动力学模型的构建过程中,除了确定模型所包含的代谢途径(图3),还需要考虑代谢网络的边界条件。当只选择细胞中完整代谢反应的一个子集进行研究时,需要处理所选部分与细胞其余部分以及细胞环境之间的通量。本文采用3 种处理方式的耦合来模拟式(7)中的外部相互作用。
第一种处理方法是让代谢物如CO2或磷酸盐(phosphate)保持恒定的浓度。这适用于代谢物参与大量反应,或者代谢物可以自由地进出细胞。第二种处理是对于某些特定的代谢物对(通常是辅酶),例如三磷酸腺苷(ATP) 和二磷酸腺苷(ADP)。其中,一对代谢物中的某一个代谢物总是出现在另一个代谢物所参与反应的不同侧。因此,这些特定代谢物对的总浓度在代谢网络上保持守恒。本文通过为每对代谢物添加虚拟循环反应(virtual recycling reaction)来模拟边界通量去处理这种类型。第三种也是最常见的一种边界条件,涉及代谢网络的养分摄取(nutrient intake)和生物量生产(biomass production)。在代谢动力学模型中,除了代谢网络所包含的代谢物(表1),还添加了一种虚拟的“外部”代谢物(external metabolite),它能够和代谢网络中的某些代谢物进行反应,以此代表这些代谢物和模型中未包括的代谢部分之间的可调节交换。在2.2中,正是通过调节这种“外部”代谢物与丝氨酸/甘氨酸的通量交换实现了丝氨酸/甘氨酸转换的可控调节。
3.1.2初始值
对于大规模的代谢网络动力学建模,获得足够多的体内动力学参数一直是一个主要的障碍[26]。在没有可靠实验数据情况下,本文将代谢物的初始浓度设为1 mmol/L。同理,将式(2)中的初始米氏常数Ki和Kj'分别设为其对应底物和产物的初始浓度,即xi/Ki=xj/Kj'= 1。这样的设定来自对生理条件下细胞中化学反应的观察,当反应物浓度与酶的亲和力相匹配时,酶是最有效的[27]。对于生理条件下已知可逆的所有化学反应,其热力学平衡常数(thermodynamic equilibrium constants)Keq设为1。对于模型中所有化学反应的VF和VB,不同的初始值会得到不同的代谢网络稳态通量。本文对VF和VB选择了较小的初始值。如果初始值能够使代谢网络达到稳定,则不对其进行调控。如果初始值不能使代谢网络达到稳定,则其在方程(15)的调控作用下,逐步增大并最终能够使代谢网络达到稳定状态。对于胃癌细胞代谢动力学模型所包含的61 个代谢物,30 个由胃癌组织代谢组学数据确定[24-25],其余浓度均设为1 mmol/L(表1)。当得到胃癌细胞更多精确的动力学参数信息时,模型可以得到进一步优化。
3.1.3模型计算结果与对应RNA-seq数据的对比
在2.1中,为验证本文所构建的胃癌细胞代谢动力学模型的可靠性,将不同初始值下的模型代谢网络稳态通量与上海交通大学附属瑞金医院的胃癌组织RNA-seq 数据(https://www.ncbi.nlm.nih.gov/geo/,GSE54129)进行了对比(图4)。在对生物学信息进行分析时,通常会面临大量的高维数据,如基因表达数据(图4b)和蛋白质表达数据等。这些数据可能包含大量的变量,而且这些变量之间可能存在复杂的相互关系。为了更好地理解和解释这些数据,需要将这些数据转换为更低维度的表示形式。PCA 就是一种常用的降维方法,它可以将高维数据转换为低维数据,同时保留原始数据中的主要变化信息[28]。换句话说,通过PCA 降维,能将生物学信息中的“噪声”信息去除。
在图4a 中,根据聚类分析结果将模型计算结果分为3 组(A1、A2、A3),其分别与图4b 中根据基因表达情况和聚类分析结果(PCA 降维后)所划分的3 组胃癌组织样本(B1、B2、B3)相对应。在对比过程中,优先考虑A1-B1和A3-B3。除去电子传递链(electron transport chain,ETC)部分(原因见3.1.1),选择45个化学反应的稳态通量与其对应的酶基因表达进行对比。其中,43 个化学反应对比良好。需要特别说明的是,与3.2相关的化学反应被包含在内。
3.2 丝氨酸/甘氨酸转换影响胃癌细胞增殖的动力学机制
在2.2中,通过改变胃癌细胞代谢动力学模型摄取丝氨酸/甘氨酸的能力,模拟胃癌细胞不同的营养摄取模式。当丝氨酸可用时,模型优先消耗丝氨酸生成甘氨酸,表明胃癌细胞与其他多种癌症细胞一样优先摄取丝氨酸以满足其增殖需求[11]。由表2可知,模型胞外丝氨酸的可用性还能够决定胞内丝氨酸/甘氨酸转换的方向,这与多种肿瘤的生长和增殖都依赖于细胞外丝氨酸的可用性一致[29]。当小鼠被限制了丝氨酸和甘氨酸的摄入时,HCT116 结肠癌细胞的异种移植生长速度大约是正常饮食的一半[30]。在人类结肠癌和肺癌细胞系中,细胞在含有丝氨酸而不含甘氨酸的培养基中的增殖程度,与在含有这两种氨基酸的培养基中的增殖程度难以区分,而单独切断丝氨酸与耗尽这两种氨基酸对细胞增殖的影响程度相同[11]。结合上述研究及本文的模拟结果,表明丝氨酸/甘氨酸转换的方向改变可能是丝氨酸影响癌症细胞增殖的关键原因。
丝氨酸到甘氨酸的转化提供了一个一碳单位,而甘氨酸到丝氨酸的转化需要一个一碳单位(图5)。胃癌细胞优先消耗丝氨酸生成甘氨酸表明其对于一碳单位的需求可能推动了丝氨酸到甘氨酸的转化。在2.3中,通过增加胃癌细胞代谢动力学模型中甘氨酸转换成丝氨酸的反应速率,模拟胃癌细胞快速消耗一碳单位,这会导致其用于细胞增殖的一碳单位不足。通过观察模型在一碳单位不足应激下的自主调控发现,其显著上调了生成SAM 和SAH的稳态通量(分别增加231.58%和213.57%),而其他代谢途径如mTHF 生成的稳态通量变化则较小(增加23.97%)。在多种类型的癌细胞中,叶酸代谢所提供的一碳单位参与SAM 生成的反应似乎具有较低的活性,这与本文2.3中SAM的生成通量水平较低一致(图4)。但最近的研究表明,丝氨酸的可用性能够影响ATP 的从头合成从而间接支持SAM 的生成[31],本文的结果进一步支持了该结论。
SAM 是DNA 和RNA 甲基化以及组蛋白甲基化反应的主要甲基供体,DNA 序列特定位点和组蛋白尾部的甲基化是人体基因组中调节基因表达的主要表观遗传特征之一。SAM 及其衍生物SAH 可以通过调节关键表观遗传酶的活性,直接影响肿瘤细胞的表观遗传景观(epigenetic landscape),最终决定癌症细胞的命运[32-33]。最近的一项体外实验表明,SAM对于胃癌细胞的增殖能力具有重要影响。高水平的SAM 显著抑制了胃癌细胞的增殖能力,而低水平的SAM 则能够促进胃癌细胞的增殖[34]。此外,SAM 也被证明能够显著影响体外乳腺癌细胞和结直肠癌细胞的增殖能力[35-36]。胃癌细胞代谢动力学模型在甘氨酸转化为丝氨酸的速率提高时,显著提升了SAM的生成通量,而SAM又与胃癌细胞增殖能力密切相关。这表明可以通过改变胃癌细胞中丝氨酸/甘氨酸的转化速率来调控SAM 的生成,其可能通过改变细胞甲基化水平进而影响其增殖能力。
综上所述,本文的研究结果表明,胃癌细胞中由丝氨酸/甘氨酸转换所提供的一碳单位对SAM和SAH 的生成具有重要影响,而SAM 作为细胞内重要的甲基供体,其水平能够直接调控细胞的增殖能力。这表明在胃癌细胞中,丝氨酸/甘氨酸代谢很有可能是通过改变SAM 水平进而调控细胞甲基化来影响其增殖能力。这可能是丝氨酸/甘氨酸代谢能够影响胃癌细胞增殖的一种潜在动力学机制。
4 结论
胃癌是世界范围内恶性程度最高的肿瘤之一,也是中国重大的健康威胁。癌症代谢的相关研究表明,丝氨酸/甘氨酸代谢对肿瘤细胞的增殖能力具有重要影响。本研究通过构建胃癌细胞代谢动力学模型并对其进行调控分析,证明了胃癌细胞对于丝氨酸的优先摄取以及丝氨酸/甘氨酸转换速率对SAM 和SAH 生成的重要影响,其很有可能是丝氨酸/甘氨酸代谢能够影响胃癌细胞增殖的一种潜在动力学机制。本文的研究结果进一步强调了癌症细胞丝氨酸/甘氨酸代谢与SAM的联系,这为靶向丝氨酸/甘氨酸代谢的抗癌疗法提供了新的思路和方向。
利用本研究所采用的大型代谢动力学建模方法,能够在动力学参数不足的情况下构建一个稳定的代谢动力学模型。当获得更多可靠的生物学信息时,模型可以被进一步优化。在此基础上,通过改变癌症细胞动力学模型的边界条件或者特定代谢途径的反应速率,能够模拟癌症细胞在不同应激生理条件下的自主反应,为探索癌症发生发展的分子机制以及寻找新的治疗靶点提供了一种新的视角。
致谢感谢上海纳诺巴伯纳米科技有限公司对本研究的帮助和支持,感谢实验室成员姚梦超、熊瑞琪、苏洋、杨旭云的讨论。
附件见本文网络版(http://www.pibb.ac.cn或http://www.cnki.net):
PⅠBB_20230127_Table_S1.xlsx
