miR-451a和miR-21-5p双重实时荧光定量PCR检测体系的建立及应用*
2024-03-23胡舒啸陈惠香赵一霞季安全孙启凡
胡舒啸 陈惠香 胡 胜 赵一霞 季安全 李 洋 廉 洁 孙启凡**
(1)中国人民公安大学侦查学院,北京 100038;2)公安部鉴定中心,现场物证溯源技术国家工程实验室,法医遗传学公安部重点实验室,北京 100038;3)山西医科大学法医学院,太原 030001)
MicroRNA(miRNA)是一类内源性非编码RNA,具有高度稳定性及组织特异性等优点[1]。自2009年Hanson及其团队首次揭示了miRNA应用于法医体液鉴别的潜力以来,越来越多的体液特异性miRNA被筛选和验证[2-5]。体液鉴别是法医学中的一个重要课题,它可以为犯罪现场重建、嫌疑人排除、受害者辨认等提供重要的线索和证据。目前法医学借助特异性miRNA 对未知样本进行体液鉴别主要依靠的是实时荧光定量PCR (red time fluorogenic quantitative PCR)检测技术。该方法可以高效灵敏地定量检测低丰度表达的miRNA分子,也被称为法医学定量检测miRNA的金标准[6-7]。但目前使用该技术的相关研究大多采用单独逆转单重扩增的检测方式,当实验中需要对多个miRNA 标记进行同时检测时,就不可避免地需要进行多个单重检测反应[8-11]。同时犯罪现场中提取到的检材往往是微量的,此时往往需要对其等分或者进行稀释,而这两种策略都是以降低灵敏度为代价。此外,并行多个单重分析会成倍地增加工作量、各项成本以及错误风险,不利于将相应的研究成果真正意义的应用到法医实践中。基于以上原因,建立起miRNA 多重实时荧光定量PCR 检测体系可以使其在兼顾准确的同时更高效地对miRNA进行检测。
血液(血痕)是犯罪现场中最为常见的检材,在一些性侵案中确定血痕是暴力损伤性出血还是女性正常的生理性出血造成的对于确定案件性质以及犯罪现场重建都有着十分重要的意义[12]。本实验室前期基于miR-451a/miR-21-5p的表达量关系鉴别月经血(menstrual blood, MB) 与外周血(peripheral blood,PB)的方法以及单重实时荧光定量PCR 检测技术,成功实现了对PB 和MB 的100%鉴别[10-11],但该检测方法需要分别对两种miRNA 进行定量检测。本文在此基础上,进一步建立了可同时定量miR-451a和miR-21-5p的双重检测体系,并对其鉴别能力和实际应用能力进行了验证。结果表明,该检测体系具有良好的特异性、重复性和准确度,同样可以100%区分PB和MB,同时还大大节省了实验时间和样本消耗,为建立更多重miRNA 的实时荧光定量PCR 检测体系提供了思路和参考。
1 材料与方法
1.1 材料
1.1.1样本采集
依据知情同意原则,本实验共采集国内北方地区25~35 岁志愿者样本64 份,其中PB 样本和MB样本各23 份,唾液(saliva,SA) 样本、精液(semen, SE) 样本和阴道分泌物(vaginal secretion,VA)样本各6份。58份用作构建鉴别方法,剩余6份(3PB,3MB)被制作成模拟案件样本验证58份样本数据所得到的鉴别方法的准确性。样本采集已通过公安部物证鉴定中心伦理委员会审查批准。样本的采集均符合研究要求和操作规范,制备处理后置于-80℃冰箱中备用[11]。
1.1.2制备标准品及引物探针
从miRBase 数据库中查询并下载miR-451a 与miR-21-5p 的序列信息,结合引物探针设计原则和miRNA 的自身特殊属性[13-17],使用在线软件OligoAnalyzer™ Tool 和软件Primer Express 3.0 自行设计适用于双重检测的茎环逆转录引物、实时荧光定量PCR引物(通用正向引物、特异性反向引物)以及TaqMan-MGB 探针(表1)。以上材料委托生工生物工程(上海)股份有限公司合成。miR-451a、 miR-21-5p、 miR-891a-5p、 miR-144-5p、miR-203a-3p和miR-320a-3p标准品由本实验室前期委托宝日医生物技术(北京)有限公司合成并于-80℃冰箱中储存[18-19]。
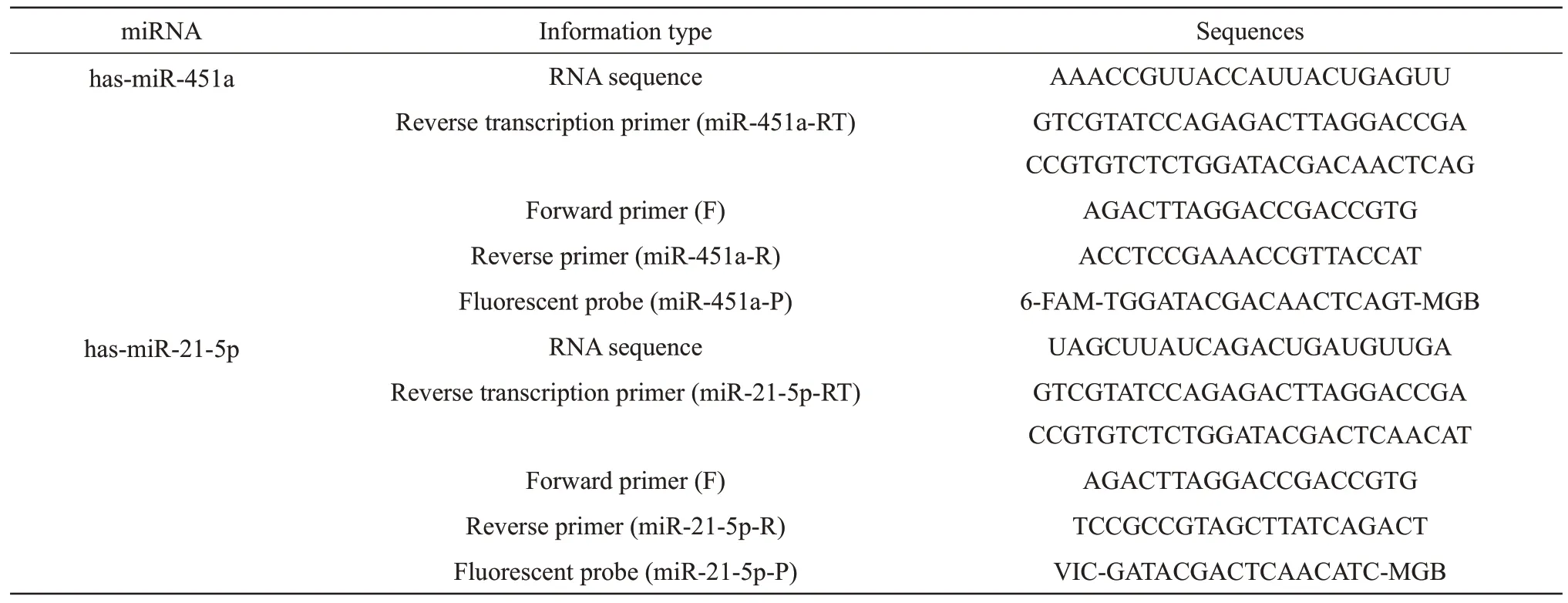
Table 1 Sequences of miR-451a and miR-21-5p themselves and their primers/probes
1.2 方法
1.2.1RNA提取与定量
选用miRNeasy mini 试剂盒(Qiagen,德国)提取样本的总RNA[20], 震荡离心后通过NanoDrop 2000c 分光光度计(Thermo Fisher,美国)测定其浓度并通过纯度(A260/A280)判断提取的RNA质量。
1.2.2逆转录
选用TaqMan ™ MicroRNA 逆转录试剂盒(Thermo Fisher,美国)进行复合逆转录实验合成cDNA。15 µl 反应体系包括:10×逆转录缓冲液1.5 µl、MultiscribeTM逆转录酶(50 U/µl)1.00 µl、RNase 抑制剂 (20 U/µl) 0.19 µl、 dNTP mix(100 mmol/L)0.15 µl、miR-451a-RT 与miR-21-5p-RT(1 µmol/L)各0.75 µl、无核酸酶水5.66 µl、样本5 µl(总RNA 含量为10 ng)。程序运行条件为:16℃、30 min,42℃、30 min,85℃、5 min。运行完成后置于4℃保存。将样本替换为无核酸酶水,设置无模板阴性对照(no template control,NTC)。
1.2.3双重qPCR反应体系的建立和优化
对miR-451a和miR-21-5p的混合标准品(各含5 ng)进行逆转录实验,接着使用QuantStudioTM7 Flex Real-Time PCR 仪运行该实时荧光定量PCR反应,反应体系包括:TaqManTMUniversal Master Mix ⅠⅠ(no UNG)5 µl、miR-451a 正反向引物各0.4 µl(终浓度均为400 nmol/L)、miR-21-5p 正反向引物各0.4 µl(终浓度均为400 nmol/L)、miR-451a-P 与miR-21-5p-P 各0.3 µl (终浓度均为300 nmol/L)、cDNA 模板0.67 µl、无核酸酶水2.13 µl。扩增反应程序为:50℃ 2min,95℃10 min;95℃ 15 s,57℃ 1 min,72℃ 30 s,循环40次。
在保证以上双重实时荧光定量PCR 反应体系中其他条件不变的情况下重点优化引物终浓度(100、200、300、400、500 nmol/L)和探针终浓度(100、200、300、400 nmol/L),并设置阴性对照组(将cDNA替换为NTC组产物)。以上所有检测均重复3次,尽可能减少操作误差。
1.2.4构建标准曲线
使用miR-451a和miR-21-5p的混合标准品(各含5 ng)先进行8 个梯度的5 倍连续稀释,再继续后续的双重实时荧光定量PCR 扩增实验,最终根据中间6 个梯度的实验数据制作miRNA 定量循环(quantification cycle,Cq)均值和起始拷贝数对数值(lg(copies/μl))间的标准曲线(所有梯度均重复3 次实验),其中各梯度下标准品起始拷贝数根据公式Copies/μl=NA×C/MW计算得到。NA是阿伏伽德罗常数,计算时取6.02×10²³;C为标准品稀释后的浓度(g/µl);MW为分子质量(g/mol)。
1.2.5验证扩增效率
对逆转录产物使用无核酸酶水进行连续5倍梯度稀释进行后续双重扩增实验并制作qPCR扩增效率曲线(所有梯度均重复3 次实验),并根据公式E=(101/k-1)×100%计算各自的扩增效率。E代表效率(efficiency),k是斜率。
1.2.6特异性分析
分别以miR-891a-5p、miR-144-5p、miR-203a-3p、miR-320a-3p 标记的标准品作为反应模板,miR-451a和miR-21-5p标准品作为阳性对照,无核酸酶水作为阴性对照进行双重实时荧光定量PCR检测,检验其特异性。
1.2.7重复性分析
选取用于建立标准曲线的6个梯度浓度混合标准品为阳性模板,以无核酸酶水为阴性对照模板,进行同一批次和不同批次的双重实时荧光定量PCR 扩增(均重复3 次实验),计算批内和批间变异系数。
1.2.8样本数据处理
对40份血液样本和18份非血液样本进行miR-451a 和miR-21-5p 的双重实时荧光定量PCR 检测,实验数据通过QuantStudio Real-Time PCR系统配套软件收集。使用非参数检验(Mann-Whitney U 检验)进行外周血与月经血、血与非血的差异性的分析,P<0.05 说明两者差异具有统计学意义。同时通过受试者工作特征 (receiver operating characteristic,ROC) 曲线的曲线下面积(area under the receiver operating characteristic curve,AUC)评估该检测体系的体液鉴别能力以及确定最佳截断值。
1.2.9灵敏度检测
取15 份样本(PB、MB、SA、SE、VA 各3份),对其从10 ng 开始进行10 倍梯度稀释(10、1、0.1、0.01、0.001 ng)来进行后续灵敏度检测。目的是确定在miR-451a/miR-21-5p 拷贝数之比(451/21Ratio)结果符合判别标准的前提下双重qPCR检测体系在每种体液中的检测极限。
1.2.10准确性验证
随机选择20 份血样(PB 和MB 各10 份),分别使用单重和双重检测体系进行miR-451a 和miR-21-5p的检测,并对451/21Ratio进行比较。
1.2.11模拟案件样本检测
为进一步验证双重实时荧光定量PCR 检测体系的实际应用能力,分别制备PB 与MB 模拟案件样本各3份(吸取50 μl PB制成血卡,剪取2 cm2的带血卫生棉),并将其放置在室外自然条件下1、4、8 d 后提取RNA,然后按照优化好的双重体系进行检测。
2 结果
2.1 双重qPCR反应体系优化
通过对双重实时荧光定量PCR 反应体系中的引物探针浓度的重点优化,最终确定了适用于检测miR-451a和miR-21-5p的双重实时荧光定量PCR反应体系(表2)。
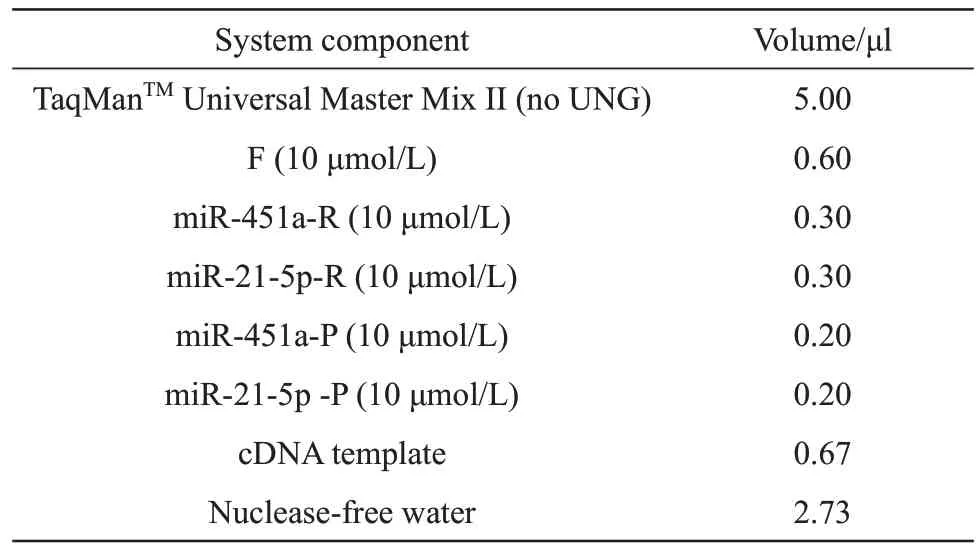
Table 2 Components of duplex real time fluorogenic quantitative PCR assay system
扩增反应程序为:50℃ 2 min,95℃ 10 min;40 次热循环(95℃ 15 s,57℃ 1 min,72℃ 30 s)。同时,在该反应条件下阴性对照组没有出现扩增曲线。
2.2 建立标准曲线
miR-451a与miR-21-5p的标准曲线计算公式分别为y=-4.869x+63.73 和y=-4.719x+61.14,R2均超过0.99(图1a,b)。两条标准曲线均具有良好且较大的线性动态范围。
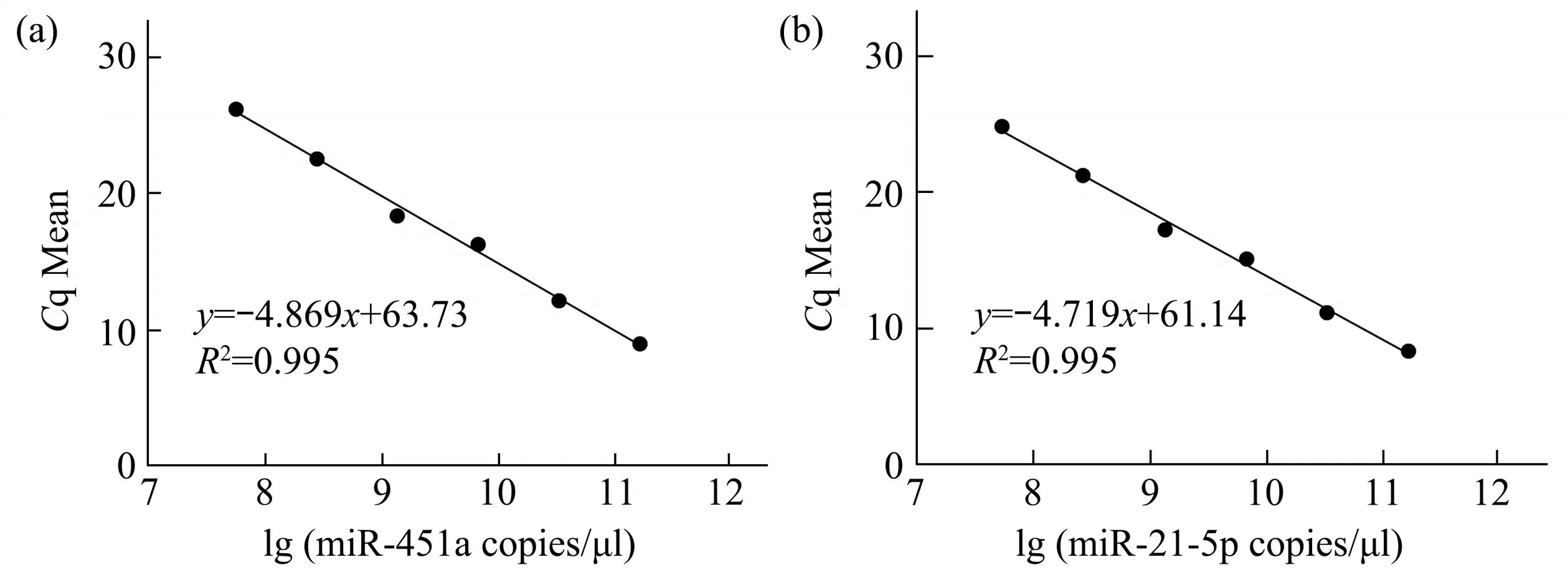
Fig. 1 Standard curve of duplex real time fluorogenic quantitative PCR assay
2.3 验证扩增效率
对稀释好的标准品产物进行优化好的双重qPCR 反应并制作miR-451a 与miR-21-5p 的扩增效率曲线(图2a,b)。两曲线的扩增效率分别为71.77%和74.81%,且R2均达到了0.998。
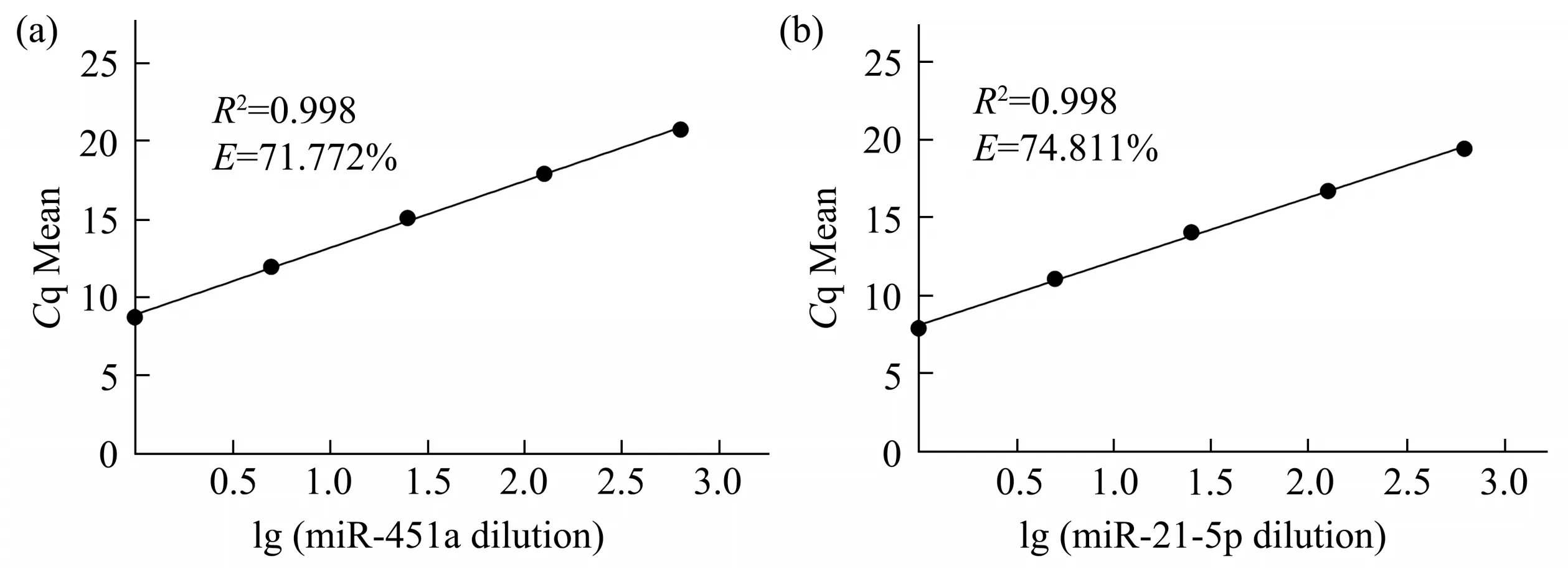
Fig. 2 Amplification efficiency diagram of duplex real time fluorogenic quantitative PCR assay
2.4 特异性分析
使用优化好的双重实时荧光定量PCR 检测体系对miR-451a、miR-21-5p、miR-891a-5p、miR-144-5p、miR-203a-3p、miR-320a-3p 标记的标准品进行特异性检测,结果显示只有miR-451a 和miR-21-5p 两标记出现扩增曲线,其余标记和阴性对照没有出现扩增,说明该双重检测体系具有良好的特异性(图3)。
2.5 重复性验证
使用已经优化的双重实时荧光定量PCR 方法对选取的各浓度梯度混合标准品进行批内和批间重复实验。结果显示两组实验变异系数均在8%以下,说明实验结果可重复性高[21-22],所建立的双重实时荧光定量PCR 方法具有良好的重复性(表3)。
2.6 样本鉴别能力分析
将451/21 Ratio定义为成miR-451a和miR-21-5p的拷贝数之比,其中miR-451a和miR-21-5p的含量可分别通过其标准曲线得到[10],451/21 Ratio计算公式如下所示:
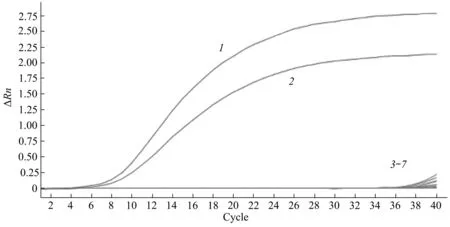
Fig. 3 Specificity test results of duplex real time fluorogenic quantitative PCR assay
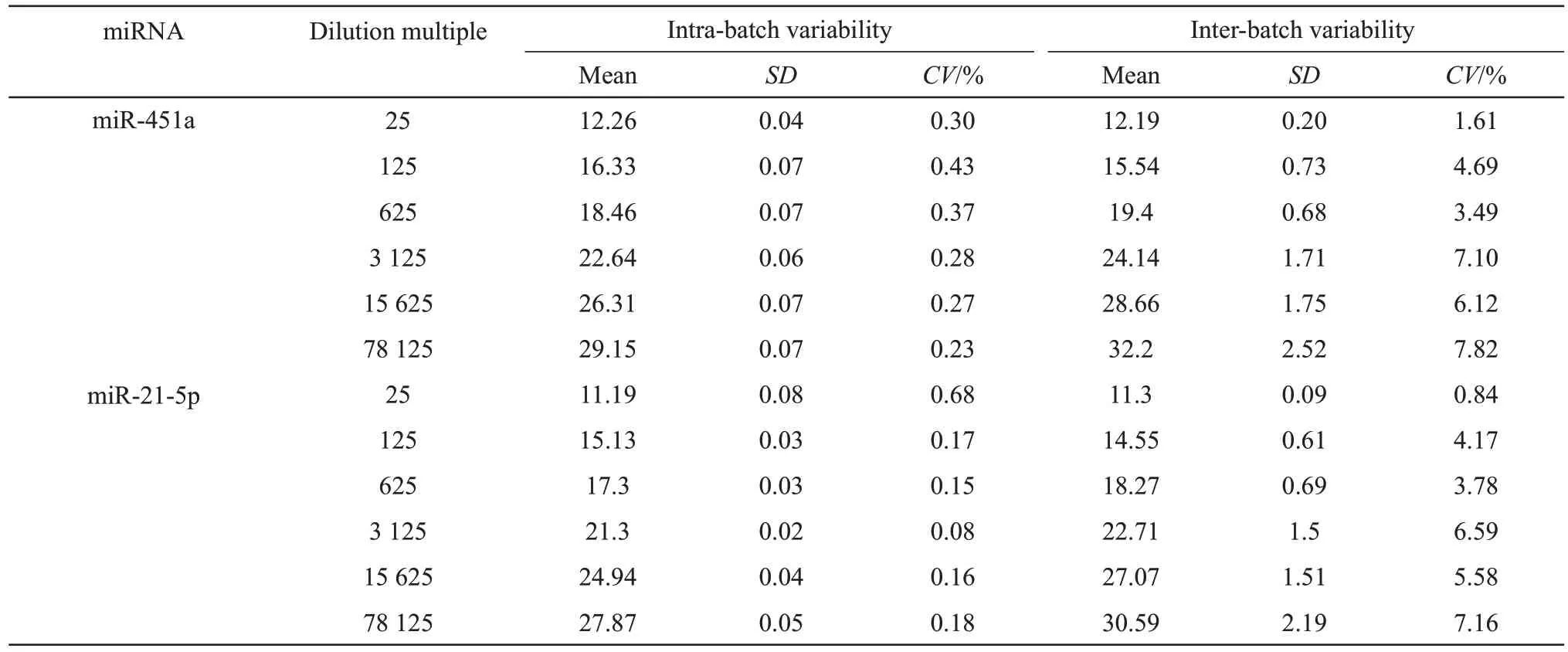
Table 3 Repeatability test results
对提取的58份样本进行miR-451a与miR-21-5p的双重扩增并对得到的数据进行比值计算以评估其应用效果。其中40份血液样本与18份非血液样本的451/21 Ratio 比较结果显示血液样本的比值显著大于非血液样本,且两者具有显著性差异(P<0.000 1)(图4a)。20 份月经血样本与20 份外周血样本的451/21 Ratio 比较结果显示外周血样本比值整体大于月经血样本的比值,两者同样具有显著性差异(P<0.000 1)(图4b)。
对实验数据进行ROC 分析,血与非血、月经血与外周血的ROC 曲线的AUC均为1。这表明基于miRNA 双重实时荧光定量PCR 检测体系得到的数据在采用该鉴别方法后对血与非血、月经血与外周血同样有100%的鉴别效果(图5a,b)。同时,血与非血、月经血与外周血的最佳截断值分别为2.989 和16.240,即该双重实时荧光定量PCR 检测体系的体液判别标准如下所示:当0<451/21 Ratio<2.989时,判别为非血液样本,2.989<451/21 Ratio<16.24 时,判别为月经血,当16.24<451/21 Ratio时,判别为外周血。
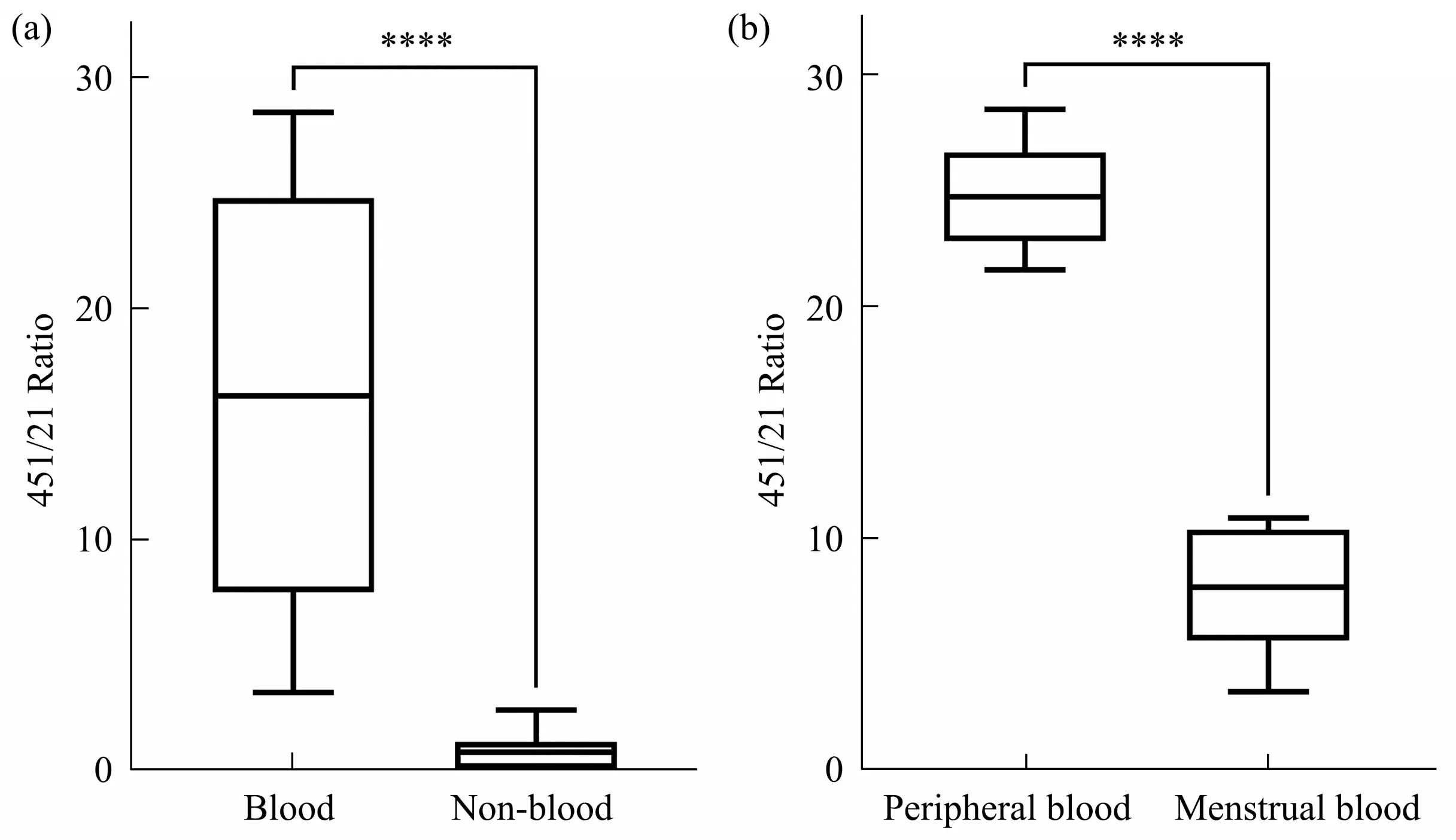
Fig. 4 Sample detection results
2.7 灵敏度检测
由于该实验为同时检测两个标记,所以检材不仅需要满足该样本类型下灵敏度偏低的单个标记所需的总RNA用量,同时451/21 Ratio结果还需要符合该双重实时荧光定量PCR 检测体系的判别标准(表4),即外周血和月经血至少需要0.1 ng 总RNA,唾液、精液和阴道分泌液至少需要1 ng 总RNA。
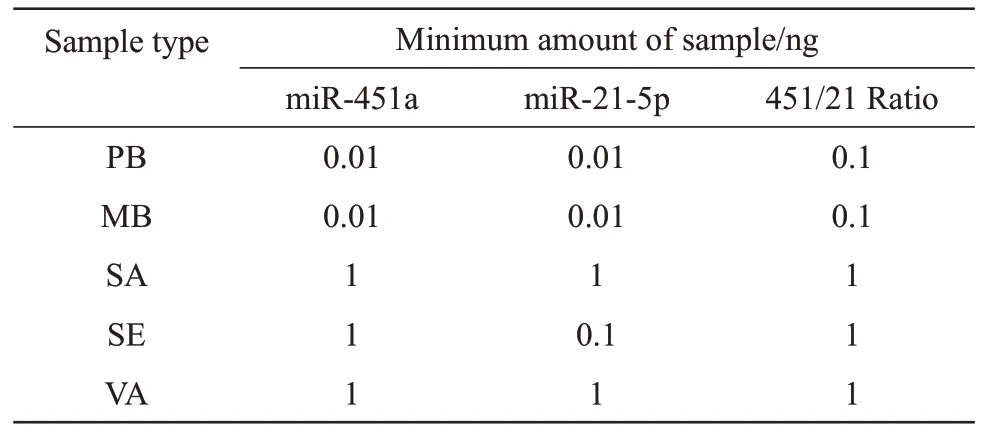
Table 4 The sensitivity of miR-451a,miR-21-5p and 451/21 Ratio in 5 body fluid
2.8 准确性验证
对经过双重和单重检测的20 个血液样本的451/21 Ratio结果进行配对t检验,两组数据差异无统计学意义(P>0.05)(表5),说明该双重实时荧光定量PCR 检测体系所得结果与单重检测的结果准确性一致。
2.9 模拟案件样本检测
对模拟放置在室外自然条件下1、4、8 d 的血液样本进行双重实时荧光定量PCR 检测(表6)。结果显示3个时间梯度下的模拟样本均能够根据该体系的判别标准进行体液的准确判别,表明该双重检测体系具有应用于法医实践的潜力。

Table 5 451/21 Ratio detection results in different systems
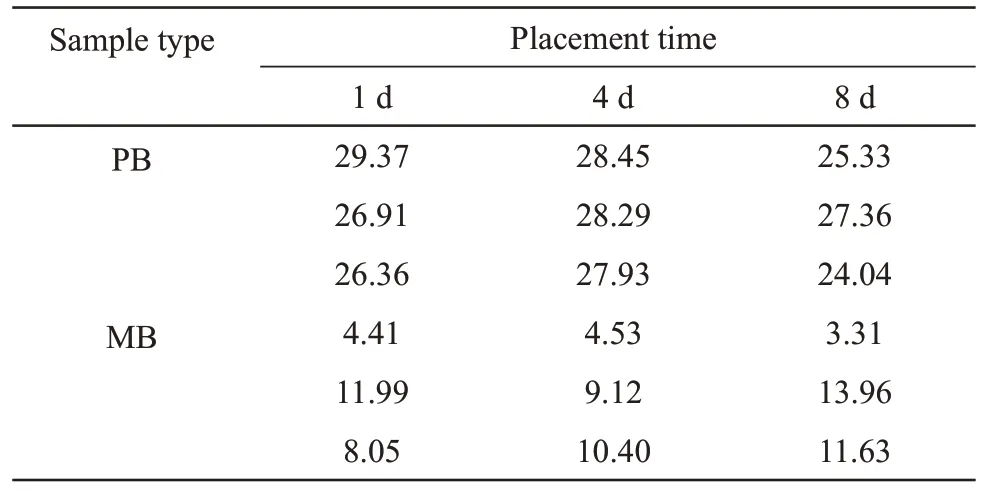
Table 6 451/21 Ratio detection results of simulated samples under different placement times
3 讨论
近年来伴随分子生物学的快速发展,实时荧光定量PCR 已经逐渐成为核酸定量检测中至关重要的技术。传统意义上的多重实时荧光定量PCR 技术是在同一反应体系内使用多组特异性引物和探针,并利用多荧光通道的实时荧光定量PCR 仪同时检测两个或两个以上分子标记。多重实时荧光定量PCR技术的出现和应用显著的降低了实验成本,并大大提高检测效率。相较于单重实时荧光定量PCR 扩增,多重实时荧光定量PCR 技术面临的最大挑战是避免多组引物之间形成二聚体或探针错配,从而导致非特异性扩增、扩增效率降低、检测灵敏度和特异性下降。为解决此问题,一方面需优化各引物序列以减少二聚体的形成,另一方面需优化反应体系中各组分的用量及反应条件,以尽可能提高扩增效率并保持一致性。
尽管在长链RNA或DNA分子上多重实时荧光定量PCR 技术已经有了较多应用[23-25],但是目前国内外有关miRNA 的多重实时荧光定量PCR 检测方法却较为稀少[26]。犯罪现场所遗留的体液斑迹往往是微量的,借助实时荧光定量PCR 技术进行体液鉴别往往需要对检材中多个特异性miRNA 标记以及内参基因进行检测分析。多重实时荧光定量PCR 技术能够有效解决传统单重实时荧光定量PCR 同时定量多种miRNA 时检材不足和消耗成倍试剂的问题,实现等量检材和试剂对多个标记进行检测,在法医学方向的应用前景十分广阔。本实验室前期利用SYBR Green 染料法和单重TaqMan 探针法开创性的建立了一种基于两种miRNAs表达量比值的月经血与外周血鉴别方法[10-11]。为进一步探索miRNA 多重实时荧光定量PCR 扩增的适用性以及优化该实验方法,本文在之前的基础上建立了一种miRNA 双重实时荧光定量PCR 检测体系。本研究首先根据miR-451a和miR-21-5p的序列特点及相关设计原则自主设计了更适合于双重实时荧光定量PCR 的引物以及探针。随后重点对引物和探针浓度进行了优化,优化首先要保证阴性对照无扩增,同时在该条件下荧光曲线拥有良好的扩增效果以及较低的Cq值。在出现荧光强度和Cq值接近的条件时,优先考虑低浓度条件,这样一方面是节省耗材,一方面也能将双重扩增中引物探针间可能存在的竞争抑制和相互干扰降到最低。优化完成的双重检测体系具有较强的特异性和可重复性,检测得到的样本数据与单重检测体系之间没有显著性差异。从鉴别能力来看,该双重检测体系依旧能够实现对血液与非血液、月经血与外周血样本的100%正确区分,且双重检测体系用于区分外周血与月经血的最佳截断值16.24与单重检测体系的16.57基本一致[11],同时其灵敏度相较于前期的单重体系也提高了一倍[10]。除此之外,本文还模拟了在室外自然条件下不同放置时间的血液检材,结果显示18 个样本均能够精确鉴别,进一步验证了该检测体系的鉴别能力和应用潜力。
4 结论
本文成功建立了miRNA 双重实时荧光定量PCR 检测体系。使用该体系对样本进行检测时,相同样本所需的实验时间以及实验耗材缩减至原来的一半,这使得样本的检测既快速又节省,实现了实验效率与经济性的双重提升,为法医体液鉴别提供了一种更高效、可靠的工具,也为后续建立更多重的qPCR检测体系并应用于法医体液分析打下了基础。
