抑郁症患者TNF-α和ADP比值的研究
2024-03-21冯毅菲张培文曹美群
冯毅菲,张培文,曹美群△
(1.广西中医药大学研究生学院,南宁 530001;2.深圳市第二人民医院老年医学研究所,广东深圳 518035;3.山东省戴庄医院精神疾病合并躯体疾病科,山东济宁 272000)
据估计,全球有超过2.79亿人患有抑郁症,抑郁症的终生患病率近15%[1-2],约有1/3的重度抑郁症患者在接受多种治疗后仍不能实现持续缓解[3],经历漫长的痛苦。因为抑郁症具有高患病率和高致残率,已经成为全世界精神疾病的首要负担,其还与糖尿病、心血管疾病和癌症等疾病患病和死亡风险的增加独立相关[4],没有心血管疾病的抑郁症患者也存在心率变异性降低、心率增快、血压升高等心脏危险因素[5]。
炎症和脂肪因子被认为是抑郁症发病的重要机制之一[6]。肿瘤坏死因子-α(TNF-α)主要由巨噬细胞产生,由脂多糖(LPS)、白细胞介素-1β(IL-1β)、干扰素-γ(IFN-γ)等多种炎症介质刺激分泌[7]。抑郁症与TNF-α水平升高相关[8-9]。脂联素(ADP)是最丰富的血浆脂肪因子,具有抗炎、增强胰岛素敏感性、改善脂质代谢等功能[10-11]。TNF-α、ADP均与抑郁症的发生、发展有密切关系,其中TNF-α是促抑郁因子[10],ADP是抗抑郁因子[12],二者存在相互拮抗的作用。本研究通过测定健康志愿者和抑郁症患者抗抑郁治疗前后血清TNF-α和ADP水平,探讨TNF-α、ADP及其比值的变化与抑郁症之间的关联,现报道如下。
1 资料与方法
1.1 一般资料
选取2020年1—12月山东省戴庄医院收治的40例抑郁症患者为观察组,其中男22例,女18例,年龄15~60岁。纳入标准:(1)符合抑郁症诊断标准,即采用美国精神障碍诊断与统计手册第4版修订版(DSM-Ⅳ-TR)轴Ⅰ障碍定式临床检查研究版进行诊断;(2)符合DSM-Ⅳ抑郁障碍首次发病和复发诊断标准;(3)汉密尔顿抑郁量表(HAMD)评分≥20分;(4)入组前12周未进行抗抑郁治疗或服用其他精神类药物。排除标准:(1)有精神分裂症、酒精和药物依赖病史;(2)有脑器质性疾病和内分泌疾病史;(3)经检查血常规、肝肾功能异常;(4)妊娠期和哺乳期;(5)有躁狂或轻躁狂发作史;(6)有严重的自杀倾向或精神障碍家族史;(7)近期有炎症性疾病或使用抗菌药物。选取同期26例健康志愿者为对照组,其中男15例,女11例,年龄15~58岁。两组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究通过山东省戴庄医院伦理委员会审批。
1.2 方法
1.2.1抑郁严重程度测评工具
本研究设计方案为病例对照研究。测评工具采用HAMD,HAMD评分<8分为无抑郁,8~<17分为轻度抑郁,17~<24分为中度抑郁,≥24分为重度抑郁。测定方法:所有研究对象入组时行HAMD评定,观察组经口服抗抑郁药物治疗4周后再行HAMD减分率评定,以HAMD减分率表示抑郁症状减轻情况,HAMD减分率=(治疗前总分—治疗后总分)/治疗前总分×100%。心理障碍疗效采用抑郁症状HAMD治疗前后减分率判断[13]。减分率≥75%为痊愈,50%~<75%为显效,25%~<50%为有效,<25%为无效。总有效=(痊愈+显效+有效)/总例数×100%。评定人员共2名,均为精神科主治医师,评定前均接受统一培训,量表评定的一致性Kappa值为0.78~0.92。
1.2.2TNF-α和ADP表达水平检测
ELISA操作步骤:结合文献及说明书,确定样品及标准品的适当稀释倍数。步骤按照TNF-α和ADP的ELISA试剂盒(购于广州创融生物科技有限公司)说明书进行。将稀释好的样品及标准品加入试剂盒对应孔中,37 ℃孵育120 min,弃去液体,甩干,加入稀释后的抗体工作液,37 ℃孵育60 min,洗涤液洗板3次,加入稀释后辣根过氧化物酶工作液,37 ℃孵育60 min,洗涤液洗板5次,加入底物溶液显色,37 ℃孵育15~30 min,加入终止液后置于自动酶标仪在450 nm波长读取各孔吸光度值,根据标准曲线获取待测样品的浓度。
1.3 统计学处理
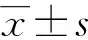
2 结 果
2.1 观察组临床疗效
观察组治疗前HAMD评分为25.5(21.0,30.0)分,治疗后评分为2.0(1.0,4.0)分,二者比较差异有统计学意义(P<0.05)。观察组痊愈34例(85.0%),显效5例(12.5%),有效1例(2.5%),无效0例,治疗有效率为100.0%。
2.2 两组TNF-α和ADP水平比较
观察组治疗前 TNF-α、TNF-α/ADP水平高于对照组,且治疗后高于治疗前(P<0.05)。观察组治疗后ADP水平低于对照组和治疗前,差异有统计学意义 (P<0.05),见表1。

表1 两组TNF-α和ADP水平比较[M(Q1,Q3)]
3 讨 论
TNF-α是先天免疫系统的核心组成部分,属于促炎细胞因子,也是与重度抑郁症相关的最常见的细胞因子之一[6]。TNF系统对重度抑郁症的发生、发展至关重要,TNF-α是促抑郁因子[14],已被证明通过激活下丘脑-垂体-肾上腺轴[14]、破坏神经递质5-羟色胺[14]、增加多巴胺代谢[14]、抑制海马发生[9]、增加血脑屏障的通透性[15]、增加一氧化氮的氧化还原信号[16]等多种机制促进抑郁症的发生、发展。
ADP是一种代谢调节剂,具有胰岛素增敏、抗炎和抗血管粥样硬化的作用,ADP在多种精神疾病中发挥有利作用,包括情绪障碍、注意力缺陷多动障碍、创伤后应激障碍、强迫症及抑郁症等[17]。抑郁症患者外周循环中ADP表达下调、脂肪过氧化物酶体增殖物激活受体γ(PPARG)-ADP轴在抑郁及焦虑行为的病理生理过程中起着重要作用[18]。在抑郁模型小鼠的侧脑室注射重组ADP可明显改善抑郁样行为[10],补充外周循环ADP和应用ADP受体激动剂都可以减轻抑郁样行为[1,10]。ADP通过脂联素受体1(AdipoR1)和脂联素受体2(AdipoR2)受体发挥作用,AdipoR1在大脑中广泛表达,ADP通过AdipoR1作用于5-羟色胺神经元[12],调节腹侧被盖区的多巴胺神经元活动和焦虑相关行为[19],通过AdipoR2调节海马体的情境恐惧消退[20]。此外,ADP激活海马体中的notch信号,由ADP-notch通路促进海马体神经元发生,对认知功能产生影响[21]。ADP还通过抗氧化应激等机制发挥抗抑郁作用[11]。
TNF-α和ADP虽然结构相似,但却具有相反的生物学效应,并相互调节对方的表达。ADP具有多种抗炎活性,其中ADP抑制TNF-α信号通路是其发挥抗炎作用的途径之一。用TNF-α处理体外脂肪细胞可以减少ADP的产生,TNF-α在体内和体外均可减少ADP的分泌[22]。另一方面,ADP也调节TNF-α水平,ADP抑制单核巨噬细胞中TNF-α mRNA的表达及TNF-α的合成释放[23]。TNF-α为促炎、促抑郁因子,而ADP则是抗炎、抗抑郁因子,因此,本研究分析治疗前后TNF-α/ADP的变化,结果发现观察组TNF-α/ADP高于对照组,且经口服抗抑郁药物治疗后进一步升高。
本研究观察组治疗前、治疗后TNF-α水平均高于对照组。一项meta分析也显示,重度抑郁症患者外周血TNF-α水平升高[6],抑郁症患者TNF-α升高与体内炎症有关[14]。同时,本研究观察组服用抗抑郁药物治疗4周后,抑郁症状改善,HAMD评分下降,但TNF-α水平较治疗前升高,在国内外也有相同结果的报道[24-27]。有学者认为,抑郁症患者在应用抗抑郁药物后,TNF-α水平应该恢复至正常;但还有不少研究证明,一些抗抑郁药物不但没有降低抑郁症患者TNF-α水平,反而升高了TNF-α水平。组胺可以剂量依赖性地刺激星形胶质细胞活化,并抑制促炎因子TNF-α的分泌[28],阿米替林、多塞平、丙帕明、米氮平等都是强有力的组胺拮抗药物[24],能够阻断组胺对TNF-α的抑制作用,从而激活TNF-α系统,促使血浆TNF-α及其可溶性受体水平升高[24]。奥氮平通过激活大鼠前额叶皮层中的内质网应激,诱导炎症和免疫反应,增加TNF-α的表达[26]。艾司西酞普兰则通过p38/磷脂酰肌醇3激酶(PI3K)通路在巨噬细胞的炎症反应中发挥作用,促使TNF-α水平升高[27]。
本研究观察组治疗前ADP水平低于对照组。一项关于抑郁症患者ADP变化的meta分析显示,抑郁症患者的ADP水平明显低于健康人群[29]。低ADP水平可能是抑郁症的独立危险因素[12]。WANG等[10]研究发现,抑郁症患者的ADP降低水平与抑郁症的严重程度相关。抑郁症患者ADP水平降低可能是由于抑郁症患者下丘脑-垂体-肾上腺轴过度激活促使血清糖皮质激素水平升高,高水平的糖皮质激素能够抑制ADP的分泌和表达[1]。抑郁症患者经抗抑郁治疗后ADP水平进一步下降,其原因可能是在抗抑郁药物作用下过量产生的TNF-α抑制了体内ADP的表达。HE等[22]研究发现,TNF-α通过改变内质网中的二硫键修饰以破坏ADP的多聚化,从而减少ADP的分泌。YU等[30]研究发现,TNF-α通过降低过氧化物酶体增殖物激活受体-γ的转录活性,进而减少ADP的产生。除抑郁症患者外,在急性心肌缺血的情况下,使用TNF-α拮抗剂后ADP表达水平升高,心肌梗死面积和细胞凋亡同步减少[31],再次证明TNF-α对ADP的抑制作用及二者相反的生物学效应。
综上所述,抑郁症患者血清TNF-α/ADP高于健康人群,TNF-α和ADP二者失衡推动了抑郁症的发生,TNF-α/ADP可成为诊断抑郁症的指标,干预TNF-α和ADP的相互作用可成为新的抗抑郁治疗研究方向。
