生长激素对结肠癌细胞侵袭和迁移的影响
2024-03-21蒋皓天
蒋皓天,汪 攀,廖 彬,龚 胜,吴 南△
(1.重庆医科大学,重庆 400016;2.中国科学院重庆绿色智能技术研究院,重庆 400714;3.中国科学院大学重庆学院,重庆 400714;4.重庆市人民医院神经外科,重庆 401147)
生长激素(growth hormone,GH)型垂体腺瘤是垂体腺瘤中的常见类型,约占垂体腺瘤的20%~30%,其特征是GH持续分泌过多,并伴随胰岛素样生长因子-1(IGF-1)升高,作用于全身组织,导致全身性神经内分泌综合征[1-3]。儿童期与青春期患病由于GH分泌过多可导致骨骺闭合延迟、长骨生长加速,发展为巨人症;成年后患病因骨骺已闭合则表现为面容改变及手足肢端增粗,发展为肢端肥大症。研究表明,GH型垂体腺瘤患者相较于健康人群,患癌风险增加,尤其是结直肠癌、甲状腺癌、乳腺癌、前列腺癌和血液系统恶性肿瘤[4-8]。已有研究发现,GH型垂体腺瘤可通过分泌GH影响乳腺癌血管生成、干性表达和化疗耐药性,并被证实在乳腺癌的发生、发展和转移中起重要作用[9]。对于同时患有GH型垂体腺瘤的结肠癌患者,过量分泌的GH是否也会促进结肠癌浸润及转移有待进一步探讨。据此,本研究拟通过体外研究探讨GH对人结直肠腺癌LoVo细胞增殖、侵袭和迁移的影响,同时分析GH在结肠癌中的调控及分子机制。
1 材料与方法
1.1 细胞与材料
人结直肠腺癌LoVo细胞株购自中国科学院上海细胞生物所细胞库;GH型垂体瘤GH3细胞株购自武汉普诺赛生命科技有限公司;重组人GH购自美国Pepro Tech公司;胎牛血清、DMEM高糖培养基、0.25%胰酶消化液购自美国Gibco公司;基质胶、Transwell小室购自美国Corning公司;GH ELISA检测试剂盒购自美国Millipore公司。
1.2 方法
1.2.1细胞培养
LoVo细胞采用含10%胎牛血清的DMEM高糖培养基,于饱和湿度、37 ℃、5% CO2培养箱中培养,贴壁生长。GH3细胞采用含15%马血清和2.5%胎牛血清的F12培养基,于饱和湿度、37 ℃、5% CO2培养箱中培养,贴壁生长。取对数生长期的细胞用0.25%胰酶消化液消化,经台盼蓝染色确定活细胞计数在95%以上,收集细胞。
1.2.2ELISA法检测GH3细胞培养上清液中GH浓度
将GH3细胞培养72 h,收集上清液,500×g离心5 min去掉细胞碎片。标准品或标本100 μL加入96孔板中,37 ℃孵育1 h;吸取上清液后加入100 μL检测溶液A,37 ℃孵育1 h;洗板3次后,加入100 μL检测溶液B,37 ℃孵育30 min;洗板3次后,加入90 μL 3,3′,5,5′-四甲基联苯胺(TMB)底物溶液,37 ℃避光显色10~20 min,加入50 μL终止液后用酶标仪检测其450 nm处吸光度[A(450)]值。根据标准品A值,建立浓度-A值标准曲线,计算出GH3细胞培养上清液中的GH浓度。
1.2.3CCK-8法确定GH最佳干预浓度
取对数生长期的LoVo细胞,调整细胞浓度为1×104/mL,接种于96孔板,每孔加入100 μL细胞悬浮液。培养24 h后,分别加入0、50、200、400 ng/mL的重组人GH,每个浓度设置5个复孔。培养48 h后,每孔加入10 μL的CCK-8溶液,酶标仪检测A(450)值。
1.2.4流式细胞术检测细胞周期
取对数生长期LoVo细胞随机分为对照组和实验组,对照组中加入磷酸盐缓冲液(PBS),实验组中加入最佳干预浓度的重组人GH,两组细胞在相同条件下体外培养48 h,后续实验均以此分组。收集两组细胞,用预冷的PBS洗涤1次,离心弃上清液。加入预冷的无水乙醇,混匀,4 ℃固定过夜。加入预冷的PBS洗涤1次,离心弃上清液。加入100 μL RNaseA,混匀,37 ℃水浴30 min。加入400 μL的碘化丙啶(PI)溶液,混匀,4 ℃避光孵育30 min。流式细胞仪在波长488 nm处进行细胞周期分析。
1.2.5Transwell实验检测细胞侵袭、迁移能力
细胞侵袭能力检测:将基质胶在4 ℃冰箱过夜融化。在冰上用预冷的枪头吸取基质胶加入冰上预冷的无血清培养基中,充分混匀,稀释基质胶至1 mg/mL。取Transwell小室放入24孔板中,取稀释的基质胶100 μL加入小室上室,37 ℃孵育30 min,将小室四周多余的基质胶洗出,继续于37 ℃孵育,使基质胶聚合成胶备用。收集对照组和实验组细胞,用PBS和无血清培养基先后洗涤一次,细胞计数后,用无血清培养基将细胞悬液调整为2×105/mL。在下室中加入500 μL含10%胎牛血清的培养基,在上室中加入200 μL各组细胞悬液。培养24 h后,取出小室,PBS洗涤2次,甲醇固定15 min,结晶紫染色10 min,PBS洗涤,棉签擦去小室中细胞,晾干后剪下小室的膜并用中性树脂封片,镜下观察。细胞迁移能力检测除不加基质胶外,其余实验步骤同上述相同。
1.2.6Western blot检测上皮间质转化 (epithelial-mesenchymal transition,EMT)相关蛋白表达
收集对照组和实验组细胞,提取总蛋白并用二奎琳甲酸(BCA)定量试剂盒测量蛋白浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)1 h分离蛋白,再冰浴电转2 h至聚偏氟乙烯(PVDF)膜。10% 脱脂奶粉室温封闭 2 h。洗涤膜,一抗β-actin(1∶2 000稀释)、E-钙黏蛋白(E-cadherin,1∶1 000稀释)、 N-钙黏蛋白(N-cadherin,1∶1 000稀释)、波形蛋白(Vimentin,1∶1 000稀释)和蜗牛蛋白-1(Snail-1,1∶1 000稀释)4 ℃孵育过夜,洗涤膜,二抗(1∶2 500稀释)室温孵育2 h,洗涤膜,于化学发光成像分析仪中曝光,拍照。分析蛋白条带灰度值,以β-actin为内参。
1.3 统计学处理
2 结 果
2.1 ELISA法检测GH3细胞上清液中GH浓度
ELISA结果显示GH3细胞培养上清液中GH浓度为(1 208±9)ng/mL。
2.2 GH对LoVo细胞增殖能力的影响
CCK-8法结果显示0、50、200、400 ng/mL各浓度GH组A(450)值分别为(0.994±0.025)、(1.084±0.051)、(1.259±0.051)、(1.284±0.009)。与0 ng/mL GH组比较,各浓度GH组A(450)值均增加,差异有统计学意义(P<0.05)。当GH浓度达到400 ng/mL GH后,与200 ng/mL GH组比较,A(450)值差异无明显变化(P>0.05),因此选择GH浓度200 ng/mL进行后续实验,见图1。

a:P<0.05,与0 ng/mL组比较。
2.3 GH对LoVo细胞周期的影响
流式细胞术实验结果显示,与对照组比较,实验组中细胞周期从G1期向S期和G2转变,G1期细胞比例下降,S期、G2期细胞比例升高,差异有统计学意义(P<0.05),见图2。
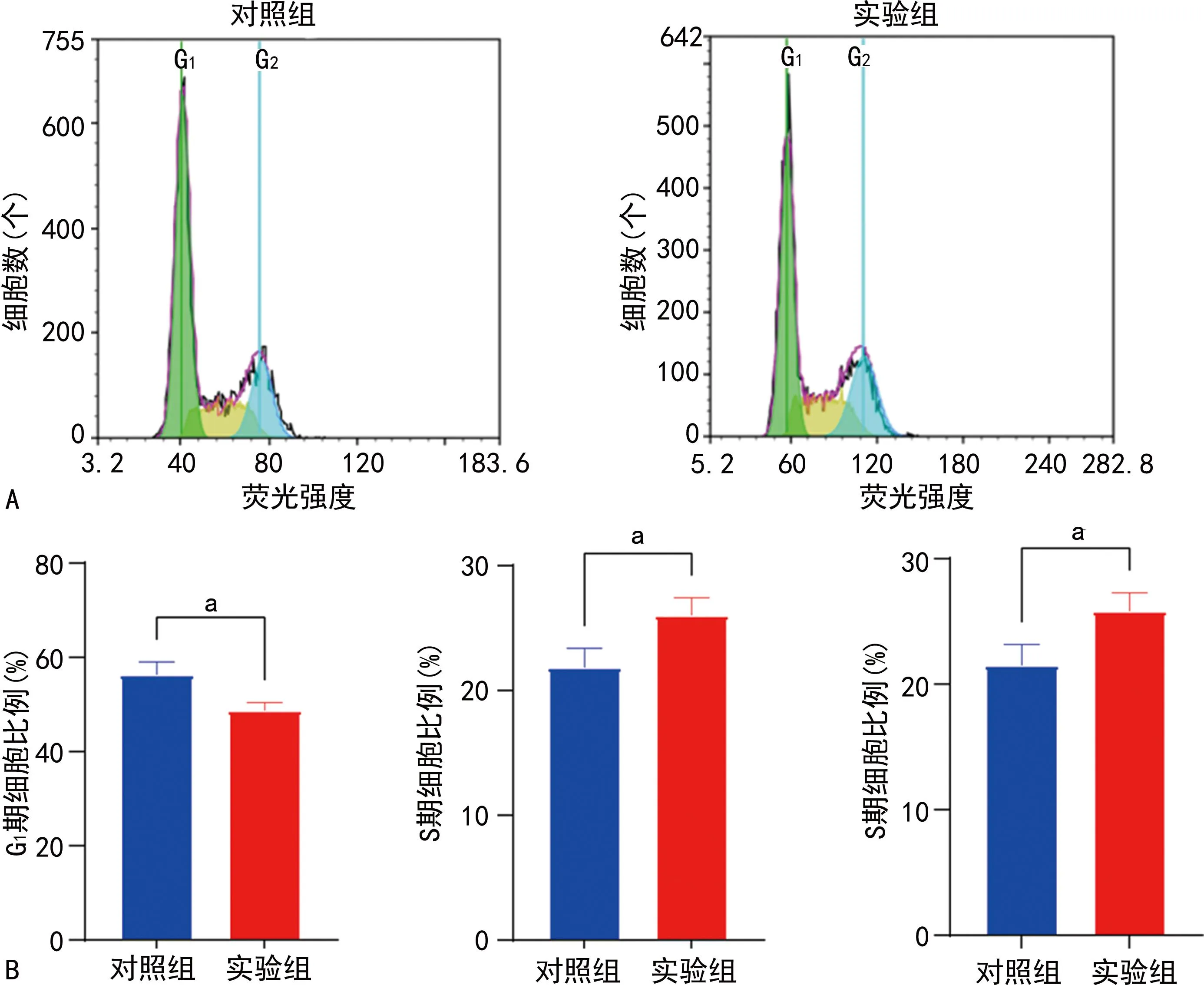
A:流式细胞图;B:流式细胞术定量分析图。a:P<0.05。
2.4 GH对人结直肠腺癌LoVo细胞侵袭和迁移的影响
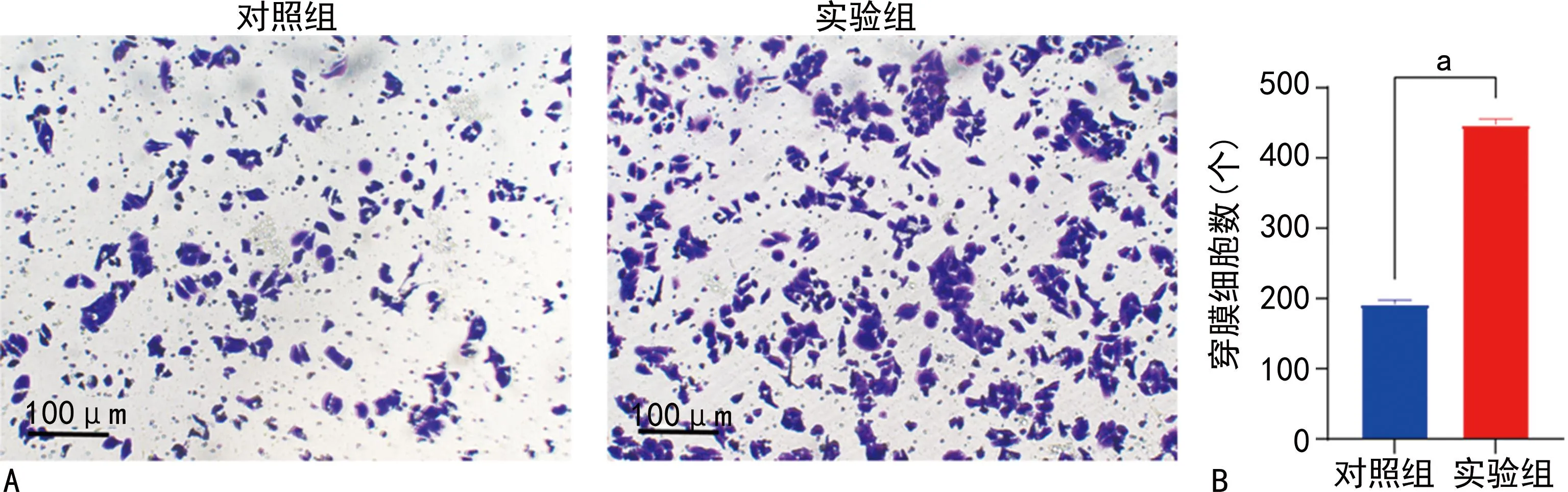
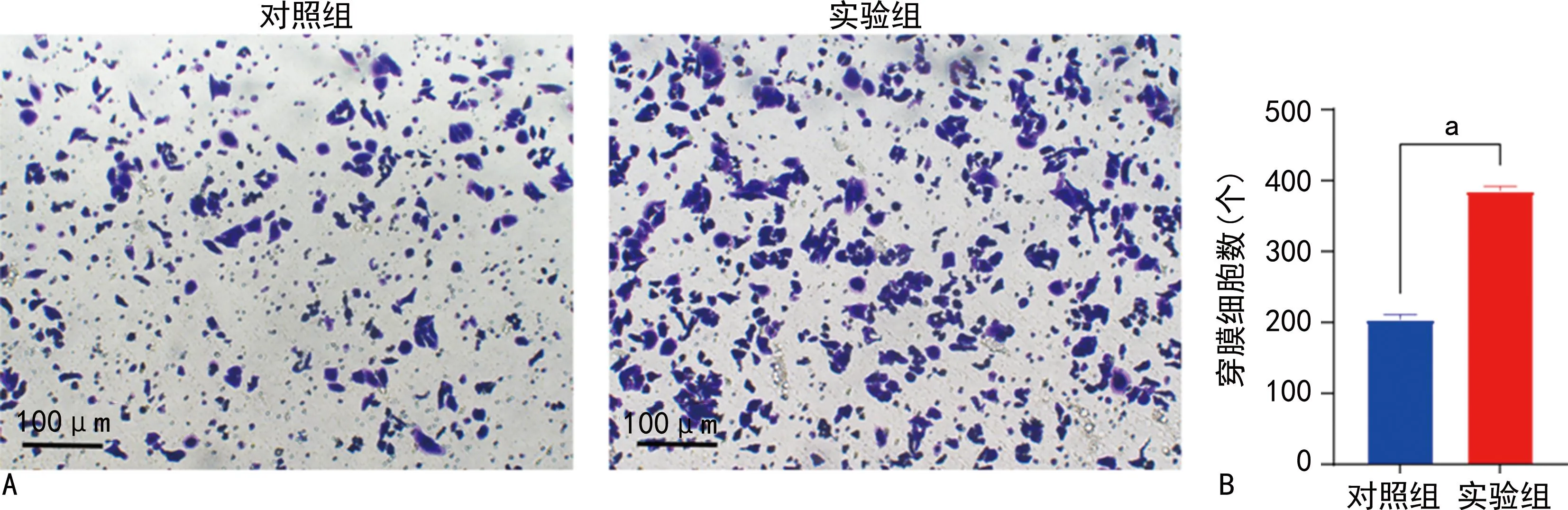
Transwell侵袭实验结果显示,对照组穿膜细胞数量为(204±6)个,实验组穿膜细胞数量为(385±6)个,实验组穿膜细胞数量较对照组明显增加,差异有统计学意义(P<0.001),见图3。Transwell迁移实验结果显示,对照组穿膜细胞数量为(192±5)个,实验组穿膜细胞数量为(447±9)个,实验组穿膜细胞数量较对照组明显增加,差异有统计学意义(P<0.001),见图4。
A:Transwell侵袭实验图;B:Transwell侵袭实验定量分析图。a:P<0.001。
A:Transwell迁移实验图;B:Transwell迁移实验定量分析图。a:P<0.001。
2.5 GH对LoVo细胞EMT相关蛋白表达的影响
Western blot实验结果显示,与对照比较,实验组细胞中N-cadherin、Vimentin和Snail-1表达水平上调,E-cadherin表达水平下调,差异有统计学意义(P<0.05,P<0.001),见图5。
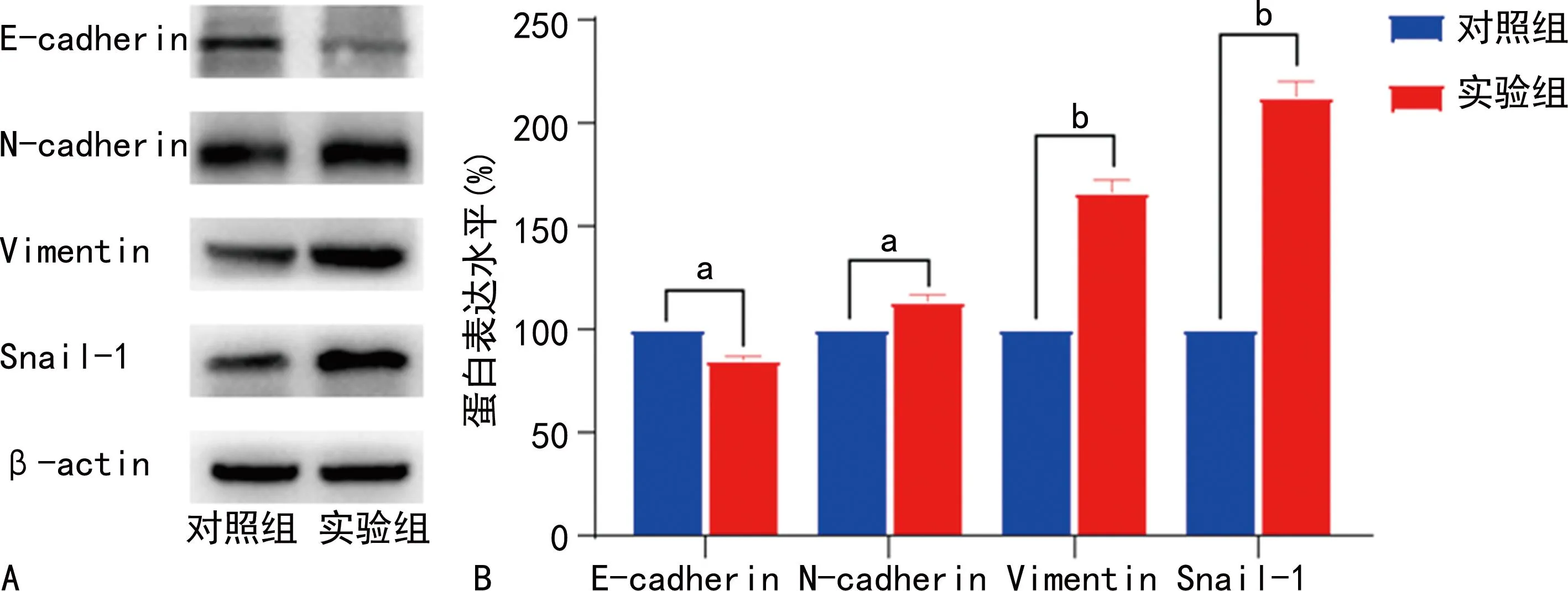
A:Western blot图;B:Western blot定量分析图。a:P<0.01;b:P<0.001。
3 讨 论
垂体分泌GH可通过膜相关生长激素受体(GHR)直接或间接作用于外周组织[10]。研究发现,GH不会直接导致正常细胞转变成恶性细胞,但它可以通过缩短细胞周期,加速DNA断裂修复的时间来增加基因突变风险,同时促进细胞增殖、EMT和血管生成,并抑制细胞凋亡来促进肿瘤进展[6]。从动物模型到流行病学再到临床研究,目前已有大量证据显示GH与致癌相关。相反,通过对诱导GH缺乏或破坏GHR的动物模型的研究,以及对患有先天GHR信号传导缺陷人群的调查发现,GH缺乏可抑制恶性肿瘤的发生及进展[11-13]。侏儒综合征(Laron综合征)是一种GHR或受体后信号通路相关基因突变所致的先天性GH不敏感疾病[14]。在对637例Laron综合征患者的长期随访中发现,Laron综合征患者中未发现恶性肿瘤病例,而其亲属恶性肿瘤发病率>20%。与一般人群比较,Laron综合征患者恶性肿瘤发病率明显降低,先天性GH不敏感可抑制恶性肿瘤的发生[7]。结直肠癌是世界第三大常见癌症,与一般人群比较,GH型垂体腺瘤患者患结直肠癌风险更高且所患结直肠癌的恶性程度较高[15-16]。为探讨GH型垂体腺瘤对结肠癌的影响,本研究对GH型垂体腺瘤GH3细胞培养上清液进行ELISA检测,结果提示GH3细胞分泌大量GH[(1 208±9)ng/mL],远超健康成人血清浓度(<2 ng/mL)。因此,与一般人群比较,高浓度的GH可能是促进GH型垂体腺瘤患者结肠癌浸润及转移的重要原因。为验证这一假说,本研究对LoVo细胞进行体外培养,并加入一定浓度的GH处理,探讨GH对LoVo细胞的影响。为确定实验所用GH的最佳浓度及GH对LoVo细胞增殖的影响,本研究使用不同浓度的GH处理LoVo细胞,并通过CCK-8法检测细胞增殖活性,结果提示GH可促进LoVo细胞增殖,并在一定浓度范围内呈剂量依赖性。受GHR饱和效应影响,当GH浓度达到400 ng/mL后,GH的促增殖效应不再增加。因此选择200 ng/mL GH浓度进行后续实验。此外,本研究发现GH可改变LoVo细胞周期,促进肿瘤细胞从G1期向S期和G2转变,促进有丝分裂。虽然GH是否影响肿瘤细胞增殖目前尚存争议[17-18],但本研究表明GH可改变细胞周期促进LoVo细胞增殖。为进一步研究GH对LoVo细胞的影响,取对数生长期LoVo细胞在高浓度重组人GH处理下体外培养,进行Transwell侵袭和迁移实验,结果证实,高浓度GH可明显促进LoVo细胞侵袭和迁移。因此,对患有GH型垂体腺瘤的结肠癌患者,过量分泌的GH可能是促进结直肠癌浸润和转移的原因。但GH促进结肠癌细胞侵袭和迁移的调控和分子机制尚未明确。
EMT是指细胞失去上皮表型并转化为间质表型的生物学过程,在肿瘤的发生、发展中发挥着重要作用,与肿瘤的侵袭转移密切相关,在分子生物学水平上通常表现为上皮型钙黏蛋白(E-cadherin)表达缺失和波形蛋白(Vimentin)表达增强[19-20]。其中E-cadherin的表达降低是EMT的关键步骤,它能改变细胞形态,降低细胞间的黏附性,促进肿瘤细胞侵袭和迁移。Snail-1是一种富含锌指结构的转录因子,可通过结合E-cadherin启动子转录位点附近的E2-box,抑制基因表达[21]。目前Snail-1已被证实在肿瘤的进展和转移中发挥重要作用,并可通过降低E-cadherin的表达和诱导EMT促进结直肠癌的转移[22]。本研究结果显示,高浓度GH可有效上调LoVo细胞N-cadherin、Vimentin和Snail-1的表达水平,抑制E-cadherin的表达水平,促进EMT。以上研究结果表明,GH型垂体腺瘤可通过分泌大量GH上调结肠癌细胞Snail-1的表达,进而下调E-cadherin的表达,上调N-cadherin和Vimentin的表达,影响细胞外基质和细胞黏附,使细胞骨架重塑,促进EMT。
综上所述,本研究结果表明GH型垂体腺瘤细胞可分泌高浓度GH。高浓度GH可有效促进结肠癌细胞侵袭和迁移,其调控分子机制可能与高浓度GH促进结肠癌细胞EMT相关。同时研究证明GH可改变细胞周期促进结肠癌细胞增殖。临床上对患有GH型垂体腺瘤的患者,应当进行结肠镜筛查。对同时患有GH型垂体腺瘤和结肠癌的患者,应当关注结肠癌是否发生转移。
