口服鱼油对糖尿病足溃疡患者伤口愈合影响的随机双盲安慰剂对照研究
2024-03-21时梦苒杜蓥漩张春林刘佳为郭小芹梁馨予
张 灏,徐 静,童 强,时梦苒,王 敏,杜蓥漩,王 渊,张春林,刘佳为,郭小芹,梁馨予,王 建△
(陆军军医大学第二附属医院:1.营养科;2.内分泌科,重庆400037)
糖尿病足溃疡(diabetic foot ulcers,DFU)是糖尿病患者常见的严重并发症之一,全球约5.37亿的糖尿病患者中有19%~34%会出现DFU[1]。这些DFU患者中约有半数会发生感染,其中约20%的中重度感染患者会被截肢或截趾[2]。然而,足部溃疡愈合后,约65%的患者会在5年内再次发生溃疡[3]。由于长期持续处于高血糖水平导致血管和神经损伤,足部伤口愈合缓慢,甚至不愈合。因伤口的治疗过程复杂且耗时,使得寻找更有效的促进创面愈合的治疗方法成为医学界的主要关注点之一。
鱼油是一种从深海鱼中提取的油脂,其中富含大量ω-3不饱和脂肪酸(omega-3 polyunsaturated fatty acids,ω-3 PUFA),尤其是二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)[4],是人体必需的脂肪酸之一,具有抗炎、抗氧化、降血脂、抗血小板聚集、促进神经系统发育的作用[5]。有研究显示,EPA+DHA可明显改善高胆固醇血症人群的炎症状态和血脂指标[6]。因其具有较强的抗炎作用,已有研究将其用于促进急慢性伤口愈合的研究中,但其用于治疗DFU鲜有报道。
目前,在DFU的研究领域主要围绕血管再通介入治疗、改善上皮细胞爬行和加强上皮细胞增殖等方面,而在改善慢性炎症反应方面的研究较少。本研究旨在观察口服鱼油对DFU患者伤口愈合的影响,以期为DFU治疗提供临床依据。
1 资料与方法
1.1 一般资料
选取2022年11月至2023年8月在本院接受诊疗的68例DFU患者为研究对象。纳入标准:(1)年龄18~80岁;(2)符合1999年世界卫生组织提出的糖尿病诊断标准[7];(3)糖化血红蛋白(glycated hemoglobin A1c,HbA1c)≤12%;(4)Wagner分级1~3级;(5)足踝以下至少有1个溃疡;(6)踝肱指数为0.7~1.2,或者下肢经皮氧分压≥30 mmHg;(7)近3个月内未接受皮质类固醇、抗氧化剂、鱼油类制剂的治疗;(8)包括骨髓炎在内的DFU感染患者在感染控制且停用抗生素后可纳入研究。排除标准:(1)对干预成分过敏;(2)活动性夏科神经关节病;(3)恶性肿瘤;(4)免疫抑制疾病或自身免疫性疾病;(5)内脏器官功能损害或衰竭;(6)近2周内接受可能影响结果的治疗;(7)妊娠或哺乳期;(8)有精神疾病史或无法配合试验进行。本研究经陆军军医大学第二附属医院伦理委员会审核批准(2022-研第464-01),入组前已向所有患者告知研究目的和方案,且在干预前获得书面知情同意。分组人员通过Excel生成的随机数,随机将受试者随机分为试验组和对照组,并保留和分配随机数字。研究人员根据分组人员的提示将干预产品按入组顺序分派给受试者。在最终数据收齐前,研究人员和受试者不得知晓随机化分组信息,分组人员不得知晓试验方案和受试者信息。研究期间3例患者失访,最终纳入试验组32例,对照组33例。两组患者性别、年龄、糖尿病病程、足溃疡时长、HbA1c、BMI、营养风险筛查(nutritional risk screening 2002,NRS2002)评分、Wagner分级,多部位溃疡、既往足溃疡史及既往介入手术史比例比较差异无统计学意义(P>0.05),见表1。
1.2 方法
1.2.1样本量估算
以第12周内伤口完全愈合的人数占各组总人数的百分比估计样本量。按照α=0.05,β=0.20,试验组的比例为53%,对照组的比例为20%,入组比例为1∶1,则每组人数为30例。考虑10%的失访率,每组人数为33例,共需研究对象66例。
1.2.2干预方法
入组前,收集患者的人群统计数据和临床基线指标,记录伤口基本情况,评估伤口并进行Wagner分级,确保符合纳入/排除标准。在研究过程中,根据护理师的临床判断,对伤口进行常规护理和清创。在干预前和干预后,抽取患者10 mL血液送至陆军军医大学第二附属医院检验科进行研究所需项目的检测。低白蛋白(albumin,ALB)水平为血清ALB<40 g/L。使用同一数码相机对伤口进行拍摄,通过Image J软件对伤口面积进行测量。
试验组采用挪威EPAX公司的EPAX5025 TGN型鱼油(生产批号:2021000724),每粒含EPA≥500 mg/g、DHA≥250 mg/g;对照组采用东莞嘉吉粮油有限公司的玉米油(生产批号:M02201008)作为安慰剂;灌制加工方为广东优莱美制药股份有限公司(生产批号:220501)。两种软胶囊在规格、外观、包装上均保持一致,无其他标志物。两组患者均口服软胶囊3 g/d,持续12周。
1.2.3结局指标
主要指标包括评估12周内伤口完全愈合、伤口愈合面积≥50%的比例,伤口完全愈合定义为伤口100%再上皮化而无引流。次要指标包括愈合时间、伤口面积、HbA1c、炎症指标[白细胞介素(interleukin,IL)-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-8、C反应蛋白(C-reactive protein,CRP)、中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet lymphocyte ratio,PLR)]、营养相关指标[总蛋白(total protein,TP)、ALB、球蛋白(globulin,GLB)、ALB/GLB、前清蛋白(prealbumin,PA)、甘油三酯(triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)]。记录患者研究期间伤口再感染情况。
1.2.4炎症指标赋值
在相关性分析中,患者炎症指标分值为0~6分,各炎症指标的赋值如下。(1)以医院相应炎症指标正常值范围作为依据赋值:①CRP>8 mg/L为1分,≤8 mg/L为0分;②IL-6>34 pg/mL为1分,≤3.4 pg/mL为0分;③TNF-α>8.1 pg/mL为1分,≤8.1 pg/mL为0分;④IL-8>62 pg/mL为1分,≤62 pg/mL为0分。(2)以既往文献参考为依据赋值[8]:①NLR>3.06为1分,≤3.06为0分;②PLR>155.41为1分,≤155.41为0分。
1.3 统计学处理
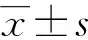
2 结 果
2.1 两组伤口愈合情况比较
干预后,试验组患者伤口完全愈合的比例明显高于对照组(P=0.007),伤口愈合面积≥50%的比例也明显高于对照组(P=0.039),见图1。
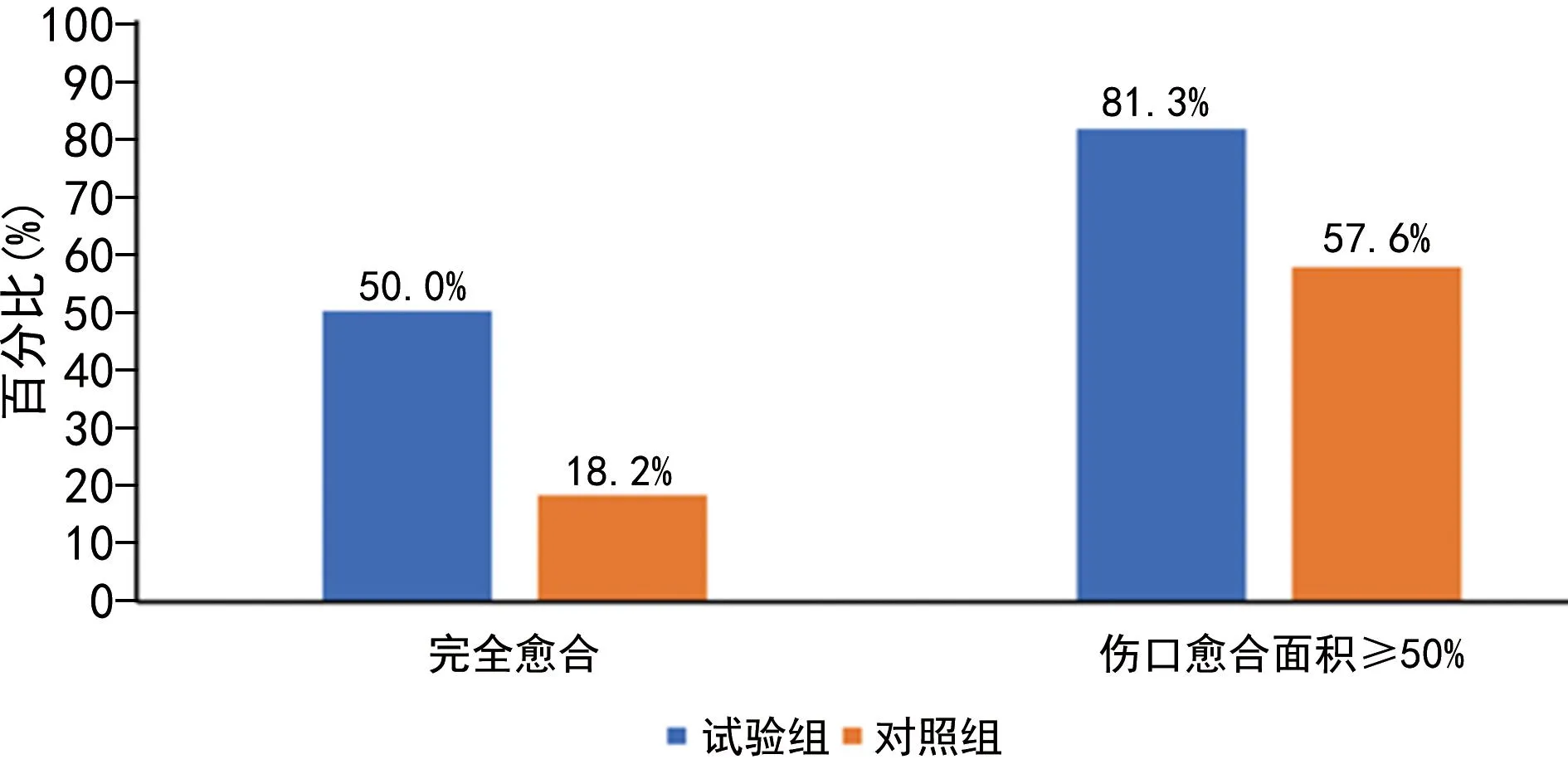
图1 两组伤口愈合情况直方图
2.2 两组不同指标分层伤口完全愈合情况
干预后,试验组在男性、HbA1c>9%、单一部位溃疡、既往有足溃疡病史、既往无介入手术史及低ALB水平的伤口完全愈合比例均高于对照组,差异有统计学意义(P<0.05),见表2。研究中有52例(80.0%)患者存在低ALB水平。
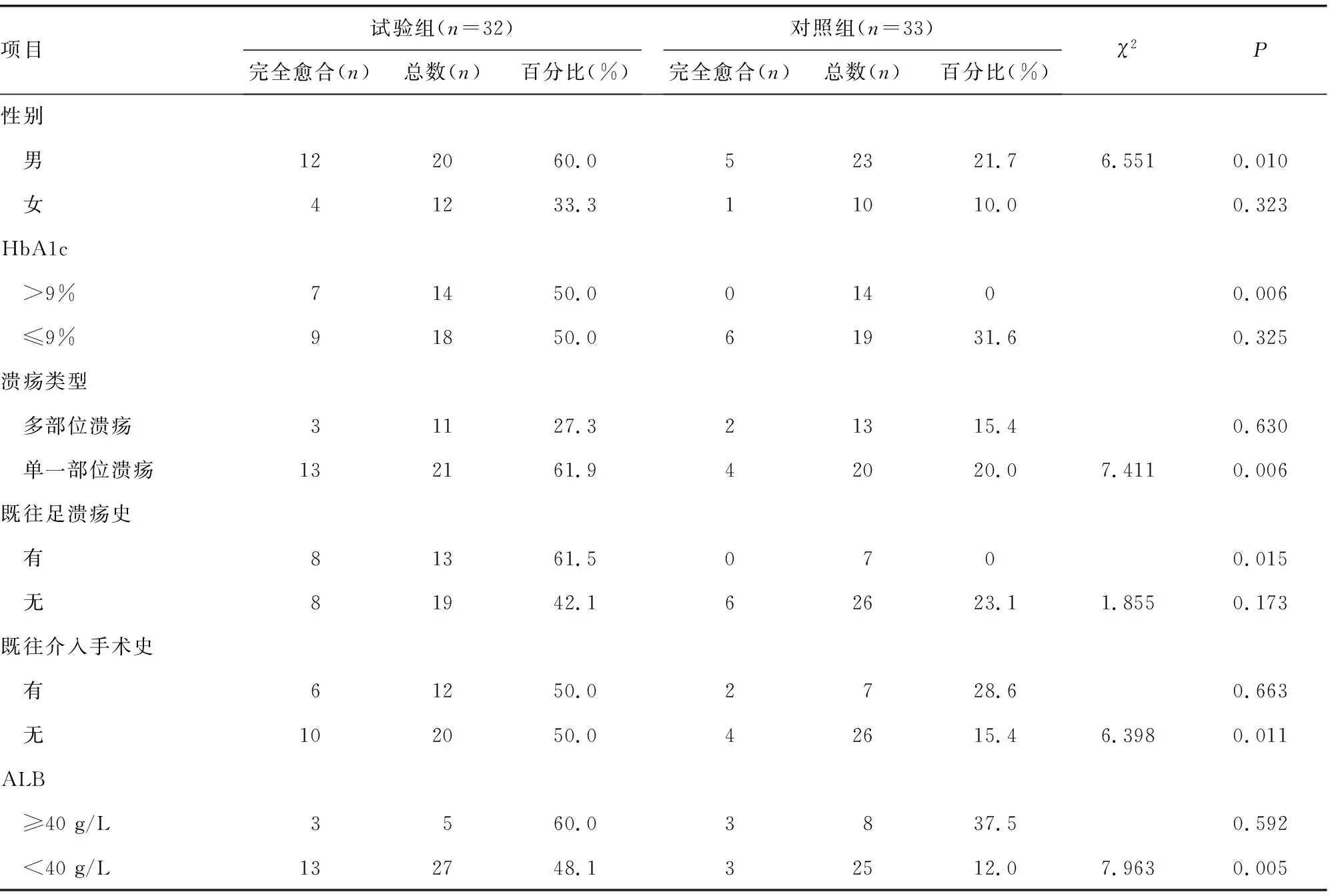
表2 两组不同指标分层伤口完全愈合比例
2.3 两组伤口完全愈合患者的愈合时间比较
试验组伤口完全愈合患者的愈合时间(53.25±16.00)d短于对照组(65.00±14.44)d,但比较差异无统计学意义(t=-1.571,P=0.132)。
2.4 两组不同指标分层伤口面积比较
干预后,试验组伤口面积较对照组缩小更明显,差异有统计学意义[2.546(1.002,6.338)cm2vs.0.667(0.191,3.596)cm2,P=0.045]。不同指标分层的结果分析显示,试验组女性和单一部位溃疡患者中伤口面积较对照组缩小更明显,差异有统计学意义(P<0.05),而其他指标比较差异无统计学意义(P>0.05),见表3。

表3 干预前后两组不同指标分层伤口面积比较[M(Q1,Q3),cm2]
2.5 两组炎症指标、糖代谢指标和营养相关指标比较
干预后,试验组IL-6和IL-8的降低值明显高于对照组(P<0.05),但两组CRP、TNF-α、NLR、HbA1c和PLR的降低值比较差异无统计学意义(P>0.05)。试验组PA改善幅度大于对照组,但两组间无明显差异(P>0.05),见表4。
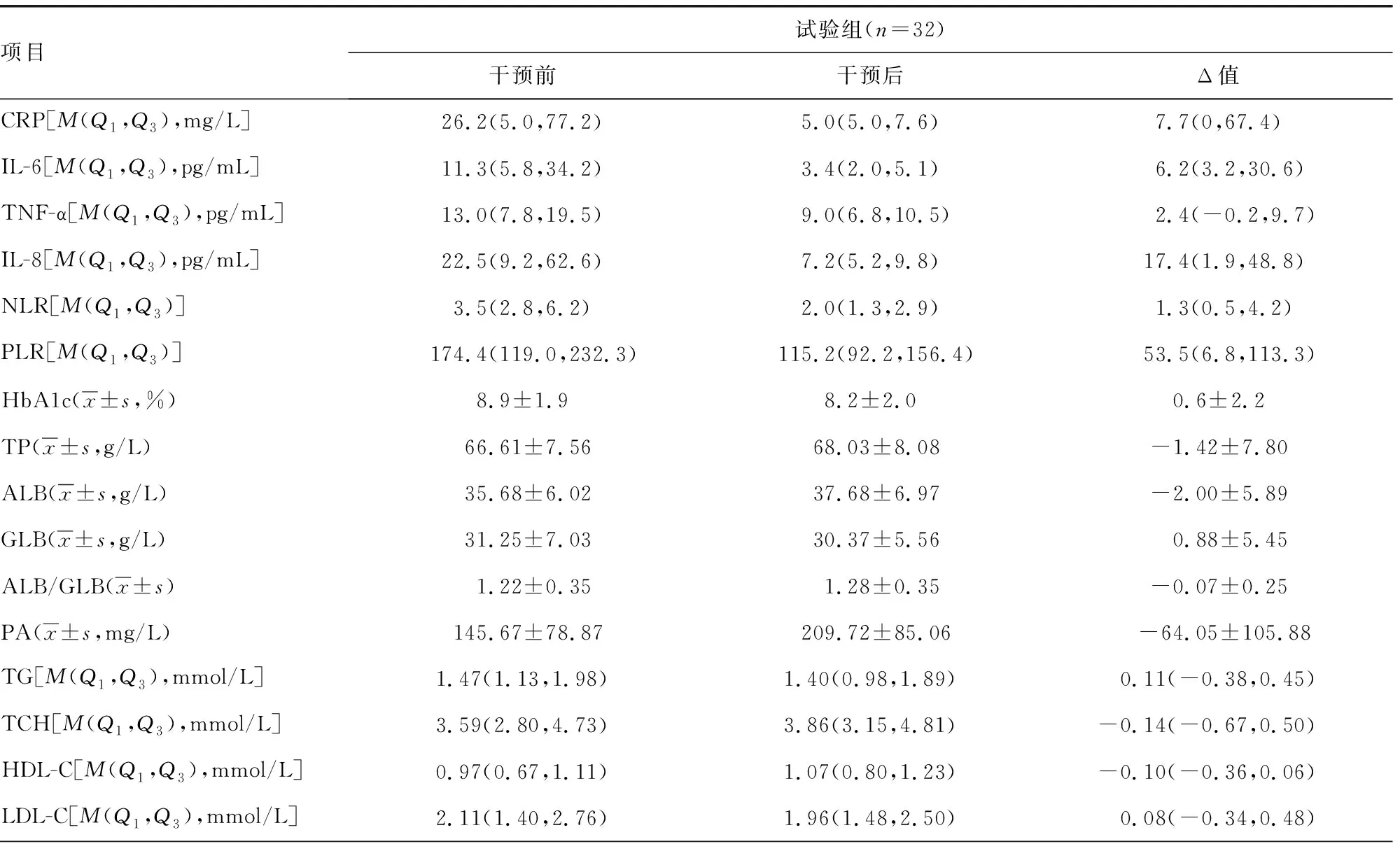
表4 干预前后两组炎症指标、糖代谢指标和营养相关指标比较
2.6 伤口愈合的相关影响因素分析
多因素logistic回归分析显示,干预措施(OR=6.771,95%CI:1.787~25.652)、HbA1c(OR=4.149,95%CI:1.026~16.770)、溃疡类型(OR=4.319,95%CI:1.026~18.173)是伤口愈合的影响因素(P<0.05),见表5。
2.7 两组再感染情况
在研究干预期间,对照组中有2例患者出现伤口感染,及时给予抗生素治疗后好转;试验组未发现伤口感染情况。
3 讨 论
足部伤口愈合缓慢,这是糖尿病患者所面临的最为突出的诸多问题之一,难以愈合的伤口不仅易发生感染,还可能导致更为严重的并发症[3]。所以,加速伤口的愈合对于提高DFU患者伤口的生活质量,以及降低医疗系统的负担都具有重大意义。目前,外科清创、足部减压、重建下肢血及抗感染治疗是DFU的一线治疗方法[2],但在机体营养和慢性炎症方面的研究较少。本研究结果发现,口服高纯度鱼油能明显提高DFU患者伤口愈合比例、缩小伤口面积和缩短伤口愈合时间。MCDANIEL等[9]发现,鱼油可以增强伤口的上皮化,促进伤口组织愈合。ONTORIA-OVIEDO等[10]通过给予富含ω-3 PUFA的外用敷料促进了成年2型糖尿病(db/db)小鼠的伤口愈合。LULLOVE等[11]研究结果提示,DFU患者移植富含ω-3 PUFA的鱼皮后的愈合率明显高于仅接受标准伤口护理的治疗。说明无论在口服还是外用上,鱼油均对DFU患者的伤口愈合发挥了明显的促进作用。本研究中,两组HbA1c在干预前后无差异,提示鱼油对DFU伤口愈合的促进作用可能不受血糖波动的影响,但目前鱼油在糖代谢中的影响仍备受争议[12]。
本研究在对伤口面积进行分层分析后发现,试验组患者伤口面积有较为明显的缩小,这提示鱼油可能在更广泛的患者群体中产生有益的治疗影响;而女性和单一部位溃疡患者中差异性明显,提示性别和溃疡类型对于鱼油的治疗反应存在差异,这可能是男性DFU的程度比女性更为严重所致[13]。而对伤口愈合率的进一步分析发现,愈合率的增加主要集中在男性、HbA1c>9%、单一部位溃疡、既往有足溃疡史、既往无介入手术史及低ALB水平等方面,提示在这些特定的患者群体中,鱼油的治疗效果可能更为明显,而且血糖的严格控制和较少的溃疡数量也被认为是伤口愈合的有利因素。为了进一步探究两组伤口愈合情况与各相关因素的关系,本研究通过多因素logistic回归分析发现,干预措施是伤口愈合的影响因素,表明鱼油确实在DFU伤口愈合方面发挥了积极有效的促进作用。
伤口愈合是一个复杂的动态过程,由止血、炎症、增殖、组织重塑4个重叠阶段组成,任何一个环节出现异常都有可能导致伤口愈合延迟[14]。在伤口炎症期,DFU患者伤口中促炎性M1巨噬细胞不能有效地转换成抗炎性M2巨噬细胞,持续分泌大量促炎性细胞因子IL-1β、IL-6和TNF-α,造成伤口愈合缓慢,并伴随许多代谢紊乱,导致进一步并发症的发生和发展[15]。本研究发现,试验组的IL-6、IL-8水平的下降程度明显高于对照组,虽然两组CRP、TNF-α、NLR和PLR的降低值无差异,但也表现出明显的下降趋势,这提示鱼油在改善机体炎症反应中起到有益的正向作用,这可能是鱼油促进创面愈合的关键机制之一。
近些年,营养与伤口愈合之间的关系已得到了广泛的关注,营养不良会增加感染、炎症反应的风险,导致伤口迁延不愈[16],而DFU患者因伤口愈合缓慢导致机体营养消耗大,普遍存在营养不良的风险。本研究中,80.0%患者存在低ALB水平,而鱼油仍然对其足部伤口愈合表现出明显的促进作用,说明鱼油对促进低ALB水平的DFU患者伤口愈合作用效果好。另外,干预后试验组PA改善幅度大于对照组,这与BAGHERI等[17]的结论一致,提示鱼油可能在一定程度上改善了DFU患者的营养摄入情况,这可能也是鱼油促进DFU患者伤口愈合的另一原因。
综上所述,鱼油对DFU的伤口愈合具有明显的促进作用,其主要机制可能是鱼油对炎症的调节作用,但仍需要多中心的随机双盲试验及更长的观察周期加以验证。
