Aβ25~35致阿尔茨海默病小鼠的脑海马组织炎症因子及BDNF表达分析
2024-03-21任锦烨何湘伟李建明
陆 雯,任锦烨,何湘伟,唐 亮,李建明△
(长沙医学院:1.临床学院;2.神经变性病基础与临床湖南省高校重点实验室,长沙 410219)
阿尔茨海默病(Alzheimer’s disease,AD)以进行性的学习和记忆功能下降为主要临床表现[1],65岁以上人群AD的发病率约为5%[2]。AD的发病机制尚不明确,脑内局部炎症被认为是AD发生、发展的重要因素[3-4]。目前,神经胶质细胞尤其是小胶质细胞的活化在神经炎症中的作用已被广泛证实[5]。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)在哺乳动物海马的发育、营养支持和神经可塑性中起着重要作用[6]。研究表明,BDNF或其受体酪氨酸激酶受体(tropomyosin-related kinase B,TrkB)水平降低的动物存在行为缺陷[7]。BDNF诱导缺失的小鼠涉及前脑包括皮质、海马体和杏仁核特异性缺失[8]。此外,研究表明BDNF与AD、帕金森病和神经退行病变相关[9-11]。AD和帕金森病患者BDNF mRNA和蛋白表达降低[12-13]。但在AD动物模型中,BDNF表达趋势说法不一致。本研究通过双侧脑室注射β-淀粉样蛋白25~35(amyloid β-protein 25-35,Aβ25~35)构建AD样小鼠模型,采用苏木素-伊红(hematoxylin-eosin,HE)染色、ELISA、Western blot、免疫组织化学、实时荧光定量逆转录PCR(real-time quantitative reverse transcription PCR,RT-qPCR)等方法,探讨Aβ25~35脑内注射对炎症因子及BDNF表达的影响。
1 材料与方法
1.1 材料
1.1.1实验动物及分组
动物实验均在长沙医学院神经科学与行为研究中心完成。动物实验过程遵循道德标准和《赫尔辛基宣言》,研究过程得到了长沙医学院动物伦理委员会的批准。取40只6周龄雄性昆明小鼠(长沙天勤生物科技有限公司),均置于可控条件下饲养,温度(23.0±0.6)℃,相对湿度(55±8)%,光暗周期12 h∶12 h。采用随机数字表法,将小鼠分为4组(各10只),均采用单次双侧脑室注射Aβ25~3520 mg/kg建立AD小鼠模型,注射后分别观察0 d(0 d组)、7 d(7 d组)、14 d(14 d组)和28 d(28 d组)。
1.1.2主要仪器与试剂
小鼠脑立体定位仪(安徽正华生物仪器设备有限公司)、Y迷宫(上海欣软信息科技有限公司),新物体识别(new object recognition,NOR)仪(上海然哲仪器设备有限公司)。Aβ25~35(美国Sigma公司),BSA(瑞士Roche公司),BCA蛋白测定试剂盒(上海碧云天生物技术有限公司),二氨基联苯胺(DAB)显色试剂盒(北京中杉金桥生物技术有限公司),HE染液(上海源叶生物科技有限公司),抗磷酸化tau(p-Tau)抗体、抗CD11b抗体、抗BDNF抗体(英国Abcam公司),山羊抗兔IgG抗体(江苏亲科生物研究中心有限公司),SuperScript VILOTMcDNA试剂盒(美国Thermo Fisher Scientific公司)。HieffTM qPCR SYBR®Green Master Mix(大连TaKaRa公司);白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA检测试剂盒(日本Sigma公司)。
1.2 方法
1.2.1Y迷宫
Y迷宫由3个相同的臂以120°相互连接组成,从一个中央平台向外辐射。将小鼠放置在一只臂末端,并让其在5 min内自由接触所有臂,记录5 min 内每只小鼠在各个臂的穿梭次数。小鼠进入每个臂的标准为四肢完全进入。小鼠依次进入3个不同臂是1个正确的交替;而每次探索中有2个臂未进入时,则为1个错误的交替。计算正确交替百分比,正确交替百分比=正确交替数/总交替数× 100%。
1.2.2NOR
测试仪器由一个黑色有机玻璃盒子组成,放置在光线昏暗的测试室内。测试中使用A、B、C 3个物体,其中A、B一样,C与A、B不同。小鼠在装置内(无物体)自由运动10 min,再放入A、B物体,A、B均无气味且固定,距离两侧壁约10 cm。将小鼠背朝物体从距物体等距离处放入装置中,记录小鼠在3 min内探索每个物体的时间(用鼻子在1 cm半径内嗅探物体和/或触摸物体)。间隔24 h后将A、B其中一个替换成C,以同样的方式将小鼠放入装置中3 min,记录小鼠在3 min内探索每个物体的时间。计算区分新物体和熟悉物体的辨别指数(discrimination index,DI),DI=(探索新物体的时间-探索熟悉物体的时间)/(探索新物体的时间+熟悉物体的时间)×100%。
1.2.3组织采集
采用0.4%戊巴比妥钠进行腹腔注射麻醉,断头取脑。左侧半脑组织(n=10)置于4%多聚甲醛中用于形态学分析;右侧半脑取海马组织(n=10)快速冻存于液氮,继而置于-80 ℃冰箱中用于生化分析。
1.2.4HE染色
将小鼠左侧半脑组织浸蜡包埋,蜡块修整后切片。于40 ℃温水中摊平组织, 60 ℃烤箱烘干。切片于苏木素染5 min, 加入1%盐酸乙醇、0.6%氨水,再于伊红染液中染色3 min;经梯度乙醇干燥后,置于二甲苯中使组织透明,中性树胶封片。光镜下计数海马神经元数量(个/mm2)。
1.2.5免疫组织化学染色
半脑组织切片复温30 min,加入3%过氧化氢(H2O2)溶液去除内源性过氧化物酶;再置于含5%正常马血清的反应管,摇床上室温孵育2 h,封闭组织中的非特异性抗原位点。加入一抗[抗p-tau(1∶800)、抗CD11b(1∶1 000)、抗BDNF(1∶1 000)],室温摇床孵育2 h,4 ℃摇床孵育过夜。每张组织切片加80 μL山羊抗兔IgG抗体,37 ℃孵育50 min;0.05% DAB覆盖染色,预孵3 min后依次加入0.03% H2O2,避光显色;浸泡于苏木素染液中染色后,流水冲洗。将组织切片浸入弱碱性溶液中返蓝,依次经 80%、90%、100%、100%梯度乙醇脱水,置于二甲苯中2次使组织透明。组织切片在每个梯度浸没8~10 min;自然风干,随后用中性树脂封片保存。采用Ckx53倒置显微镜(日本Olympus公司)以200倍倍率拍摄光学显微镜图像。采用Image-Pro Plus6.0软件(美国Media Cybernetics公司)分析免疫反应物(p-tau、CD11b、 BDNF)的光密度值。
1.2.6ELISA
将海马组织制成10%的匀浆,4 ℃下4 500 r/min离心10 min,收集上清液。采用ELISA试剂盒检测海马组织中IL-1β和TNF-α表达水平。检测在DR-200Bs酶标仪(深圳DiaTek公司)中完成,过程严格按照说明书操作。
1.2.7RT-qPCR
采用TRIZOL(美国Invitrogen公司)分离海马组织总RNA,用UV-9000紫外分光光度计(上海精密仪器有限公司)测定RNA水平和完整性。采用DNase纯化总RNA,cDNA用SuperScript VILOTMcDNA试剂盒合成。采用HieffTM qPCR SYBR®Green Master Mix在LightCycler®2.0上进行RT-qPCR。以β-actin作为标准内参, BDNF mRNA相对表达水平按照2-ΔΔCt法进行计算。
1.2.8Western blot
采用BCA蛋白测定试剂盒分析脑组织标本总蛋白水平。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)80 V下电泳1 h,使用Trans-Blot®TurboTM(美国Bio-Rad公司)将蛋白转移到膜上。总蛋白分别与兔抗小鼠BDNF单克隆抗体(1∶1 000,英国Abcam公司)、兔抗小鼠β-actin单克隆抗体(1∶1 000,英国Abcam公司)在4 ℃过夜,然后用山羊抗兔IgG抗体(1∶8 000)在室温下放置2 h,电化学发光(ECL)液曝光。使用Image-Pro Plus6.0软件(美国Media Cybernetics公司)分析BDNF蛋白灰度值,与内参β-actin比值后进行统计学分析。
1.3 统计学处理
2 结 果
2.1 Aβ25~35可损伤小鼠记忆和认知功能
Y迷宫测试结果显示,各组间穿梭次数无明显差异(P>0.05),见图1A。与0 d组相比,14 d、28 d组正确交替百分比明显降低(P<0.05),7 d组与0 d组正确交替百分比无明显差异(P>0.05),见图1B。NOR测试结果显示,各组的总探索时间无明显差异(P>0.05),见图1C。与0 d组相比,14 d、28 d组小鼠DI明显降低(P<0.05),7 d组与0 d组DI无明显差异(P>0.05),见图1D。

A:Y迷宫测试穿梭次数;B:Y迷宫测试的正确交替百分比;C:NOR测试的总探索时间;D:NOR测试阶段的辨别指数;a:P<0.05,与0 d组比较。
2.2 Aβ25~35可损伤神经元和增加p-tau表达
HE染色结果显示,0 d组海马细胞排列规则,边缘清晰,细胞核及核仁清晰,见图2A;7 d、14 d、28 d组海马细胞排列不规则,结构模糊,细胞核收缩,染色深,见图2B~D。与0 d组相比,14 d、28 d组小鼠海马组织神经元数量明显减少(P<0.05),7 d组神经元数量与0 d组比较无明显差异(P>0.05),见图2E。免疫组织化学结果显示,与0 d组相比,7 d组小鼠海马区p-Tau表达光密度值无明显差异(P>0.05),14 d、28 d组小鼠海马区p-Tau表达光密度值明显升高(P<0.05),见图2F~J。
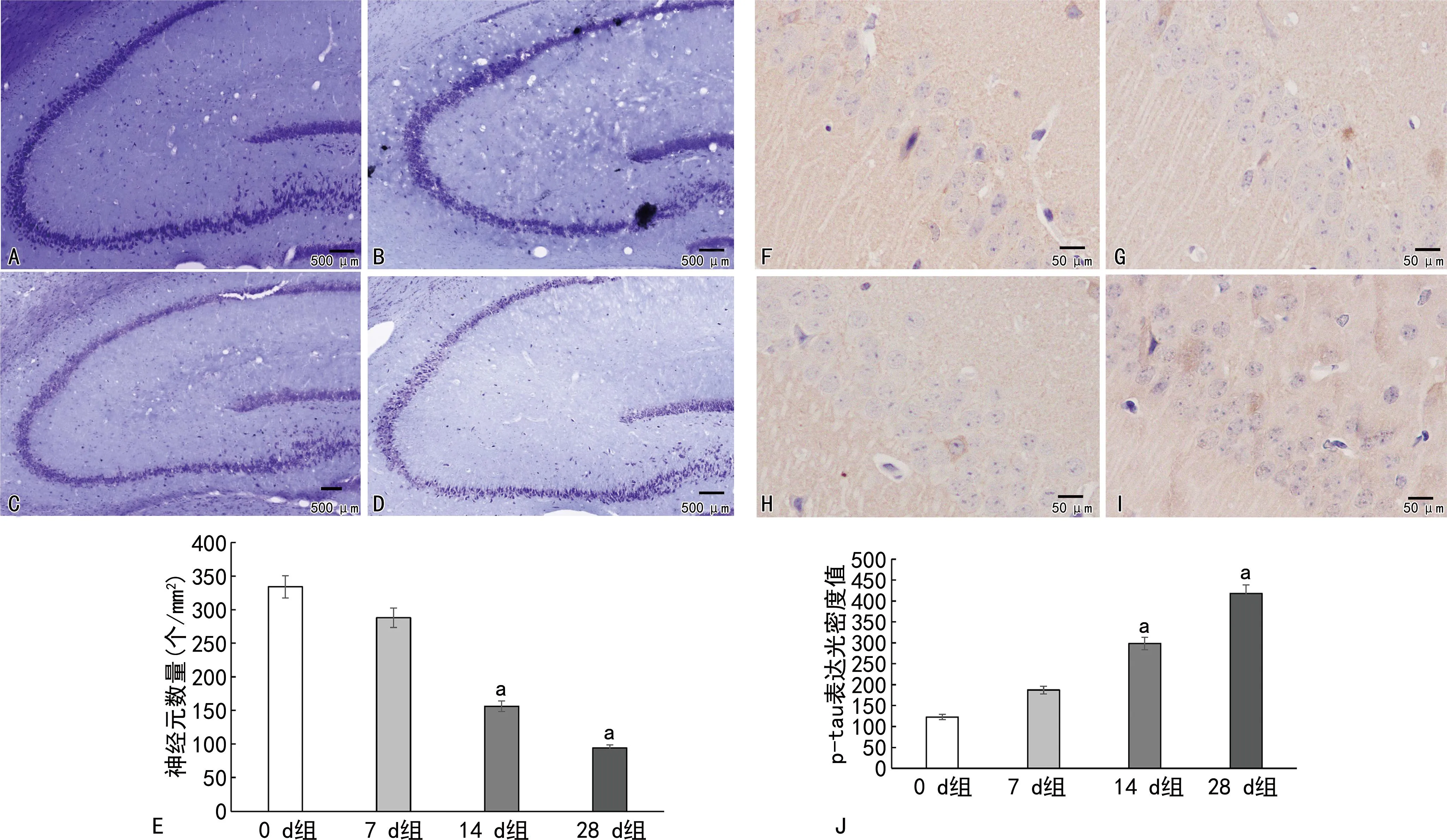
A~D:分别为0 d、7 d、14 d、28 d组HE染色;E:各组神经元数量比较;F~I:分别为0 d、7 d、14 d、28 d组p-tau免疫组织化学染色;J:各组p-tau表达光密度值比较;a:P<0.05,与0 d组比较。
2.3 Aβ25~35可活化小胶质细胞和增加TNF-α、IL-1β表达
免疫组织化学结果显示,与0 d组相比, 14 d、28 d组小鼠海马CD11b光密度值明显增加(P<0.05),见图3。ELISA结果显示,与0 d组相比, 14 d、28 d组小鼠海马组织IL-1β和TNF-α表达水平明显升高(P<0.05),见表1。
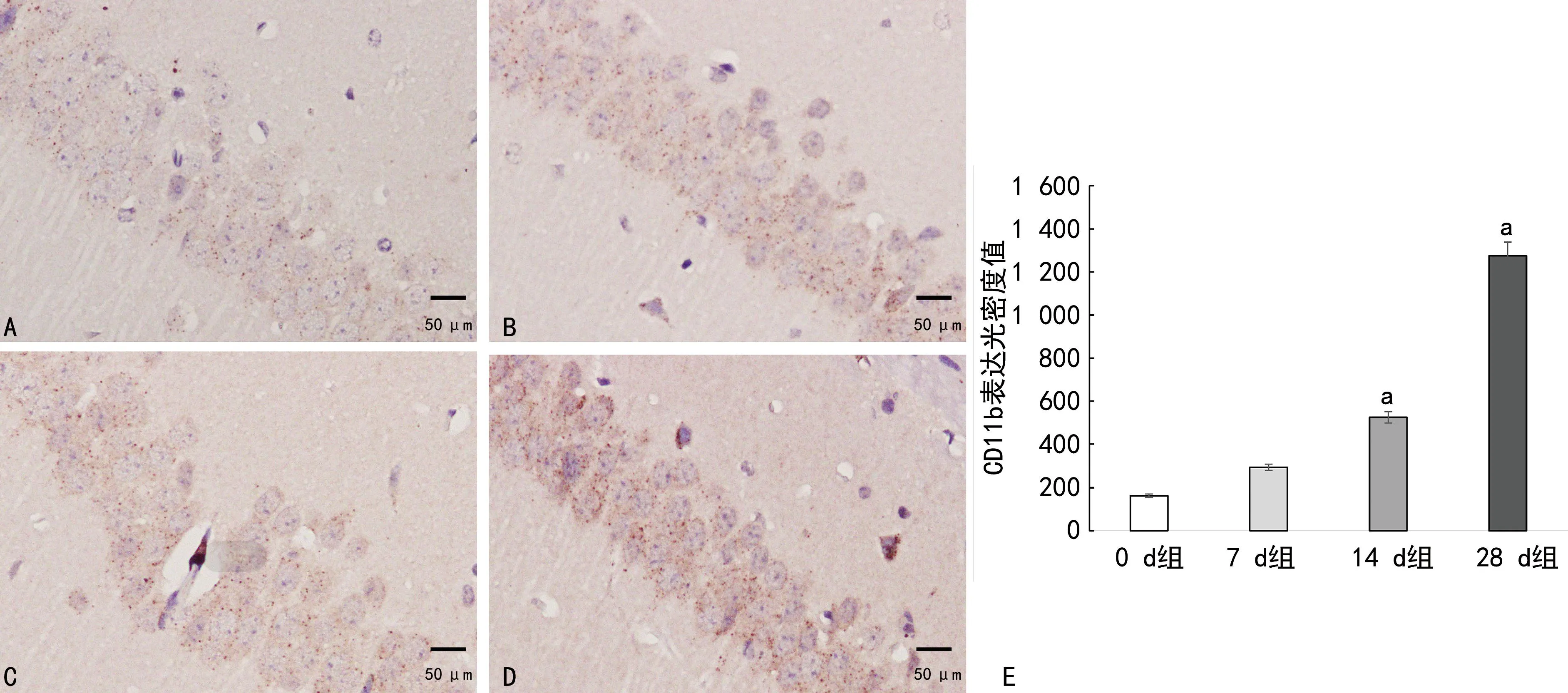
A~D:分别为0 d、7 d、14 d、28 d组CD11b免疫组织化学染色;E:各组CD11b表达光密度值比较;a:P<0.05,与0 d组比较。

表1 小鼠海马组织TNF-α和IL-1β表达水平比较
2.4 Aβ25~35可影响BDNF表达
与0 d组相比,7 d组小鼠海马组织BDNF mRNA和蛋白表达水平明显升高(P<0.05),14 d、28 d组小鼠海马组织BDNF mRNA和蛋白表达水平明显降低(P<0.05),见图4。

A~D:分别为0 d、7 d、14 d、28 d组BDNF免疫组织化学染色;E:各组BDNF表达光密度值比较;F:各组BDNF mRNA相对表达水平比较;G:各组BDNF表达SDS-PAGE图;H:各组BDNF相对表达水平比较;a:P<0.05,与0 d组比较。
3 讨 论
AD的病因复杂,神经炎症是AD发生、发展的主要因素之一,也是AD重要的治疗靶点之一[14]。目前,神经胶质细胞特别是小胶质细胞在神经炎症中的作用已成为研究热点。研究表明,由小胶质细胞激活引起的炎症反应是神经损伤的主要原因之一,亦是神经退行性疾病发病的重要机制之一[15-17]。大量研究表明,在AD患者大脑皮质的神经炎性斑块病灶周围存在大量激活的小胶质细胞[18-19]。小胶质细胞是炎症反应与中枢神经系统疾病相互作用的载体。IL-1β和TNF-α是促使小胶质细胞进入活跃状态并引起免疫反应的重要因子。在AD发展过程中,Aβ聚合物可通过核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLPR3)炎性小体与小胶质细胞结合,从而释放出IL-1β和TNF-α等炎症因子及神经毒性物质[20-22]。本研究结果显示,Aβ25~35处理小鼠后,脑海马组织小胶质细胞被大量激活,并有大量IL-1β和TNF-α表达,从而引起Tau蛋白磷酸化增加,神经元结构受损,最终损伤了小鼠记忆和认知功能,这与既往研究[23]有一定相似性。大量研究认为,基于小胶质细胞在神经炎症反应中的作用对AD进行治疗是可行的。非甾体抗炎药可以抑制小胶质细胞活化并减少活化小胶质细胞积累[24]。具有抗氧化特性的酚类化合物,如橄榄苦苷和表没食子儿茶素没食子酸酯也被报道可抑制小胶质细胞活性,缓解神经炎症反应及AD样症状[25]。此外,中药及中药提取物如片仔癀[26]、石菖蒲提取物[27]、小续命汤提取物[28]等均可抑制小胶质细胞活性,从而减轻AD小鼠神经炎症反应并缓解认知功能障碍。上述研究提示,抑制小胶质细胞炎症可能有利于AD症状的改善。
临床研究表明,AD患者会逐渐出现学习和记忆能力下降,并最终发展为行为障碍和人格缺陷[29]。BDNF具有增强突触可塑性的作用,这与学习能力和记忆形成及存储有着密不可分的关系。研究证实AD患者脑组织内BDNF水平可发生明显改变[30]。BUCHMAN等[31]研究发现,脑组织BDNF水平与老年个体生前认知能力的衰退速度呈负相关。REX等[32]研究发现,AD患者BDNF及其受体(TrkB)随着年龄的增长而减少;同时还表明,Aβ在体内外均影响BDNF的产生及其信号通路。此外,AD动物模型研究也发现脑内BDNF表达趋势呈现多样化。敖平等[33]研究发现,Aβ-AD大鼠模型组BDNF表达明显低于对照组;外源添加BDNF后,可增加BDNF的表达水平。巴迎春等[34]研究发现,脑内局部炎症时,BDNF在海马CA1区的表达先升后降。本研究发现,Aβ25~35处理小鼠7 d后BDNF表达水平明显升高,而处理14、28 d后BDNF表达水平较0 d组明显降低。Aβ可激活小胶质细胞引起炎症反应,诱发氧化应激产生氧自由基,促进细胞凋亡及细胞内钙稳态失衡,导致神经元变性[35]。体内也存在对Aβ的清除机制,BDNF可保护神经元免受Aβ损伤。ARANCIBIA等[36]研究表明,在小鼠体内及体外研究中均可观察到BDNF对Aβ聚集沉积所致的神经毒性有保护作用。上述结果提示,Aβ25~35处理的0~7 d为急性损伤期,神经元损伤较严重,为抵御外来异物刺激,维持神经元存活,内源性BDNF表达水平明显升高,但具体机制尚不明确。可能与BDNF通过结合TrkB激活信号传导,调节钙离子表达,拮抗自由基损伤,提升细胞内抗氧化酶活性等,从而促进细胞修复、抑制细胞凋亡有关。
综上所述,Aβ25~35可损伤小鼠记忆和认知功能,其可能通过活化小胶质细胞,增加TNF-α、IL-1β及p-tau的表达实现。此外,AD样小鼠脑海马区损伤早期BDNF表达升高,而损伤中晚期表达降低。
