甲型流感病毒H1N1型灭活病毒标准物质研究
2024-03-20乐丽欢王炤坤李兰英闻艳丽胡轶红
许 丽, 乐丽欢, 杨 雪, 王炤坤, 李兰英, 闻艳丽, 陶 晴, 胡轶红, 刘 刚
(1.上海市计量测试技术研究院 国家市场监管重点实验室(生物分析计量溯源),上海 201203;2.中国科学院 上海免疫与感染研究所 公共技术服务中心 病原发现与大数据平台,上海 200031)
1 引 言
呼吸道感染是引起人类尤其是婴幼儿死亡的主要病因之一,病毒是呼吸道感染的主要病原体,可通过接触、飞沫和气溶胶传播,传染性强,严重威胁人类健康[1, 2]。甲型流感病毒(influenza A virus, FluA)是一种RNA病毒,根据病毒表面糖蛋白血凝素(hemagglutinin, HA)和神经氨酸酶(neuraminidase, NA)的不同,可以分为18个HA亚型(H1~H18)和11个NA亚型(N1~N11)[3, 4],其中H1N1亚型是感染人类的主要亚型之一[5],易引起流感破坏性大流行,需要做到早期快速灵敏诊断,以减少病毒传播和流行。
近年来,应用于病毒核酸高灵敏度检测的技术飞速发展,包括逆转录实时荧光定量PCR(RT-qPCR)、恒温核酸扩增、重组酶聚合酶扩增、生物传感器等[6~13],相关检测试剂盒不断被研发并投入使用,为诊疗一线的快速精准诊断和治疗提供了有利支撑[14, 15]。核酸标准物质可以用于评价核酸检测结果的准确性和溯源性,经数据库查询,目前国内针对流感病毒核酸检测共有5种国家有证标准物质,分别为禽流感病毒H5亚型(WF19株)核糖核酸标准物质(GBW(E)091224)、禽流感病毒H7亚型(LN114株)核糖核酸标准物质(GBW(E)091225)、甲型H1N1流感病毒假病毒核酸标准物质(GBW(E)091257)、甲型H3N2流感病毒假病毒核酸标准物质(GBW(E)091258)和乙型(维多利亚系)流感病毒假病毒核酸标准物质(GBW(E)091259)。但需要注意的是,目前缺乏灭活病毒形式的甲型流感病毒H1N1型核酸有证标准物质,已有标物序列不能覆盖甲型流感病毒H1N1型基因组全长,也无法对提取、检测等病毒分析全过程进行质量控制,给病毒核酸检测的量值溯源带来风险,影响相关试剂和产业的高质量发展。
针对上述情况,研制了一种灭活病毒形式的甲型流感病毒H1N1型核酸标准物质,其原料来源于培养的真实病毒。具体制备流程为:首先对灭活后的病毒进行灭活效果确认;然后采用数字PCR(digital PCR, dPCR)方法联合多家实验室对灭活病毒标准物质候选物进行定值;再对标准物质的均匀性、稳定性进行评估;最后对量值不确定度及应用性能进行分析。经验证该标准物质可为H1N1型甲型流感病毒检测的全过程提供计量溯源和质量控制支撑。
2 材料与方法
2.1 主要试剂
甲型流感病毒H1N1型毒株(VR-825)购自美国细胞培养物收藏中心(American type culture collection, ATCC);病毒核酸提取试剂盒购自宝生物工程(大连)有限公司;病毒稀释保存液购自广州邦德盛生物科技有限公司;新冠病毒RNA标准物质(GBW(E)091111)来自上海市计量测试技术研究院;新型冠状病毒、副流感病毒、人鼻病毒A型、人鼻病毒B型、人鼻病毒C型、呼吸道合胞病毒、人麻疹病毒、人风疹病毒核酸标准品来自上海市计量测试技术研究院;One-step RT-ddPCR Kit for Probes购自美国伯乐公司;甲型H1N1流感病毒(2009)RNA检测试剂盒(PCR-荧光探针法)购自广州达安基因股份有限公司;甲型流感病毒/乙型流感病毒/呼吸道合胞病毒核酸检测试剂盒(PCR-荧光探针法)购自郑州安图生物工程股份有限公司;引物探针由百力格生物科技(上海)股份有限公司合成。
2.2 主要仪器
病毒培养箱(Thermo scientific);倒置相差显微镜(Olympus);微滴式数字PCR仪及配套仪器(伯乐);实时荧光PCR仪(Life Technologies);芯片式dPCR仪(臻准生物科技(上海)有限公司)。
2.3 灭活病毒培养和标准物质制备
培养甲型流感病毒H1N1型,宿主细胞为MDCK细胞,培养条件为EMEM培养基(1%青霉素/链霉素,1 μg/mL TPCK),35 ℃,5%CO2。培养 3~5天后收集病毒液,离心去除细胞和细胞碎片,使用0.45 μm滤膜过滤除去细小颗粒。冰浴条件下向病毒液加入β-丙内酯(终浓度为0.1%),室温摇晃过夜灭活病毒。离心收集灭活病毒,将灭活后的病毒重新接种培养宿主细胞,连续培养7天,采用实时荧光PCR法监测病毒Ct值变化趋势,如Ct值不变即表明病毒完全灭活。将收集的灭活病毒按照一定的比例进行稀释,随后进行分装,共分装200管,每管210 μL,分装完成后立即置于-80~-70 ℃条件下保存。
2.4 数字PCR定值方法
经核酸提取效率确认,选取基于核酸制备膜技术的试剂盒用于研究中的标准物质核酸提取。优化后采用的数字PCR定值引物探针见表1,配制体系见表2,扩增程序见表3。
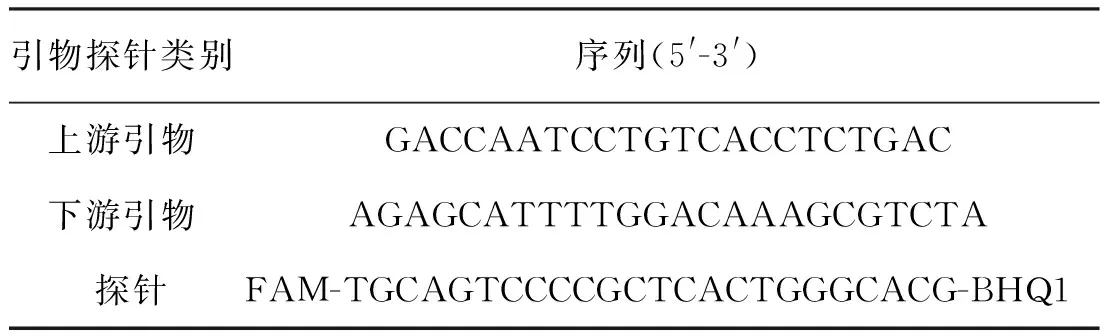
表1 数字PCR定值引物探针序列Tab.1 Sequences of primers and probe for digital PCR detection

表2 数字PCR体系配制Tab.2 Preparation of digital PCR system μL

表3 数字PCR扩增程序Tab.3 Digital PCR amplification program
2.5 标准物质联合定值和数据处理过程
联合5家实验室采用优化后的数字PCR方法对标准物质的拷贝数浓度量值共同进行定值。定值的同时发放统一的能力验证样品,检验参与定值实验室检测准确性和提取效率。对全部定值数据除以每家实验室的提取效率,随后进行统计处理,对组内数据进行正态分布检验、离群值检验,组间数据进行等精度检验、离群值检验,最后将符合要求的平均值再次计算平均值,即为标准物质的标准值。
3 结果与分析
3.1 标准物质的制备
甲型流感病毒H1N1型培养物经化学灭活后,对其灭活效果进行验证。将灭活前和灭活后病毒重新接种培养宿主细胞,培养一周时间,期间连续取样5次进行病毒核酸实时荧光PCR检测,Ct值越小代表病毒核酸含量越高。实验结果显示,灭活之前的接种样品(图1红色线),随着培养时间的延长,Ct值明显降低,展示了典型的病毒感染细胞并进行自我复制的过程;灭活后样品病毒实时荧光PCR的Ct值没有明显变小(图1蓝色线),证明灭活病毒接种细胞后无复制繁殖,灭活效率良好,可确保无生物危害。
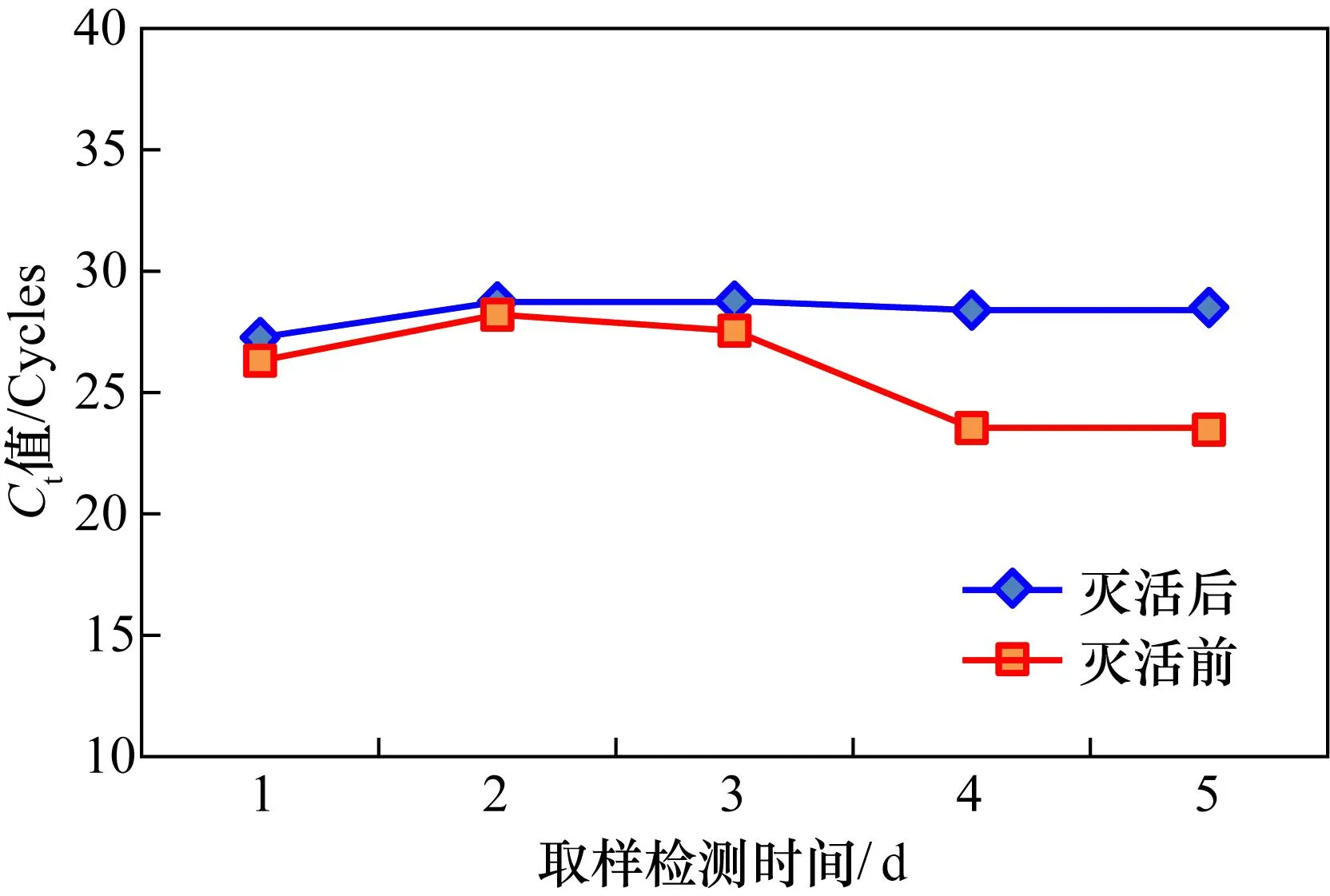
图1 灭活病毒重新接种宿主细胞培养过程实时荧光PCR检测结果Fig.1 Real-time PCR results of inactivated virus re-inoculation in host cell culture
3.2 定值方法的建立、优化与验证
3.2.1 核酸提取效率验证
选取基于核酸制备膜技术的试剂盒用于研究中的标准物质核酸提取,使用新冠病毒RNA标准物质(GBW(E)091111)对其核酸提取效率进行验证。验证方法:对加入人工血清的新冠病毒RNA标准物质进行核酸提取;接着对N基因片段进行数字PCR定值;检测值除以新冠病毒RNA标准物质N基因的标准值即为试剂盒的核酸提取效率。经验证,研究所采用的试剂盒核酸提取效率为100.9%,满足标准物质定值需求。
3.2.2 数字PCR定值方法优化
设计2套引物探针对标准物质提取核酸进行扩增,2套引物探针扩增信号如图2所示,根据图中结果可知,使用第1套引物探针(图2引物探针1)获得的数据,明显具有更优的信号区分度,故而优选第1对引物探针用于后续的病毒核酸数字PCR测量实验。
接下来,设置多种引物-探针浓度组合,分别进行数字PCR测量,比较病毒核酸定量结果,最终选择定量结果(如图3(a)所示)浓度最高的组合(引物为 600 nM,探针为100 nM),作为最终数字PCR定值的引物探针条件。考察数字PCR退火温度条件,在50~60 ℃之间设置8个不同的梯度温度作为数字PCR的退火温度,进行数字PCR测量,根据定量结果(如图3(b)所示),优选定量浓度最优的54 ℃为最佳退火温度。优化后的数字PCR方法信号区分雨滴图见图3(c)。
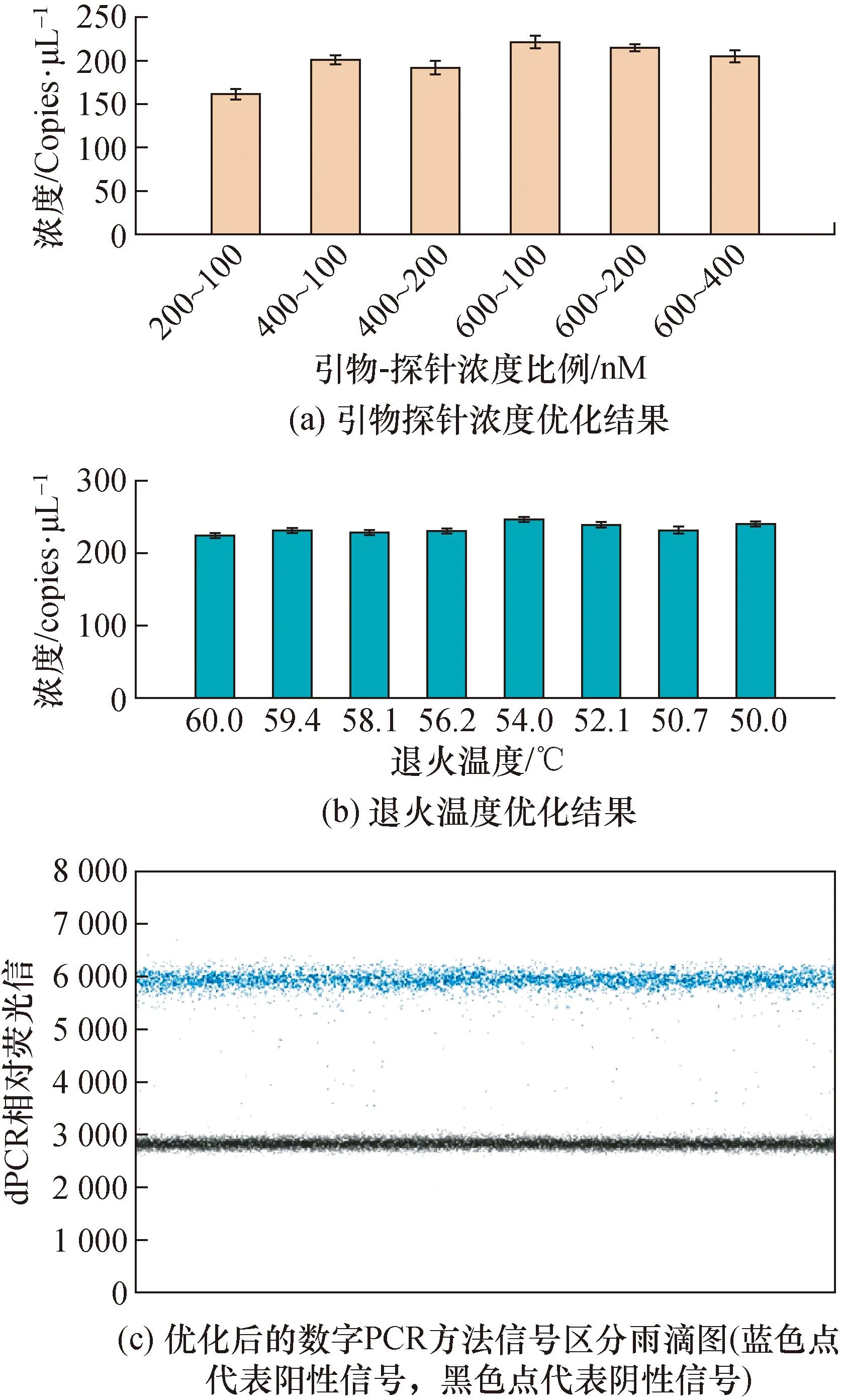
图3 关键参数优化和优化后的检测结果图Fig.3 Key parameter optimization and optimized test results
3.2.3 数字PCR定值方法考察研究
对方法关键指标进行验证和考察。首先验证了方法的特异性,选取6种其他呼吸道病毒核酸标准品(新型冠状病毒、副流感病毒、人鼻病毒A型、人鼻病毒B型、人鼻病毒C型、呼吸道合胞病毒、人麻疹病毒、人风疹病毒)作为核酸模板,用研究中的数字PCR定值方法进行扩增,扩增结果均为阴性,显示该方法特异性良好。然后考察了方法的重复性,将标准物质样品独立检测8次,检测数据的相对标准偏差(RSD)为2.7%图4,即为定值方法的重复性。最后验证了方法的检测限,将标准物质核酸稀释至2、1、0.5 copies/μL后进行数字PCR扩增,确定95%置信度水平下能够稳定检测的非0结果最低浓度为1 copies/μL,该浓度检测结果标准偏差(S)为0.36,则该方法的最低检测限(LOD)为1.09 copies/μL(3S),最低定量限(LOQ)为3.64 copies/μL(10S)。
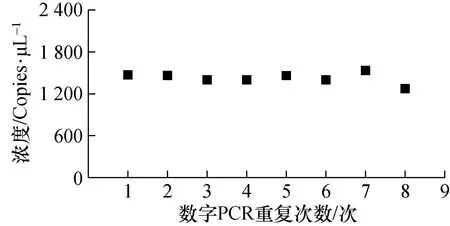
图4 数字定值PCR方法重复性考察结果Fig.4 Verification of the repeatability of digital PCR method
3.3 均匀性评估结果
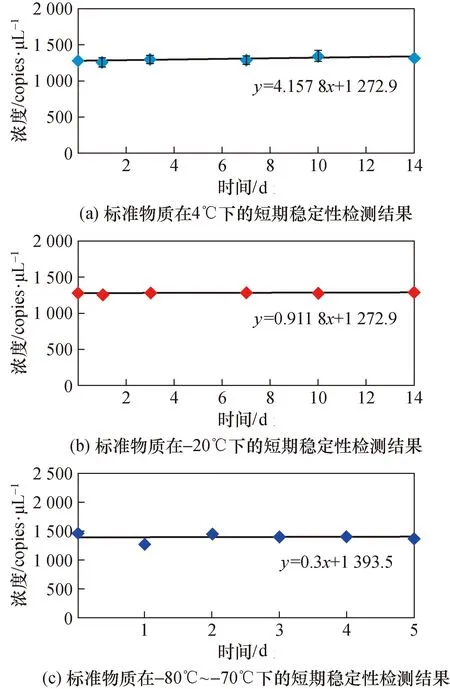
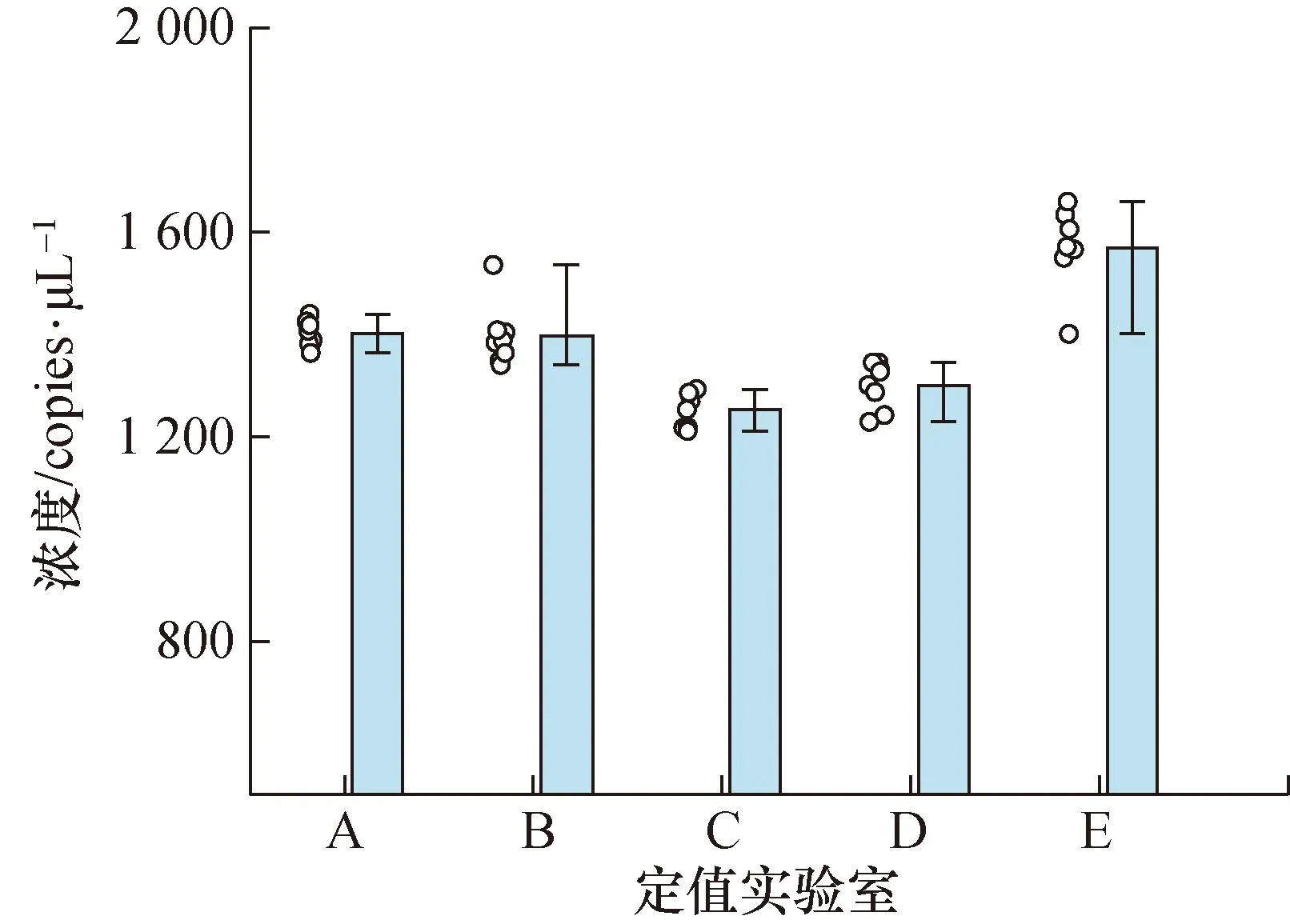
参照JJF 1343-2022《标准物质的定值及均匀性、稳定性评估》[16]对标准物质进行均匀性评估。从分装完毕的200瓶灭活病毒标准物质样品中随机选取11瓶,每瓶取样3次,每次取样50 μL进行检测。核酸提取后,采用数字PCR方法进行检测,采用方差分析法(F检验)进行均匀性检验,检测结果见图5。对计算得到标准物质的拷贝数进行F检验,检验结果见表4,由于F 图5 均匀性评估检测结果Fig.5 Uniformity evaluation test results 表4 标准物质的均匀性评估统计分析结果Tab.4 Statistical analysis results of homogeneity evaluation of reference materials 3.4.1 短期稳定性评估结果 评估标准物质在-20 ℃及4 ℃温度下放置0、1、3、7、10和14天后,采用数字PCR作为测量方法,考察标准物质浓度量值随着保存时间延长是否有量值变化的情况。采用同步稳定性评估方案[16],通过回归曲线方法来进行稳定性监测,以判断标准物质量值是否有单方向变化的趋势。测定结果见图6(a)和图6(b),统计结果显示标准物质在-20 ℃及4 ℃下放置14天量值均保持稳定,满足标准物质运输要求。 图6 稳定性检测结果Fig.6 Stability test results 图7 5家实验室数字PCR定值结果Fig.7 Digital PCR detection results of 5 laboratories 3.4.2 长期稳定性评估结果 测定标准物质在-80~-70 ℃条件下放置0、1、2、3、4、5月后的浓度量值,检测结果见图6(c)。通过回归曲线方法来进行稳定性监测,以判断标准物质量值是否有单方向变化的趋势,统计结果显示标准物质在在-80~-70 ℃条件下保存5个月保持稳定,并且稳定性监控还在持续进行中。 共5家单位参与了本标准物质的数字PCR联合定值。每家实验室的提取效率及测量准确性都进行了科学评估。定值结果除以各家实验室的提取效率,即为最终的定值数据,详见图8。对定值数据进行统计分析,确保无组内可疑值、组间等精度、组间无可疑值后,求出数据的总平均值,最终得出标准物质的定值结果为1 384.5 copies/μL。 对标准物质的均匀性引起的不确定度、标准物质的稳定性引起的不确定度、标准物质的定值过程带来的不确定度分别进行评定及统计合并,得出最终标准物质的相对扩展不确定度为18%,各不确定度分量和评定结果见表5。 表5 标准物质不确定度评定结果Tab.5 Uncertainty evaluation results of the reference material (%) 通过真实病毒培养、浓缩、病毒灭活、灭活效果验证、核酸提取方法研究、数字PCR定值方法建立、优化与验证、均匀性评估、稳定性评估、应用性能验证等步骤,研制了甲型流感病毒H1N1型灭活病毒形式的标准物质。相较于RNA片段、质粒DNA、假病毒等形式的标准物质,该甲型流感病毒H1N1型灭活病毒标准物质可以为核酸提取与核酸检测全过程提供质量控制支持,因其包含病毒全基因组核酸,还具有更广的适用范围。此外,研究建立了一套高准确度数字PCR定值方法,实现了标准物质核酸浓度的精准定量。该标准物质或可在甲型流感病毒H1N1型核酸的检测方法开发、试剂盒质量评价、检测实验室室内、室间质控等方面得到应用。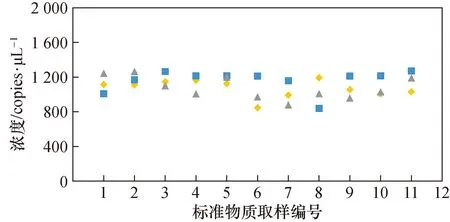
3.4 稳定性评估
3.5 标准物质的定值结果
3.6 标准物质的不确定度评定结果

4 结 论
