基于微透析结合UPLC的弩药微乳经皮给药后多成分皮肤药动学研究
2024-03-14谢欢宋选飞周斌刘耀杨芳芳陈迎龙朱艳张永萍
谢欢,宋选飞,周斌,刘耀,2,3,杨芳芳,2,3,陈迎龙,朱艳,张永萍,2,3
(1.贵州中医药大学药学院,贵州 贵阳 550025;2.贵州省中药民族药炮制与制剂工程技术研究中心,贵州 贵阳 550025;3.国家苗药工程技术研究中心,贵州 贵阳 550025;4.贵州中医药大学针灸推拿学院,贵州 贵阳 550025;5.贵州健康职业学院中医药系,贵州 铜仁 554300)
微透析是一种动态监测活体组织或器官中内源性物质和外源性物质的细胞外含量变化的技术[1],具有多位点实时采样、采样量小且所得样品纯净等诸多优点[2]。但由于微透析实验中采样量较少,待测物含量较低,为满足检测限要求,微透析常与各种灵敏度高的分析方法如UPLC、LC-MS/MS、HPLC-MS/MS、GC-MS等联用,这样不仅可以监测组织或器官的细胞外液中游离分子的水平,还可以阐明药物的体内过程及其组织或器官靶向性[3-4]。微透析技术最初旨在研究动物大脑中的内源性物质[5],但后来也逐渐应用于关节[6]、肝脏[7]、皮肤[8]、血液[9]等部位。
苗医弩药针疗法是苗医外治法中的经典疗法[10],常用配方由生草乌、白龙须、黑骨藤、透骨香、大血藤5味药材组成。其中以热药为主,冷药为辅,五药合用共奏祛风除湿、散寒止痛、舒筋活络之功,用于治疗各种风湿疾病[11]。传统的弩药针制法粗犷,易造成交叉感染,且使用时患者疼痛感明显,顺应性较差;经改良后的弩药也有使用剂量不准确,可控性较差等缺点,极大地阻碍了其临床应用及推广。课题组前期已成功将弩药液制备成弩药微乳,可解决弩药针疗法易交叉感染、依从性差等缺点[12];同时,本课题组前期研究表明,弩药微乳经皮给药治疗膝骨关节炎模型大鼠具有较好的疗效,但其经皮给药后的药动学特征目前尚无研究。因此,本研究拟采用微透析实时采样技术结合UPLC,考察弩药微乳经皮给药后多种有效成分的皮肤药动学特征,以期为该制剂后续研究提供参考。
1 材料
1.1 仪器
ACQUITY UPLC仪(Waters公司);瑞典CMA4004微透析系统(康森特生物科技有限公司);RYJ-12B透皮扩散仪(上海圣科仪器设备有限公司);DJ-A恒温磁力搅拌器(常州澳华仪器有限公司);DZF-6210真空干燥箱(天津市泰斯特仪器有限公司);HY-2雷磁涡旋仪(上海仪电科学股份有限公司);AUW1200型电子天平(SHIMADZU公司)。
1.2 试药
绿原酸对照品(批号:DSTDL002103)、苯甲酰新乌头原碱对照品(批号:DST230227-056)、杠柳毒苷对照品(批号:DSTDG004101)、新乌头碱对照品(批号:DSTDX002502),均购于成都德思特生物技术有限公司;黑骨藤、生草乌、大血藤、透骨香、白龙须均购于贵州省贵阳市花果园太升药材市场(批号:20220619,原产地均为贵州),由贵州中医药大学孙庆文教授对药材进行鉴定;肉豆蔻酸异丙酯(上海麦克林生化科技有限公司,批号:14114475);蓖麻油聚乙烯醚-35(罗恩试剂,批号:61791-12-6);乙腈(安徽天地高纯溶剂有限公司,批号:22055173)。
1.3 动物
新西兰兔,雄性,体质量为2.0~2.5 kg,购于贵阳经济技术开发区鹏程农业科技公司,许可证号为SCXK(黔)2018-0001,实验经贵州中医药大学动物实验伦理委员会批准(伦理审查编号:20230007)。
2 方法与结果
2.1 微透析分析方法的建立
2.1.1 色谱条件 色谱柱ACQUITY UPLC HSS T3(1.8 μm,2.1 mm×100 mm);柱温:35 ℃,流速:0.2 mL·min-1,检测波长:235 nm;流动相为乙腈(A)-0.1%磷酸水(B)。梯度洗脱程序为0~1 min,10%B,1~3 min,10%~35%B,3~4 min,35%~40%B,4~9.5 min,40%~42%B,9.5~14 min,42%~10%B,进样量为1 μL。
2.1.2 混合对照品溶液的配制 精密称取绿原酸4.83 mg,苯甲酰新乌头原碱4.89 mg,新乌头碱4.43 mg,杠柳毒苷5.29 mg,选用乙腈定容至10 mL,得质量浓度分别为0.483、0.489、0.443、0.529 mg·mL-1的混合对照品储备液,置4 ℃冰箱保存。
2.1.3 空白灌流液的制备 称取磷酸氢二钠1.195 g,磷酸二氢钠4.67 g,氯化钠2.395 g,加水定容至500 mL,过0.22 μm的滤膜,即得。
2.1.4 弩药微乳的制备 称取处方量药材,即黑骨藤30 g,生草乌20 g,大血藤50 g,透骨香50 g,白龙须15 g,共165 g,在80 ℃下,8倍量70%乙醇回流提取1 h,共提取2次,60 ℃减压浓缩回收乙醇,40 ℃真空干燥,得干浸膏约21.45 g(生药含量为7.69 g·g-1);精密称取质量分数为3%的油相(肉豆蔻酸异丙酯)、24%的混合乳化剂(蓖麻油聚乙烯醚-35∶无水乙醇=2∶1),于旋涡震荡仪上混匀后,加入3%的弩药干浸膏(即空白微乳总组分质量的3%),继续旋涡混匀,最后缓慢滴加73%的水,即得。
2.1.5 标准曲线的建立 分别精密吸取混合对照品储备液0.01、0.1、0.2、0.5、1.0、1.5、2.0 mL,用灌流液稀释定容至10 mL,得不同质量浓度的混合对照品溶液。以峰面积(Y)为纵坐标,质量浓度(X)为横坐标,绘制标准曲线,得到回归方程和相关系数(r)。结果如表1所示,弩药微乳中4种成分线性关系良好。

表1 4种成分线性回归方程及线性范围Table 1 4 Linear regression equations and linear range
2.1.6 专属性 取空白灌流液、含混合对照品的灌流液及体内微透析样品分别进样分析。结果见图1。结果表明,其专属性良好,空白灌流液对待测成分无干扰。
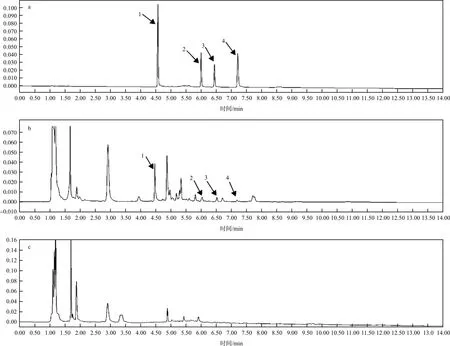
注:1.绿原酸;2.苯甲酰新乌头原碱;3.杠柳毒苷;4.新乌头碱
2.1.7 精密度 取混合对照品,连续进样6次,结果显示,绿原酸、苯甲酰新乌头原碱、杠柳毒苷、新乌头碱各峰峰面积的RSD值分别为0.654 3%、0.832 1%、0.306 4%、0.607 6%,均符合要求。
2.1.8 稳定性 取混合对照品,分别于2、4、6、8、10、12、24 h进样分析,计算各成分的RSD值,结果表明绿原酸、苯甲酰新乌头原碱、杠柳毒苷及新乌头碱各峰峰面积的RSD值分别为2.069 5%、1.212 5%、1.142 3%、1.097 3%,均符合要求,表明各对照品在室温下放置24 h稳定性良好。
2.2 微透析探针回收率的测定
2.2.1 线性探针前处理 探针在使用前,需以蒸馏水灌流过夜,充分洗净黏附在探针上的杂质;植入体内时,需先置于0.1%的肝素钠溶液中,以蒸馏水为灌流液,灌流30 min以上,以防植入体内后发生凝血,影响实验的进行。微透析试验过程中所涉及的所有溶液均需经0.22 μm滤膜过滤后方可使用。
2.2.2 回收率的计算 微透析实验中,半透膜的扩散具有双向性。在实际在体实验中,药物的相对回收率无法计算,当药物相对回收率与相对损失率近似相等时,即可选用反透析法(即减量法)来校正体内回收率。
增量法:将探针浸入含一定混合对照品的灌流液中,以空白灌流液灌流,此时,药物从膜外向膜内扩散,所得的溶液为透析液,其相对回收率(RR)=C透析液/C灌流液×100%。
减量法:将探针浸入空白灌流液中,以含一定对照品的灌流液灌流,此时,药物从膜内向膜外扩散,所得溶液为透析液,其相对损失率(RL)=(C灌流液-C透析液)/C灌流液×100%。

2.2.4 探针回收率影响因素考察
2.2.4.1 温度对探针回收率的影响 将微透析探针浸没在装有含混合对照品灌流液的反应瓶中,控制转速为300 r·min-1,流速为1.0 μL·min-1,以空白灌流液进行灌流。分别于25、32、37 ℃收集3份透析液,每更换1次温度需平衡1 h后再收集透析液,每份透析液30 μL。按照色谱条件进样分析,按公式计算RR。结果表明探针回收率与温度有关,见图2。提示我们在体内实验中,应尽量保持动物体温的恒定,以防温度的波动影响探针回收率。

图2 不同温度下4种成分RRFig.2 RR of 4 components at different temperatures
2.2.4.2 流速对探针回收率的影响 采用增量法及减量法探究流速对微透析探针回收率的影响。流速分别为0.5、1.0、1.5、2.0 μL·min-1平行收集3份透析液,每更换1次流速需平衡1 h后再收集透析液,每份透析液30 μL。按照色谱条件进样分析,按公式计算RR及RL。结果见图3。随着流速的升高,各成分的回收率均逐渐降低,综合考虑各成分回收率,最终选择流速为0.5 μL·min-1进行后续的在体试验研究。
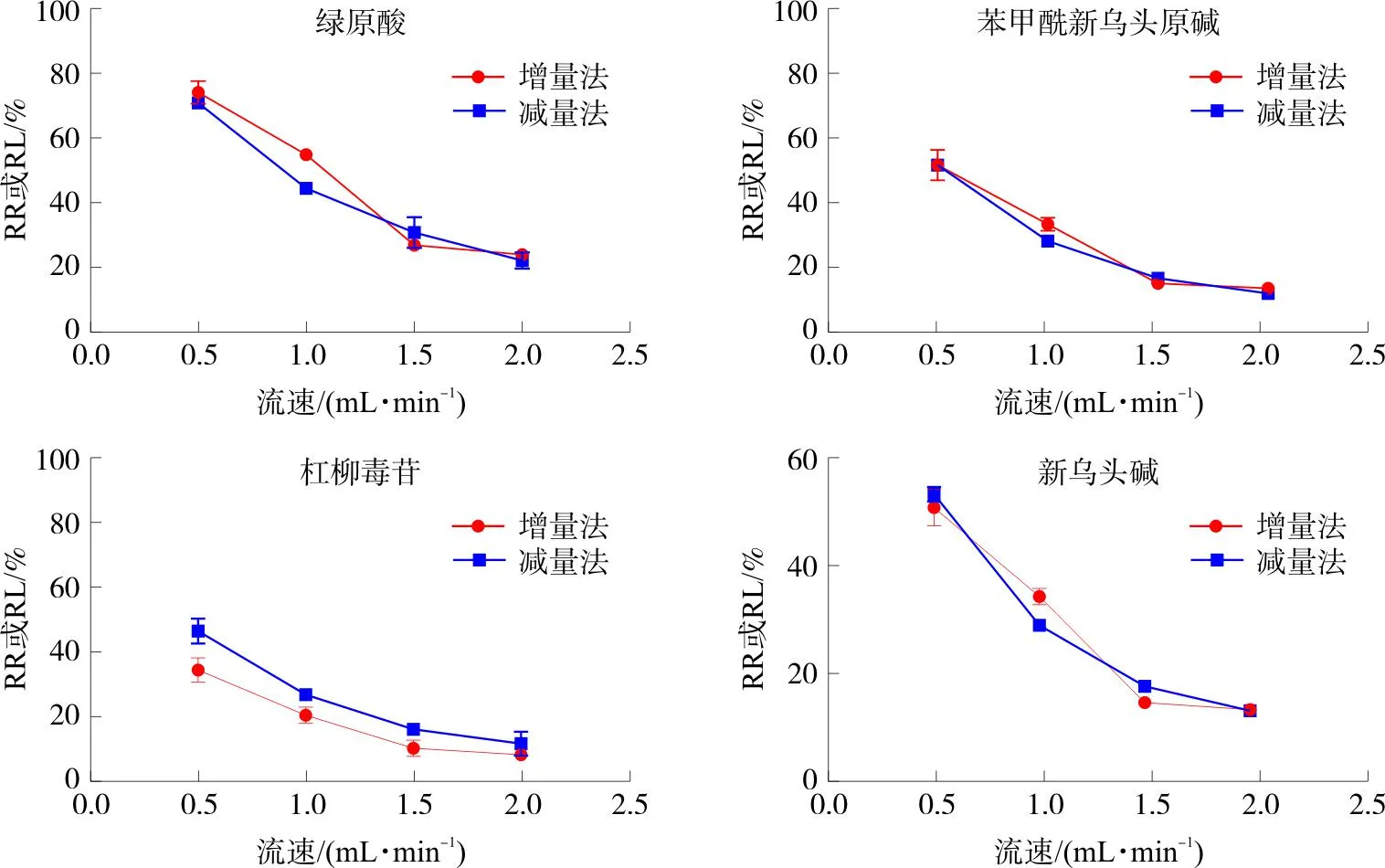
图3 不同流速下4种成分RR及RLFig.3 RR and RL of 4 components at different flow velocities
2.2.4.3 药物的质量浓度对探针回收率的影响 配制3种不同质量浓度(C1、C2、C3)的混合对照品,其中绿原酸、苯甲酰新乌头原碱、杠柳毒苷、新乌头碱的质量浓度分别为C1(22.99、13.77、18.10、18.59 μg·mL-1)、C2(39.81、24.42、34.28、32.96 μg·mL-1)、C3(53.39、44.20、60.89、75.42 μg·mL-1)。采用增量法及减量法进行实验,增量法以空白灌流液进行灌流,探针浸没在3种不同质量浓度(C1、C2、C3)的混合对照品中。减量法以含3种不同质量浓度(C1、C2、C3)的混合对照品灌流液进行灌流。均收集3份透析液,每更换1次质量浓度需平衡1 h后再收集透析液,每份透析液30 μL。按照色谱条件进样分析,按公式计算RR及RL,见图4。结果发现,4种成分在不同质量浓度下的回收率相差不大,表明探针的回收率不会因周围药物质量浓度的变化而发生剧烈波动,且各质量浓度下,探针的RR与相对损失率基本一致,表明选用反透析法来校正探针在体回收率是具有可行性的。
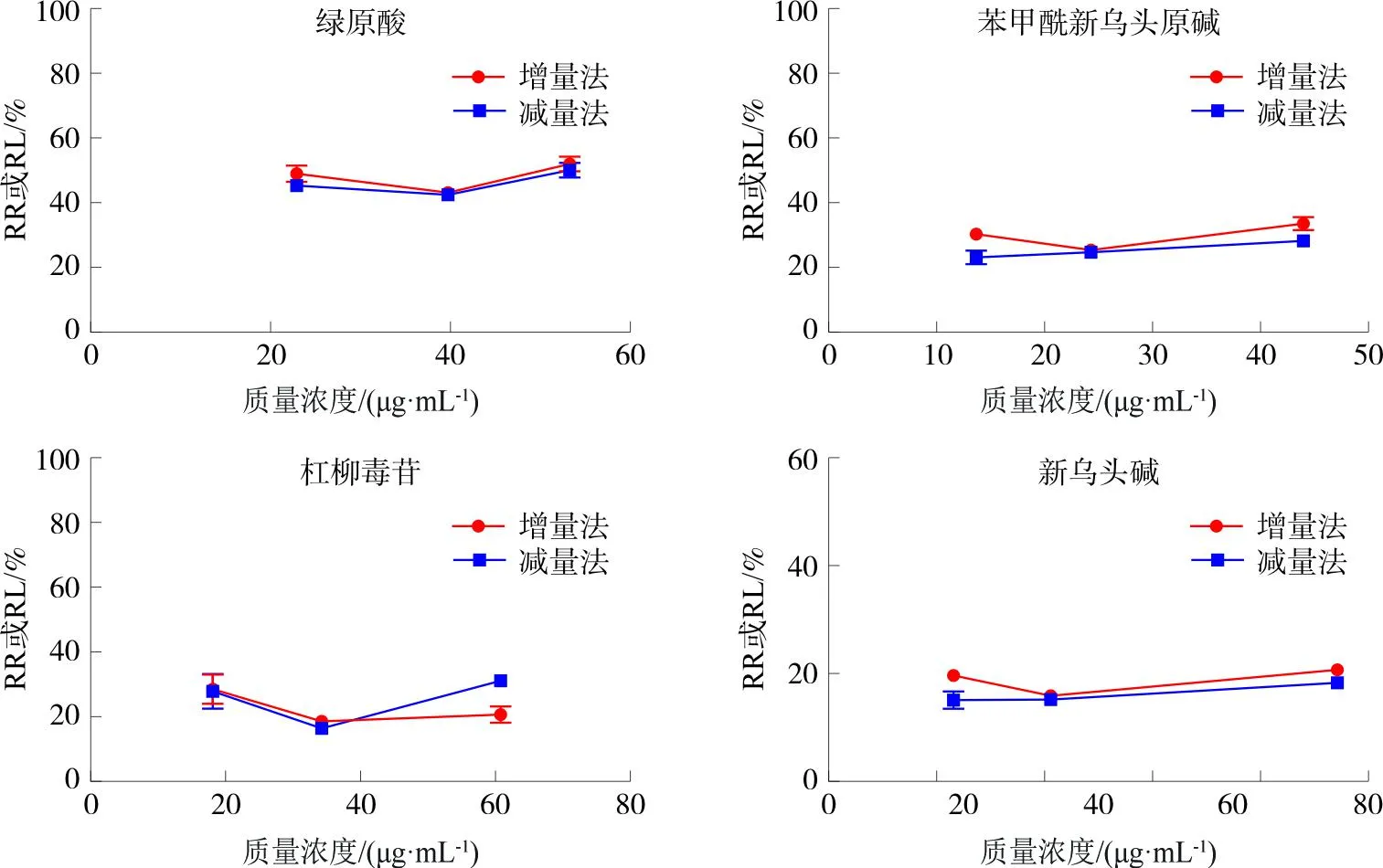
图4 不同质量浓度下4种成分RR及RLFig.4 RR and RL of 4 components in different concentrations
2.2.5 体内回收率 选用新西兰兔3只,禁食不禁水12 h,用脱毛膏将背部毛发除去,20%乌拉坦(5 mL·kg-1)耳缘静脉麻醉,固定在加热板上,植入探针,连接微量注射泵进样端及出样端,先采用生理盐水灌流1 h,再换用PBS缓冲液进行灌流,平衡30 min。采用减量法测定自制探针回收率及在体11 h回收率的稳定性,即选用含混合对照品的灌流液进行灌流,其中绿原酸、苯甲酰新乌头原碱、杠柳毒苷、新乌头碱的质量浓度分别为23.35、13.85、19.89、19.31 μg·mL-1。实验过程中保持动物体温恒定,流速为0.5 μL·min-1,每隔1 h收集1次样品,共收集11 h,按公式计算在体回收率。结果显示,各成分在体回收率在11 h内未出现剧烈波动,见图5。绿原酸在体回收率为(34.70±12.99)%,苯甲酰新乌头原碱在体回收率为(20.76±6.18)%,杠柳毒苷在体回收率为(15.60±8.61)%,新乌头碱在体回收率为(25.49±7.98)%。
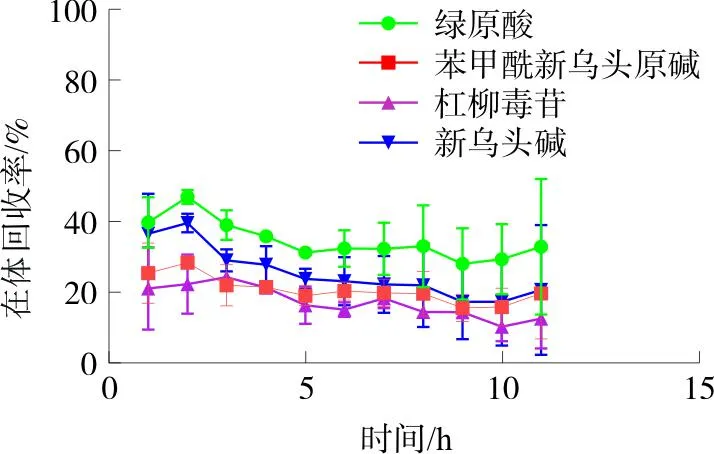
图5 探针在体回收率Fig.5 In vivo recovery rate of the probe
2.3 弩药微乳经皮给药后皮肤药动学研究
2.3.1 色谱条件 除进样量为10 μL以外,其余色谱条件同体外回收率含量测定相同。
2.3.2 线性关系 分别精密吸取混合对照品储备液0.05、0.1、0.3、0.5、1.0、2、5 mL,用灌流液稀释定容至10 mL,得不同质量浓度的混合对照品。分别进样10 μL,以峰面积(Y)为纵坐标,质量浓度(X)为横坐标,绘制标准曲线,得到回归方程和r,见表2。

表2 4种成分线性回归方程及线性范围Table 2 4 Linear regression equations and linear range
2.3.3 在体微透析实验 按“2.2.5”项下处理方法操作后,弩药微乳皮肤涂抹给药2 mL,给药面积为4 cm×2 cm,给药后开始收集样品,流速为0.5 μL·min-1,分别于1、2、3、4、5、6、7、8、9、10、11 h收集透析液。采用UPLC测定各成分含量。然后按“2.2.5”项下测得的探针体内回收率(D,%)进行校正,求得皮肤组织中实际成分的质量浓度,C实际药物的质量浓度=C透析液药物的质量浓度/D×100%。采用Graph Pad 8.0软件,以各时间点下的药物的质量浓度对时间作图,得到各成分的药-时曲线图,见图6。采用DAS 2.0软件对数据进行处理,获得tmax、Cmax、AUC0-11 h、AUC0-∞、MRT0-11 h、MRT0-∞等药动学参数,见表3。
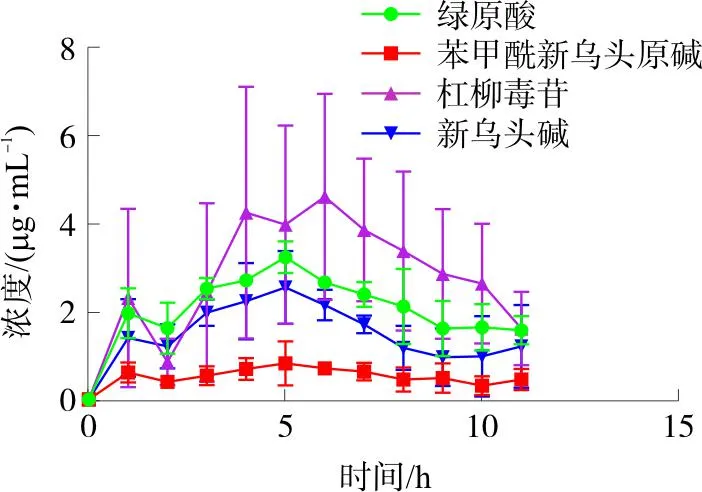
图6 弩药微乳经皮给药后皮下组织中4种成分药-时曲线图Fig.6 Drug-time curve of 4 components in subcutaneous tissue after transdermal administration of crossbow

表3 各成分药动学具体参数Table 3 Specific pharmacokinetic parameters of each component
弩药微乳经皮肤给药后,各成分皮下质量浓度在3~6 h内达到峰值,平均滞留时间MRT0-∞在7~23 h内,各药物质量浓度达到峰值后,缓慢下降并维持在一个相对稳定的水平,且一次给药后,11 h内仍然能在皮下组织中检测到各成分,表明弩药微乳中多成分能在皮肤内有一定的浓度蓄积,可在较长时间内持续释放药物。
3 讨论
微透析是一种在体、实时、动态取样技术,能够直接实时地反映靶组织中外源性或内源性物质随时间变化的趋势[13]。传统药代学、药动-药效学研究方法局限性较多,采用微透析进行取样,所得样品纯净,无需对样品进行前处理等繁琐操作,同时所得透析液中药物浓度为游离药物浓度,更能真实、准确地反映药物在机体内的吸收、分布、代谢、排泄规律及药-时等规律[14]。
弩药中最主要的化学成分为生物碱类、酚酸类成分。现代药理学研究表明,生草乌中的生物碱类成分具有较好的生理活性[15];杠柳毒苷为黑骨藤所特有的成分,具有抗炎、镇痛等作用[16];黑骨藤、大血藤等藤类植物富含酚酸类成分,具有抗炎、抗病毒等作用[17]。同时,乌头类生物碱及杠柳毒苷既为有效成分又是毒性成分,如何合理把握剂量尤为关键。因此,本研究选用生物碱类、强心苷类及酚酸类成分为指标性成分,探究其经皮渗透性能,为后续制剂的开发应用提供基础。
目前皮肤微透析探针常用的有瑞典CMA公司生产的CMA 30探针[18],价格昂贵且多为一次性消耗品。考虑到所测成分分子量较大,试验成本等问题,最终选用自制探针[19]进行试验,其分子截留量为12 kDa,有效透析膜长度为15 mm。经本研究表明,该探针可用于弩药微乳多成分皮肤药动学研究。自制探针在体回收率低于体外回收率,可能是因为探针处于环境错综复杂的体内,周围组织液量少,皮肤中的一些蛋白质、多糖等物质,黏附在探针表面,阻碍了药物在探针内外的交换。鉴于在体取样时间较长,动物中途苏醒后发生挣扎易损坏探针,影响实验进程,且在9 h后各成分下降程度趋于稳定,综合考虑各因素,最终选择采样时间为11 h。
除绿原酸外,其余成分均为脂溶性成分,故优先选用对脂溶性成分具有较好回收率的无水乙醇-PEG400-生理盐水(5∶2∶3)作为灌流液[20],但与预期结果相反,各成分在该灌流液中回收率均较低。后选用50%无水乙醇为灌流液,5种成分回收率得到一定提高,但仍然低于30%。结合乌头类成分的性质,选用pH值为5.44的PBS缓冲液为灌流液时,4种成分回收率均大于30%,且在该灌流液中相对稳定。因此,本实验最终选择PBS缓冲液为4种成分的灌流液。
本研究建立的UPLC含量测定方法,在14 min内即可对透析液中4种成分进行分离,可满足在体微透析检测方法的需求。通过微透析在体实时采样技术,有效避免内源性物质的干扰及动物种属差异等问题,所得结果更接近真实情况。
