黄芪-莪术-重楼配伍调控巨噬细胞极化对结直肠癌细胞增殖、迁移影响
2024-03-14杜利莉王钢梁研赵凡应佳辉尹刚唐德才卞勇
杜利莉,王钢,梁研,赵凡,应佳辉,尹刚,唐德才,卞勇
(1.南京中医药大学实验动物中心,江苏 南京 210023;2.南京中医药大学中医学院,江苏 南京 210023;3.南京中医药大学药学院,江苏 南京 210023)
结直肠癌是常见的消化系统恶性肿瘤,发病率和死亡率逐年上升[1]。肿瘤中主要浸润的巨噬细胞即肿瘤相关巨噬细胞(Tumor-associated macrophages,TAMs),在不同刺激条件下可极化为不同表型,即经典激活的M1表型和交替激活的M2表型。其中,M2型巨噬细胞具有免疫抑制,参与肿瘤细胞增殖,参与淋巴管、血管生成和转移以及更具治疗耐药性等特性[2]。研究显示,结直肠癌中TAMs倾向于转化为具有促癌作用的M2表型,通过分泌生长因子促进结直肠癌增殖、侵袭、迁移和血管生成,并通过分泌趋化因子募集调节性T细胞,抑制T细胞和NK细胞的抗肿瘤免疫作用,中断免疫细胞相互作用,产生结直肠癌免疫抑制微环境[3]。介导肿瘤微环境的免疫抑制和免疫逃逸的M2型巨噬细胞的靶向治疗已成为改善结直肠癌治疗效果和患者预后的潜在方法[4-5]。
黄芪补气固表,莪术活血祛瘀,重楼清热解毒,互相配伍相使,在结直肠癌临床治疗中具有较好的抗肿瘤转移、降低复发率效果[6]。研究表明,黄芪、莪术、重楼三者复合相使能明显降低结肠癌裸鼠模型原位瘤的体积和肝转移灶数[7]。黄芪-莪术-重楼配伍又能通过降低血管内皮通透性、抑制肿瘤侵袭性伪足的形成及成熟,从而抑制结直肠癌转移[8-9]。另有研究显示,黄芪、莪术、重楼均具有抗肿瘤和免疫调节作用[10-12]。黄芪-莪术配伍能抑制M2型巨噬细胞极化及其向肿瘤微环境的浸润,从而抑制结直肠癌细胞生长和转移[13]。因此,本研究拟基于巨噬细胞极化探究黄芪-莪术-重楼配伍抗结直肠癌生长转移的作用及机制,为黄芪-莪术-重楼配伍的临床应用提供理论依据。
1 材料
1.1 实验细胞
人单核细胞THP-1、结直肠癌细胞HCT116均购于中国科学院细胞库。
1.2 主要药物与试剂
黄芪为蒙古黄芪Astragalusmembranaceus(Fisch.) Bge. var. mongholicus (Bge.) Hsiao的干燥根;莪术为温郁金CurcumawenyujinY. H. Chen et C. Ling的干燥根茎;重楼为云南重楼ParispolyphyllaSmith var. yunanensis (Franch.) Hand.-Mazz.的干燥根茎。上述药材饮片均购自江苏省中医院中药房,并由南京中医药大学陆兔林教授鉴定。
胎牛血清(上海诺娃,AB-FBS-0500S,);佛波酯(Phorbol 12-myristate 13-acetate,PMA)(美国Sigma,P1585);人IL-4(美国PeproTech,96-200-04-5);CCK-8试剂盒(上海碧云天,C0039);IL-10 ELISA试剂盒(上海酶联,m1064299);TNF-α ELISA试剂盒(上海酶联,m1077385);TGF-β ELISA试剂盒(上海酶联,m1064258);RNA提取试剂盒(南京诺唯赞,R711);反转录酶试剂盒(南京诺唯赞,R223-01);SYBR qPCR试剂盒(南京诺唯赞,Q711-02);RIPA裂解液(苏州新赛美,WB3100);PMSF(上海碧云天,ST506);蛋白磷酸酶抑制剂(北京索莱宝,P1260);Anti-IL-10抗体(英国Abcam,ab133575);Anti-CD206抗体(英国Abcam,ab64693);Anti-ARG1抗体(英国Abcam,ab96183);Anti-TNF-α抗体(英国Abcam,ab307164);Anti-iNOS抗体(英国Abcam,ab178945);Anti-GLS抗体(英国Abcam,ab156876);Anti-GAPDH抗体(武汉三鹰,10494-1-AP);HRP Goat Anti-Rabbit IgG(H+L)(武汉三鹰,SA00001-2)。
1.3 主要仪器
超净工作台(苏州净化,SW-CJ-1FD),CO2培养箱(美国Thermo,BB150),Countstar细胞计数仪(上海睿钰,IC1000),酶标仪(瑞士Tecan,Infinite M1000 Pro),倒置显微镜(德国Leica,ebq100-04),荧光定量PCR仪(杭州朗基,Q2000A),垂直电泳仪(武汉赛维尔,SVE-2),化学发光仪(北京君意,JY-ClearECL)。
2 方法
2.1 黄芪-莪术-重楼配伍冻干粉制备
参照前期研究[8-9],按药物用量比例4∶2∶3取黄芪、莪术、重楼饮片,浸泡0.5 h后,煎煮、过滤收集滤液。旋转蒸发浓缩为生药量浓度为1 g·mL-1的药液,-80 ℃冷冻过夜,次日于冻干机进行冻干,得到黄芪-莪术-重楼配伍冻干粉,得率11.76%,-20 ℃保存备用。使用时称量所需量的冻干粉溶于细胞培养基中,并用孔径为0.22 μm的滤膜过滤除菌。
2.2 细胞培养
THP-1细胞、HCT116细胞分别培养于含10%胎牛血清、1%青霉素/链霉素双抗溶液的RPMI-1640培养基及DMEM培养基中,并置于37 ℃,5%CO2的细胞培养箱培养。
2.3 M0、M2型巨噬细胞诱导极化
取对数生长期的THP-1细胞接种于6孔板中,接种密度为每孔5×105个。加入100 ng·mL-1PMA刺激24 h,细胞贴壁诱导分化为M0型巨噬细胞;PMA诱导24 h后更换培养基并加入20 ng·mL-1IL-4刺激48 h诱导其向M2型巨噬细胞极化。
2.4 CCK-8检测细胞活力
2.4.1 黄芪-莪术-重楼配伍浓度筛选 取对数生长期的THP-1细胞,用含100 ng·mL-1PMA的培养基重悬后,取每孔100 μL接种于96孔板中,接种密度为每孔1×104个,于37 ℃,5%CO2的细胞培养箱中培养。24 h后更换培养液分别为含0、0.5、1、2、4、8、10 mg·mL-1黄芪-莪术-重楼配伍冻干粉的培养基,培养箱中继续培养。48 h后每孔加入10 μL CCK-8试剂,孵育2 h后,酶标仪于450 nm波长处检测吸光度(OD值)。
2.4.2 细胞分组给药 确定黄芪-莪术-重楼配伍浓度后,THP-1细胞经PMA处理后,分为M0组(PMA处理)、M2组(PMA+IL-4处理)、M2+黄芪-莪术-重楼组(PMA+IL-4+黄芪-莪术-重楼配伍处理)。各组给药处理48 h后更换培养基为无血清培养基,继续培养24 h,取上清,离心,制成条件培养基(CM)。取HCT116细胞以每孔6×103个接种于96孔板,24 h后更换培养基为CM,细胞分为M0-CM组、M2-CM组、M2+黄芪-莪术-重楼-CM组。培养24 h后加入CCK-8 溶液孵育后检测OD值, 探讨培养细胞上清对HCT116细胞增殖的影响。
按公式:细胞存活率=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%,计算细胞存活率。
2.5 qPCR检测IL-10、CD206、ARG1、TNF-α、iNOS、IL-1β、GLS mRNA表达水平
按2.4.2项下THP-1细胞分组进行给药,培养48 h后收集细胞。使用Freezol Reagent和反转录酶试剂盒提取RNA并合成cDNA。按ChamQ Universal SYBR qPCR Master Mix说明书进行IL-10、IL-1β、TNF-α、iNOS、GLS mRNA水平检测。反应条件:95 ℃,30 s;95 ℃,10 s,60 ℃,30 s并收集荧光,共40个循环;60→95 ℃,每隔0.5 ℃读荧光值生成熔解曲线。以GAPDH作为内参,使用2-ΔΔCt计算相对表达水平。引物由北京擎科生物科技股份有限公司和上海生工生物工程股份有限公司合成,引物序列信息见表1。

表1 引物序列Table 1 Primer sequences
2.6 Western blot检测IL-10、CD206、ARG1、TNF-α、iNOS、GLS蛋白表达水平
按2.4.2项下THP-1细胞分组进行给药,培养48 h后收集细胞,使用RIPA裂解液、PMSF及蛋白磷酸酶抑制剂配制的蛋白裂解液进行总蛋白的提取。SDS-PAGE法进行蛋白电泳、转膜、封闭,一抗4 ℃孵育过夜,二抗室温孵育。ECL试剂显影拍照。采用Image J软件进行蛋白条带灰度值分析。
2.7 ELISA法检测细胞上清IL-10、TGF-β、TNF-α水平
按2.4.2项下THP-1细胞分组进行给药,培养48 h后收集细胞培养上清,离心去除沉淀物后按ELISA试剂盒说明书检测细胞培养上清中IL-10、TGF-β、TNF-α水平。
2.8 Transwell实验检测结直肠癌细胞迁移
按2.4.2项下HCT116细胞分组并用CM重悬HCT116细胞,吸取200 μL细胞悬液于Transwell小室上方,细胞密度为每孔5×104个。小室下方加入含10%胎牛血清的培养基600 μL。培养24 h后,擦去上室未迁移细胞,经多聚甲醛固定、结晶紫染色后,显微镜对迁移细胞进行观察和计数。
2.9 统计学方法

3 结果
3.1 黄芪-莪术-重楼配伍对巨噬细胞活力的影响
CCK-8结果显示,0.5、1、2 mg·mL-1黄芪-莪术-重楼配伍对巨噬细胞活力无明显抑制作用。当黄芪-莪术-重楼配伍浓度达到4、8、10 mg·mL-1时,细胞活力显著下降且具有剂量依赖性,差异均有统计学意义(P<0.01,P<0.001)(图1)。因此,选取2 mg·mL-1进行后续实验。

注:与空白对照组相比,
3.2 黄芪-莪术-重楼配伍对巨噬细胞极化表型标志物mRNA表达水平的影响
与M0组相比,经IL-4诱导的M2组IL-10、CD206、ARG1 mRNA表达均显著升高(P<0.01,P<0.001,图2),而经黄芪-莪术-重楼配伍处理的M2+黄芪-莪术-重楼组IL-10、CD206、ARG1 mRNA表达均显著降低(P<0.05,P<0.01),IL-1β、TNF-α、iNOS mRNA表达显著升高(P<0.05,P<0.01)。
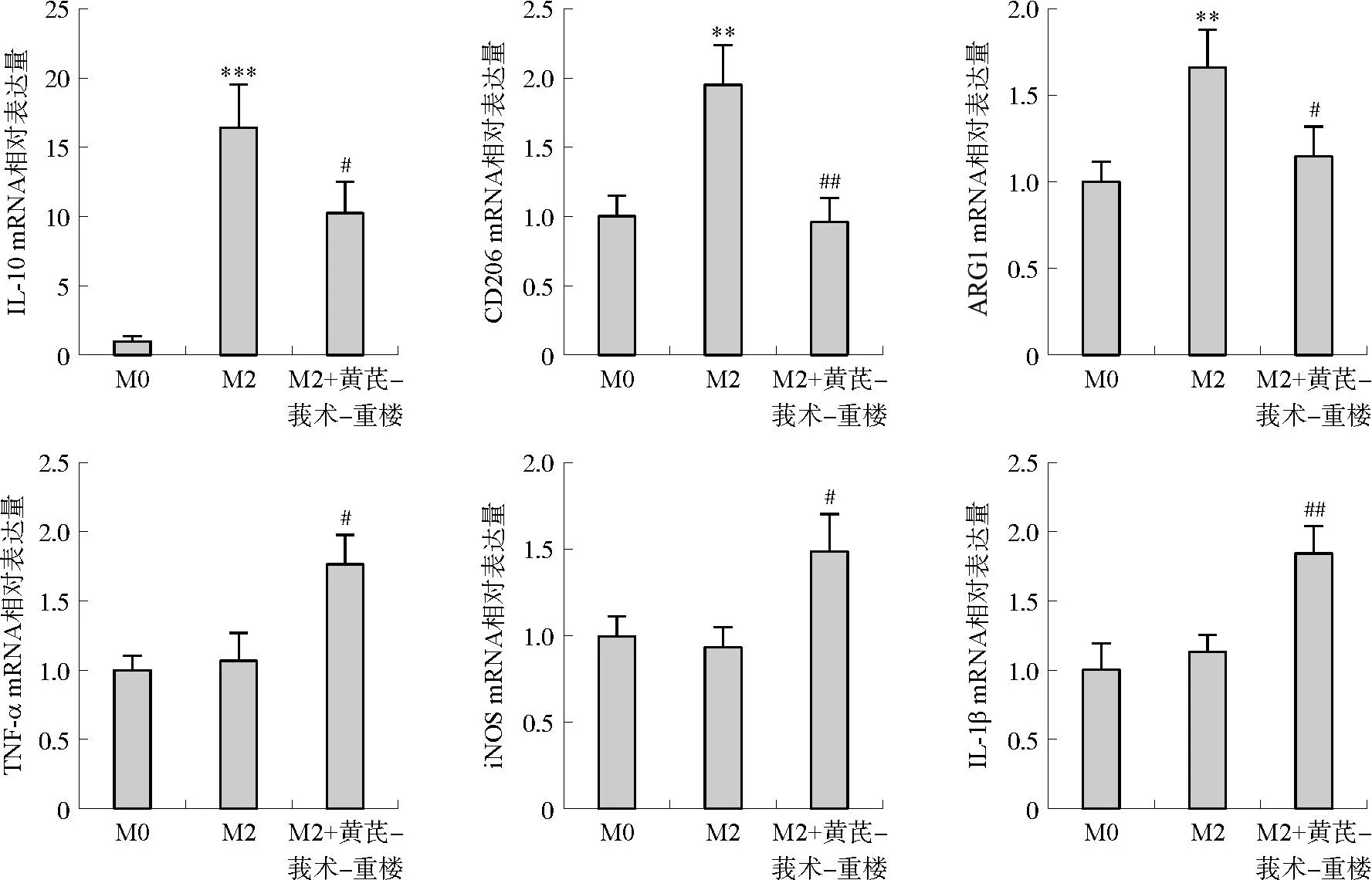
注:与M0组相比,**P<0.01,***P<0.001;与M2组相比,
3.3 黄芪-莪术-重楼配伍对巨噬细胞极化表型标志物蛋白表达水平的影响
Western blot结果显示,与M0组相比,M2组IL-10、CD206、ARG1蛋白表达显著升高(P<0.01,P<0.001,图3);与M2组相比,M2+黄芪-莪术-重楼组IL-10、CD206、ARG1蛋白表达均显著降低(P<0.05,P<0.01),TNF-α、iNOS蛋白表达显著升高(P<0.01,P<0.001)。

注:与M0组相比,**P<0.01,***P<0.001;与M2组相比,
3.4 黄芪-莪术-重楼配伍对细胞上清中细胞因子水平的影响
ELISA结果显示,与M0组相比,M2组细胞上清中IL-10、TGF-β水平显著升高(P<0.01,P<0.001,图4);与M2组相比,M2+黄芪-莪术-重楼组细胞上清中IL-10、TGF-β水平显著降低(P<0.05,P<0.01),TNF-α水平显著升高(P<0.01)。
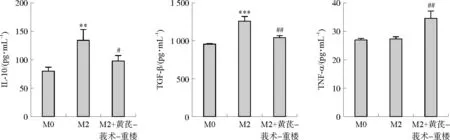
注:与M0组相比,**P<0.01,***P<0.001;与M2组相比,
3.5 黄芪-莪术-重楼配伍抑制M2型巨噬细胞极化对结直肠癌细胞增殖、迁移的影响
CCK-8结果显示,与M0-CM组相比,M2-CM组干预显著促进HCT116细胞增殖(P<0.001,图5A),M2+黄芪-莪术-重楼-CM组较M2-CM组显著抑制HCT116细胞增殖(P<0.001)。同时,Transwell迁移实验结果显示,与M0-CM组相比,M2-CM组HCT116细胞迁移数显著增多(P<0.01,图5B),而与M2-CM组相比,M2+黄芪-莪术-重楼-CM组HCT116细胞迁移数显著减少(P<0.01)。

注:A.CCK-8检测HCT116细胞增殖能力,n=4;B.Transwell检测HCT116迁移能力(×100),n=3;与M0-CM组相比,**P<0.01,***P<0.001;与M2-CM组相比,
3.6 黄芪-莪术-重楼配伍对巨噬细胞GLS mRNA和蛋白表达的影响
qPCR结果显示,与M0组相比,M2组GLS mRNA水平显著升高(P<0.01,图6A);与M2组相比,M2+黄芪-莪术-重楼组GLS mRNA表达显著下降(P<0.05)。Western blot结果显示,与M0组相比,M2组GLS蛋白水平显著升高(P<0.001,图6B);与M2组相比,M2+黄芪-莪术-重楼组GLS蛋白表达显著下降(P<0.01)。

注:A.qPCR检测GLS mRNA表达水平;B.Western blot检测GLS蛋白表达水平;与M0组相比,**P<0.01,***P<0.001;与M2组相比,
4 讨论
肿瘤发生发展常以“虚、瘀、毒”为核心病机。正气亏虚、瘀血凝滞、癌毒走窜,机体免疫异常,结直肠癌细胞可逃避免疫系统监视进行异常增殖。研究显示,含黄芪、莪术或重楼的中药配伍或复方基于此病机进行抗肿瘤治疗并取得一定疗效[14-15]。在结肠癌原位移植瘤模型小鼠中,黄芪-莪术配伍可下调上皮间质转化标志物N-cadherin、MMP-7等表达,降低结肠癌免疫相关指标,调节Th17/Treg动态平衡维持肿瘤微环境稳态,抑制肿瘤生长[16]。前期研究已证实,黄芪-莪术-重楼配伍能够抑制结直肠癌生长和转移[8-9]。基于前期研究,本文探究黄芪-莪术-重楼配伍调控免疫抗结直肠癌生长转移的新机制。
巨噬细胞是减轻病原免疫反应和维持肠道内环境稳定的关键细胞[17]。巨噬细胞极化与结直肠癌预后相关,且M2型巨噬细胞与较差的结直肠癌特异性生存率相关[18]。Liu等[19]通过体内外实验证实,黄芪活性成分黄芪甲苷显著减少M2型巨噬细胞和增加M1型巨噬细胞以抑制结直肠癌CT26细胞增殖并诱导细胞凋亡,减少TGF-β、IL-10等抗炎因子产生,增加肿瘤中TNF-α等促炎因子产生,抑制结直肠癌肿瘤生长;Yu等[20]发现肺癌中重楼皂苷Ⅶ使巨噬细胞转化为M1型巨噬细胞,招募CD8+T细胞肿瘤内浸润,发挥抗肿瘤免疫逃逸作用;重楼皂苷Ⅱ诱导微环境中M2型巨噬细胞为M1型,在胃癌荷瘤裸鼠体内表现出良好的抑瘤率[21]。最新研究显示,黄芪、莪术配伍抑制M2极化进而抑制结直肠癌生长转移[13]。通过建立巨噬细胞极化模型发现,黄芪-莪术-重楼配伍下调M2型巨噬细胞标志物IL-10、ARG1、CD206 mRNA和蛋白表达(P<0.05,P<0.01),并上调M1型巨噬细胞标志物IL-1β mRNA表达及TNF-α、iNOS mRNA和蛋白表达(P<0.05,P<0.01,P<0.001),同时促进巨噬细胞分泌TNF-α并抑制IL-10、TGF-β分泌(P<0.05,P<0.01),表明黄芪-莪术-重楼配伍对巨噬细胞极化具有调控作用。结合共培养实验发现,黄芪-莪术-重楼配伍干预巨噬细胞后的细胞培养上清显著抑制HCT116细胞增殖和迁移(P<0.01,P<0.001),提示黄芪-莪术-重楼可能通过调控巨噬细胞极化抑制结直肠癌生长转移。
谷氨酰胺代谢与结直肠癌更强的生存能力、耐药性和不良预后密切相关,抑制谷氨酰胺代谢可增强抗肿瘤免疫反应,降低结直肠癌小鼠肿瘤生长,提高存活率[22-23]。另有研究显示,谷氨酰胺参与调节巨噬细胞激活和免疫功能,并诱导巨噬细胞极化[24-25]。GLS是调控谷氨酰胺代谢的关键酶,可催化谷氨酰胺转化为谷氨酸,谷氨酸随后可转化为α-酮戊二酸(α-Ketoglutarate,α-KG),作为回补底物参与三羧酸循环,为肿瘤细胞提供增殖、迁移所需能量[26]。Feng等[27]发现,GLS特异性抑制剂可显著抑制M2型巨噬细胞标记基因表达,而其介导的谷氨酰胺分解可促进M2巨噬细胞浸润和活化。此外,抑制GLS表达,中断谷氨酰胺代谢,可上调TNF-α、抑制IL-10等表达,将M2型巨噬细胞极化为M1型,抑制肿瘤生长[28]。前期研究发现,黄芪-莪术-重楼配伍的活性成分之一莪术醇,通过抑制谷氨酰胺酶GLS1表达,中断谷氨酰胺分解,增加细胞内谷氨酰胺含量并降低谷氨酸、α-KG等水平,抑制结直肠癌侵袭和迁移[29]。本研究探究黄芪-莪术-重楼配伍调控巨噬细胞极化时发现,巨噬细胞中GLS mRNA和蛋白表达显著下调(P<0.05,P<0.01)。因此,猜测黄芪-莪术-重楼配伍可能通过抑制GLS表达,中断谷氨酰胺代谢,诱导M2型巨噬细胞极化为M1型巨噬细胞,从而抑制结直肠癌生长、转移。
综上,黄芪-莪术-重楼配伍能够调控巨噬细胞极化抑制结直肠癌细胞增殖、迁移,其机制可能与谷氨酰胺代谢有关。为更全面揭示黄芪-莪术-重楼配伍、谷氨酰胺代谢、巨噬细胞极化、结直肠癌之间的关系,仍需开展更多的体内外实验进行深入研究,以期为黄芪-莪术-重楼配伍临床应用提供理论和实验依据。
