陕西省药物临床试验机构现状分析
2024-03-14张娟利刘美佑樊婷婷张迪周军红王婧雯文爱东空军军医大学第一附属医院药剂科西安7003陕西省药品技术审核查验中心西安70065
张娟利,刘美佑,樊婷婷,张迪,周军红,王婧雯,文爱东*(.空军军医大学第一附属医院药剂科,西安 7003;.陕西省药品技术审核查验中心,西安 70065)
药物临床试验作为医药产业发展的重要环节,不仅是药物上市的必经之路,更是把好药品质量安全的第一关[1]。为了更好地满足药物研发对药物临床试验的需求,2019年11月国家卫生健康委和国家药品监督管理局(NMPA)联合发布《药物临床试验机构管理规定》,明确规定药物临床试验机构由资质认定改为备案管理,自2019年12月1日正式实施[2]。这并非放松了对临床试验的监管力度,而是将管理理念从以往的“严进宽出”逐渐转变为“宽进严出”模式,监管重点从事前监管转变为事中、事后监管。备案制的实施虽然极大地简化了药物临床试验审评、审批流程,缓解了以往药物临床试验机构数量严重不足的突出矛盾,但同时也带来可能影响药物临床试验质量的潜在风险[3-5]。因此,如何有效防范这些风险将成为新的议题。
陕西省作为西北地区药物临床试验资源大省,积极响应国家“备案制”号召,出台了多项鼓励政策,致力于推动我省药物临床试验的发展。本文通过查询NMPA网站,以及药物临床试验登记与信息公示平台,收集药物临床试验相关数据,对陕西省药物临床试验机构的发展历程、资格认定、专业认定及参与开展药物临床试验项目情况进行回顾性分析。结合最新出台的药品相关法律法规和工作实施的实际情况,本研究将对我省现阶段药物临床试验机构存在的问题及在备案制实施后将要面临的问题进行思考并提出相应对策,以期推动我省药物临床试验实现更快更好的发展。
1 材料
国家药品监督管理局网站(https://www.nmpa.gov.cn/);药物临床试验机构备案管理信息平台(https://beian.cfdi.org.cn/CTMDS/apps/pub/drugPublic.jsp);药物临床试验登记与信息公示平台(http://www.chinadrugtrials.org.cn/index.html)。
2 方法
登录NMPA和药物临床试验机构备案管理信息平台,分别收集备案制实施前后陕西省通过药物临床试验资格认定的医疗机构信息,对陕西省药物临床试验机构的资格认定时间、地区分布情况、认定专业及主要研究者(Principal Investigator,PI)等信息进行统计;通过登录药物临床试验登记与信息公示平台收集陕西省各医疗机构药物临床试验项目注册相关信息,对项目的药物类型、试验分期及专业属性进行统计,其中2013年1月1日至2019年11月30日为备案制实施前周期,2019年12月1日至2023年7月10日为备案制实施后周期。比较陕西省在备案制实施前后机构备案和承接项目的变化,分析现阶段该省药物临床试验的改革成果及存在的问题。
3 结果
3.1 陕西省药物临床试验机构的发展
自2004年《药物临床试验机构资质认定办法(试行)》颁布以来,2005年陕西省首批通过药物临床试验机构资格认定的医疗机构为空军军医大学第一附属医院、第二附属医院,2006年以来,陕西省肿瘤医院、陕西省中医医院、西安市精神卫生中心、西安交通大学第一附属医院和第二附属医院等相继完成药物临床试验机构资格认定。由图1可以看出,2019年以前,陕西省资格认定的机构数量呈稳定上升的趋势,至2019年底陕西省药物临床试验机构资格认定医疗机构增至20家。自2019年备案制实施以来,陕西省药物临床试验机构数量迅速上升,至2023年7月已发展到42家,增幅为110.0%。

图1 2005年以来陕西省每年药物临床试验机构资格认定情况Fig 1 Annual qualification of drug clinical trial institutions in Shaanxi province since 2005
3.2 备案制后陕西省药物临床试验机构分布情况
截至2023年7月10日,陕西省共备案药物临床试验机构42家,除备案制实施前通过资格认定的20家机构外,新增备案22家。除省疾病预防控制中心和西安宝石花长庆医院外,其余40家均为三级甲等医疗机构,包括三级甲等专科医院10家(如西北妇女儿童医院、西安市精神卫生中心、陕西省肿瘤医院、西安市胸科医院等);三级甲等综合医院30家,其中包括中医医院5家(新增1家)。从地域分布来看,备案机构主要集中在省会城市西安(30家),少部分分布于教育、经济、医疗等较完善的城市如咸阳、汉中、宝鸡、延安、安康,无机构分布的4个地级市分别为铜川、渭南、榆林和商洛,机构具体分布如图2所示。由此可见,药物临床试验的发展与经济、教育、医疗资源的分布等密切相关。
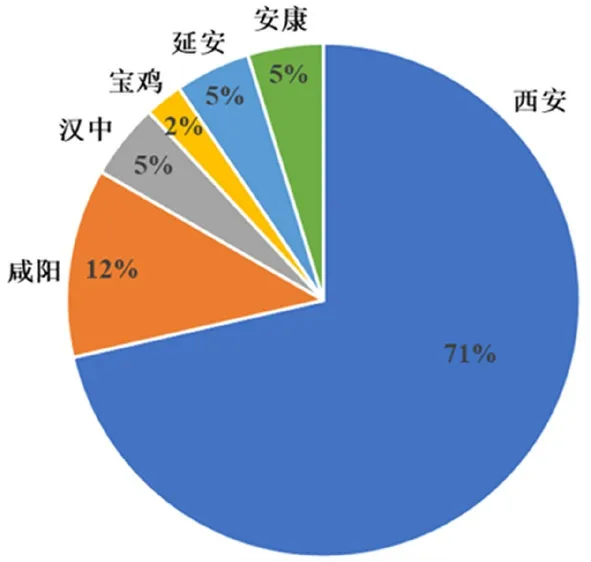
图2 陕西省药物临床试验机构的分布Fig 2 Distribution of the number of registered institutions in Shaanxi province
3.3 陕西省药物临床试验机构备案专业情况
截至2023年7月10日,陕西省药物临床试验机构备案专业种类共158个,较备案制实施前(82个)新增76个,增幅92.68%。我省备案专业种类较为齐全,其中含西医专业123个,占全部备案的77.85%,包括外科专业20个,内科专业19个,口腔专业11个,医学影像学和儿科专业各10个,疾病预防控制中心8个,传染科和耳鼻咽喉科专业各7个,妇产科专业5个,皮肤科和精神科专业各4个、肿瘤科专业3个等;中医相关专业35个,占全部备案专业的22.15%。备案专业种类数较多的有西安交通大学第一附属医院(46个)、空军军医大学第一附属医院(38个)、空军军医大学第二附属医院(27个)、西安交通大学第二附属医院(24个)、陕西中医药大学第二附属医院(23个)等(见图3)。如表1所示,备案数量较多的专业为神经内科、内分泌科、呼吸内科、心血管内科、肿瘤科、消化内科、血液内科、妇科、肾病学和骨科等,与这些疾病发病率较高,相关药物市场需求较大有关[6-8]。

表1 陕西省药物临床试验机构备案专业(n=158)Tab 1 Record-keeping specialties of drug clinical trial institutions in Shaanxi province (n=158)
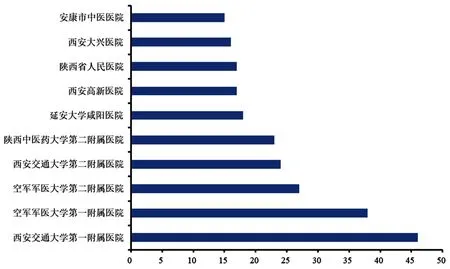
图3 陕西省备案专业种类数量前 10的药物临床试验机构Fig 3 Number of professional types of top 10 drug clinical trial institutions in Shaanxi province
3.4 陕西省药物临床试验机构备案主要研究者情况
根据2019年12月1日实施的《药物临床试验机构管理规定》要求,PI应当具有高级职称并参加过3个以上药物临床试验。陕西省药物临床试验机构备案的PI共947人。其中,高级职称597人,副高级职称350人,分别占PI总人数的63.04%和36.96%。陕西省药物临床试验机构备案PI分布严重不均,集中分布于医疗水平较高的医院,其中西安交通大学第一附属医院备案PI人数高达132人,占备案PI总人数的13.94%;空军军医大学第一附属医院和第二附属医院分别备案PI人数为104人和74人,分别占备案总人数的10.98%和7.81%。由图4可知,备案PI数量排名靠前的机构为资格认定的机构且大部分也是陕西省开展临床试验较早的医疗机构[9]。

图4 陕西省备案PI数量前10的药物临床试验机构Fig 4 Number of principal investigators of top 10 drug clinical trial institutions in Shaanxi province
3.5 承接临床试验项目情况
截至2023年7月10日,陕西省临床试验机构共承接临床试验项目2173项,登记日期为备案制实施后的项目为1263项。从试验状态来看,已完成641项,进行中1427项,主动暂停或终止105项。从药品分类来看,化学药物1226项,中药/天然药物130项,生物制品817项。从试验分期来看,Ⅰ期124项,Ⅰ/Ⅱ期81项,Ⅱ期541项,Ⅱ/Ⅲ期53项,Ⅲ期1183项,Ⅳ期113项,生物等效性44项,其他类34项。其中,承接临床试验项目较多的科室为呼吸科、血液内科、肿瘤科、消化内科、消化外科、心血管内科、神经内科、皮肤科、内分泌科等,承接项目较多的临床试验机构为西安交通大学第一附属医院(796项)、空军军医大学第二附属医院(449项)、空军军医大学第一附属医院(432项)、西安交通大学第二附属医院(212项)、延安大学咸阳医院(159项)、陕西省人民医院(142项)等。这与这几家药物临床试验资格认定时间较长有关,也与我省卫生资源配置现状有关。
3.6 监督检查情况
根据国家药监局综合司发布的《药物临床试验机构监督检查办法(试行)(征求意见稿)》,省级药品监督管理部门负责省内试验机构的监督检查,包括备案后的首次监督检查、日常监督检查、有因检查,并负责对试验机构问题的整改情况进行跟踪检查[10-11]。备案制实施至2023年7月10日,陕西省34家药物临床试验机构累计共接收66次监督检查,包括注册核查12次(均未发现真实性问题)、新机构首次检查18次、新增专业首次检查20次,日常监督检查16次。其中,新机构首次检查结果为“通过”的机构数量有1家,即咸阳市第一人民医院;结果为“部分专业进行整改,经省局现场检查合格后再承接临床试验项目”的有2家;结果为“基本符合规定,现场发现问题已提交整改报告”的机构数量有14家;结果为“整改后通过”的有1家。新增专业首次检查结果为“基本符合备案要求,或已提交整改报告”的机构有16家;结果为“基本符合备案要求,经省局现场检查合格后再承接临床试验项目”的有2家;结果为“部分专业整改后再查”的有2家。日常监督检查结果为“基本符合GCP要求,通过”的有12家,“整改后通过”的有4家。
4 讨论
备案制实施后,陕西省积极响应政策号召,出台了多项鼓励政策,促使越来越多的医疗机构及研究人员加入到临床试验的队伍中来。截至2023年7月10日,我省备案的药物临床试验机构数量已增至42家,增幅为110.0%;备案专业种类158个,增幅为92.68%;承接药物临床试验项目由910项增至2173项,增幅为138.79%;累计接受各类监督检查66次,直接通过率为60.61%。总之,备案制的实施有力推动了我省临床试验的发展,有效缓解了我省临床试验资源紧缺的局面,但同时也为我省临床试验监管带来了新的挑战和诸多风险因素。
省内药物临床试验机构地区分布不均衡:陕西省内药物临床试验机构大都集中在经济、医疗水平较为发达的城市,其中西安和咸阳机构数量占比83.0%,其他地级市多数在1~2家,部分地级市甚至尚无一家医疗机构具备药物临床试验资格。这种发展及分布极不均衡,在一定程度上反映了各地医疗资源优势未得到充分发挥。究其原因,与部分地级市经济不够发达、临床试验认知程度低以及政府支持力度弱有关。建议我省在资源分配的过程中给予欠发达地级市政策上的倾斜,加大对资金和技术等方面的支持,引导和帮扶具有二级甲等以上资质的机构也投入到药物临床试验机构的建设中来,使我省医疗资源配置更为合理。
临床试验研究人员能力水平参差不齐:由于我省新增备案的机构处于新生和成长阶段,大多数机构及专业组存在承接项目数量少、运行时间短等情况,随之造成研究人员经验不足、缺乏团队合作和风险把控能力等诸多问题。因此,临床试验机构及研究团队应从不同层面加大研究人员培训力度,除开展基本的GCP培训外,所有研究者还需定期对国家最新法律法规及相关政策等开展日常培训,让他们在质量保证、流程把控、试验条件支撑、项目设计实施和研究能力培训等方面充分发挥作用。其次,各临床试验机构应当注重人才引进,解决他们的职称、编制以及待遇问题,积极推动和落实相关激励措施,调动研究人员的工作积极性。
省内Ⅰ期临床研究平台相对匮乏:Ⅰ期临床试验机构有别于Ⅱ、Ⅲ、Ⅳ期临床试验,需要独立的区域、设施设备、人员等,这就需要投入大量的资金、人力、物力[12]。目前,陕西省能开展Ⅰ期药物临床试验的机构仅有7家,占备案总机构16.67%。Ⅰ期药物临床平台仍然较为匮乏,提示省内丰富的优势医疗资源未得到充分利用,需要政府和医疗机构给予充足的资金支持和政策倾斜,加快省内Ⅰ期临床试验平台的搭建。若医疗机构自筹资金建设Ⅰ期临床试验研究室存在较大困难,也可与医药企业、合同研发服务(CRO)公司等联合投资,由机构提供平台、管理等服务,这种新形式的合作模式可集中企业、医疗机构的优势,促进Ⅰ期临床研究平台的建设。
总之,机构备案制的实施,既为临床试验的发展带来了机遇,同时也提出了新的挑战。备案制的落地还需配套政策的保驾护航,需要来自多方的支持和配合。包括陕西省药品监督管理局作为全省药物临床试验机构的监管部门,除了日常监督检查工作,还应充分挖掘省内临床试验资源,加强全省的新机构建设,使优质临床试验资源最大化共享。其次,还应做好临床试验产业的培育与引导工作,增强过程质控、出台针对临床试验平台和人才的鼓励措施,切实提高全省临床试验的规范化水平。
