基于UHPLC-Q-Exactive Orbitrap-MS的三种基原溪黄草及其干预小鼠肝纤维化的血清化学研究
2024-03-14覃萍苏阳静陈永苗郑瑞瑶钟佳妮叶晓燕葛跃伟陈阿丽广东药科大学新药研发中心广东省药物新剂型重点实验室广州50006广东药科大学附属第一医院广州5006广东药科大学中药学院广州50006
覃萍,苏阳静,陈永苗,郑瑞瑶,钟佳妮,叶晓燕,葛跃伟,陈阿丽*(.广东药科大学新药研发中心,广东省药物新剂型重点实验室,广州 50006;.广东药科大学附属第一医院,广州 5006;.广东药科大学中药学院,广州 50006)
溪黄草是唇形科香茶菜属的一种多年生草本,其性寒,味苦,主产于黑龙江、江西、广东、广西、福建等地,长期以来一直作为民间中草药被广泛使用[1]。溪黄草是一种多基原中药,包括线纹香茶菜Rabdosialophanthoides(Buch.-Ham.exD.Don)Hara、纤花香茶菜Rabdosialophanthoides(Buch.-Ham.ex D.Don)Hara var.gerardiana(Benth)Hara以及溪黄草Rabdosiaserra(Maxim)Hara三种基原。研究表明,溪黄草具有清热利湿、凉血散瘀的作用,可用于急性胆囊炎、急性黄疸型肝炎等病症的治疗[2]。
肝纤维化是一种肝组织细胞外基质过度沉积(特别是胶原沉积)的病理生理过程[3]。若肝纤维化不能及时治愈,可能会进一步发展为肝硬化,甚至恶化为肝癌。肝纤维化是一个可逆的病理过程,减弱或消除纤维化形成的致病因素可逆转肝纤维化病理过程[4-5]。
研究表明,溪黄草可以抵抗多种因素引起的肝纤维化,但不同基原溪黄草的化学成分差异大,各企业采用的基原也无统一标准[6-7]。有学者采用经典的肝纤维化诱导剂四氯化碳对小鼠进行处理,在病理生理学上可使小鼠的肝脏组织与人的肝脏组织具有相似性[8]。本研究分析三种基原溪黄草的药物化学成分及其口服给药后肝纤维化小鼠血清中的化学成分,对后续溪黄草药效物质基础以及抗肝纤维化研究具有重要意义。
1 材料与方法
1.1 实验动物及试药
50只雄性SPF级8周龄C57BL/6J小鼠[河南斯克贝斯生物科技股份有限公司,许可证号:SCXK(豫)2020-0005];线纹香茶菜药材、纤花香茶菜药材和溪黄草药材(广州白云山和记黄埔中药有限公司溪黄草GAP基地,由广东药科大学田素英教授鉴定为真品)。甲醇、甲酸均为质谱纯(美国赛默飞公司);蒸馏水[屈臣氏集团(香港)有限公司];其余试剂均为分析纯。
1.2 三种基原溪黄草提取物的制备
取三种基原溪黄草药材适量,粉碎,过80目筛,加入8倍体积的95%乙醇,于80℃水浴中回流提取1.5 h,提取2次,过滤,合并滤液并减压浓缩,冷冻干燥后得三种基原溪黄草乙醇提取物冻干粉。
1.3 供试品溶液的制备
精密称取溪黄草冻干粉25 mg、纤花香茶菜冻干粉41 mg、线纹香茶菜冻干粉33 mg(相当于0.5 g药材量),量取10 mL甲醇置于锥形瓶中,称定质量,超声处理30 min后,补重,10 000 r·min-1、4℃离心10 min,取500 μL上清液于5 mL量瓶中,加入甲醇至刻度,摇匀,使用0.22 μm微孔滤膜过滤,配制成供试品溶液。
1.4 动物分组与给药
50只雄性8周龄C57BL/6J小鼠,随机分成空白对照组、模型组、线纹香茶菜给药组、纤花香茶菜给药组、溪黄草给药组。空白对照组腹腔注射橄榄油,其余4组腹腔注射四氯化碳溶液,给药剂量为1 μL·g-1,一周2次,共8周。准确称取溪黄草冻干粉257 mg、纤花香茶菜冻干粉421.48 mg、线纹香茶菜冻干粉339.24 mg(相当于5.14 g药材量),分别溶解于10 mL羧甲基纤维素钠溶液,配制成供试药液。空白对照组以及模型组小鼠每日灌胃羧甲基纤维素钠溶液,各给药组给予供试药液,给药剂量为5.14 g·kg-1,连续给药8周。末次给药12 h后摘眼球取血,并用1.5 mL EP管收集,4℃条件下4500 r·min-1离心12 min,取血清,保存于-80℃冰箱。
1.5 血清样品的制备
将血清样本从-80℃冰箱中取出解冻,涡旋混匀,取100 μL置于EP管中,加入400 μL提前预冷的甲醇,充分涡旋2 min,冰水浴超声30 min后,10 000 r·min-1、4℃条件下离心10 min。取上清液,氮吹浓缩,残留物加入80 μL的80%甲醇复溶,0.22 μm的微孔滤膜过滤,得到血清化学样品。
1.6 UHPLC-Q-Exactive Orbitrap-MS检测条件
采用Shim-pack GIST-HP C18色谱柱(2.1 mm×150 mm,3 µm),预柱为Shim-pack GIST-HP C18,流动相为0.1% 甲酸水(A)-甲醇(B);流速为0.3 mL·min-1;柱温30℃;进样量2 μL,梯度洗脱(0~3 min,10%B;3~8 min,10%→35%B;8~30 min,35%→55%B;30~35 min,55%→65%B;35~56 min,65%~95%B;56~58 min,95%;58~63 min,95%→10%;63~65 min,10%B)。采用电喷雾离子源(ESI),正、负离子模式下进行Fullscan及MS/MS扫描,MS/MS采用数据依赖型(DDA)数据采集,扫描范围m/z100~1500;毛细管电压:3.5 kV;鞘气流速:45 arb;辅助气体流速:10 arb;毛细管温度:350℃。
1.7 不同基原溪黄草药材及血清样品化学成分鉴定
应用UHPLC-Q-Exactive Orbitrap-MS技术对三种不同基原溪黄草药材样品以及给药小鼠血清样品进行分析,包括保留时间、高分辨准分子离子峰、MS/MS碎片离子等,结合对照品比对及文献报道,进行化合物推定。
2 结果
2.1 UHPLC-Q-Exactive Orbitrap-MS 色谱图的采集
以负离子模式为例,采集的三种基原溪黄草药材样本及其给药小鼠血清样本的色谱图结果见图1,鉴定药物化学成分结果见表1。

表1 鉴定药物化学成分结果Tab 1 Identification of chemical components
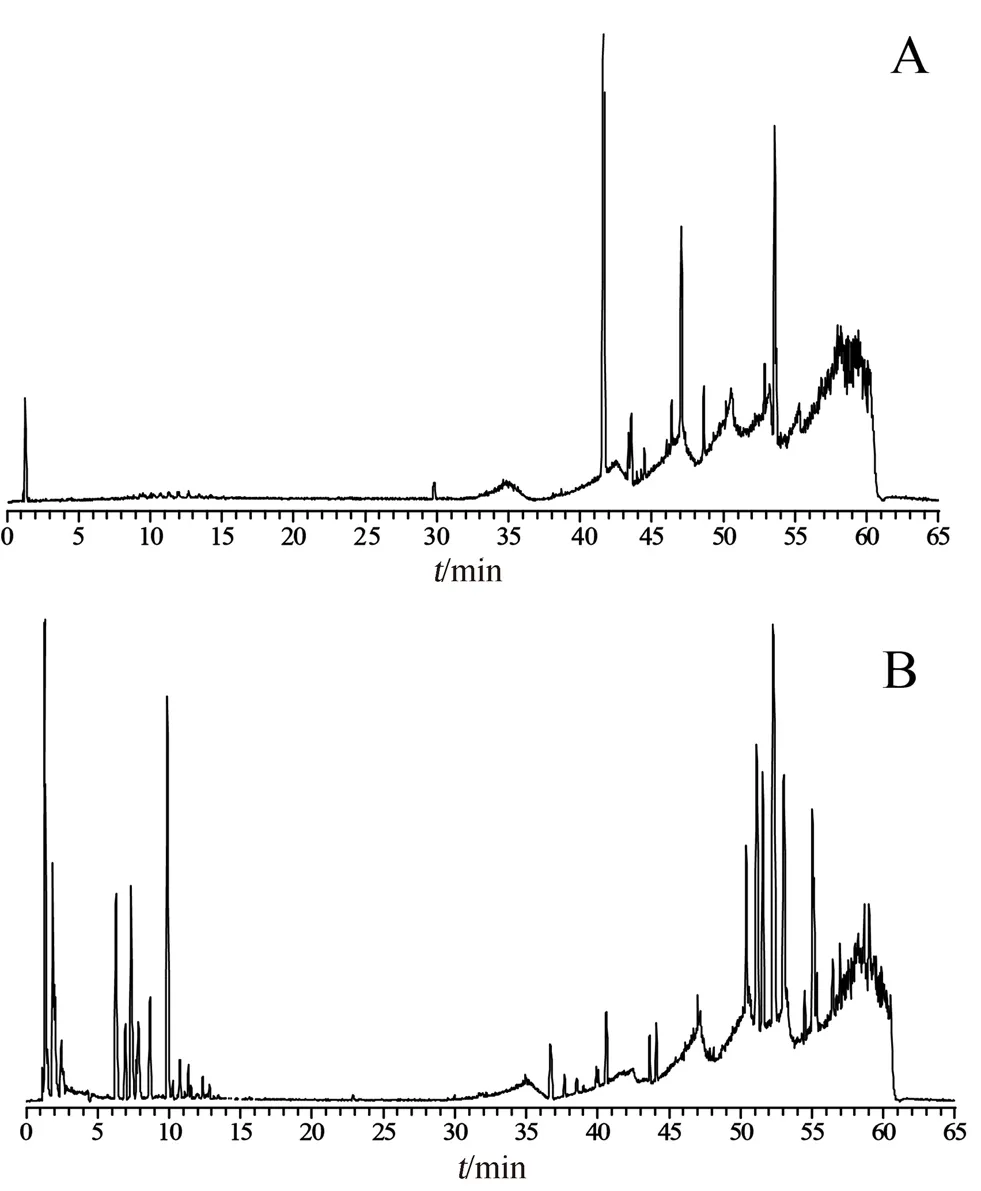
图1 溪黄草药材(A)及其给药组血清(B)负离子模式基峰离子流色谱图Fig 1 ESI-of based peak chromatogram of Rabdosia serra(A)and the serum of Rabdosia serra administration group(B)
2.2 三种不同基原溪黄草药材样品化学成分的裂解规律
2.2.1 酚酸类成分的裂解规律 结果显示,酚酸类成分主要有香草酸、原儿茶酸和迷迭香酸等。以迷迭香酸为例,在负离子模式下,保留时间为17.61 min,准分子离子峰为m/z359.0778[MH]-,其在裂解过程中丢失一分子丹参素和一分子咖啡酸,前者生成碎片离子m/z197.0454和m/z161.0228,后者生成碎片离子m/z179.0348。此外,丹参素通过中性丢失一分子H2O可生成碎片离子m/z179.0348,该碎片离子再失去一分子CO2,生成m/z135.0446。碎片离子m/z133.0295则推测为m/z161.0228通过中性丢失一分子CO生成。此裂解规律与文献报道一致[19],因此推测该结构为迷迭香酸,其质谱裂解规律见图2。
2.2.2 黄酮类成分的裂解规律 结果显示,黄酮类成分主要有夏佛塔苷和芦丁等。以芦丁为例,在负离子模式下,保留时间为17.03 min,准分子离子峰为m/z609.1470[M-H]-,其在裂解过程中丢失一分子糖苷,生成碎片离子m/z301.0347。该碎片离子通过发生RDA反应裂解生成m/z178.9984,而后通过中性丢失一分子CO生成碎片离子m/z151.0021,此裂解规律与文献报道一致[20]。芦丁质谱裂解规律见图3。
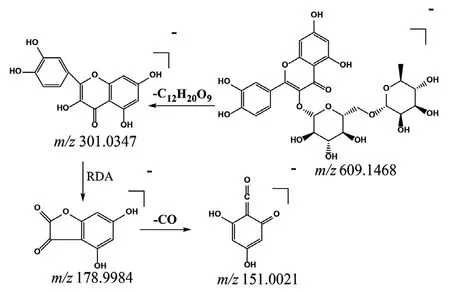
图3 芦丁质谱裂解规律Fig 3 Proposed fragmentation pathways of rutin
2.2.3 二萜类成分的裂解规律 结果显示,二萜类成分主要有horminone、kamebakaurin和maoecrystal A等。其中maoecrystal A是一种有代表性的对映贝壳杉烷类二萜化合物,其3,20-环氧 C-20 位被氧化。Maoecrystal A的保留时间为38.06 min,准分子离子峰为m/z387.1815[M-H]-,其在裂解过程中丢失了一分子CH3COOH,生成碎片离子m/z327.1606,该碎片离子再丢失一分子H2O,生成m/z309.1502,这与其他 C-20 位被氧化的对映贝壳杉烷类二萜的碎裂途径一致,并且此裂解规律与文献报道一致[15]。Maoecrystal A的质谱裂解规律见图4。
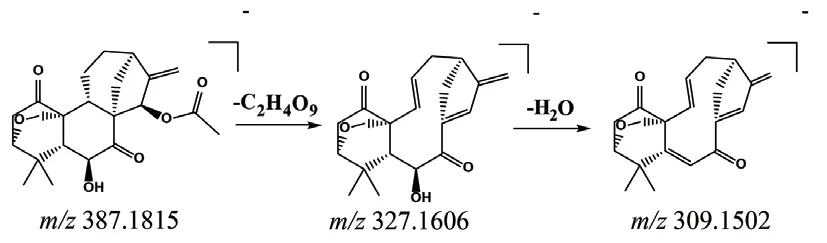
图4 Maoecrystal A质谱裂解规律Fig 4 Proposed fragmentation pathways of maoecrystal A
2.3 三种不同基原溪黄草在给药小鼠血清中入血成分的鉴定
M1在正离子模式下的准分子离子峰为m/z118.0867[M+H]+,推测其分子式为C5H11NO2。在其二级质谱图中检测到特征碎片离子m/z59.0738,在溪黄草药材及其血清中均被检出,结合文献[9]推测该化合物为甜菜碱。M2在负离子模式下的准分子离子峰为m/z188.9858[M-H]-,推测分子式为C6H6O5S,其特征碎片为m/z109.0283,推测是M2丢失一分子SO3所得。纤花药材中可检出原儿茶酸,但在血清中未检出原型,可能是由于其具有3个羟基易与硫酸结合,因而推测M2为原儿茶酸失去一分子CO2所形成的O-硫酸酯化合物[21],其在小鼠体内可能的代谢途径见图5。M3在负离子模式下的准分子离子峰为m/z179.0343[M-H]-,推测分子式为C9H8O4,其特征碎片离子m/z135.0442可能是前体离子裂解过程中失去一分子CO2所得,且该碎片离子通过丢失一分子CO,进而产生m/z107.0492,推测该结构为咖啡酸,在三种基原溪黄草血清中均被检出原型。结合文献,迷迭香酸在体内代谢产物有咖啡酸,因而推测咖啡酸可能是其代谢产物[22]。咖啡酸的质谱裂解规律见图6,该裂解途径与文献报道一致[23-24]。

图5 原儿茶酸体内代谢途径Fig 5 Metabolic way of protocatechuic acid
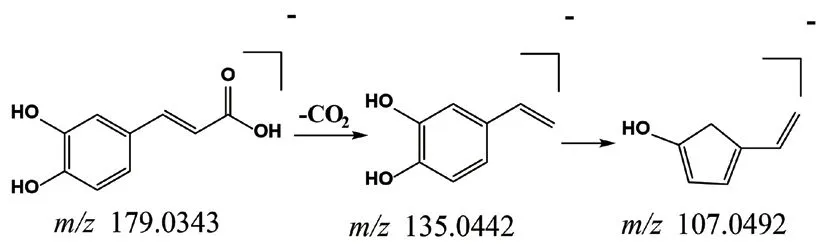
图6 咖啡酸质谱裂解规律Fig 6 Proposed fragmentation pathways of caffeic acid
具体三种基原溪黄草给药小鼠血清中入血成分及可能代谢产物见表2。
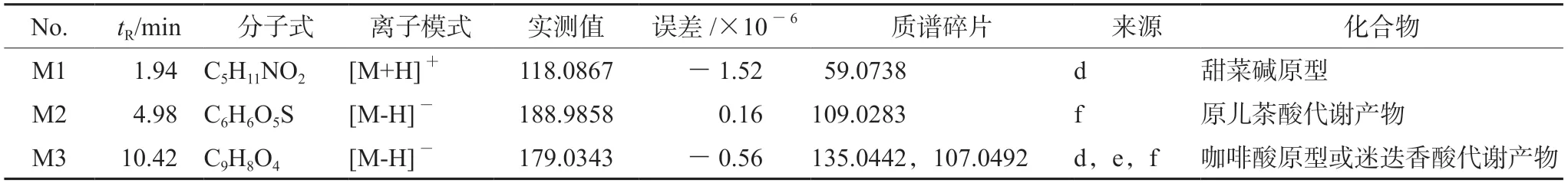
表2 小鼠血清中入血成分及可能代谢产物的鉴定Tab 2 Identification of blood components and possible metabolites in mouse serum
3 讨论
本实验采用UHPLC-Q-Exactive Orbitrap-MS技术研究四氯化碳致肝纤维化小鼠模型中三种基原溪黄草的入血成分。结果在三组药材中共鉴定出40个化合物,包括二萜、酚酸、黄酮及其他类化合物;在给药小鼠血清中鉴定出2个入血成分,包括1个有机酸类和1个生物碱类,鉴定出2个可能的代谢产物均为酚酸类化合物。其中,在溪黄草药材和给药组血清中分别鉴定出26个和2个化合物;在线纹香茶菜药材和给药组血清中分别鉴定出34个和1个化合物;在纤花香茶菜药材和给药组血清中分别鉴定出33个和2个化合物。
研究表明,氧化应激是四氯化碳诱导肝纤维化发病的重要机制之一[25]。甜菜碱为生物碱类化合物,具有抗氧化及抗炎作用,能够抑制肝星状细胞的活化进而达到抗肝纤维化的效果[24,26]。原儿茶醛与原儿茶酸同为抗氧化、抗炎作用较强的酚酸类化合物,都具有很好的护肝功效[27-29]。在药材和给药小鼠血清中均检出酚酸类化合物咖啡酸,研究发现,其通过激活NRF2/ARE信号通路,提高抗氧化相关基因水平,增强肝细胞清除自由基的能力,改善肝细胞氧化应激,从而达到保肝作用[30]。
综上所述,以上入血成分及代谢产物在抗炎、抗氧化等方面发挥着重要作用,由此推测这些成分可能是三种药材发挥作用的潜在药效物质。虽然三种基原溪黄草药材中均检出较多二萜类成分,但未在入血成分中检出,其原因可能为二萜类成分进入小鼠体内后发生了生物转化过程,因而难以检出原型成分[31-32]。
本研究应用UHPLC-Q-Exactive Orbitrap-MS技术完成了三种基原溪黄草及其给药后入血成分的初步鉴定,为后续研究溪黄草的药效物质基础及其抗肝纤维化作用提供了理论参考。
