基于5-LOX/LTB4信号通路探讨黄芩苷/栀子苷对PM2.5暴露致血管内皮功能障碍的干预作用及其机制
2024-03-14孙欠欠张行行赵麓赵安东史永恒王川刘继平王斌陕西中医药大学药学院陕西咸阳712046中医药脑健康产业陕西省高校工程研究中心陕西咸阳712046陕西省中医药管理局中药药效机制与物质基础重点研究室陕西咸阳712046
孙欠欠,张行行,赵麓,赵安东,史永恒,王川,刘继平,王斌*(1.陕西中医药大学药学院,陕西 咸阳 712046;2.中医药脑健康产业陕西省高校工程研究中心,陕西 咸阳 712046;3.陕西省中医药管理局中药药效机制与物质基础重点研究室,陕西 咸阳 712046)
大气PM2.5可经呼吸直达肺泡,沉积于肺泡表面;其可溶性组分或PM0.1还可透过肺泡壁的生理屏障进入循环系统,随血流而作用于全身的靶器官[1-2]。据大量流行病学及《中国心血管病报告2018》最新研究数据显示,大气PM2.5污染是引起我国居民心血管疾病发病率和死亡率持续增加的重要风险因素[3-5]。内皮细胞损伤是导致许多心血管疾病的起始环节和重要指标[6],而进入血液循环系统的PM2.5颗粒可通过多种途径损伤血管内皮细胞,薛盼盼等[7]将PM2.5与人脐静脉内皮细胞共培养后发现,PM2.5可诱导内质网应激并致其铁死亡;张一凡等[8]研究发现,PM2.5可触发氧化应激和炎症反应,并激活P38MAPK信号通路促进内皮细胞损伤和凋亡。
课题组前期研究发现,PM2.5暴露可活化心肌组织NLRP3炎性小体,促进炎性反应和心肌细胞凋亡[9],可以通过调节MAPK通路、AMPK通路、NF-κB通路与Sirt1通路,影响内皮舒张因子一氧化氮(NO)以及活性氧(ROS)的释放,引发血管内皮损伤[10-11]。课题组一直致力于黄芩苷(baicalin,BC)、栀子苷(geniposide,GD)抗脑血管损伤药效及机制研究,黄芩苷、栀子苷以最佳比例7∶3配伍,在30、60 mg·kg-1剂量应用时可有效抑制5-LOX/CysLTs/CysLTsR通路表达[12]、抗炎[13]、降低兴奋性氨基酸毒性[14]、调节小胶质细胞极化状态[15]等。课题组最新的研究表明,黄芩苷、栀子苷配伍可呈部分内皮依赖性地舒张由U46619预收缩的脑基底血管,其机制可能与调节NO表达有关;可通过调节HIF-1α/eNOS信号通路表达,保护由缺血缺氧诱导损伤的血管内皮损伤。因此,本实验拟通过离体血管环实验和在体动物实验探讨黄芩苷联合栀子苷在30(低)、60 mg·kg-1(高)剂量对改善PM2.5诱导的血管内皮功能障碍作用及其机制。
1 材料
1.1 动物
SPF级SD大鼠32只,雄性,(220±20)g [成都达硕实验动物有限公司,动物许可证编号:SCXK(川)2020-030]。饲养于陕西中医药大学中药药理实验动物房内,温度 23~25℃,相对湿度 45%~55%,自由摄食与饮水,昼夜各半,适应性饲养1周。实验过程中对动物的处置符合3R原则,本实验通过动物实验伦理审查(伦理批件号:SUCMDL20220301001)。
1.2 试药
一氧化氮合酶抑制剂(L-NAME)、环氧合酶抑制剂(INDO)、乙酰胆碱(ACh)、5-羟色胺(5-HT)、硝普钠二水合物(SNP,批号分别为67791、84227、133975、HY-B1473、HY-A0119,MCE公司);黄芩苷(批号:B20570,含量≥98%)、栀子苷(批号:B21661,含量≥98%)(上海源叶生物科技有限公司);内皮型一氧化氮合酶(eNOS)抗体(批号:ab215717,Abcam公司);诱导型一氧化氮合酶(iNOS)抗体(批号:BS-0162R,北京博奥森生物技术有限公司);5-LOX抗体(批号:GB111330-100,武汉赛维尔生物科技有限公司);白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)ELISA试剂盒(批号:0047R2、0190R2、0180R2,江苏酶免实业有限公司);转化生长因子β1(TGF-β1)ELISA试剂盒(批号:EK0514,武汉博士德生物科技有限公司);白三烯B4(LTB4)ELISA试剂盒(批号:U96-3681E,YOBIBIO)。
1.3 仪器
DMT 630M 离体微血管张力测定系统(丹麦DMT 公司);Powerlab 生物信号采集处理系统(澳大利亚 ADI 公司);TH-1000CⅡ智能大流量空气颗粒采样器(武汉市天虹有限责任公司);电泳仪、转膜仪及化学发光系统(美国 Bio-rad 公司);Scientz-10N型真空冷冻干燥机(宁波新艺生物科技股份有限公司)。
2 方法
2.1 血管肌张力测定
腹腔注射1%戊巴比妥钠(50 mg·kg-1)麻醉大鼠后,腹主动脉采血处死,剥离肠系膜组织,浸于预冷的Na+-PSS溶液中,显微镜下分离肠系膜动脉,切成4段,每段2~3 mm,穿入 2 根40 μm 的金属丝,迅速移至盛有37℃、氧饱和的Na+-PSS溶液的浴槽中,利用两端金属丝固定血管环,平衡 30 min 后,分3次施加1 mN 的预张力,每次间隔10 min;更换5 mL 60 mmol·L-1K+-PSS 收缩血管,重复两次,当两次刺激收缩力均大于5 mN,且无明显差异时,可用于后续实验[16]。即分别测定BC/GD对正常基础状态,5-HT预收缩,以及一氧化氮合酶抑制剂(L-NAME)、环氧合酶抑制剂(INDO)、L-NAME+INDO 孵育血管后的肠系膜动脉血管的舒张作用。
2.2 PM2.5颗粒采集及混悬液的制备
将 PM2.5颗粒采集器固定于陕西中医药大学四号教学楼楼顶,楼高约 20 m。通过采集器将PM2.5颗粒附着于玻璃纤维膜上,将膜裁剪为1 cm×1 cm方块,置于烧杯中,加入纯水没过,低温超声 60 min,洗脱滤膜,1800 目尼龙滤网过筛除去不溶性大颗粒,滤液真空冷冻干燥 3 d,转移至 60℃ 烘箱继续干燥 24 h 后,洁净台分装至无菌离心管,-20℃保存。使用前,称取适量溶于生理盐水,超声震荡15 min,注意现用现配。
2.3 实验动物分组及给药
32只大鼠适应性饲养结束后,按随机数字表法分为对照组、PM2.5组(15 mg·kg-1)、BC/GD低剂量组(30 mg·kg-1)、BC/GD高剂量组(60 mg·kg-1),每组 8 只,采用非暴露式气管滴注PM2.5混悬液进行染毒[17],对照组气管滴注等量生理盐水,每6日1次,共10次[18],滴注体积为 1 mL·kg-1。BC/GD为灌胃给药,给药周期为1个月,从染毒1个月后开始给药。染毒期间观察各组大鼠毛发、精神、饮食、活动状况。给药结束后,禁食12 h,1%戊巴比妥钠(50 mg·kg-1)麻醉,腹主动脉取血处死,取肠系膜动脉进行指标检测。
2.4 HE染色观察血管内皮状态
取出大鼠肠系膜动脉,用预冷的生理盐水清洗干净,吸水纸吸干表面多余水分,4%多聚甲醛固定72 h后,经脱水、包埋、切片、脱蜡、染色、制片,光镜下不同倍数观察肠系膜动脉内皮组织病理学状态,选取固定位置拍照。
2.5 ELISA检测血清中IL-1β、IL-6、TNF-α、TGF-β1、LTB4水平
腹主动脉血液样本常温静置30 min,3000 r·min-1离心15 min,分装血清,-80℃冻存,严格按照试剂盒说明书测定血清中IL-1β、IL-6、TNF-α、TGF-β1、LTB4水平。
2.6 化学发光法检测肠系膜动脉组织ROS水平
取适量肠系膜动脉血管组织,冰上消解后剪碎,用预冷的PBS冲洗,除去细胞碎片,与适量的酶消化液一起,37℃水浴30 min,孵育过程中,使用移液枪吹打细胞,孵育结束后,PBS清洗,300目的尼龙网过筛,收集滤过的细胞,500 r·min-1离心10 min,吸弃上清液,并用 PBS洗 1~2 次沉淀。利用DCFH-DA对细胞沉淀重新悬浮(1×106~2×107个·mL-1),在37℃下培养30 min,每3~5 min反转混合一次,以保证探头和细胞的完全接触,收集孵育(探针标记)后的单细胞悬液,1000 r·min-1离心10 min,收集细胞沉淀,PBS再次冲洗1~2次,再次悬浮,并在最佳激发波长 488 nm,最佳发射波长 525 nm处测定荧光度值。
2.7 硝酸还原酶法检测肠系膜动脉组织NO水平
取适量肠系膜动脉组织与9倍量生理盐水在冰上机械匀浆,制成10%的匀浆液,3000 r·min-1离心10 min,取上清液进行NO水平检测。
2.8 Western blot法检测肠系膜动脉5-LOX、eNOS、iNOS蛋白表达
取肠系膜动脉组织,加入RIPA裂解液提取蛋白并测定蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后加入抗体(1∶1000),4℃孵育过夜;洗涤后加入二抗(1∶5000)孵育,洗涤后加入ECL超敏发光液显影,采用成像仪摄像、测量,利用Image Pro Plus 5.0软件分析计算条带灰度值。
2.9 统计学方法
采用SPSS 26.0软件进行数据分析,数据采用±s表示,组间差异采用单因素方差分析(One-way ANOVA),P<0.05表示差异具有统计学意义。
3 结果
3.1 BC/GD对基础状态血管张力的影响
与二甲基亚砜(DMSO)组比较,BC/GD对内皮完整的基础状态的肠系膜动脉血管环无明显影响(P>0.05),提示BC/GD对正常基础状态的肠系膜动脉无舒张作用(见图1)。
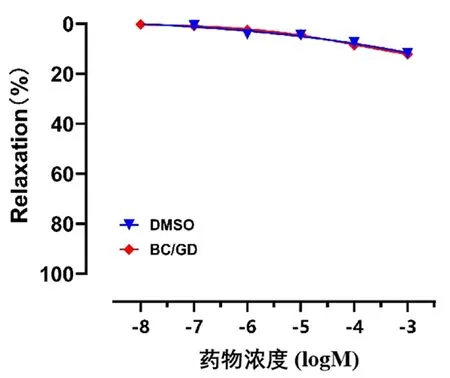
图1 BC/GD对基础状态的血管环张力的影响Fig 1 Effect of BC/GD on vascular ring tension in the base state
3.2 BC/GD对5-HT预收缩的肠系膜动脉血管张力的影响
结果显示,BC/GD能明显舒张血管环。提示BC/GD能舒张5-HT预收缩的肠系膜动脉血管(见图2)。
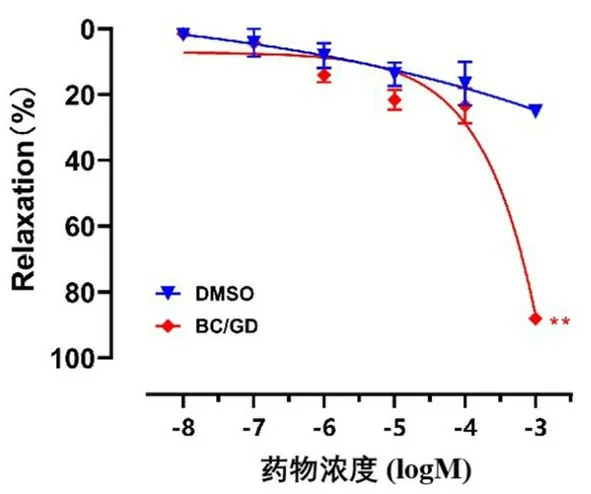
图2 BC/GD对5-HT预收缩的肠系膜动脉血管张力的影响Fig 2 Effect of BC/GD on the tension of the mesenteric artery precontracted with 5-HT
3.3 BC/GD舒张血管作用的内皮机制
L-NAME、INDO、L-NAME+INDO孵育血管30 min后,5-HT预收缩血管,加入BC/GD后监测血管环张力变化,结果显示,L-NAME、INDO、L-NAME+INDO均能抑制BC/GD的舒张血管作用,但L-NAME对BC/GD舒张血管的抑制作用较INDO强。提示BC/GD对血管的舒张作用与调节NO表达有关(见图3)。

图3 BC/GD舒张血管作用的内皮机制Fig 3 Endothelial mechanism of BC/GD on the vasodilation
3.4 PM2.5对血管内皮功能的影响
ACh是一种内皮依赖性血管扩张剂,通过刺激内皮细胞产生NO;SNP是一种非内皮依赖的血管扩张剂,直接释放NO来舒张血管[19-20]。为了研究PM2.5对肠系膜动脉血管内皮功能的影响,将内皮完整的肠系膜动脉分别与DMSO、25 mg·mL-1PM2.5、50 mg·mL-1PM2.5、100 mg·mL-1PM2.5共孵育2 h后,加入1×10-5mol·L-15-HT预收缩血管环,稳定后加入ACh舒张血管。结果显示,与DMSO组比较,50、100 mg·mL-1BC/GD组对ACh的血管舒张效应明显减弱(P<0.01);而各个浓度的PM2.5对SNP的血管舒张效应无明显影响。提示50 mg·mL-1以上的PM2.5可引起血管内皮损伤,血管舒张效应减弱(见图4)。

图4 不同浓度PM2.5对ACh、SNP血管舒张效应的影响Fig 4 Effect of different concentrations of PM2.5 on the vasodilation of ACh and SNP
3.5 BC/GD对PM2.5诱发血管内皮损伤的影响
为了研究BC/GD对PM2.5引起的血管内皮损伤的影响,将BC/GD(1×10-3mol·L-1)与PM2.5共同孵育2 h后,加入1×10-5mol·L-15-HT预收缩血管环,稳定后累加浓度加入ACh舒张血管,观察对血管舒张的影响。结果显示,PM2.5组血管舒张效应明显减弱,加入BC/GD共同孵育后,血管舒张作用明显增强。提示BC/GD能增强血管舒张效应,对PM2.5造成的血管内皮损伤有保护作用(见图5)。

图5 BC/GD对PM2.5诱发血管内皮损伤的影响Fig 5 Effect of BC/GD on vascular endothelial injury induced by PM2.5
3.6 大鼠一般情况
滴注过程中,对照组大鼠毛色有光泽,饮食、行动正常,呼吸顺畅平稳,无其他明显异常状态,滴注组大鼠在滴注4次后毛色变暗、呼吸急促、变得暴躁,且随着染毒次数的增多,上述症状逐渐加重;饮食未见明显异常,体重增长情况良好,无明显异常。而开始灌胃后,上述异常体征得到有效改善,但体重增长相较于未给药前减缓(见表1)。

表1 大鼠体重变化(g)Tab 1 Changes in body weight of rats (g)
3.7 各组大鼠肠系膜动脉病理学观察
对照组大鼠肠系膜动脉血管内皮细胞连续、完整,无明显病理损伤;PM2.5组大鼠肠系膜动脉内皮完整性严重受损、出现缺失,内皮皱缩,BC/GD能不同程度改善大鼠内皮损伤程度和完整性(见图6)。提示BC/GD对PM2.5诱导的血管内皮损伤具有保护作用。

图6 BC/GD对各组大鼠肠系膜动脉内皮完整性的影响(HE染色,×200)Fig 6 Effect of BC/GD on the endothelial integrity of the mesenteric arteries in rats of each group(HE染色,×200)
3.8 ELISA法检测血清中IL-1β、IL-6、TNF-α、TGF-β1水平
与对照组比较,PM2.5组IL-1β、IL-6、TNF-α水平明显升高(P<0.01),TGF-β1水平显著降低(P<0.01);与PM2.5组比较,BC/GD高剂量组大鼠IL-1β、IL-6、TNF-α水平明显降低(P<0.01),TGF-β1水平显著升高(P<0.01);BC/GD低剂量组大鼠TNF-α水平明显降低(P<0.01),IL-1β、IL-6、TGF-β1水平无明显差异(见图7)。

图7 BC/GD对各组大鼠血清IL-1β、IL-6、TNF-α、TGF-β1水平的影响Fig 7 Effect of BC/GD on the serum IL-1β,IL-6,TNF-α,and TGF-β1 levels of rats in each group
3.9 化学发光法检测肠系膜动脉中ROS水平
与对照组比较,PM2.5组大鼠肠系膜动脉中ROS水平显著升高(P<0.01);与PM2.5组比较,BC/GD高剂量组大鼠肠系膜动脉中ROS水平显著降低(P<0.01);BC/GD低剂量组大鼠肠系膜动脉中ROS水平与PM2.5组无明显差别(见图8)。
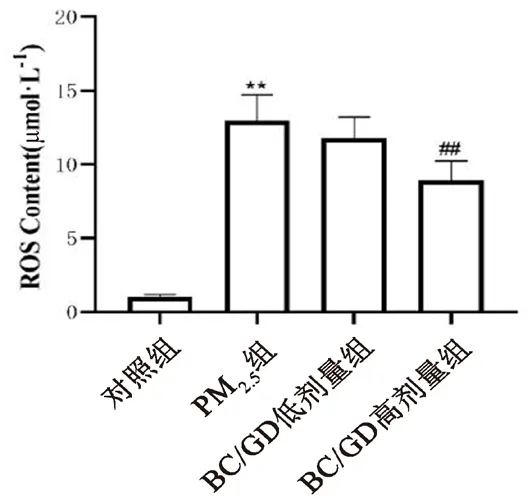
图8 BC/GD对各组大鼠肠系膜动脉ROS水平的影响Fig 8 Effect of BC/GD on the ROS levels in mesenteric arteries of rats in each group
3.10 硝酸还原酶法检测肠系膜动脉中NO水平
与对照组比较,PM2.5组大鼠肠系膜动脉中NO水平显著降低(P<0.01);与PM2.5组比较,BC/GD高剂量组大鼠肠系膜动脉中NO水平显著升高(P<0.01);BC/GD低剂量组大鼠肠系膜动脉中NO水平与PM2.5组无明显差别(见图9)。

图9 BC/GD对各组大鼠肠系膜动脉NO水平的影响Fig 9 Effect of BC/GD on the NO levels in mesenteric arteries of rats in each group
3.11 肠系膜动脉中5-LOX、eNOS、iNOS蛋白表达和血清中LTB4水平
与对照组比较,PM2.5组5-LOX、iNOS、LTB4水平明显升高,eNOS蛋白表达显著降低(P<0.05);与PM2.5组比较,BC/GD低、高剂量组大鼠5-LOX、iNOS蛋白表达显著降低,eNOS蛋白表达显著上升(P<0.05);BC/GD高剂量组LTB4水平降低(P<0.05)(见图10)。
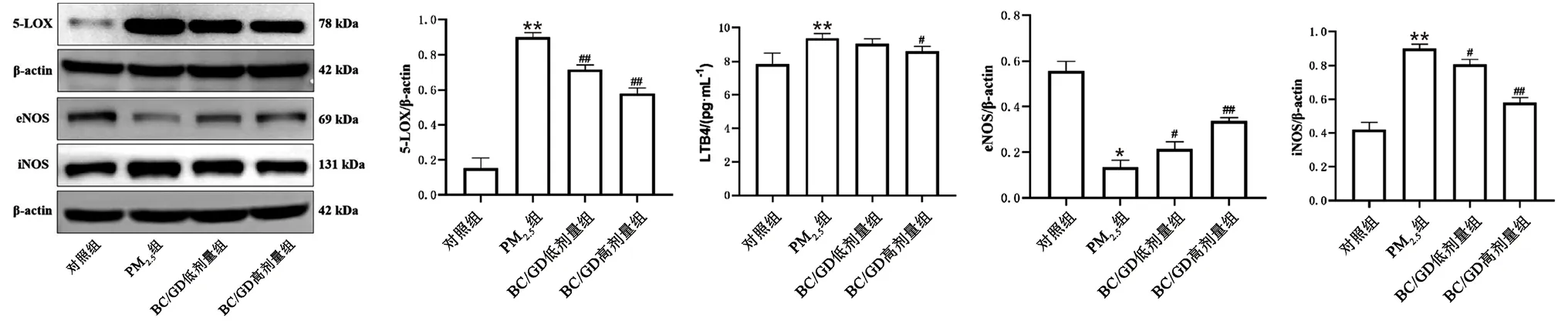
图10 BC/GD对各组大鼠肠系膜动脉中5-LOX、eNOS、iNOS蛋白表达和血清中LTB4水平的影响Fig 10 Effect of BC/GD on the expression of 5-LOX,eNOS,and iNOS protein in the mesenteric artery and the level of LTB4 in the serum of rats in each group
4 讨论
PM2.5具有粒径小、成分复杂、危害大等特点,易通过上呼吸道黏膜到达并堆积在肺部,再通过肺循环进入全身血液循环[21]。多项研究表明,PM2.5已经成为诱发心肌细胞炎性细胞因子水平增加、诱导血管内皮凋亡、凝血功能异常、自主神经功能失衡等心血管疾病不可忽视的重要因素[22]。
血管内皮细胞是附着于血管内皮生长的单层鳞状细胞,与血液直接接触,对血液中的异物刺激具有直接反应[23],正常生理情况下,内皮细胞可感知内外环境的变化并分泌多种血管活性物质来维持机体内环境稳定[24]。黄芩苷为唇形科植物黄芩干燥根中提取的黄酮类物质,具有保肝、利胆、降压、镇静、消炎等药理活性。栀子苷为茜草科植物栀子干燥成熟果实中提取的环烯醚萜类物质,具有保肝利胆、解热镇静、降压、抗炎、止血等药理作用。研究表明,黄芩苷具有浓度依赖性血管舒张作用[25],但鲜见栀子苷舒张血管的相关报道。本实验中,BC/GD对基础状态的肠系膜动脉血管环张力无明显影响,但能明显舒张由5-HT预收缩的血管环,加入一氧化氮合酶抑制剂L-NAME、环氧合酶抑制剂INDO或两者合用孵育血管环后,均能明显抑制BC/GD的血管舒张作用,但L-NAME的抑制作用更为明显,提示BC/GD舒张血管作用与内皮舒张因子NO有关。体内外研究表明,进入血液循环的PM2.5颗粒可通过多种途径引起血管内皮细胞损伤,引起血管舒张功能障碍[26]。本实验将不同浓度PM2.5与血管环共孵育2 h后,发现50 mg·mL-1的PM2.5能明显减弱ACh引发的血管舒张,而对SNP引发的血管舒张效应无明显影响,提示PM2.5引起的血管舒张效应减弱与内皮有关。将BC/GD和PM2.5共孵育血管环2 h后,BC/GD能明显改善由PM2.5诱导的舒张效应减弱的作用。提示PM2.5与肠系膜动脉血管环共孵育后能通过多种途径损伤血管内皮,诱发血管内皮功能障碍,而BC/GD对PM2.5造成的血管损伤具有保护作用。
NO是一种具有内皮功能的多效性功能分子,也是机体最强的血管舒张物质,由内皮细胞中的L-精氨酸在钙-钙调蛋白依赖性的NOS催化下合成释放[27]。而NOS具有三种不同的亚型,即在正常状态下表达的神经元型一氧化氮合酶(nNOS)和eNOS以及在损伤后诱导表达的iNOS[28]。内皮细胞受到PM2.5刺激后,会引起血管通透性增加、NO生成减少,促进血管紧张素Ⅱ等血管收缩介质的表达与释放,导致内皮功能障碍[29]。而PM2.5由于其复杂的化学组成和粒径大小,表面通常吸附重金属(如铅、锌、铁、镉、镍、砷和铬等)和毒害有机物,其中过渡金属离子可以催化氧化还原反应,在PM2.5表面产生ROS或活性氮[30]。ROS可以直接灭活NO,也可通过耗竭四氢生物蝶呤(BH4),使eNOS的合成受到抑制,NO含量减少,加速内皮功能障碍[31]。为进一步探讨BC/GD抗PM2.5暴露致使的血管内皮功能障碍作用及其机制,本研究利用气管滴注法构建PM2.5染毒模型。在前期的预实验中选择7.5、15、30 mg·kg-1三个PM2.5浓度分别滴注1个月、2个月、3个月进行造模浓度和时间的筛选,结果发现,15 mg·kg-1PM2.5滴注2个月能明显激活NLRP3炎性小体,诱导心肌细胞结构损伤、促进炎症反应和心肌细胞凋亡[9];致使脑组织炎性损伤和激活小胶质细胞并向M1型极化,因此,本实验继续采用该造模方法。对各组大鼠血管功能性指标进行检测,结果显示,PM2.5组大鼠肠系膜动脉内皮严重受损,血管中ROS升高,NO降低,而BC/GD组大鼠内皮损伤得到改善;60 mg·kg-1能明显降低ROS水平、升高NO水平,促进eNOS、抑制iNOS表达。
课题组一直致力于研究5-脂氧酶(5-LOX)/白三烯B4(LTB4)信号通路介导的机体损伤,5-LOX可以催化花生四烯酸(AA)生成白三烯A4(LTA4),LTA4在一系列酶催化反应下可生成半胱氨酰白三烯(CysLTs)和LTB4[32]。LTB4是重要的促炎脂质介质和炎症趋化因子,主要表达于巨噬细胞、血小板、平滑肌细胞和内皮细胞等细胞中[33],LTB4可激活LTB1和LTB2两个受体,从而激活并招募B细胞和T细胞,促进核因子-κB(NF-κB)产生和IL-6、TNF-α等炎症因子表达,引发炎症级联反应,促进细胞凋亡[34]。有研究表明,5-LOX、FLAP和LTA4H在动脉粥样硬化病变处均处于高表达状态,因此,本研究继续选择该通路对BC/GD改善PM2.5诱导的血管内皮功能障碍机制进行探讨。结果显示,PM2.5组大鼠血清中TNF-α、IL-1β、IL-6、LTB4水平显著升高,TGF-β1水平显著降低,大鼠肠系膜动脉中5-LOX蛋白表达明显增加,而60 mg·kg-1BC/GD能明显下调5-LOX、LTB4、TNF-α、IL-1β、IL-6表达,上调TGF-β1表达。提示BC/GD可通过抑制5-LOX/LTB4信号通路活化,抑制下游炎性介质释放,降低炎性损伤。
综上所述,BC/GD可通过抑制5-LOX/LTB4信号通路表达,下调ROS水平,上调eNOS表达,下调iNOS表达,升高血管中NO水平,改善PM2.5诱导的血管内皮功能障碍。
