基于氮素对枸杞甜菜碱含量及代谢关键酶影响的转录组分析
2024-03-13禹雅楠刘根红郑国琦周佳瑞
禹雅楠,刘根红,郑国琦,周佳瑞
(宁夏大学,银川 750021)
【研究意义】宁夏枸杞(LyciumchinenseL.),枸杞属,隶属于茄科,茄族,枸杞亚族,多为多棘刺浆果类落叶小灌[1]。在世界各地均有分布,在我国主要分布于宁夏、内蒙古、新疆等西北、华北的干旱和半干旱地区。枸杞喜冷凉气候,耐寒力很强,抗逆性较强,是一种适应性很广的树种[2]。其根系发达,因具有改善土壤结构、提高土壤肥力、抗旱耐盐碱和耐寒耐瘠薄等生态作用[3],以及较高的营养价值和药用价值,是我国重要的经济作物之一[4]。甜菜碱是一种季胺类化合物,被发现存在于多种生物中[5],其含量有利于提高植物对低温、高温、盐碱、干旱、重金属等非生物胁迫的耐性[6],在植株细胞内,通常以胆碱为底物,经胆碱单加氧酶(CMO)与甜菜碱醛脱氢酶(BADH)逐步催化氧化生成,其活性在逆境时增强,从而促进甜菜碱的合成[7]。肥料是作物增产的主要途径之一,其中氮肥是最重要也是最常用的肥料。氮素是植物体内多种激素、蛋白质等的重要组成成分,在植物的生长及生理代谢中起着重要作用[8]。研究表明,适量增施氮肥有助于作物产量提升,提高果实品质[9]。转录组学是指从RNA水平研究基因表达的情况,转录组即一个活细胞所能转录出来的所有RNA的总和,是研究细胞表型和功能的一个重要手段,转录组也是连接遗传信息基因组和生物功能蛋白组的桥梁[10]。高通量测序技术因其具有数据量大、快速便捷、准确性好等优点,近年来被广泛应用于发掘和鉴定药用植物在生长发育及次生代谢产物生物合成方面的相关功能基因[11]。目前,转录组高通量测序技术已经成为研究药用植物发育、阐明植物活性成分和次生代谢生物合成途径相关基因表达调控的重要手段[13]。【前人研究进展】陈静等[14]研究表明,玉米叶片喷施甜菜碱可以缩小不同播期处理间产量的差异,有利于增加不同播期夏玉米的产量。刘根红等[15]研究表明,在施氮量为30 kg/666.7 m2时,枸杞甜菜碱及其相关酶含量达到最佳。何志强等[16]研究发现,枸杞叶片叶绿素含量随施氮量的增加而增加,百粒重和单株产量随施氮量的增加呈先增加后减少趋势,当施氮量为40 或60 g/株时,叶绿素含量、百粒重和单株产量最大。王一莹等[17]研究发现当氮肥施用量达到280 kg/hm2时,春玉米产量可达14 000 kg/hm2,合理氮肥有助于干物质向子粒中转移,进而实现增产。Tian等[18]研究表明,对于地力低下的土壤,提高施氮量能够明显提高油菜产量。孟小伟等[20]通过转录组测序分析,筛选出与类黄酮生物合成有关的Unigene共45个,为与黑果枸杞果实品质有关的基因筛选、克隆和功能分析等提供研究基础和理论依据。包雪梅等[21]研究发现,黑果枸杞中参与花青素合成代谢的结构基因表达量均高于白果枸杞,且调控花青素生物合成的bHLH转录因子CL8159.Contig5_All的表达水平比白果枸杞增强2139.57倍,说明这个基因很有可能是控制黑果枸杞黑果性状的候选基因。【本研究切入点】目前关于枸杞品质、产量等的研究报道较多,但是基于转录组水平上分析枸杞相关成分含量及代谢通路等的研究较少。【拟解决的关键问题】利用高通量技术手段从转录组学水平研究不同施氮量对枸杞甜菜碱含量的影响,通过对差异表达基因的分析,了解氮素在枸杞甜菜碱合成过程中所涉及的代谢通路,为提高枸杞甜菜碱含量提供理论依据。
1 材料与方法
1.1 试验地概况
试验设在宁夏南梁农场(106°13′ E,38°40′ N),海拔1090 m。属典型大陆性气候,干旱少雨,蒸发强烈,日照时间长,光热资源丰富,无霜期短。年降雨量约250 mm,多集中在7—9月。土壤以盐分较高的灌淤土为主(图1),该地区种植枸杞总面积达1×107m2。

表1 供试土壤的基本理化性质
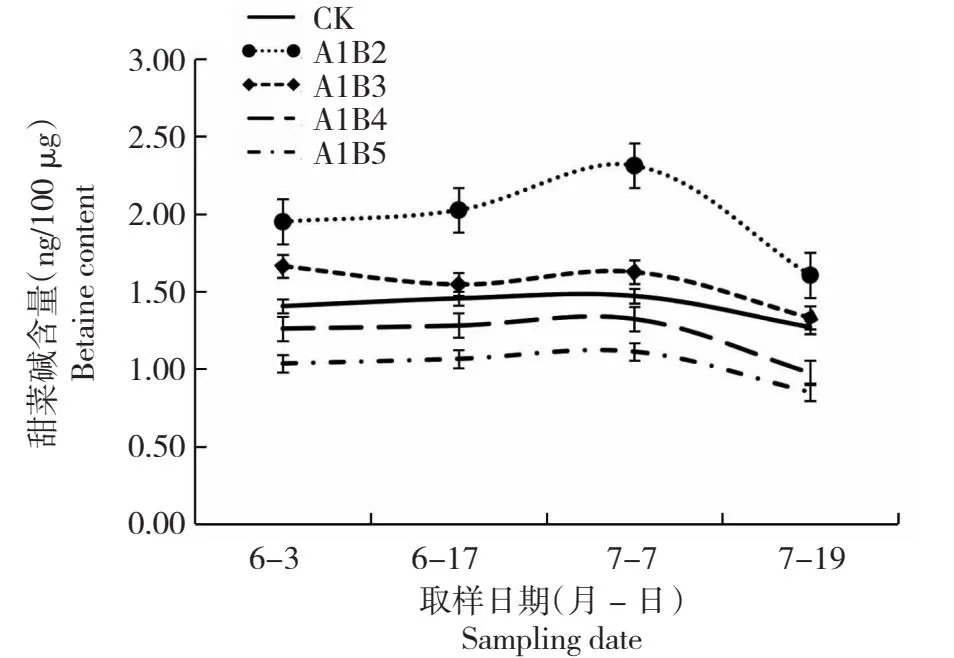
图1 不同施肥量枸杞甜菜碱含量的变化Fig.1 Changes of betaine content in L.barbarum with different fertilization amounts
1.2 供试材料及试验设计
试验品种为‘宁杞1号’(3年生)。试验于2022年4—10月在宁夏南梁农场进行,裂区试验设计,主区为氮肥施用深度A(A1:0~20 cm,A2:20~40 cm),副区为氮素施用量B(CK:0 kg/666.7 m2、B1:15 kg/666.7 m2、B2:30 kg/666.7 m2、B3:45 kg/666.7 m2、B4:60 kg/666.7 m2),各处理设18棵树,3次重复,共15个小区。施肥时期以4月中旬开沟基施并灌水,5月底、6月初结合锄草追肥一次,基追比例为2∶1,供试肥料为磷酸二铵(氮素含量18%)、尿素(氮素含量46%),有机肥配施磷钾肥作底肥,常规磷肥施用量(纯磷40 kg/666.7 m2),常规钾肥施用量(纯钾30 kg/666.7 m2),常规有机肥(氮素含量0.53%)施用量(基施腐熟有机肥3000 kg/666.7 m2)、常规灌水量(200 m3/666.7 m2),其他田间管理同大田生产。
1.3 测定项目及方法
1.3.1 枸杞甜菜碱含量及相关酶含量测定 甜菜碱含量采用分光光度法测量。主要原理为:甜菜碱在强酸条件下和硫氰酸铬铵(雷氏盐)发生反应产生沉淀,沉淀用丙酮溶解形成红色溶液,在525 nm处有特征吸收峰,测定525 nm处的吸光度值,可计算样品中甜菜碱含量[22]。在枸杞挂果后(6月20日左右)取样3次,各处理随机取鲜果适量,进行筛选和洗净,之后放置在70 ℃左右的烘箱中进行烘干,烘干后放置于干燥皿中冷却,冷却后研磨,研磨成粉时装入离心管,冷藏于冰箱中进行备用。
甜菜碱醛脱氢酶、单加氧酶的提取以及活性测定参考梁峥等[23]的方法。甜菜碱醛脱氢酶、单加氧酶的提取:准确称取4 g枸杞叶片,倒入液氮,迅速将其研成粉末状。加入20 mL酶提取缓冲溶液(100 mmol/L Tricine-KOH,pH 8.5,2 mmol/L EDTA,2 mmol/L DTT,0.6 mol/L蔗糖)研磨成匀浆,以1000 r/min离心10 min,将所得上清液在10 000 r/min再离心20 min,收集上清液,并加入饱和度55%的(NH4)2SO4,得到的沉淀用1.5 mL醇悬浮缓冲液(10 mmol/ L Tris-HCl,pH 7.8,1 mmol/L DTT,10%甘油)溶解,并在该缓冲液中透析除去硫酸铵,即得酶粗提液。
1.3.2 测序数据质量评估方法 待枸杞夏果成熟后第一次采收时,在田间每个处理取20粒,存于冻存管中,放到液氮中,然后转移到-80 ℃冰箱中保存,最后将样品置于干冰中寄送上海派森诺生物科技有限公司进行RNA提取以及转录组测序。
本研究中Illumina HisepTM获得的原始图像数据文件经CASAVA碱基识别(Base calling)分析转化为原始测序序列(Sequenced reads),称之为Raw date或Raw reads,测序结果以FASTQ(简称为fq)文件格式存储。采用Fast.QC软件对测序下机的Raw reads进行序列的质量评估以及序列过滤,得到可以用于后续分析的高质量Clean reads。
1.3.3 差异基因的筛选和功能分析 本次分析显著差异基因筛选原则为:① log2FC>1或<-1;② FDR<0.05。基于数据库,将分析得到的差异基因分别从BP、MF、CC三个层面进行GO注释,得到基因参与的所有GO,采用Fisher检验计算每个GO的显著性水平(P-value),从而筛选出差异基因显著富集的GO。
1.3.4 差异基因信号通路分析 将筛选出的差异基因基于KEGG数据库进行Pathway注释,得到差异基因参与的所有Pathway term,采用Fisher检验计算Pathway的显著性水平(P-value),从而筛选出差异基因显著富集的Pathway term。
1.4 数据的整理与分析
数据用 Microsoft Excel 2010进行整理,用SPSS 20.0进行分析。
2 结果与分析
2.1 枸杞甜菜碱含量
由图1可以看出,随着枸杞生育期的推进,不同施氮量枸杞果实内甜菜碱含量大致呈先上升后下降趋势,其中A1B3处理的枸杞果实内甜菜碱含量呈先下降后上升再下降趋势。整体来看,A1B2处理的甜菜碱含量最高,其次依次是A1B3、CK、A1B4、A1B5处理。表明,适量增施氮肥能够有效提高枸杞果实甜菜碱含量。
2.2 相关酶含量
2.2.1 胆碱单加氧酶含量 由图2可看出,不同处理下,枸杞胆碱单加氧酶含量随着生育期的推进基本呈先上升后下降趋势。6月3日,随施氮量增加呈先降低再上升趋势,总体来看,A1B5处理的枸杞胆碱单加氧酶含量最高,CK次之。A1B3处理的枸杞胆碱单加氧酶含量在7月7日增长最快。综合以上分析来看,胆碱单加氧酶含量先随施氮量的增加而减少,在施氮量超过45 kg/667 m2时开始增高。

图2 不同施肥量枸杞胆碱单加氧酶含量Fig.2 Choline monooxygenase content in L.barbarum with different fertilization amount
2.2.2 甜菜碱醛脱氢酶含量 由图3可看出,各个处理中枸杞甜菜碱醛脱氢酶含量的表现各异,并没有随着氮肥施用量的增加而上升;6月3日和6月17日,除A1B5处理的枸杞甜菜碱醛脱氢酶含量最低以外,其他各个处理差异不大;7月7日和7月19日,A1B2处理的枸杞甜菜碱醛脱氢酶含量明显升高,且远高于其他几个处理;A1B5处理的枸杞甜菜碱醛脱氢酶含量虽呈上升趋势,但仍低于其他几个处理;A1B3、A1B4处理和CK在整个生育期变化不明显。
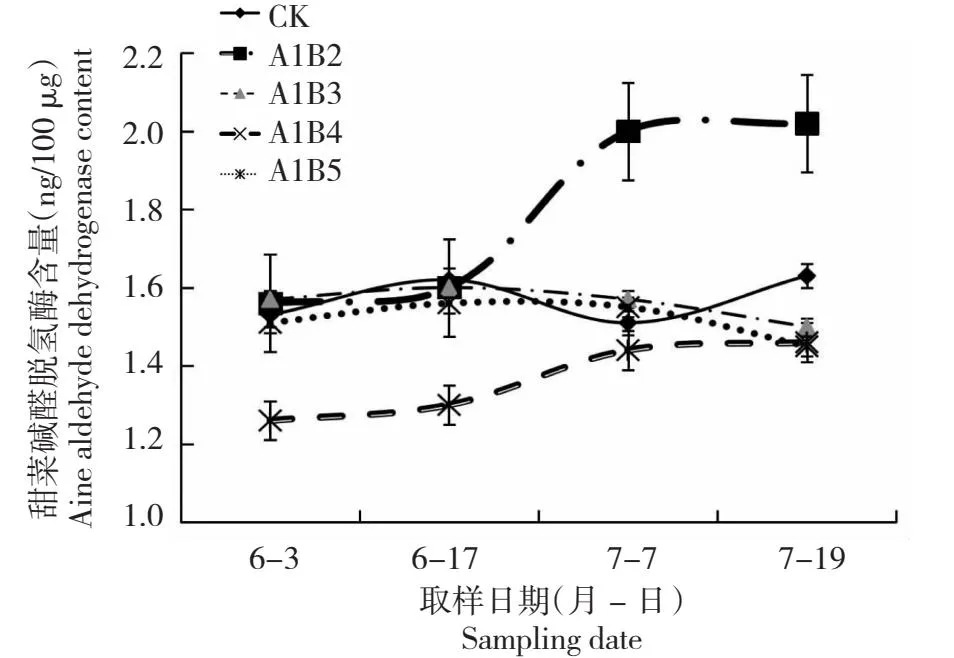
图3 不同施肥量枸杞甜菜碱醛脱氢酶含量Fig.3 Betaine aldehyde dehydrogenase content in L.barbarum with different fertilization amount
2.3 RNA-Seq高通量测序数据质量检测结果
由表2可看出,枸杞果实在5个处理条件下的15个样品,通过转录组测序共获得39 043 082~49 566 136原始读数(Raw reads),各样本的有效碱基数(Clean base)基本达到5.7 Gb以上,Q20(测序错误率小于1%)均在97%以上,Q30(测序错误率小于0.1%)均在94%以上,表明这15个样品的测序质量良好,具有较高的可靠性,满足后续分析要求。
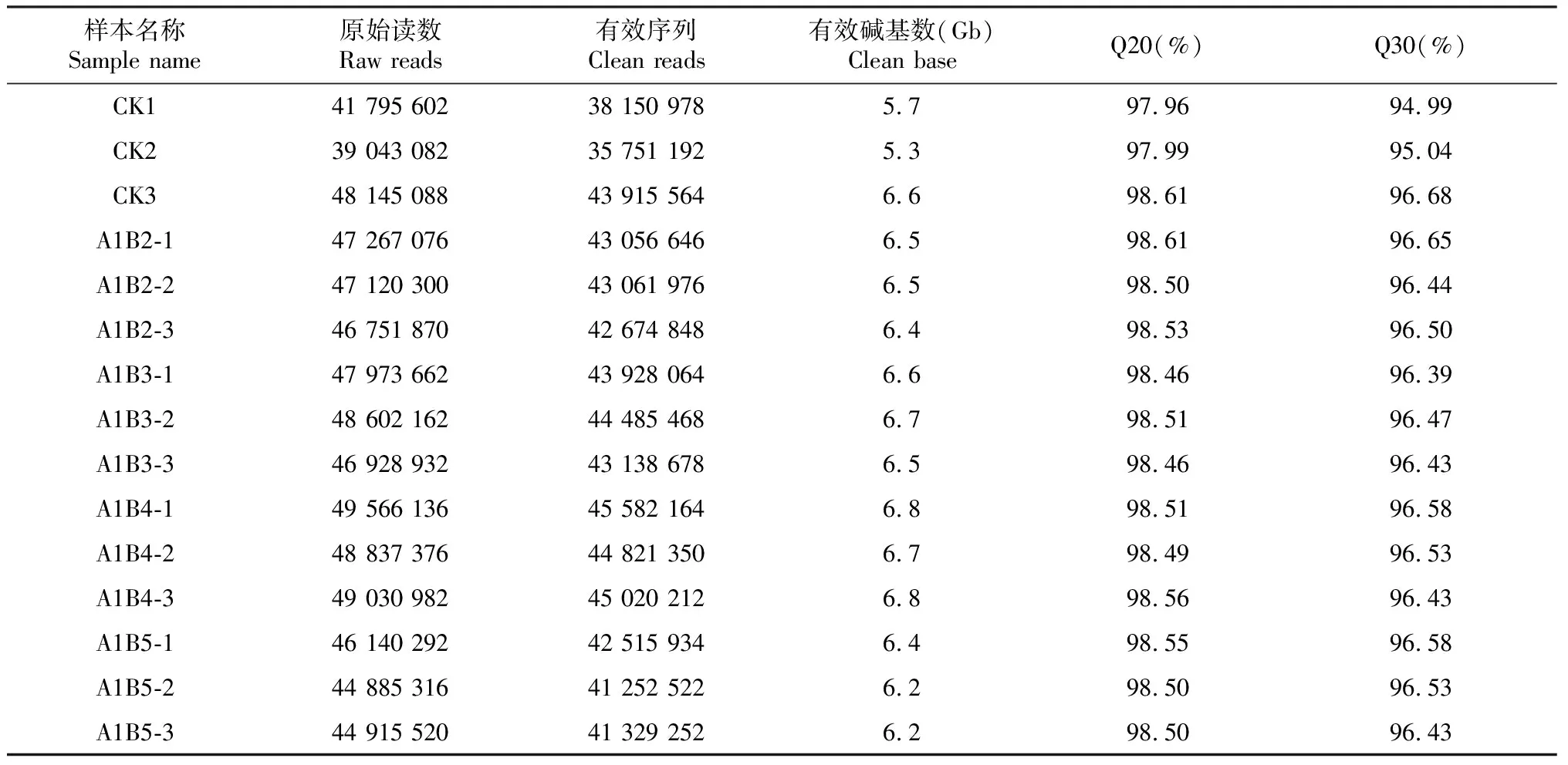
表2 样本测序质量
2.4 Unigene的功能注释
将所提取基因通过与NR数据库的比对(图4)发现,在马铃薯(Solanumtuberosum)中比对到同源序列的Unigenes最多,共10 303条,占总数的17.78%。其次为烟草(Nicotianatabacum),共8869条,占总数的15.31%。

图4 NR注释物种分类 Fig.4 NR annotated species classification
为进一步分析Unigene的功能,将枸杞Unigene库与KOG数据库进行比对,共获得71 122个KOG注释(图5),主要富集在普通功能预测(General functional prediction only,19 911个)、信号转导机制(Signal transduction mechanisms,4981个)以及翻译后修饰、蛋白转换、分子伴侣(Posttranslational modification,protein turnover,chaperones,4217个)。
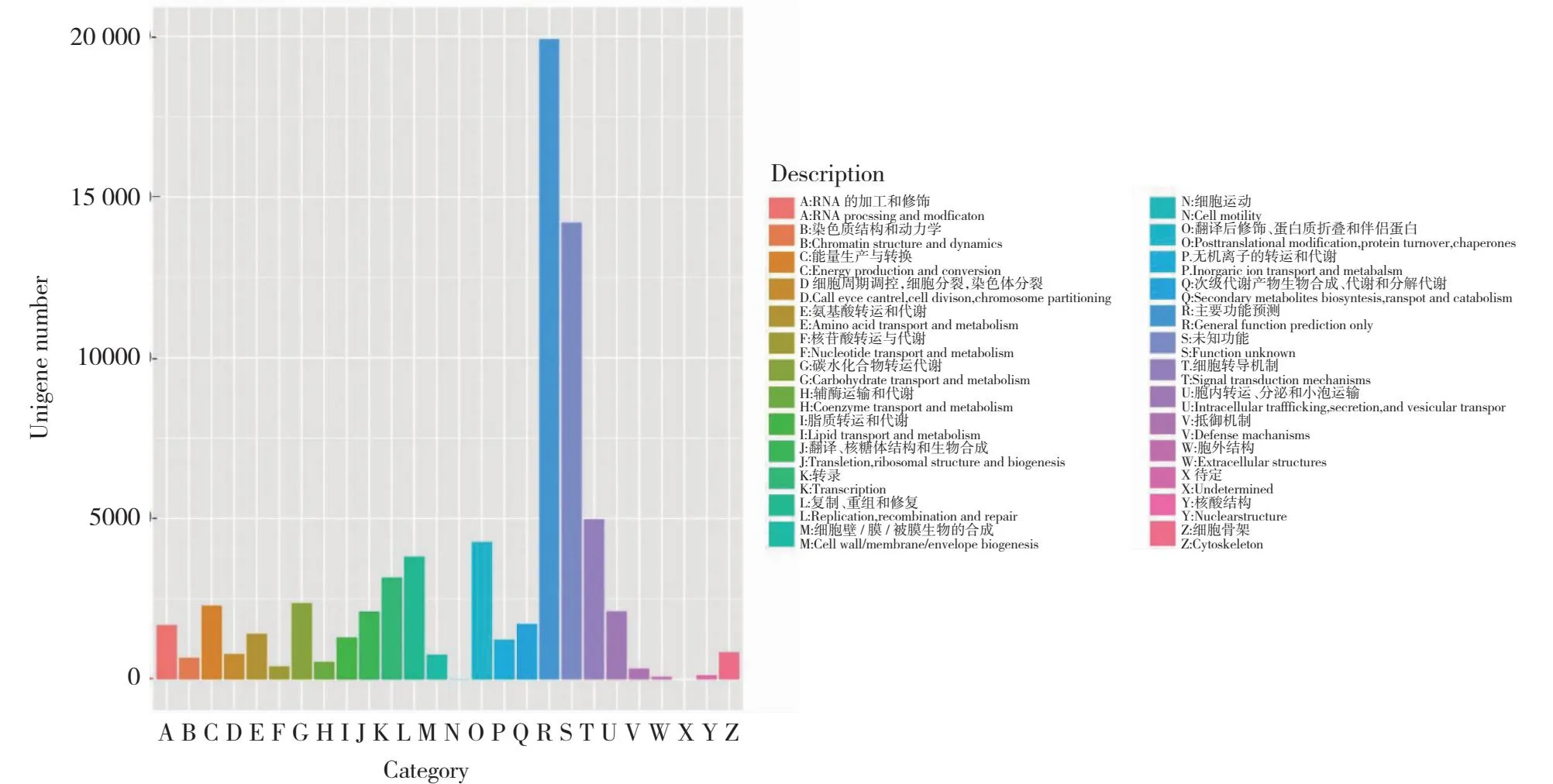
图5 KOG功能注释分类Fig.5 KOG functional annotation classification
2.5 差异表达基因筛选
为准确对差异基因进行功能分类,GO analysis 将显著性差异基因分配到不同的功能分类中,获得的GO数据库注释的Unigene可分为分子功能(Molecular function,MF)、细胞组分(Cellular component,CC)和生物过程(Biological process,BP)三大类别。
由表3可知,在施氮深度为0~20 cm处理中,施氮肥15 kg/666.7 m2(B2处理)与30 kg/666.7 m2(B3处理)的样品相对于CK来看,差异表达基因数分别为4263和6018个,且上调数量均明显高于下调数量;而施氮肥45 kg/666.7 m2(B4处理)差异表达基因数最高,但上调数目与下调数目的差异并不显著。

表3 表达差异分析结果
2.6 差异表达基因功能注释和富集分析
2.6.1 差异基因GO注释和分类 差异基因GO功能分析结果(表4)显示,与CK处理相比,A1B2处理共有3013个基因差异表达,A1B3处理共有3429个基因差异表达,A1B4处理共有2176个基因差异表达,A1B5处理共有1463个基因差异表达。

表4 显著差异基因的GO分析结果
在A1B2处理中,有9402条注释到生物过程(BP)(图6-A),主要富集在核酸模板转录调控过程(GO:0097659)、RNA生物合成过程(GO:0032774)等;7613条注释到分子功能(MF),主要富集在DNA结合转录因子活性(GO:0003700)、转录调节活性(GO:0140110)、木葡聚糖转移酶活性(GO:0016762)等;25 034条注释到细胞组分(CC),主要富集在细胞膜(GO:0031224)、质外体(GO:0071944)、光合膜(GO:0034357)。

图6 不同处理差异表达基因GO功能分析Fig.6 GO function analysis of differentially expressed genes in different treatments
在A1B3处理中,有4496条注释到生物过程(BP)(图6-B),主要富集在光合作用(GO:0015979)、木葡聚糖代谢过程(GO:0010411)、细胞壁大分子代谢过程(GO:0044036)等;3312条注释到分子功能(MF),主要富集在DNA结合转录因子活性(GO:0003700)、四吡咯结合(GO:0046906)、转录调节剂活性(GO:0140110)等;26 207条注释到细胞组分(CC),主要富集在膜的整体成分(GO:0016021)、细胞膜(GO:0016020)、光系统(GO:0009521)等。
在A1B4处理中,有2816条注释到生物过程(BP)(图6-C),主要富集在光合作用(GO:0015979)、蛋白-发色团连接(GO:0018298)、光合作用(GO:0019684)、氧脂素代谢过程(GO:0031407)等;4087条注释到分子功能(MF),主要富集在叶绿素结合(GO:0016168)、吡咯结合(GO:00469064)、DNA结合转录因子活性(GO:0003700)等;4094条注释到细胞组分(CC),主要富集在光合膜(GO:0034357)、类囊体部分(GO:0044436)、叶绿体类囊体膜(GO:0009535)等。
在A1B5处理中,有4416条注释到生物过程(BP)(图6-D),主要富集的过程有光合作用(GO:0015979)、碳水化合物代谢过程(GO:0005975)、氧化还原过程(GO:0055114)、木葡聚糖代谢过程(GO:0010411)等;3168条注释到分子功能(MF),主要富集在半乳糖苷酶活性(GO:0004565)、四吡咯结合(GO:0046906)、半乳糖苷酶活性(GO:0015925)等;3619条注释到细胞组分(CC),主要富集在细胞壁(GO:0005618)、光合膜(GO:0034357)、类囊体部分(GO:0044436)等。
2.6.2 差异表达基因KEGG注释 挑选CorrectedP-value<0.05时在每个对比组中最显著富集的前20条Pathway条目进行散点图绘制,共涉及35条通路。其中A1B2 VS CK对比组中,最显著富集的通路为植物激素信号转导(ko04075),其次是植物病原菌互作(ko04626)、MAPK植物信号通路(ko04016)以及核糖体(ko03010),分属于环境信息处理、生物系统、遗传信息处理三大类(图7-A);A1B3 VS CK对比组中,最显著富集的通路为内质网合成蛋白质(ko04141)、植物激素信号转导(ko04075)、植物病原菌互作(ko04626)以及MAPK植物信号通路(ko04016),分属于遗传信息处理、环境信息处理、生物系统三大类(图7-B);

图7 枸杞差异表达基因KEGG富集分析Fig.7 KEGG enrichment analysis of differentially expressed genes in Lycium barbarum
在A1B4 VS CK对比组中,最显著富集的通路是光合作用(ko00195)、植物激素信号转导(ko04075)、核糖体(ko03010)以及植物病原菌互作(ko04626),分别属于代谢作用、环境信息处理、遗传信息处理、生物系统四大类(图7-C);在A1B5 VS CK对比组中,最显著富集的通路是核糖体(ko03010)、糖酵解/糖原异生信号通路(ko00010)、植物激素信号转导(ko04075)以及光合作用碳固定(ko00710),分属于遗传信息处理、代谢作用、环境信息处理三大类(图7-D)。
2.6.3 枸杞果实甜菜碱代谢途径差异表达基因的分析 甜菜碱的合成主要经过两步脱氢氧化反应,即首先在胆碱单加氧酶(Choline monooxygenase,CMO)的催化下,将胆碱(Choline)氧化为甜菜碱醛(Betaine aldehyde dehydrogenase),再在甜菜碱醛脱氢酶(Betaine aldehyde dehydrogenase,BADH)的催化下将甜菜碱醛氧化为甜菜碱。胆碱单加氧酶和甜菜碱醛脱氢酶由核基因编码,定位于叶绿体中,因此甜菜碱主要合成部位为叶绿体,有部分研究表明,细胞质中也能合成部分甜菜碱[25]。
对差异基因进行GO分析,选取与甜菜碱合成相关的2条代谢通路进行分析,并对2条代谢通路中的关键差异表达基因进行筛选。由表5可看出,在与CK的对比下,A1B2处理中共有135个差异表达基因参与甜菜碱合成途径,80个为上调基因,55个为下调基因,该处理上调基因主要富集在磷酸转移酶活性(GO:0016773,69个)、单加氧酶活性(GO:0004497,17个);A1B3处理中共有62个差异表达基因参与甜菜碱合成途径,41个为上调基因,主要富集在单加氧酶活性(GO:0004497,37个)、磷酸转移酶活性(GO:0016775,4个);A1B4处理共有51个差异表达基因参与甜菜碱合成途径,其中19个为上调基因,主要富集在单加氧酶活性(GO:0004497,19个);A1B5处理共有62个差异表达基因参与甜菜碱合成途径,其中17个为上调基因,主要富集在单加氧酶活性(GO:0004497,17个)。根据参与枸杞甜菜碱合成途径的差异表达基因以及差异基因上调与下调数目,可以初步判断A1B2处理对枸杞果实甜菜碱合成相关基因的调控效果更显著。
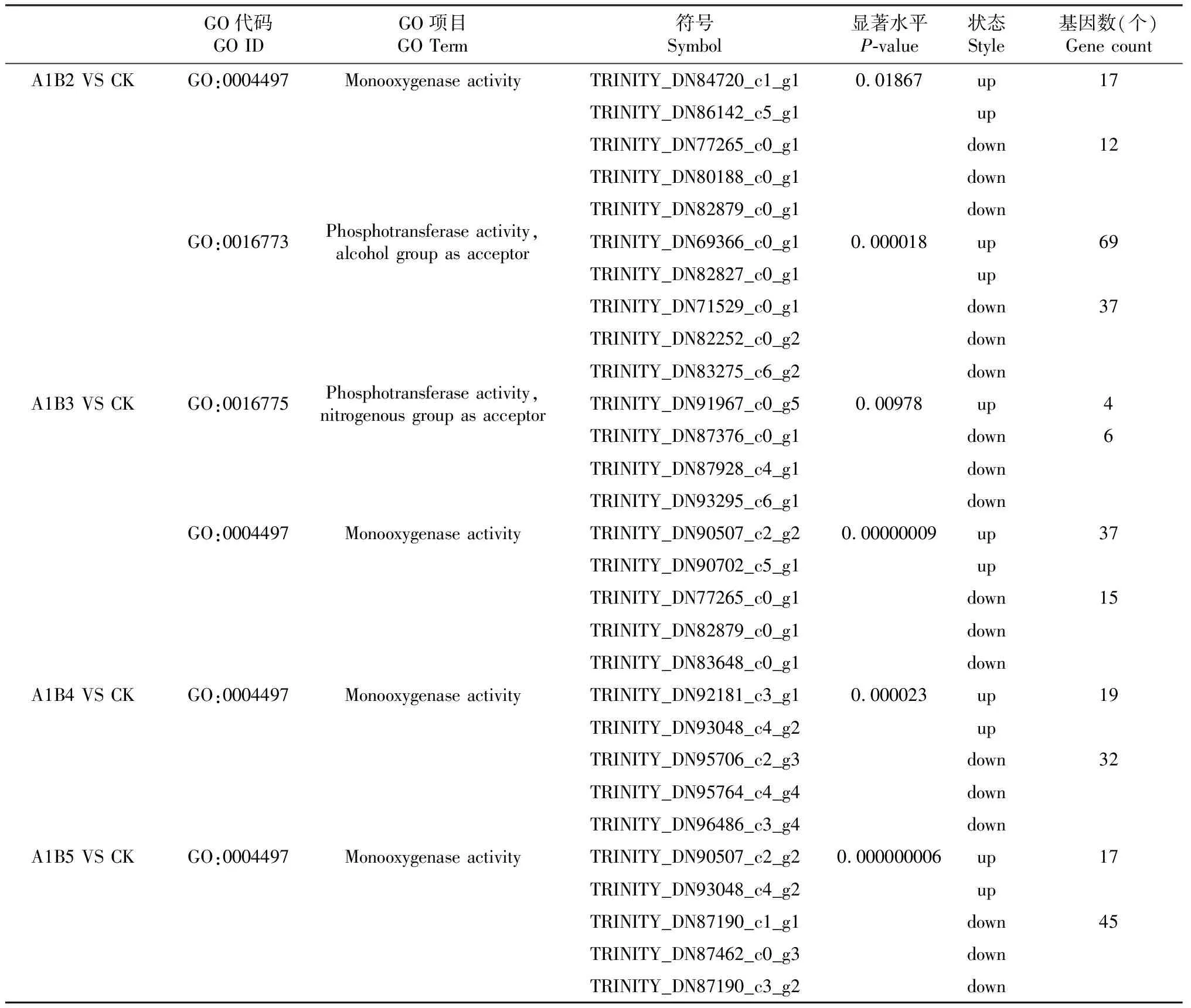
表5 不同处理条件下枸杞果实甜菜碱代谢途径差异表达基因
由表5可看出,随着施氮量的变化,枸杞果实甜菜碱合成途径的差异表达基因也各不相同,这些与甜菜碱、及相关代谢酶的合成与分解的基因表达量的变化导致枸杞果实中甜菜碱含量发生变化。说明影响枸杞果实甜菜碱含量及其代谢通路、枸杞果实甜菜碱相关代谢酶含量等的重要因素之一可能是基因表达的差异性。
3 讨 论
对于枸杞来说,氮素是整个生长过程中需求量最大的养分元素,因此,施氮量的多少是决定枸杞果实各项品质指标的重要影响因素之一。宋仰超等[28]研究表明,适量施氮量与水的配比,能够有效提高枸杞果实的百粒重及其外观指标,最大限度提高枸杞产量及其经济效益,刘敏等[29]研究结果也与其相近。黄婷等[30]研究表明,不同施肥配比方案,枸杞果实内多糖、甜菜碱等物质的含量也会随之发生变化。本研究表明,在施氮量为15 kg/666.7 m2时,枸杞果实内甜菜碱含量最高。
进一步分析甜菜碱合成相关酶的基因表达差异发现,随着施氮量的增加,参与甜菜碱合成途径的磷酸转移酶(Phosphotransferase activity)活性和单加氧酶(Monooxygenase activity)活性的编码基因表达量均基本上调,表明施氮量可能通过调控磷酸转移酶、单加氧酶等与甜菜碱合成相关酶活性的基因,从而调控枸杞果实中甜菜碱的含量。
据已有研究可知,甜菜碱的生成部位主要有叶绿体和细胞质,光诱导能促进其生成[31]。5个处理中,注释基因主要富集在光合作用、质外体、单加氧酶活性、叶绿素、四吡咯结合酶活性等过程中;且对差异表达基因进行KEGG注释后,发现差异基因信号通路显著富集在植物极速信号传导、核糖体、植物病原菌互作中。表明加施氮肥能够明显影响作物叶绿素合成相关基因的表达、相关酶活性基因的表达以及与光和反应相关基因的表达等。结合各个处理果实中甜菜碱的含量,推测氮素可能通过调控枸杞叶绿素合成过程中所参与的各部位及酶活等,从而调控甜菜碱的含量。林一凡等[32]研究表明适量的缓释氮肥能够有效提高香蕉苗的养分积累量、光合作用等,从而提高其生物量。王乐等[33]研究表明,在苗期合理增施一定量的氮肥,能够明显促进燕麦生长以及叶绿素体色素的合成。桑姝丽等[34]研究表明,适量增施恰当品种的氮肥,能够明显提高青萝卜肉质根中叶绿素的含量。本试验结果均与以上研究结果一致。
4 结 论
适量氮肥能够提高枸杞甜菜碱含量以及与甜菜碱合成相关酶的含量;通过转录组测序分析,发现单加氧酶合成途径上有90个上调的差异表达基因,说明可能在基因方面一定程度调控了枸杞甜菜碱的合成。关于这些差异表达基因是否是由于氮素的调控从而影响枸杞果实甜菜碱合成及相关酶的含量,需要进一步进行试验验证。
