青海茄参光合相关抗寒基因的初步筛选
2024-03-13赵艳艳
王 成,赵艳艳
(1. 青海大学农牧学院,西宁 810016; 2. 青海大学省部共建三江源生态与高原农牧业国家重点实验室,西宁 810016)
【研究意义】青海茄参(MandragorachinghaiensisKuang et A. M. Lu)是茄科多年生草本植物,生于海拔4000 m左右的河滩草地、岩石缝或林下等。青海茄参在自然环境下的生存条件极其恶劣,它在8 ℃下能完成正常的生命周期,在2 ℃下器官组织生长较小,但不会死亡。研究表明,茄科植物体内蕴藏着丰富的抗寒基因,如陈世伟[1]、张田田[2]和王恩旭[3]团队研究的番茄抗寒基因SlCR1、SlHY5、GGR、XTH3、P-p和NAC2,以及朱文超[4]团队研究的辣椒抗寒基因CaAQP等。青海茄参作为一个在高海拔、低温度环境下生长的茄科植物,推测其体内蕴含丰富的抗寒基因。【前人研究进展】目前国内外对青海茄参的研究甚少,本研究前期相继对其进行了低温胁迫下的叶片转录组测序分析,青海茄参MYB、AP2、WRKY家族成员的理化特性分析、信号肽分析、亚细胞定位、蛋白保守结构域的分布、跨膜结构域分析、二级结构分析及低温胁迫下部分转录因子表达情况分析[5-6],种子萌发特性分析[7]以及不同组织营养品质分析[8],现阶段开始进行抗寒基因的筛选与功能验证。随着测序技术的发展,越来越多物种的基因组被测定,基因组学技术愈发成熟[9]。青海茄参作为尚未公布基因组序列的物种,利用转录组测序可以快速高效地呈现出准确度高的信息[10]。利用转录组测序技术(RNA-seq)开发EST-SSR标记,逐渐成为一种低成本、高效率的技术,该技术已经在植物品种鉴定方面广泛应用[11]。目前,转录组学在植物系统分类、物种鉴定以及遗传多样性分析等方面均取得了一定的进展,在植物系统学的研究中发挥着极其重要的作用[12]。温度对植物光合作用的影响程度较大,温度过高、过低以及持续长短都会影响植物光合作用的正常进行,低于临界温度的低温胁迫会直接伤害植物的光合机构,降低光能的同化率,增加热辐射消耗的比例,对植物内部器官造成严重伤害。研究表明,随着低温胁迫时间的延长,大多数光合参数会持续下降,当温度恢复正常时,下降参数则会有不同程度的回升[13-14]。叶绿素荧光信号由植物体内发出,并且具有丰富的光合作用信息,可以利用叶绿素荧光参数研究植物在低温胁迫下的光合作用[15]。低温胁迫影响叶片光能的吸收、转换与光合电子传递,使过剩能量积累于光系统Ⅱ反应中心,损伤植物叶片光合器官。研究表明,随着低温胁迫的延长,植物叶片的PSⅡ最大光化学效率(Fv/Fm)显著下降,电子传递速率(ETR)减慢,非光化学淬灭系数(NPQ)先上升后下降[16-19]。【本研究切入点】我国粮食主产区主要分布在东半部地区,限制西部地区粮食作物如茄科茄属马铃薯的主要原因是西部高海拔、低温度的地理环境。我国基因库亟需优质的抗寒基因以发展西部农业。本研究前期虽然首次测定了青海茄参的转录组和代谢组,但未深入挖掘具体的基因功能和作用机理,光合作用与温度密切相关,植物受到低温胁迫时光合作用变化明显,易寻找关键时间节点。【拟解决的关键问题】本研究通过光合生理试验确定了分析转录组的关键时间节点,在低温胁迫下的青海茄参叶片转录组数据中的数千个差异基因中筛选出候选基因,为下一步的转基因功能分析提供理论依据,以期为我国逆境农业栽培提供新鲜血液,为基因库提供更优质的抗寒基因。
1 材料与方法
1.1 试验材料
光合生理试验材料:2022年8月青海省果洛藏族自治州达日县(99°11′15″ E,33°15′15″ N)选取野外生长健康强壮且无病虫害的野生青海茄参种子进行组织培养。
转录组分析叶片样本:2022年采集的野生青海茄参叶片放于人工气候箱0 ℃(12 h/12 h光周期,光照强度12 000 Lx)低温处理12 h,为避免昼夜节律变化的影响,于上午8:00开始低温处理,在0 h(常温样品)、12 h 2个时间点分别采样,每个时间点设3个生物学重复,采集生长点下完全展开叶,液氮速冻后储存于-80 ℃冰箱中备用。
1.2 光合生理试验
1.2.1 光合生理材料的培养与胁迫处理 种子的消毒工作和培养基选择借鉴段红俊等[7]的方法,用100 mg/L的GA3激素浸泡16 h,接种前用75%的乙醇消毒30 s后用无菌水清洗2次,转入20%NaClO消毒剂中消毒30 s,后用无菌水清洗2次,最后将种子均匀放置在灭菌滤纸上,等其表面水分完全被吸干后接种于涂好1/2 MS培养基的培养瓶中,每瓶8粒种子。将培养瓶放在人工气候箱中,培养条件为:光照强度12 000 Lx,光周期16 h/8 h,昼夜温度均为25 ℃,相对湿度70%。
试验0 ℃低温处理依据:根据其正常生长条件得知,青海茄参在8 ℃时可以正常发育并开花,2 ℃下叶片虽然不会死亡,但各组织生长较小,已有低温胁迫迹象。本次试验结合试验室条件决定以0 ℃作为低温胁迫处理温度。
培养3个月后,选取长势健康一致、无病变,且叶片≥4的组培植株5株进行0 ℃低温处理(光照强度12 000 Lx,光周期16 h/8 h,昼夜温度均为0 ℃,相对湿度70%),并选取5株进行常温对照(光照强度12 000 Lx,光周期16 h/8 h,昼夜温度均为25 ℃,相对湿度70%)。
1.2.2 叶片光合与叶绿素荧光参数测定 测定低温处理0、2、4、8、12和24 h 6个时间点以及常温对照的组培青海茄参植株的光合与叶绿素荧光参数。用Yaxin-1102便携式光合蒸腾仪测定气孔导度(Gs)、蒸腾速率(Tr)、净光合速率(Pn)、胞间CO2浓度(Ci)。每个处理选5株,每株选取4片叶子,每片叶子测3个重复,即每个时间点60个重复。用JUNIOR-PAM荧光仪测定荧光参数: 初始荧光强度(Fo)、最大荧光强度(Fm)、PSⅡ最大光化学效率(Fv/Fm)、光化学猝灭系数(qP)、非光化学猝灭系数(qN)、电子传递速率(ETR)。每个处理选5株,每株选取4片叶子,每片叶子测3个重复,即每个时间点60个重复。
1.2.3 数据处理 采用SPSS 17.0进行数据处理分析,以LSD法进行差异显著性分析,显著性水平设定为P<0.05,采用Excel软件作图。
1.3 转录组测序及候选基因筛选
1.3.1 叶片总RNA提取 将0 h (常温样品)和12 h的叶片样本进行转录组分析,每个时间点选取5片叶混合研磨后置于冻融管保存,委托北京诺禾致源科技股份有限公司进行转录组测序。
1.3.2 候选基因筛选 使用Trinity(v2.4.0)软件和Corset软件对转录本进行拼接和聚类处理,以获取用于后续分析的Unigenes。通过NCBI Blast(2.2.28+)将Unigenes比对到NR数据库得到该Unigenes的功能注释,并对获得Unigenes进行基因的GO注释和KEGG注释。随后通过KEGG注释得到的通路筛选出光合相关代谢通路,进一步筛选出通路中的差异表达基因,以此初步筛选出可能参与青海茄参低温胁迫表达的候选光合相关抗寒基因。
1.4 实时荧光定量试验
通过转录组数据分析,在光合作用和光合作用-天线蛋白2个通路中筛选出响应耐寒机制的7个差异表达基因,根据这7个候选基因的转录组核苷酸序列,利用Primer 5软件设计实时荧光定量引物,进而利用实时荧光定量PCR(qRT-PCR)分析基因在青海茄参低温胁迫过程中的表达情况,引物由上海生工生物工程技术服务有限公司合成(表1)。
2 结果与分析
2.1 低温对青海茄参光合参数的影响
从图1可知,0 ℃低温胁迫对青海茄参叶片的净光合速率(Pn)影响较大,整体呈下降趋势,尤其是8~24 h下降幅度激增,推测12 h左右青海茄参光合相关通路发生了重要反应;0 ℃低温胁迫对于青海茄参气孔导度(Gs)的影响在处理前期不明显,虽然整体呈下降趋势,但在8~12 h时下降幅度最大,说明青海茄参叶片对于低温的敏感时期在8~12 h左右;0 ℃低温胁迫对于青海茄参叶片胞间CO2浓度(Ci)的影响较为明显,整体呈上升趋势且在8~12 h时上升幅度最大,推测青海茄参叶片在低温处理8~12 h左右时光合效率显著降低,导致胞间CO2积累量较多;0 ℃低温胁迫对青海茄参叶片蒸腾速率(Tr)的影响整体呈下降趋势,在8~12 h时下降幅度最大,且在12 h后变化程度趋于平稳,推测青海茄参叶片在低温处理8~12 h左右时光合相关通路发生重要反应导致光合效率明显降低,蒸腾速率急剧下降。
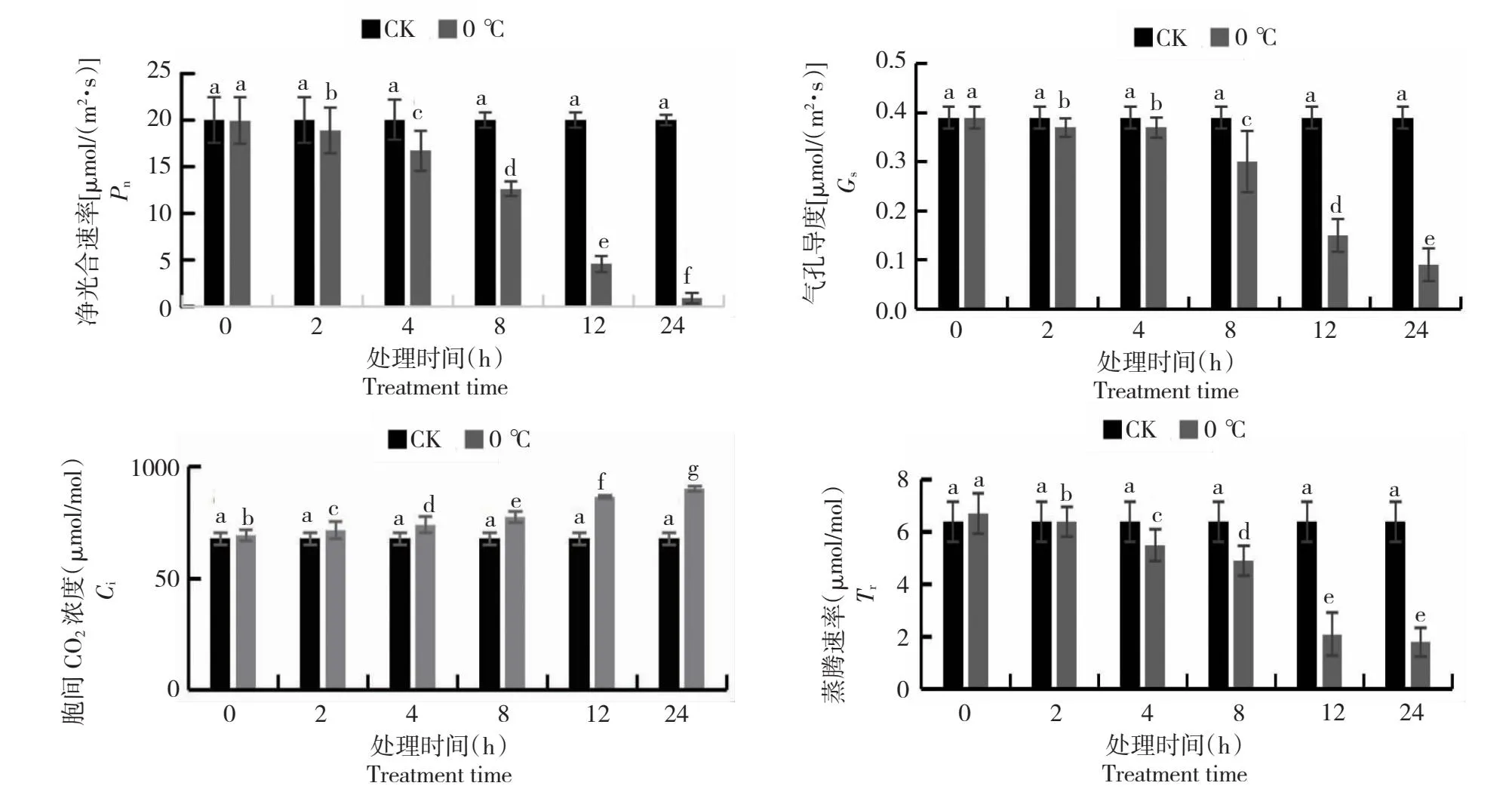
不同小写字母代表在P<0.05水平上差异显著。下同。Different lowercase letters represent significant differences at the P<0.05 level. The same as below.
2.2 低温对青海茄参叶绿素荧光参数的影响
从图2可知,随着0 ℃低温胁迫处理时间的增加,青海茄参叶片的初始荧光值(Fo)呈逐渐上升趋势,且在8~12 h上升幅度最大,在0 ℃低温胁迫处理4~24 h的过程中,青海茄参叶片的Fo值显著高于对照组,说明低温胁迫下的青海茄参叶片光系统Ⅱ反应中心受到了严重破坏;随着0 ℃低温胁迫处理时间的增加,青海茄参叶片最大荧光值(Fm)呈下降趋势,且在8~12 h下降幅度最大。在0 ℃低温胁迫处理2~24 h的过程中,青海茄参叶片的Fm值显著低于对照组;随着0 ℃低温胁迫处理时间的增加,青海茄参叶片光系统Ⅱ最大光化学效率(Fv/Fm)呈下降趋势,且在4~8 h下降幅度最大,在0 ℃低温胁迫处理4~24 h的过程中,青海茄参叶片的Fv/Fm值显著低于对照组;随着0 ℃低温胁迫处理时间的增加,青海茄参叶片的qP值有明显的下降趋势,且在8~12 h下降幅度最大,在0 ℃低温胁迫处理4~24 h的过程中,青海茄参叶片的qP值显著低于对照组,由此说明,低温胁迫下,青海茄参叶片的电子传递受到了较大程度的抑制;随着0 ℃低温胁迫处理时间的增加,青海茄参叶片的qN值上升趋势明显,且在8~12 h上升幅度最大,在0 ℃低温胁迫处理4~24 h的过程中,青海茄参叶片的qN值显著高于对照组。由此说明,0 ℃低温胁迫下青海茄参叶片天线色素吸收的光能大部分没有被利用,而是以热能形式消耗掉;随着0 ℃低温胁迫处理时间的增加,青海茄参叶片的ETR值有明显的下降趋势,且在8~12 h下降幅度最大,在0 ℃低温胁迫处理4~24 h的过程中,青海茄参叶片的ETR值显著低于对照组,说明青海茄参叶片的电子传递效率受到了严重抑制。
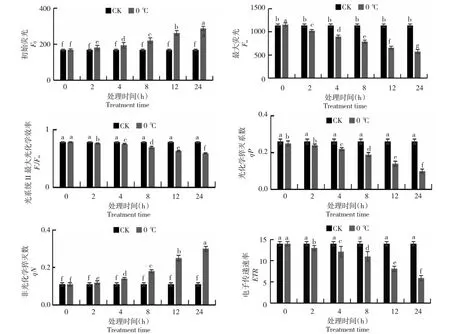
图2 低温对青海茄参叶绿素荧光参数的影响Fig.2 Effect of low temperature on chlorophyll fluorescence parameters of Qinghai eggplant ginseng
2.3 转录组数据分析筛选光合相关抗寒基因
2.3.1 青海茄参叶片差异表达基因筛选 对转录本进行组装和聚类,得到了55 663个Unigenes。以FPKM>0.3为基因表达标准,在0 ℃低温胁迫0和12 h的青海茄参叶片样品转录组数据中分别筛选出31 084和29 697个基因,其中2个处理共有基因23 630个,只在0 h样本中表达的基因有7454个,只在12 h样本中表达的基因有6067个。
为探究青海茄参的抗寒分子机制,以padj<0.05且|log2(fold change)|>1作为显著差异表达阈值,对0 ℃青海茄参叶片低温胁迫12 h前后的差异基因谱图进行全面的分析鉴定。之后从55 663个Unigenes中鉴定出1919个上调表达差异基因和995个下调表达差异基因。将差异表达基因进行KEGG富集分析,筛选出差异代谢通路240条,选择与光合作用相关的光合作用-天线蛋白通路和光合作用通路进行基因筛选,对通路中的差异表达基因进行差异表达程度、高同源性基因研究等方面综合筛选出候选基因。
2.3.2 光合作用-天线蛋白通路候选基因筛选 在光合作用-天线蛋白通路(图3)中筛选出CAB-8(Cluster-10474.16694)、CAB-11(Cluster-10474.17761)和CP24-10B(Cluster-10474.17028)3个差异基因。
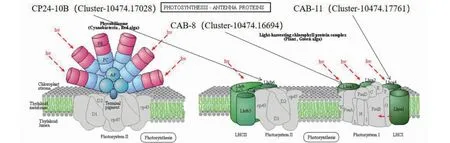
图3 光合作用-天线蛋白通路Fig.3 The photosynthesis antenna protein pathway
2.3.3 光合作用通路候选基因筛选 在光合作用通路(图4)中筛选出CH-02(Cluster-10474.17880)、FD-C2(Cluster-10474.17210)、CP-43(Cluster-10474.20814)和PSI-D2(Cluster-10474.17465)4个差异基因。
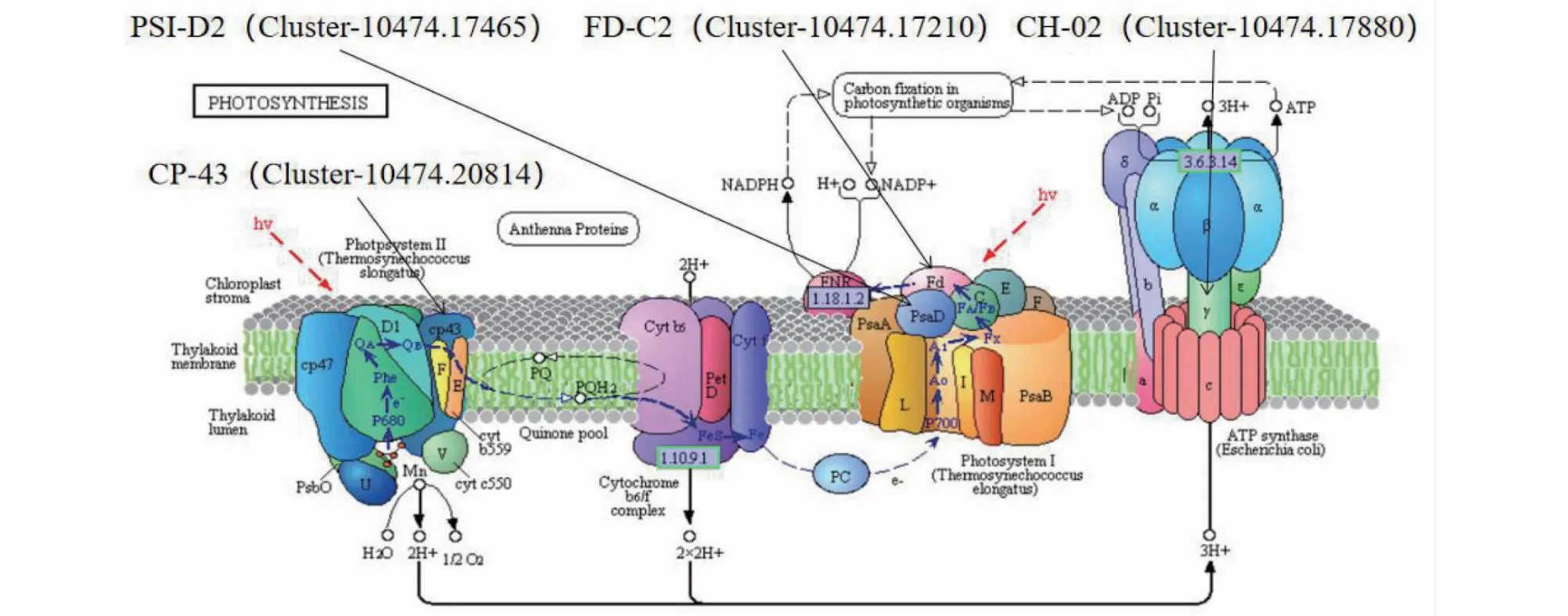
图4 光合作用通路Fig.4 The photosynthetic pathway
2.4 候选基因荧光定量分析
2.4.1 实时荧光定量引物筛选 用Primer 5软件设计的实时荧光定量引物(表1)进行PCR特异性筛选(图5),结果表明荧光引物特异性较好,无引物二聚体,可用于后续的实时荧光定量PCR实验。
M: 2000 bp DNA marker; 1:叶绿素a-b结合蛋白CAB-8引物;2:叶绿素a-b结合蛋白CAB-11引物;3:叶绿素a-b结合蛋白CP24-10B引物;4:叶绿体ATP合酶γ链Ch-02引物;5:光系统I反应中心亚基II PSI-D2引物;6:铁氧还蛋白Fd-C2引物;7:光系统II反应中心蛋白CP43引物。M: 2000 bp DNA marker; 1: Chlorophyll a-b binding protein CAB-8 primer; 2: Chlorophyll a-b binding protein CAB-11 primer; 3: Chlorophyll a-b binding protein CP24-10B primer; 4: Chloroplast ATP synthase γ chain Ch-02 primer; 5: Photosystem I reaction center subunit II PSI-D2 primer; 6: Ferredoxin Fd-C2 primer; 7: Photosystem II reaction center protein CP43 primer.
2.4.2 基因表达调控分析 将选出的7个差异表达基因利用实时荧光定量PCR(qRT-PCR)分析基因在青海茄参低温胁迫过程中的表达情况,以18S rRNA作为内参基因设置实时荧光定量程序。结果分为两类(图6),第一类是CP43的表达先上升后下降,整体呈上升趋势,在12 h时表达量达到最高,且在8~12 h上升幅度最大;第二类是CAB-8、CAB-11、CP24-10B、CH-02、PSI-D2和Fd-C2的表达先下降后上升,整体呈下降趋势,在12 h表达量达到最低,其中CAB-8和CAB-11在2~4 h下降幅度最大,而CP24-10B、CH-02、PSI-D2和FdC2在0~2 h下降幅度最大。初步推测0 ℃低温胁迫2和12 h为青海茄参光合相关抗寒基因关键表达时间节点。
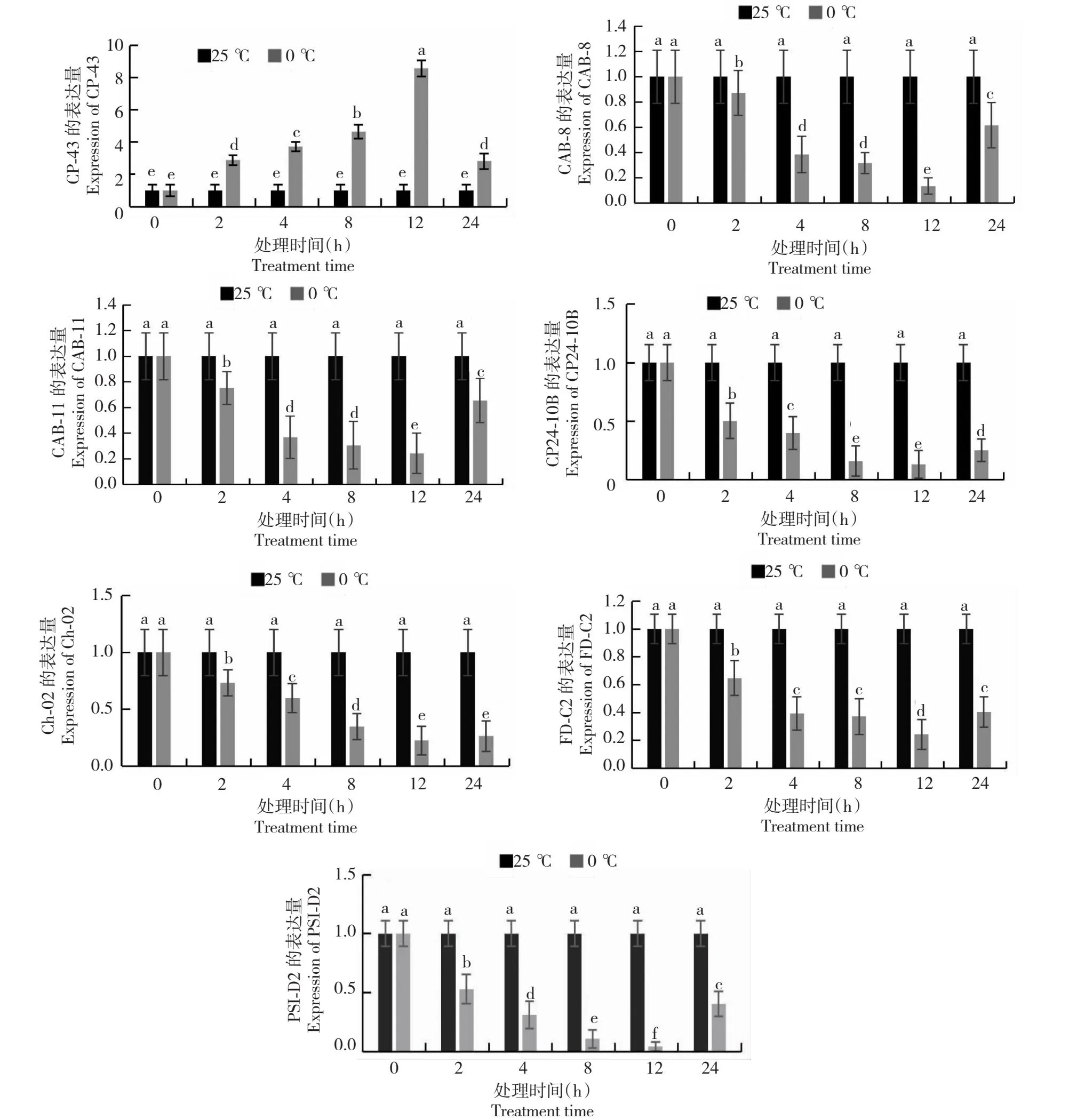
图6 青海茄参低温胁迫下相关基因表达量分析Fig.6 Analysis of the expression levels of related genes in Qinghai eggplant ginseng under low temperature stress
3 讨 论
本研究中,0 ℃低温对于青海茄参叶片的净光合速率、气孔导度、胞间CO2浓度以及蒸腾速率影响都很大,且明显变化时间都在8~12 h左右,通常认为植物在受到逆境胁迫时,净光合速率下降是由2种因素引起:气孔因素或非气孔因素[20-21]。气孔因素指气孔关闭导致胞间CO2浓度降低从而降低光合能力,净光合速率下降。非气孔因素指气孔导度下降的同时胞间CO2浓度上升,这一类导致净光合速率下降的原因是植物体内发生了反应。本试验结果表明,在低温胁迫下青海茄参叶片的净光合速率下降是由非气孔因素引起的,说明光合相关通路在关键时间点发生了重要反应。
0 ℃低温对于青海茄参叶片的初始荧光、最大荧光、光系统Ⅱ最大光化学效率、光化学猝灭系数、非光化学猝灭系数以及电子传递速率影响程度较大且响应速度快于光合参数,明显变化时间都在8~12 h左右,Fo值上升表明光系统Ⅱ反应中心发生可逆失活或被破坏[22],Fv/Fm值降低表明植株叶片发生了光抑制[23],qP值下降体现出原初电子受体的电子传递受到抑制[24],qP值下降表明0 ℃低温胁迫下青海茄参叶片天线色素吸收的光能大部分都没有被利用,而是以热能形式消耗掉[25],ETR为光合电子传递速率,是光合作用中光能转化最大效率的一种度量,可以反映光合机构机能的变化[26-27]。结合光合参数最终分析决定以12 h为关键节点进行后续实验。
通过光合作用直接通路和光合关联代谢通路的分析得到的差异基因,经过实时荧光定量结果与光合及叶绿素荧光参数变化的分析对比,推测7个基因(CAB-8、CAB-11、CP24-10B、CH-02、FD-C2、CP-43和PSI-D2)都有可能是光合相关抗寒基因,分析其家族功能具体如下。
光捕获叶绿素a/b结合蛋白(Chlorophyll a/b binding protein,Cab)是一类能捕获光能,并将转化为电能的光能传递到光反应中心引起光化学反应的色素蛋白,这些蛋白复合体由色素结合蛋白与色素结合而成,然后通过色素结合蛋白的跨膜区将其锚定在类囊体膜上,且高等植物进行光合作用时光能的捕获与传递主要是通过Cab来完成[28-29]。在高等植物中,Lhc家族基因可以调控光合作用,光合作用是响应植物低温胁迫以及维持植物生存的重要环节,而CAB-8及CAB-11在代谢通路中分别属于Lhca3和Lhca4两个Lhc基因家族的亚家族,参与调控光合作用[30]。叶绿素结合蛋白CP24在调节光合作用中起着重要作用,缺少CP24的植株光合速率和生长速率会明显下降。研究表明,一定数量的叶绿素等色素分子与CP24结合,可以保持其稳定性和活性。弱光下叶绿素与CP24结合量增加,以吸收光子,保护光合器官;强光下胡萝卜素与CP24结合量增加,发挥光保护作用;黑暗下叶绿素和CP24积累迅速减少,即也有一定胁迫保护作用[31-37]。
通过代谢通路分析可知,CH-02基因位于ATP合酶y链上,此处ATP合酶分布于叶绿体类囊体上,参与光合磷酸化等重要过程,且有研究发现ATP合酶在低温胁迫下有着重要调控作用[38]。铁氧还蛋白(Fd)是一类参与光合电子传递的低分子量的酸性电子传递蛋白。光合型Fd参与多种依赖光的代谢调节过程,因为其可以将光激发电子从光系统I传递给各种相关酶。有研究表明,Fd表达水平的改变能够改变植物对低温胁迫的抗性[39]。光合系统主要分为光系统I和光系统II,光系统II是一个独立的复合体,可分为天线和核心两部分。天线系统由Lhca和Lhcb两种捕光色素蛋白复合物组成,Lhcb与50个叶绿素a分子结合并与反应中心紧密结合成内周天线系统CP43[40]。通过代谢通路分析可知,PSI-D2位于PsaD上,光系统I有3个膜外在的亚基:PsaC、PsaD和PsaE,三者均位于光合系统I基质外侧,以提供铁氧还蛋白的停靠点。亚基PsaD位于靠近连接区的基质峰附近,从PSI到铁氧还蛋白的电子转移至关重要[41],PsaD通过1个短环连接到1个α螺旋上与PsaA和PsaC形成相互作用,两者分别是光系统I最重要的亚基和最重要的外部亚基,PsaA含有大部分天线蛋系统的叶绿素和类胡萝卜素以及大部分辅助因子,而PsaC与PSI核心对接以及通过形成PsaC嵌入基质隆起与PsaE和PsaD相作用[42-43]。因此亚基PsaD是光系统I不可或缺的部分。研究证明,光系统I被证明可以通过循环电子传递进行吸收光的光化学和非光化学猝灭,从而起到保护光合器官的作用,还有研究发现替代电子传递途径可能在此过程中发挥一定作用[44-45]。
4 结 论
通过低温胁迫光合生理试验确定了青海茄参光合相关抗寒基因响应的关键时间节点为12 h,对在关键时间节点的转录组数据分析后筛选出的7个基因进行了实时荧光定量试验,分析出不同时间节点的基因表达量。本研究确定了候选基因,为后续的基因功能验证提供了一定理论基础。
