根际细菌群落结构对黄瓜幼苗干旱胁迫的响应
2024-03-13赵文麟张新梅解志强张应华许俊强
王 灿,赵文麟,张新梅,许 彬,罗 文,解志强,张应华,许俊强
(1. 云南农业大学/云南省滇台特色农业产业化工程研究中心,昆明 650201;2. 文山州农业科学院,云南 文山 663000;3.云南农业大学云南省蔬菜生物学重点实验室,昆明 650201)
【研究意义】黄瓜(CucumissativusL.)为葫芦科黄瓜属蔬菜作物,是中国主要栽培的蔬菜种类之一[1]。干旱严重限制作物的生长致使作物产量和品质下降,是世界粮食安全和作物生产力的主要制约因素之一[2]。但由于黄瓜苗期根系不发达,生长需水量较大,对水分反应敏感,缺水会严重影响黄瓜幼苗的生长质量[3]。因此提高黄瓜抗旱性促进生长质量是保障黄瓜种植产业健康发展的重要措施之一。【前人研究进展】大量研究表明,植物根际微生物通过直接或间接途径参与植物的生长和发育,同时协助植物抵御逆境胁迫(非生物及生物)。干旱胁迫下作物可以与相关的根际微生物(特别是能对土壤环境变化迅速响应的各种根际微生物群落)建立正向联系,从而提高抗性,缓解干旱胁迫导致的损伤[4]。韦海波等[5]研究表明,干旱对长雄野生稻根际微生物群落结构多样性指数无显著影响,但显著改变了微生物群落整体组成,同时显著提高相关抗旱微生物丰度。Piccoli等[6]对阿根廷圣路易斯省西南区收集的含羞草科牧豆树属植物(Prosopisstrombulifer)根部微生物群落进行检测,发现并分离获得大量有益细菌,如恶臭假单胞菌(Pseudomonasputid)、芽孢杆菌(Bacillus)、梭状赖氨酸芽孢杆菌(Lysinibacillusfusformis)等。同时将这些微生物接种到植株根际可显著增加植株体内ABA含量进而提高抗干旱能力,这一结果有望作为优质的外源ABA提供者接种于植物根系土壤提高植物抗旱能力[7-8],同时可将其制作为农用微生物有机肥应用到干旱、半干旱地区土壤改良和作物生长中。方静[9]研究表明,耐旱春小麦能够增加放线菌门和奇古菌门(Thaumarchaeota)等根际抗旱相关有益微生物的相对丰度,能够通过特定的信号传导通路刺激耐旱春小麦抗旱相关基因的表达,使其更能适应干旱环境。可见微生物在植物抵御逆境中发挥着重要作用,在农业生产中有着巨大利用潜力,因此认识根际微生物群落对干旱环境扰动有何响应、干旱环境下植物-根际微生物互作关系,以及如何在农业生产中高效利用是当前研究的重点。【本研究切入点】目前,大量研究表明干旱对黄瓜生理代谢、酶活性、转录组表达有显著影响,但干旱对黄瓜根际微生物群落组成是否有影响、微生物对黄瓜干旱环境扰动有何响应及微生物对异常环境的指示作用等方面研究鲜见报道。【拟解决的关键问题】以黄瓜秧苗为研究对象从根际微生物群落多样性角度探讨干旱对黄瓜秧苗根际土壤细菌群落结构和功能的影响,挖掘可能在干旱胁迫下对黄瓜秧苗生长有正向反馈的土壤有益微生物,为黄瓜抗旱育种、栽培研究提供新思路。
1 材料与方法
1.1 试验材料
供试黄瓜品系‘99-1’是雌性系高代自交材料,由云南农业大学滇台中心提供,抗旱能力表现为良好。
育苗基质土为设施大棚内种植红土与育苗基质按体积1∶1的混合土,混合土有效氮301.53 mg/kg、有效磷89.34 mg/kg、有效钾370.59 mg/kg、pH 5.71,经托普云农TZS-3X土壤水分检测仪检测土壤最大持水量(灌满水饱和状态下,待土壤中重力水排除后的数值)为39%。
供试仪器:凝胶电泳系统、离心机,Bio-Rad公司生产;NovaSeq PE250 仪器,Illumina 公司生产。
1.2 试验设计
试验于2021年9月至2022年6月在文山州农业科学院人工气候室内进行。55~60 ℃温水浸泡黄瓜种子15 min,常温浸种4~6 h后转移至28 ℃恒温箱黑暗催芽,露白后播种于装有基质的塑料穴盘(28孔,每孔规格为5 cm×5 cm×5 cm)中,昼夜温度设置为(27±1) ℃常规管理。幼苗长至3~4叶时,使用托普云农TZS-3X土壤水分检测仪监测土壤含水量,待含水量自然下降到基质土壤最大含水量的60%~70%时进行干旱试验。试验共设置2个处理,分别为处理D(基质土最大含水量的60%~70%)和处理N(基质土最大含水量的80%~90%)。处理时长为7 d,期间动态监测基质土的水分变化,控制各处理的基质土含水量保持在既定范围。处理结束后,每盘选取整齐一致的幼苗10株混合为1次重复(处理D 4次重复,处理N 5次重复),抖落根系附着的土壤后装于50 mL无菌离心管中-80 ℃保存用于DNA提取、建库、NovaSeq PE250 高通量测序,并收集秧苗叶片保存于4 ℃用于生理检测。
1.3 测定方法
植株叶片叶绿素含量、可溶性糖含量、丙二醛含量、脯氨酸含量、根系活力、根系超氧化物歧化酶(采用氮蓝四唑法测定)参照王灿等[10]的方法检测。
采用CTAB法提取土壤细菌DNA,用琼脂糖凝胶电泳检测DNA。根据扩增测序区域,以基因组DNA为模板,使用带Barcode的特异引物、Phusion®High-Fidelity高保真酶进行PCR反应。反应体系:Phusion Master Mix 15 μL,引物 515F 和 806R (2 μmol/L)各 3 μL,ddH2O 2 μL,DNA (1 ng/μL) 7 μL;反应条件:98 ℃,1 min;98 ℃,10 s,50 ℃,30 s,72 ℃,30 s,30 个循环;72 ℃,5 min。文库构建使用NEBNext®UltraTMII DNA Library Prep Kit,并进行Qubit和Q-PCR定量,文库合格后使用Illumina NovaSeq6000进行两端测序(由北京诺禾致源科技股份有限公司完成)。使用16S V4区引物(515F:5’-CTGCCAGCMGCCGCGGTAA-3’和806R:5’-GGACTAC HVGGGTWTCTAAT-3’),通过Illumina NovaSeq进行两端测序。
1.4 数据质控与分析
原始数据采用软件Word 2003整理。使用软件FLASH V1.2.11对样本reads拼接得到Raw Tags;使用软件Fastp质控得到Clean Tags;使用软件Usearch将Clean Tags与数据库进行比对最终得到Effective Tags。使用软件QIIME2中的DADA2模块对Effective Tags进行降噪过滤丰度小于5的序列,得到扩增子序列变异(ASVs);使用Classify-sklearn模块将得到的ASVs与Greengene数据库比对得到每个ASVs的物种信息。
使用软件QIIME2计算observed_ASVs、Shannon、Simpson、Chao1、Goods_coverage,并绘制稀释曲线(Rarefaction Curve);observed_ASVs表示观测到的物种数目,指数越大说明观测到的物种越多;Shannon和Simpson指数综合体现物种的丰富度和均匀度,数值越大表示物种多样性越高;goods_coverage表示覆盖度,测序覆盖度越高指数越大;同时基于observed_ASVs绘制物种累积箱形图(Species accumulation boxplot),并计算Unifrac距离;使用软件R绘制主坐标分析图(PCoA)分析不同样本的细菌群落结构差异;LEfSe分析通过软件LEfSe来完成,默认设置LDA score阈值为4,设定>4为指示物种(有显著差异性的物种)。
根际细菌群落功能进行预测使用软件PICRUSt2;基于Greengene数据库中的ASVs基因信息预测共同祖先的基因功能谱,从而对样本菌群进行同源蛋白簇(Clusters of orthologous groups of proteins,COG)功能预测。
2 结果与分析
2.1 不同处理黄瓜幼苗生理代谢测定
正常处理N的叶片叶绿素和可溶性糖含量分别是2.440和10.380 mg/g,显著高于处理D的1.547和8.356 mg/g(P<0.05);处理D的叶片中脯氨酸和丙二醛含量为51.807 μg/g和54.848 nmol/g,显著高于处理N的32.628 μg/g和29.005 nmol/g;在根系活力中,处理N的根系活力为32.670 μg/(g·h),显著高于处理D的20.714 μg/(g·h);处理N的超氧化物歧化酶(SOD)含量为324.826 U/g,显著低于处理D的578.363 U/g(表1)。说明,相较处理N,干旱处理D黄瓜幼苗受到干旱胁迫,试验处理正确,可用于后续试验。
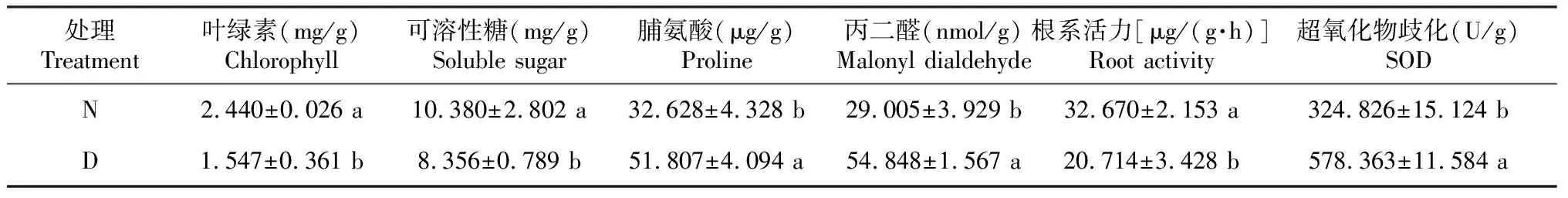
表1 不同处理对黄瓜幼苗生理指标的影响
2.2 不同处理黄瓜幼苗根际土壤细菌群落组成
通过NovaSeq PE250高通量测序并优化后,正常处理N和干旱处理D有效序列分别是83 466.2和78 798.6,碱基数目是21 171 896.6和19 962 790.6 nt,平均长度是254和253 nt,GC百分比分别是57.238%和56.444%(表2)。由图1可知,持续抽样下新的ASVs出现速率随着样本量的加大,箱形图位置逐渐趋于平缓,说明测序结果可基本覆盖样品中所有的物种,数据量充分且已经能够反映处理中土壤细菌群落情况,可用于后续数据分析。
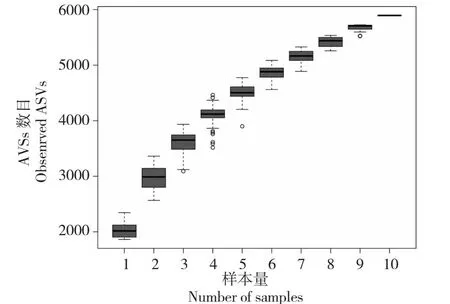
图1 Observde_ASVs物种累积箱形图Fig.1 Observde_ASVs species accumulation boxplot

表2 测序数据质量
处理N和处理D共同的ASVs数为2050个,处理N独有的ASVs是1365个,处理D独有的是1695个,处理D较处理N多600个(图2-a)。门分类水平下丰度排名第1的是变形菌门(Proteobacteria),占比分别是34.27%(处理N)和29.18%(处理D);丰度排名第2的是芽单胞菌门(Gemmatimonadota),占比分别是18.21%(处理N)和11.78%(处理D);丰度排名第3的是拟杆菌门(Bacteroidota),占比分别是7.20%(处理N)和13.53%(处理D);丰度排名第4的是酸杆菌门(Acidobacteriota),占比分别是10.16%(处理N)和9.61%(处理D);丰度排名第5的是放线菌门(Actinobacteriota),占比分别是9.36%(处理N)和10.48%(处理D)(图2-b)。
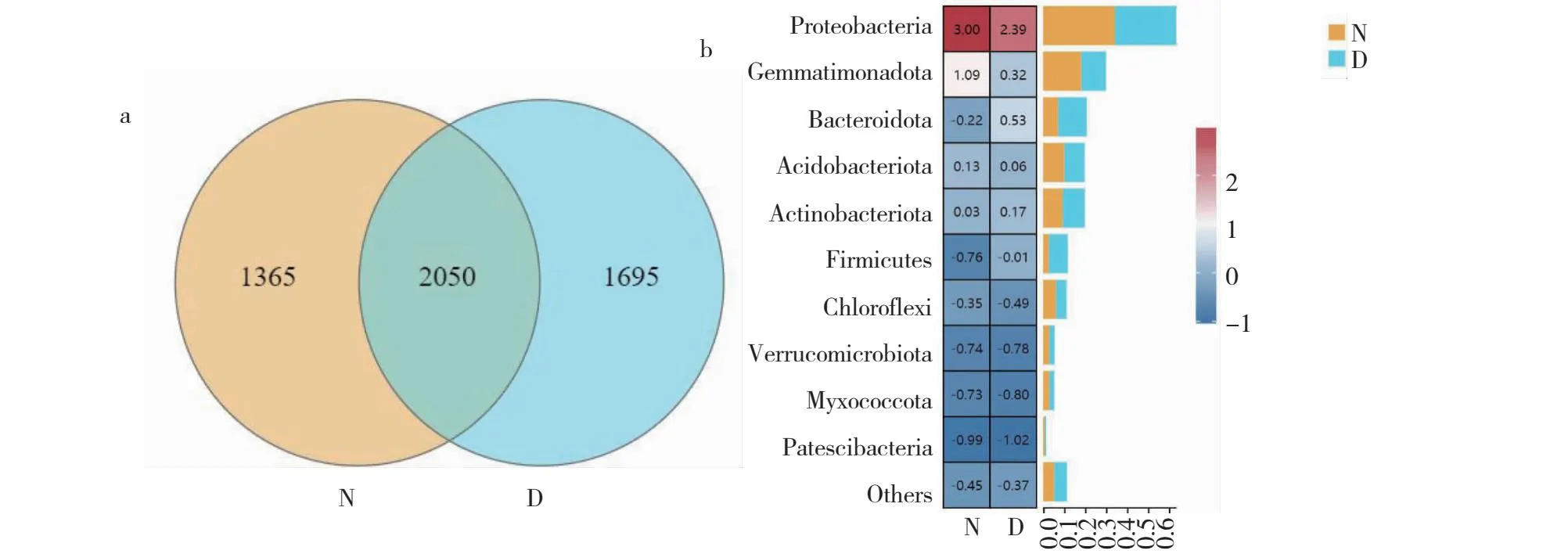
a:ASVs 韦恩图;b:门分类水平下细菌种类相对丰度热图(Top10)。a: Asvs venn diagram; b: Heat map of relative abundance of bacterial species at phylum level (Top10) .
2.3 不同处理黄瓜幼苗根际土壤细菌群落多样性差异
对不同处理的α多样性指数(Chao1、Shannon、Simpson)进行统计,从表3可知,处理D的Chao1、Shannon、Simpson均高于处理N,但差异不显著。基于Weighted unifrac距离进行PCoA分析,PCoA1、PCoA2分别贡献了35.54%和17.34%(图3)。PCoA1将处理N和处理D分开,二者间差异显著(R2=0.578,P=0.007)。处理N相较于处理D样本点离散程度较小,表明干旱处理对黄瓜幼苗根际细菌群落结构具有较大的扰动。门分类水平下,处理N相较于处理D显著上调的微生物为芽单胞菌门(Gemmatimonadota),下调的是拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes)(P<0.05)(图4)。说明相较于正常处理N,干旱处理D显著富集拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes)。利用软件LEfSe(LDA值为4)差异分析属分类水平上土壤细菌群落(图5),处理N中芽单胞菌门(Gemmatimonadota)、变形菌门(Proteobacteria)、芽单胞菌属(Gemmatimonas)和鞘脂单胞菌科(Sphingomonadaceae)显著富集。处理D中,显著富集的有拟杆菌门(Bacteroidota)[包括拟杆菌纲(Bacteroidia)、拟杆菌目(Bacteroidales)、Muribaculaceae属]和厚壁菌门(Firmicutes)[包括梭菌纲(Clostridia)、芽孢杆菌纲(Bacilli)]。说明这些细菌在黄瓜幼苗根际土壤细菌群落中是具有统计学差异的标志物种(Biomarker)。

图3 Weighted unifrac PCoA分析Fig.3 Weighted unifrac PCoA analysis

图4 黄瓜幼苗根际土壤细菌群落(门分类水平)Fig.4 Rhizosphere soil bacterial community in cucumber seedlings(phylum level)

图5 黄瓜幼苗根际土壤细菌群落LEfSe差异分析Fig.5 LEfSe difference analysis of rhizosphere soil bacterial community in cucumber seedlings

表3 细菌群落多样性指数
2.4 不同处理黄瓜幼苗根际土壤细菌群落功能预测
基于同源蛋白簇(COG)数据库使用PICRUSt 2对不同处理细菌群落功能进行注释。处理D中独有的COG为70个,显著高于处理N的11个(图6-a、6-b),其主要表现在RNA加工和修饰、染色质结构和动力学、转录、氨基酸运输和代谢、碳水化合物的运输和代谢等。处理N中独有的KEGG代谢通路有7条,少于处理D的12条(图6-c),包括芳香化合物、l-谷氨酸等降解和CMP-假氨基甲酸酯、四氢甲蝶呤等的合成(表4);处理D极显著(P<0.001)高于处理N的丰度值,代谢通路丰度前3位的是与硫胺素相关的合成途径、嘌呤核苷酸从头生物合成超途径II、葡萄糖和木糖降解超途径。此外还有次级代谢物的合成与降解途径,如吡哆醛5’-磷酸合成、香叶基香叶基二磷酸生物合成I、甲羟戊酸途径I、甘露聚糖降解、乙炔降解、乳糖和半乳糖降解等(表5)。

图6 黄瓜幼苗根际土壤细菌群落COG韦恩图(a)、柱形图(b)及KEGG韦恩图(c)Fig.6 Rhizosphere soil bacterial community COG veen plot (a), column plot (b) and KEGG veen plot (c) in cucumber seedlings
3 讨 论
干旱胁迫严重影响植物的生长发育,表现为叶片萎蔫、光合减弱、膜脂过氧化、丙二醛积累对细胞产生毒害等,而逆境中植物会产生各种应对策略,如ABA调节气孔关闭,Pro参与渗透压调节,保护酶清除体内活性氧和自由基等[11]。本试验中,干旱处理黄瓜叶片叶绿素、可溶性糖含量和根系活力显著低于正常处理,脯氨酸、丙二醛、超氧化物歧化酶含量则显著高于正常处理,与陈文妃等[12]干旱降低了黄瓜植株根系活力,而提高脯氨酸、SOD、丙二醛等含量结果一致。
不同环境下植物可改变其根分泌物的组成,影响根际土壤微生物群落组成和丰度变化[13]。本试验中2个处理的α多样性指数无显著差异,但PCoA分析中2个处理在PCoA1轴(35.54%)显著分离,说明干旱和非干旱下黄瓜根际细菌群落区别明显,这与张江伟等[14]、梁新波等[15]结果一致。此外2个处理样本点离散程度有一定差异,处理D各样本点离散程度较大,表明干旱对黄瓜根际细菌群落结构扰动较大,也可能在干旱条件下生理代谢途径存在差异,进而引起分泌化合物组分及相对丰度的差异,间接导致根际细菌结构组分的不同[16]。韦海波等[5]发现长雄野生稻在干旱胁迫下,相对丰度显著升高的类群有酸杆菌门(Acidobacteria)、疣微菌门(Verrucomicrobia)、泉古菌门(Crenarchaeota)、放线菌门(Actinobacteria)和α-变形菌(Alphaproteobacteria)等,而螺旋菌门(Spirochaetes)、硝化螺旋菌门(Nitrospirae)、绿菌门(Chlorobi)和δ-变形菌(Deltaproteobacteria)等的相对丰度显著下降。丁红等[17]表明花生在干旱低氮下放线菌门、酸杆菌门、厚壁菌门相对丰度显著增加,变形菌门丰度显著下降。试验中正常处理与干旱处理相比,芽单胞菌显著上调,拟杆菌和厚壁菌下调,表明干旱处理中拟杆菌和厚壁菌显著富集。LEfSe分析表明,处理N中显著富集的指示微生物是芽单胞菌门、变形菌门、芽单胞菌属和鞘脂单胞菌科,干旱处理中则是拟杆菌门下拟杆菌纲、拟杆菌目、Muribaculaceae属和厚壁菌门下梭菌纲、芽孢杆菌纲显著富集,说明这些细菌对干旱下黄瓜根际环境变动较敏感。拟杆菌门和厚壁菌门参与土壤有机质分解和分泌物多糖代谢过程[18-19],拟杆菌作为多糖降解途径的主要成员,能将复杂多糖转化为可利用的化合物,使其能高效利用植物根系分泌的多糖化合物,在特定环境(干旱、低肥)中更具竞争力[19]。拟杆菌门Muribaculaceae科在降解复杂碳水化合物上具有功能多样性,表现出对复杂多糖有较高敏感性[19-20]。植物受中度或短期干旱时会增加根部碳水化合物的储存,提高根系分泌物主糖类、氨基酸、有机酸和黄酮类等次生代谢物的浓度,而重度或长期干旱时,根系生长停止,正反馈效应也停止[21]。因此在黄瓜干旱前中期,Muribaculaceae科可作为响应黄瓜干旱的指示物种。厚壁菌多数为革兰氏阳性有益菌,产生乙酸盐、丁酸盐、乳酸盐和抗菌物质,可防止病原体入侵植物体[18, 22]。干旱处理下厚壁菌门中的梭菌纲和芽孢杆菌纲显著富集,其具有固氮和纤维素降解能力,同时芽孢杆菌分泌的脂肽类物质可作为诱导因子,激发植物抗逆性,使植物通过乙烯途径和水杨酸途径正调控诱导抗病相关基因表达[22-24],这些微生物可能对黄瓜抵御干旱逆境起重要指示作用。
PICRUSt 2功能预测结果显示,干旱处理对黄瓜根际细菌群落功能具有较高的诱导和促进作用,主要以RNA加工和修饰、染色质结构和动力学、转录、氨基酸运输和代谢、碳水化合物的运输和代谢等为主,表明干旱处理显著提高菌群质膜上转运蛋白的表达,介导氨基酸、糖类脂质、次级代谢物等的耗能转运等功能,这与De等[25]和孙中兴等[26]的干旱、盐胁迫下植物根际微生物群落的功能一致。KEGG代谢途径注释发现,干旱处理显著提高与硫胺素、香叶基香叶基二磷酸、甲羟戊酸等氨基酸、嘌呤嘧啶和次级代谢物相关的合成途径,同时提高以糖类、氨基酸等为主的降解途径,和降低了某些正常代谢途径等。表明干旱处理下黄瓜植株通过根系合成复杂多糖类和氨基酸参与渗透调节,导致相关细菌群落显著富集。干旱处理下黄瓜根际细菌群落功能中硫胺素相关合成途径表达显著上调,说明硫胺素在植物应对生物胁迫(炭疽病和白粉病)[27]和非生物胁迫(干旱、高盐)[28-29]过程中起重要作用,Wei等[30]对干旱条件下的枫杨施加外源硫胺素,可有效缓解干旱胁迫对枫杨的影响,并激活8个叶绿素合成基因的表达,提高叶绿素含量,同时刺激主要由生长素介导的信号通路中的基因表达,从而提高耐旱性。这一结果为微生物参与黄瓜抗旱研究及黄瓜种植生产中相关益生菌的利用提供新思路。
4 结 论
黄瓜幼苗根际细菌群落多样性在干旱处理与正常处理下无显著差异,但干旱处理显著改变细菌群落结构;干旱胁迫对某些细菌相对丰度产生剧烈影响,显著增加根际细菌群落有益细菌种类丰度和功能丰度;上调与硫胺素等次级代谢物相关的合成途径和以糖类、氨基酸为主的降解代谢途径。该研究结果为黄瓜抗旱生长中发掘相关有益微生物提供基础和为其他作物研究提供思路。
