体外冲击波疗法对膝关节骨性关节炎大鼠滑膜和软骨组织炎症因子的影响及机制*
2024-03-13杨兴月黄圆月安松松毛冬梅黄媛馨杨俊龙于子龙秦乐王林沃春新
杨兴月, 黄圆月, 安松松, 毛冬梅, 黄媛馨, 杨俊龙, 于子龙, 秦乐, 王林, 沃春新***
(1.贵州医科大学 麻醉学院, 贵州 贵阳 550004; 2.贵州医科大学附属医院 疼痛科, 贵州 贵阳 550004)
膝关节骨关节炎 (knee osteoarthritis, KOA),也称为慢性退行性关节炎,是一种常见的关节疾病,会导致严重的关节功能障碍[1]。KOA患者的主要症状包括疼痛、膝关节活动受限,晚期还会导致关节畸形,甚至关节出现严重的内翻、外翻畸形或屈曲挛缩畸形,降低患者的生活质量[2]。有数据显示,全球患KOA人数已达2.5 亿[3]。研究表明,促炎细胞因子作为KOA的生化标志物,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)及IL-6等在患者膝关节内明显升高[4];膝关节疼痛是KOA患者的主要症状,非甾体类抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)和阿片类药物可以缓解此疼痛症状,但NSAIDs易导致消化道溃疡、出血和血小板下降、肝毒性等副作用,阿片类药物则易产生药物成瘾、认知障碍、谵妄、跌倒和骨折等风险[5-6]。KOA 疼痛的发生机制较为复杂,可能与炎性疼痛(外周敏化)和中枢神经系统内神经的敏感性改变(中枢痛觉敏化)有关[7];滑膜炎通过炎症介质引起疼痛,膝关节疼痛与 KOA患者滑膜炎的程度之间存在关联[8];MIA诱导的KOA大鼠膝关节软骨分解,软骨下骨暴露并且损伤,支配软骨下骨的神经活动和敏感性发生变化,会导致晚期骨关节炎的疼痛[9];软骨降解产物可以促进炎症因子和化学物质的释放,这些物质通过直接刺激伤害感受器、降低其疼痛阈值引发疼痛,炎性介质也可刺激暴露的软骨下骨内的神经而产生疼痛[10]。目前许多治疗方法对KOA患者疼痛症状均未达到满意的治疗效果,减轻KOA患者痛觉敏化、防止KOA患者疼痛症状从急性疼痛向慢性持续性疼痛的转变将是缓解KOA患者疼痛的一种潜在有效的、新颖的方法;减轻KOA患者的滑膜与软骨组织的炎症可能会延缓痛觉敏化,从而减轻KOA患者疼痛症状。许多临床研究表明,体外冲击波疗法(extracorporeal shockwave therapy,ESWT)可以减轻KOA患者疼痛症状,改善膝关节功能[11-12],但其机制尚不清楚。因此,本研究欲探讨ESWT对 KOA大鼠滑膜及软骨组织炎症因子的影响及机制。
1 材料与方法
1.1 实验材料
1.1.1实验动物 雄性 Sprague Dawley(SD)大鼠30只,体质量300 g,购自北京华阜康科技股份有限公司[许可证号SCXK(京)2019-0008],饲养于室温(23±1)℃的房间,12 h/12 h明暗循环,自由进食进水;适应饲养2周后进行实验。
1.1.2主要试剂和仪器 碘乙酸钠(monosodium iodoacetate,MIA;贵阳超研远诚生物科技有限公司),多聚甲醛溶液(贵州伟博鑫生物科技有限公司),兔多克隆抗体 Anti-IL-1β抗体、兔多克隆抗体 Anti-TNF-α抗体、兔多克隆抗体 Anti-IL-6抗体(Affinity生物技术有限公司),免疫组织化学二抗辣根过氧化物酶(horse radish peroxidase,HRP)标记的山羊抗兔免疫球蛋白 G(immunoglobulin G,IgG ;武汉塞维尔生物科技有限公司);病理切片机(上海徕卡仪器有限公司),脱水机(意大利迪佩斯公司),PL-200热刺痛仪(成都泰盟软件有限公司),Von Frey纤维丝、电子测痛仪足底刺痛仪(ZS-PM,上海玉妍科学仪器有限公司),包埋机(武汉俊杰电子有限公司),其余试剂(武汉赛维尔生物科技有限公司)。
1.2 研究方法
1.2.1造模及实验分组 大鼠随机均分为对照组(n=10)、模型组(n=10)及冲击波组(n=10),均予10%水合氯醛(300 mg/kg)腹腔注射麻醉,于右侧膝关节处剃毛器备皮、碘伏消毒;对照组大鼠右侧膝关节腔注射0.9%生理盐水50 μL,模型组和冲击波组大鼠右侧膝关节腔注射2 mg/50 μL MIA构建KOA大鼠模型;造模后第14天,冲击波组大鼠内侧软骨下骨区域涂适量耦合剂后行体外冲击波治疗(1.0 bar,6 Hz,800 次;治疗探头为15 mm发散式;1次/周、共4次),对照组与模型组大鼠不予冲击波干预,仅予冲击波声音刺激。
1.2.2右后爪热缩爪潜伏期(paw withdrawal thermal latency,PWTL)检测 各组大鼠于术前 (baseline, BL)和术后第3、7、14、21、28、35及42天测量PWTL。各组大鼠置于PL-200热刺痛仪的实验反应箱,待其适应安静后,记录大鼠右后爪从开始加热到抬起或舔后爪的间隔时间,测量时间不超过20 s;每只大鼠测量3次,间隔时间>15 min/次,取平均值做为PWTL。
1.2.3右后爪足底机械刺激缩足阈值(mechanical withdrawal threshold,MWT)检测 各组大鼠于BL和术后第3 、7、14、21、28、35及42天测量MWT。采用足底刺痛仪(ZS-PM)测量MWT,将各组大鼠放置于底部为网格的有机玻璃箱内适应20 min,四肢不频繁活动后开始测定。观察者未知测试时大鼠的分组。用标准化的纤维丝冯弗雷刺激大鼠右后爪中部足底,从2 g开始,纤维丝弯曲至“C”或“S”型并维持4~8 s,观察各组大鼠缩足反应并记录,阴性反应则给予大一级力度纤维丝进行刺激,阳性反应则给予小一级力度纤维丝进行刺激,出现阴性到阳性或阳性到阴性变化时的最小阳性纤维丝力度为MWT,以g为单位。
1.2.4右膝关节X线检查 各组大鼠于术后第42天给予10%水合氯醛(300 mg/kg)腹腔注射麻醉,仰卧位于检查台,调整大鼠右侧膝关节置于检查台中央十字线中点处,行X线检查。
1.2.5免疫组织化学法(immunohistochemistry,IHC)检测右侧膝关节滑膜组织IL-1β、IL-6及TNF-α 表达 取“1.2.4”X线检查后各组大鼠,予2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,开胸经心脏灌注4% 多聚甲醛,取右侧膝关节置于4%多聚甲醛固定24 h,置于20%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)脱钙液(25~30 ℃)中脱钙,每2天观察1次;至针可扎动骨头时(约1个月)取出,脱水,石蜡包埋、切片,滴加pH为8.0的EDTA抗原修复液至完全覆盖组织,37 ℃烤箱孵育30 min,自然冷却,玻片置于pH为7.4的磷酸缓冲盐溶液(phosphate buffer solution,PBS)中于脱色摇床上晃动,洗涤3次、5 min/次;切片放入3%双氧水溶液,室温避光孵育25 min,洗涤,加3%牛血清白蛋封闭30 min,分别加兔抗鼠抗体IL-1β、IL-6及TNF-α的一抗抗体,湿盒内4 ℃孵育过夜;加入HRP标记的山羊抗兔二抗IgG,室温孵育50 min;洗涤,滴加新鲜配制二氨基联苯胺(diaminobenzidine,DAB)显色液,苏木素复染3 min、水洗,冲洗,苏木素返蓝液返蓝,冲洗,切片依次放入梯度酒精、二甲苯Ⅰ中脱水透明,取出晾干,封片,置于白光显微镜下进行观察滑膜组织,使用Image J软件(美国National Institutes of Health 公司)分析免疫组织化学平均光密度(mean optical density,MOD)值。
1.2.6免疫组织化学法(immunohistochemistry,IHC)检测右侧膝关节软骨组织IL-1β、IL-6及TNF-α 表达 取“1.2.4”X线检查后各组大鼠,予2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,经4%多聚甲醛心脏灌注后,取右侧膝关节置于4%多聚甲醛固定24 h,于20% EDTA脱钙液中脱钙,脱钙完成后取出脱水,石蜡包埋、切片后,滴加pH为8.0的EDTA抗原修复液修复30 min,洗涤后切片放入3%双氧水溶液,室温避光孵育25 min,洗涤,加3%牛血清白蛋封闭30 min,分别加兔抗鼠抗体IL-1β、IL-6及TNF-α的一抗抗体,湿盒内4 ℃孵育过夜;加入HRP标记的山羊抗兔二抗IgG,室温孵育50 min;洗涤后滴加DAB显色液,苏木素复染3 min,水洗后苏木素返蓝液返蓝,冲洗,切片依次放入75%酒精5 min、85%酒精5 min、无水乙醇Ⅰ 5 min、无水乙醇Ⅱ5 min、正丁醇5 min、二甲苯Ⅰ5 min 中脱水透明,取出晾干,封片,置于白光显微镜下进行观察软骨组织,使用Image J软件分析免疫组织化学MOD值。
1.3 统计学分析

2 结果
2.1 PWTL
术后第3、7、14、21、28、35及42天,模型组与冲击波组大鼠PWTL较对照组时间缩短,差异有统计学意义(P<0.05);术后第21天,冲击波组大鼠PWTL时间较模型组延长,差异无统计学意义(P>0.05),但术后第28~42天时2组比较、差异有统计学意义(P<0.05)。见表1。

表1 各组大鼠术后各时点Tab.1 PWTL in three groups at each time
2.2 MWT
术后第3~42天,模型组与冲击波组大鼠MWT均较对照组降低(P<0.05);术后第21~42天,冲击波组大鼠与模型组相比MWT值升高(P<0.05)。见表2。

表2 各组大鼠术后各时点Tab.2 MWT in three groups at each time
2.3 右膝关节X线特征
对照组大鼠右膝关节的关节间隙均匀,膝关节对线良好,关节面平整光滑,关节边缘整齐规则、无骨赘,关节内无游离体;模型组大鼠右膝关节的关节间隙明显狭窄,膝关节对线不齐,关节面粗糙变形,关节边缘有骨赘形成;冲击波组大鼠右膝关节的关节间隙狭窄较模型组改善,膝关节对线不齐且较模型组轻,关节面粗糙变形且较模型组改善,关节边缘骨赘形成且较模型组减少。见图1。
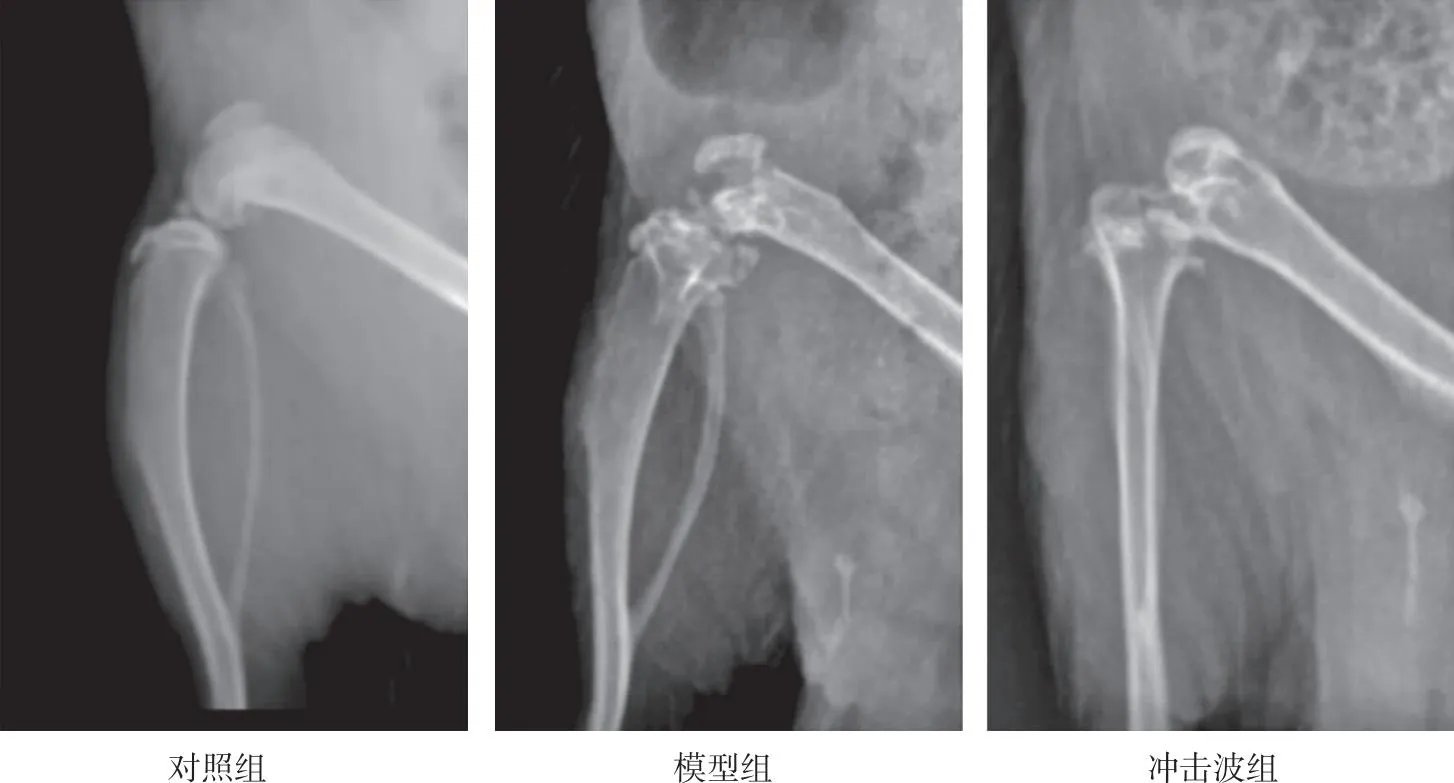
图1 各组大鼠右膝关节的X线检查结果Fig.1 X-ray examination results of right knee joint of rats in each group
2.4 滑膜组织IL-1β、IL-6及TNF-α的表达
与对照组比较,模型组、冲击波组大鼠膝关节滑膜组织TNF-α、IL-1β及IL-6表达增加(P<0.05);与模型组比较,冲击波组大鼠膝关节滑膜组织TNF-α、IL-1β及IL-6表达减少(P<0.05)。见图2。
2.5 软骨组织IL-1β、IL-6及TNF-α的表达
与对照组比较,模型组与冲击波组大鼠膝关节软骨组织TNF-α、IL-1β及IL-6表达增加,差异有统计学意义(P<0.05);与模型组比较,冲击波组大鼠膝关节软骨组织TNF-α、IL-1β及IL-6表达减少,差异有统计学意义(P<0.05)。见图3。

注:A、B分别为软骨组织IL-1β、IL-6及TNF-α的染色结果和定量结果;(1)与对照组比较,P<0.05;(2)与模型组比较,P<0.05。
3 讨论
KOA是一种高发病率的慢性进行性疾病,可严重影响患者的生活质量,其中疼痛是最常见症状,易发展为慢性疼痛[13]。KOA病理改变主要包括软骨退化、软骨下骨硬化、骨赘形成、滑膜炎症及韧带钙化[14],其中滑膜炎症是其病理变化的重要特征[15]。林璐璐等[16]认为KOA疼痛的原因包括外周和中枢敏化,炎症反应是KOA患者膝关节疼痛的驱动因素,巨噬细胞、肥大细胞、炎症介质等均参与了KOA疼痛致敏的发生,导致了外周伤害感受器和脊髓神经元的敏化。 痛觉敏化在慢性疼痛中扮演着至关重要的角色,如在KOA的病理过程中,关节内的结构、生物力学、细胞及生化均会发现变化,易引起伤害性输入的增加,从而导致痛觉敏化[17];临床上KOA患者约20%可出现痛觉敏化现象,与单侧或双侧受累无关[18-19]。Neogi等[20]研究表明,滑膜炎症与KOA疼痛致敏有关,早期靶向炎症是预防KOA致敏的治疗方法,可减轻疼痛严重程度;也有研究显示,滑膜炎症与膝关节疼痛有关,滑膜炎是膝关节炎抗炎疗法的候选治疗靶点,可发挥镇痛作用[21]。本研究结果显示,与对照组比较,模型组大鼠随着造模时间的延长,PWTL时间逐渐缩短,MWT阈值逐渐降低,表明KOA大鼠在形成慢性疼痛的过程中出现了痛觉敏化,ESWT可延长降低KOA大鼠的PWTL,升高其MWT,从而改善其痛觉过敏。
KOA炎症产生的IL-1β、IL-6及TNF-α不仅是关节炎症和进一步变性的介质,还可激活伤害感受器,诱导或促进炎症性疼痛以及神经性疼痛,从而导致痛觉敏化[22]。有研究显示,KOA患者滑液、滑膜及软骨的IL-1β、IL-6及TNF-α水平升高[23],提示IL-1β、IL-6及TNF-α是KOA炎症产生的主要促炎细胞因子。IL-1β可刺激IL-6、TNF-α等促炎细胞因子的释放[24];IL-1β、IL-6及TNF-α可直接作用于关节伤害性感受器导致疼痛症状,也可影响沿神经轴的多个点的疼痛反应,增加感觉神经的兴奋性导致慢性疼痛[25]。本研究结果显示,ESWT可降低KOA大鼠膝关节滑膜和软骨组织IL-1β、IL-6、TNF-α等促炎因子水平。
ESWT是一种将机械性脉冲声波转换为弹道式冲击波,进而作用于人体局部组织的物理疗法,是肌肉骨骼系统疾病的许多病理改变的安全有效的治疗方法,已用于许多肌肉骨骼疾病,具有无创、安全及有效等特点[26]。冲击波可以产生间质和细胞外反应,如缓解疼痛、血管形成、蛋白质生物合成、细胞增殖、神经和软骨保护以及破坏肌肉骨骼结构中的钙沉积[27];冲击波具有组织损伤修复重建、组织粘连松解、扩张血管和血管再生作用、镇痛及神经末梢封闭作用、高密度组织裂解、炎症及感染控制等生物作用[28]。Abe等[29]研究显示,低能量ESWT在急性心肌梗死大鼠模型中除血管生成作用外,还有抗炎作用;多数临床研究亦表明,ESWT对KOA患者具有治疗作用[30-32]。本研究结果显示,ESWT可降低KOA大鼠膝关节滑膜和软骨组织IL-1β、IL-6及TNF-α的表达。
综上所述,ESWT可降低KOA大鼠膝关节滑膜和软骨组织IL-1β、IL-6及TNF-α的表达,从而改善KOA炎症;还可缓解KOA大鼠痛觉敏化症状,其机制可能与冲击波改善局部炎症因子的分泌、减少炎症反应有关。因此,本研究表明了ESWT对KOA具有治疗作用,从而有助于推动ESWT用于KOA的临床治疗。
