自噬对锌指转录因子1及高糖诱导的肾小管EMT的影响*
2024-03-13安小敏李清璇王彤龙天华杨鹏卢雨微张小龙郭兵石明隽
安小敏, 李清璇, 王彤, 龙天华, 杨鹏, 卢雨微, 张小龙, 郭兵,4, 石明隽,5***
(1.贵州医科大学 病理生理学教研室, 贵州 贵阳 550025; 2.贵州省常见慢性疾病发病机制及药物研究重点实验室, 贵州 贵阳 550025; 3.地方病与少数民族疾病教育部重点实验室, 贵州 贵阳 550025; 4.贵州省常见重大慢性疾病发病机制及药物开发应用创新基地, 贵州 贵阳 550025; 5.贵州医科大学省部共建药用植物功效与利用国家重点实验室, 贵州 贵阳 550025)
随着糖尿病发病率逐年升高,其并发症糖尿病肾脏疾病(diabetic kidney disease, DKD)的发病率也逐渐增加,成为终末期肾功能衰竭的重要原因[1]。肾小管上皮细胞-间充质转化(epithelial- mesenchymal transition, EMT)能增加肾间质细胞外基质(extracellular matrix, ECM)沉积、促进肾间质纤维化及DKD的发生发展[2],但DKD时EMT的发生机制尚不十分明确。锌指转录因子1(zinc-finger transcription factor 1, Snail1)是上皮细胞向间充质细胞转化和癌症相关成纤维细胞活化所必需的转录因子。Snail1可抑制E-钙粘附素基因表达,诱导EMT[3]。本课题组的前期研究发现,在高糖培养的原代大鼠肾小管上皮细胞中Snail1的表达明显增多,并且在高糖培养的肾小管上皮细胞中敲低内源性Snail1能明显降低其分泌ECM的能力[4],提示Snail1可能影响肾小管上皮细胞EMT而促进DKD时肾纤维化的发生。但在DKD中,肾小管上皮细胞内Snail1蛋白增多的机制尚不清楚。自噬是细胞内蛋白降解的两种主要途径之一,通过自噬小体与溶酶体的融合可降解自噬小体内包裹的老化细胞器、侵入的病原体及蛋白质等,从而实现细胞稳态、能量的生成和细胞器的更新等作用。本课题组前期研究与国内外大量研究发现糖尿病(DM)大鼠模型中,肾组织的自噬水平明显受到抑制[5-6],而提高其自噬水平能明显抑制DKD的发生发展[7],表明自噬与DKD的发生发展密切相关。Grassi等[8]发现在肝细胞中抑制自噬能明显减少Snail1蛋白的自噬性降解,促进EMT的发生。但在DKD中,自噬是否通过调控Snail1的降解而影响肾小管上皮细胞EMT过程,目前尚不清楚。因此本研究拟以DM大鼠和高糖培养的大鼠NRK-52E细胞为研究对象,研究自噬对Snail1以及大鼠肾小管上皮细胞EMT的调控作用及机制,为进一步深入理解DKD肾纤维化发病机制、寻找治疗靶点提供理论依据。
1 材料与方法
1.1 实验材料
健康雄性Sprague-Dawley(SD)大鼠12只,体质量180~220 g,购自北京华阜康生物科技股份有限公司[生产许可证号SCXK(京)2009-0007],动物实验规程已获贵州医科大学动物伦理委员会批准,符合国家科学技术委员会颁布的《实验动物管理条例》。NRK-52E细胞购自(上海中科院细胞库),链脲佐菌素(streptozotocin, STZ;美国Sigma公司),逆转录试剂盒、实时荧光定量PCR试剂(北京中杉公司),胎牛血清(FBS,以色列BIOIND公司),抗微管蛋白(β-Tublin)抗体、抗体辣根过氧化物酶标记羊抗兔和羊抗小鼠IgG(武汉普美克生物技术有限公司),兔抗微管相关蛋白1轻链 3(microtubule associated protein 1 light chain 3, LC3-Ⅱ/Ⅰ;北京博奥森生物技术有限公司),兔抗Snail1、鼠抗自噬降解底物蛋白1(sequestosome 1, SQSTM1/p62;美国Abcam公司)、兔抗自噬基因BECN 1(coiled-coil myosin-like BCL2-interacting protein, Beclin1;美国Abcam公司),二甲基亚砜(DMSO;北京索莱宝科技有限公司),雷帕霉素(RAP,苏州碧云天有限公司),氯喹(CQ)、放线菌酮(CHX)及蛋白酶抑制剂(MG-132,美国ECM公司),双标荧光腺相关病毒(Lenti-mCherry-EGFP-LC3B,碧云天生物技术)。所用引物由上海生物工程股份有限公司根据设计合成。
1.2 研究方法
1.2.1动物模型建立、分组和动物标本采集 大鼠适应性喂养1周,随机抽查大鼠血糖均<8 mmol/L,随机分为正常对照(NC)组和DM组,每组6只。模型复制方法参照文献[8],禁食不禁水6 h后,乙醚麻醉大鼠,DM组予尾静脉注射2%的STZ(53 mg/kg,用高压后的0.1 mol/L、pH 4.5柠檬酸-柠檬酸钠缓冲液配置,即配即用),NC组注射等体积柠檬酸-柠檬酸钠缓冲液。72 h后测大鼠血糖,以空腹血糖≥16.7 mmol/L判断为DM模型复制成功,2周后行醋酸法进行尿蛋白定性测试,尿蛋白阳性者判断肾功能损害,发生DKD。造模成功后第24周末处死两组大鼠,处死前1 d收集24 h尿液,记录24 h尿量。处死前禁食不禁水6 h,股动脉取血,室温离心(1 000 r/min,5 min)后取上清,-20 ℃保存。处死大鼠后取肾组织,冠状切面约2 mm厚片,部分于4%甲醛溶液中固定,其余部分冻在-80 ℃保存备用。
1.2.2生化指标检测 收集的血清送至贵阳金域检验中心进行生化指标检测(雅培2000全自动生化检测仪)检测血糖、血尿素氮(BUN)和尿白蛋白(UAlb)计算24 hUAlb(24 h尿量和尿白蛋白的乘积)。
1.2.3细胞培养及分组 NRK-52E细胞置于二氧化碳(CO2)孵箱中培养(DMEM培养基,10%FBS,5%CO2,37 ℃),待细胞密度达到50%时,加入无血清的DMEM培养液同步化培养细胞12 h后,将细胞分为正常糖组(NG,5.5 mmol/L)、高糖组(HG,30 mmol/L)、高渗组(HM,30 mmol/L)和高糖+药物组(HG+自噬激动剂RAP或抑制剂CQ),含1%FBS相应培养基继续培养48 h后收集细胞蛋白和/或RNA标本进行相关检测。
1.2.4免疫荧光化学染色观察P62、Snail1、α-平滑肌肌动蛋白(α-SMA)、E-钙黏蛋白(E-cadherin)的表达 将NRK-52E细胞在12孔板中进行爬片,根据分组分别用相应培养基培养48 h后,弃培养基,PBS洗涤,4%多聚甲醛室温固定15 min,预冷的PBS洗涤(5 min×3次),加入0.2%TritonX-100室温放置6 min,PBS洗涤(5 min×3次),3%BSA室温孵育封闭30 min,滴加一抗,4 ℃冰箱孵育过夜;次日室温复温30 min,PBS洗涤(5 min×3次),加入荧光二抗37 ℃避光孵育1 h,PBS洗涤(5 min×3次),抗荧光猝灭剂封片后,激光共聚焦显微镜观察并拍摄保存图像。
1.2.5Western blot法检测自噬、EMT、纤维化相关指标 -80 ℃冰箱冻存的大鼠肾组织,每只鼠取100 mg肾皮质加蛋白裂解液1 mL,高通量研磨机研磨;细胞样本则根据细胞量多少加入适量蛋白裂解液,用细胞刮刮取细胞。组织或细胞样本置于4 ℃裂解30 min后离心(4 ℃,12 000 r/min,15 min),取上清液变性制备蛋白样本进行聚丙烯酰胺凝胶电泳、转膜、封闭,分别加入抗体[小鼠抗β-Tublin抗体(1∶1 000)、兔抗α-SMA(1∶1 000)、兔抗collagen Ⅲ(1∶1 000)、鼠抗E-cadherin抗体(1∶1 000)、兔抗Snail1(1∶1 000)、兔抗p62(1∶1 000)、兔抗LC3(1∶1 000)、兔抗Beclin1(1∶1 000)],4 ℃冰箱孵育过夜;TBST洗膜,加入相应的辣根过氧化物酶标记的山羊抗鼠Ⅱ抗(1∶10 000)、山羊抗兔Ⅱ抗(1∶10 000),室温摇床孵育1 h;TBST洗涤,Smart-ECL发光试剂在凝胶成像仪进行化学发光曝光,以β-tubulin作为内参,实验重复3次,用蛋白条带结果用Image Lab5.0软件进行分析各个条带灰度值,计算相对表达量后统计数据。
1.2.6免疫共沉淀实验验证P62与Snail1之间相互作用 NRK-52E细胞密度达到50%时,加入无血清的DMEM培养液同步化培养细胞12 h后,将NG组和HG组细胞继续培养48 h后弃培养液,PBS清洗3遍,加入细胞裂解液500 μL,冰上裂解30 min,把裂解好的细胞刮下来,冰上超声:强度37%,4 s、3次,离心取上清(4 ℃,15 min,12 000 r/min),每500 μL裂解液加入ProteinA+G磁珠20 μL,室温翻转摇床上缓慢翻转1 h。NG组又分为全蛋白组(Input组)和IP组(IP组又分为阴性对照IgG组和实验组Snail1/P62)。磁分离取出磁珠后按IP实验中所需抗体稀释比例加对应的抗体,4 ℃翻转摇床上缓慢翻转过夜。用预冷的细胞裂解液500 μL洗3次磁珠,最后1次按照初始体积加入裂解液,每400 μL裂解液加入100 μL 1×SDS-PAGE电泳上样缓冲液,100 ℃金属浴10 min,磁分离把磁珠离心至管底,取上清进行Western blot。
1.2.7Lenti-mCherry-EGFP-LC3B检测自噬流 共聚焦皿中培养NRK-52E细胞,细胞密度达50%时,更换培养液(约加入正常培养体系的1/2体积),然后根据预实验结果加入相应体积的病毒液培养6 h后,补充培养液至正常体系,继续培养48 h,激光共聚焦显微镜观察自噬流情况并拍摄保存图像。所有操作均需避光。
1.2.8验证上调或抑制自噬后对Snail1蛋白降解作用的影响 CHX作为蛋白合成抑制剂,加入后可阻断蛋白合成的来源,MG-132作为泛素-蛋白酶体降解途径的阻断剂,可以阻断蛋白通过泛素途径的降解,联合CHX与MG-132处理后,可将蛋白通过自噬降解的多少作为单一变量进行观察。在正常糖中联合CHX和MG-132处理NRK-52E细胞,收集0、1、2、4、6、8及10 h的蛋白;在HG条件下分别使用RAP上调自噬或CQ抑制自噬48 h,再联合使用CHX+MG-132处理细胞,分组为HG+DMSO/RAP组、HG+DMSO/CQ组,收集0、6及10 h的蛋白,Western blot观察Snail1的衰减速率。
1.3 统计学分析
2 结果
2.1 各组大鼠的一般情况及生化指标
造模后72 h,DM组大鼠血糖≥16.7 mmol/L,提示糖尿病模型复制成功。造模第2周后,每周监测大鼠血糖、体质量,NC组大鼠血糖正常,体质量稳定增加,DM组大鼠出现多饮、多食、多尿症状,体质量增长减慢甚至减轻。24周时处死大鼠,血和尿生化检测结果显示,与NC组相比,DM组大鼠血糖、BUN、24 h UAlb升高,差异具有统计学意义(P<0.05)。见表1。
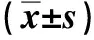
表1 NC和DM组大鼠血糖、BUN、24 h UAlb的变化Tab.1 The changes of rat blood glucose, BUN, and 24 h UAbl in NC and DM
2.2 DM大鼠肾组织和高糖培养的NRK-52E中LC3-Ⅱ/Ⅰ、Beclin1表达减少,p62表达增加
Western blot结果显示(图1),在DM组大鼠肾组织和高糖培养的NRK-52E中,p62表达增加,LC3-Ⅱ/Ⅰ减小,Beclin1表达减少,差异有统计学意义(P<0.05)。提示高糖环境中肾小管上皮细胞自噬受到抑制。
注:A为大鼠肾组织结果,B为高糖刺激NRK-52E细胞结果;(1)与NC组比较,P<0.05。
2.3 高糖培养的NRK-52E细胞中自噬流受阻
如图2结果所示,HG培养的NRK-52E中自噬流阻滞在自噬溶酶体融合(晚期)之前。
2.4 在高糖培养的NRK-52E中上调自噬可缓解EMT、减少ECM沉积,抑制自噬时结果相反
Western blot结果显示,RAP刺激后,与HG组相比,HG+RAP组中p62表达降低,LC3-Ⅱ/Ⅰ增加,Beclin1表达升高(P<0.05,图3A);提示自噬水平提高;HG+RAP组中α-SMA、Collagen Ⅲ的表达减少,E-cadherin表达增多(P<0.05,图3B);提示提高自噬水平后抑制了肾小管上皮细胞EMT,且ECM减少。CQ刺激后,与HG组相比,HG+CQ组中LC3-Ⅱ/Ⅰ增加,p62表达增多,Beclin1表达减少(P<0.05,图3C);提示自噬溶酶体降解受到抑制;HG+CQ组中α-SMA、Collagen Ⅲ的表达增多,E-cadherin表达减少(P<0.05,图3D);提示抑制自噬后加剧了EMT,且ECM沉积增多。

注:A为RAP刺激后LC3-Ⅱ/Ⅰ、p62、Beclin1的表达变化,B为RAP刺激后α-SMA、E-cadherin以及Collagen Ⅲ的表达变化;C为CQ刺激后LC3-Ⅱ/Ⅰ、p62、Beclin1的表达变化;D为CQ刺激后α-SMA、E-cadherin、Collagen Ⅲ的表达变化;(1)与HG组比较,P<0.05。
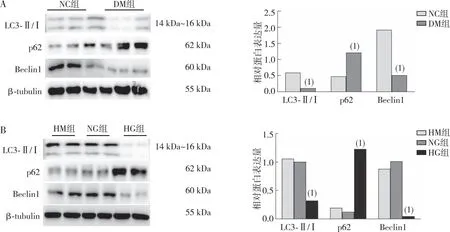
2.5 免疫荧光观察到在高糖培养的NRK-52E中上调自噬可缓解EMT,抑制自噬时结果相反
如图4结果所示,细胞免疫荧光观察到,与HG组相比,HG+RAP组中p62、α-SMA表达减少,E-cadherin表达增多,差异有统计学意义(P<0.05),而HG+CQ组中结果相反,差异有统计学意义(P<0.05)。提示上调自噬可以延缓EMT的发生,抑制自噬则可促进EMT的发生。
注:A、B、C分别为各组NRK-52E中p62、α-SMA和E-cadherin的表达;(1) 与HG组相比,P<0.05;(2) 与HG组相比,P<0.05。
2.6 DM大鼠肾组织及高糖培养的肾小管上皮细胞中Snail1的表达及自噬对Snail1的调控
在DM大鼠肾组织及高糖培养的NRK-52E中,与NC组相比,DM组Snail1蛋白增多(P<0.05);与NG组相比,HG组Snail1蛋白增多(P<0.05,图5A);在NRK-52E细胞中,使用自噬激动剂RAP刺激后,与HG组相比,HG+RAP组Snail1的蛋白表达减少,而使用自噬抑制剂CQ刺激后,与HG组相比,HG+CQ组Snail1的蛋白表达增多(P<0.05,图5B);免疫共沉淀结果显示,Snail1与p62之间存在蛋白相互作用(图5C);免疫荧光结果观察到Snail1与p62存在共定位现象(图5D)。以上结果提示在高糖环境中Snail1表达增多,且可能通过p62连接,进入到自噬途径降解。

注:A为Western blot测定DM大鼠及高糖培养的NRK-52E中Snail1表达;(1) 与NC组相比,P<0.05;(2) 与NG组相比,P<0.05;B为Western blot测定RAP/CQ组中Snail1的蛋白水平;(1) 与HG组相比,P<0.05;(2) 与HG组相比,P<0.05;C为免疫共沉淀结果;D为细胞免疫荧光结果(400×)。
2.7 自噬对高糖培养的肾小管上皮细胞Snail1降解的作用
Western blot结果显示:CHX、MG-132合并刺激NKR-52E不同时间,在NG组中观察到Snail1蛋白半衰期约为6 h(在第6小时衰减到51%),而在第10小时则减少到11%(图6A),故后续实验采用0、6及10 h这3个时间点作为Snail 1蛋白衰减的观察时间。在HG条件下分别使用RAP上调自噬或CQ抑制自噬48 h,再联合使用CHX+MG-132处理细胞,结果显示,与HG+DMSO组相比,在HG+RAP组中上调自噬后第6小时Snail 1蛋白衰减速率明显较DMSO组加快(42%比89%),10 h时Snail1的衰减速率更快(16%比86%);与HG+DMSO组相比,HG+CQ组中抑制自噬后第6小时Snail 1蛋白衰减速率较DMSO组无明显变化(97%比98%),而10 h时Snail 1蛋白衰减较DMSO组更慢(96%比89%)。提示Snail1通过自噬途径降解,而调控自噬水平可以调控Snail1蛋白的降解速率。
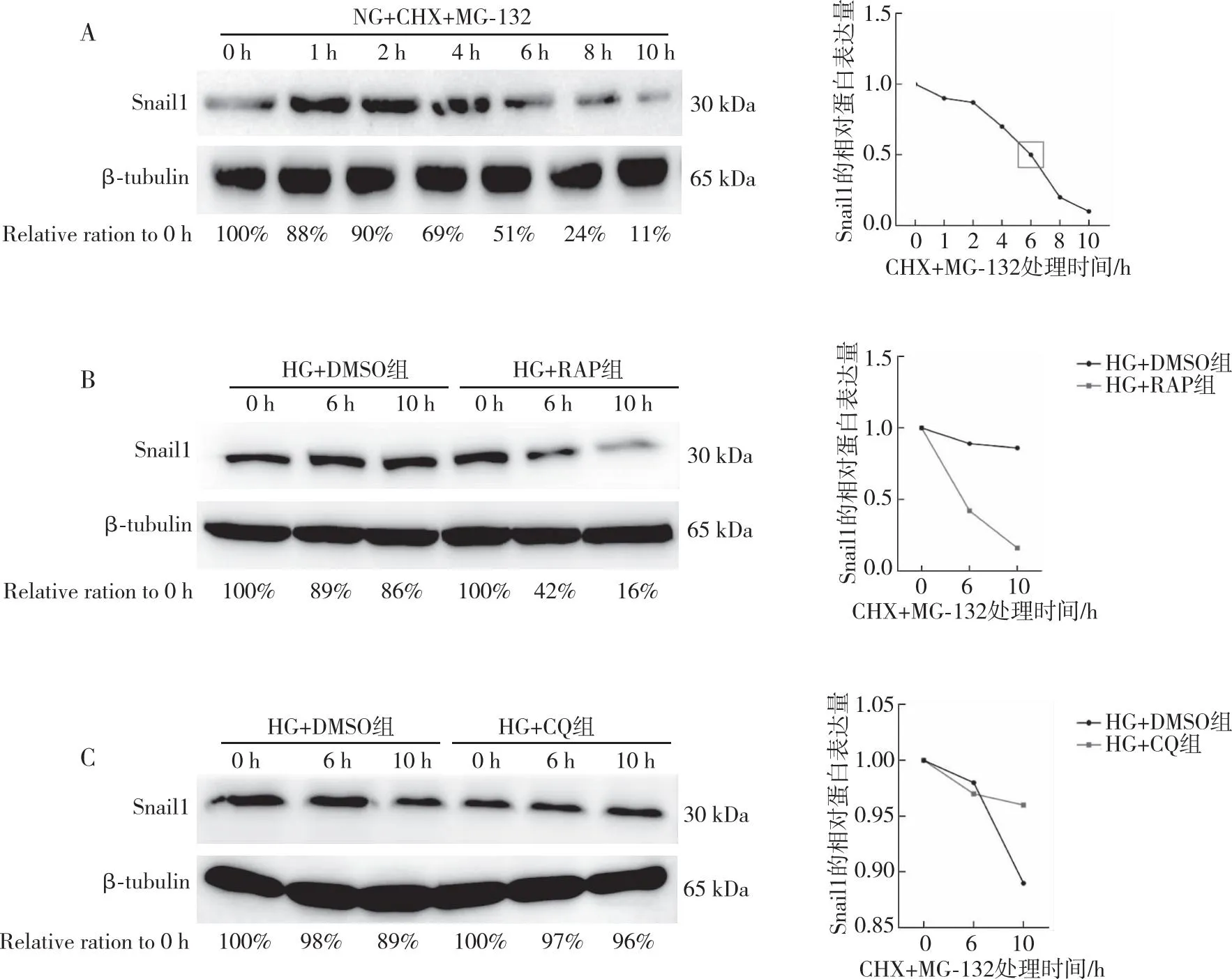
注:A为Snail1蛋白衰减时间点的摸索,线图中方框表示在CHX+MG-132联合处理下,Snail1蛋白半衰期约为6 h(在第6小时衰减到51%);B为RAP刺激后Snail 1蛋白的衰减速率变化;C为CQ刺激后Snail1蛋白的衰减速率变化。
3 讨论
目前我国DM患者人数居世界首位,在我国20~79岁成年人中,发病率高达10%[1],DKD是糖尿病最普遍且严重的并发症之一,是DM患者终末期死亡的主要原因[2-3]。肾间质纤维化是引发DKD终末期肾功能衰竭的主要原因[4,9-10],肾间质纤维化时正常的肾小管和肾间质结构被大量聚集的ECM所代替,最终引起肾功能衰竭[5]。肾小管EMT能增加肾间质内ECM的沉积、促进肾间质纤维化及DKD的发生发展[11-15]。本研究结果证实在DM大鼠肾组织及高糖培养的NRK-52E细胞中α-SMA、Snail1表达均增高,E-cadherin表达降低,Collagen Ⅲ的表达增高,高糖环境下肾小管上皮细胞发生了EMT、ECM沉积增多;细胞免疫荧光实验也证实了上述结果。
近年来有研究发现,自噬与EMT的发生发展密切相关[16-18]。除了泛素-蛋白酶体降解途径外,自噬是细胞中蛋白质降解的另一种主要途径。在自噬过程中,LC3-Ⅰ会先经自噬相关基因 7(autophagy-related gene 7, ATG7)和自噬相关基因3(autophagy-related gene 3, ATG3)等蛋白修饰和加工,再与磷脂酰乙醇胺(PE)相偶联形成LC3-Ⅱ,并定位于自噬体内外膜上。因此,即可通过观察LC3-Ⅱ/Ⅰ的变化可预测自噬水平的高低;除LC3之外,p62是目前研究较广泛的另一个自噬底物。在自噬体形成过程中,p62可标记需被降解的蛋白并链接到LC3上,继而将其包裹入自噬体,再进入溶酶体中降解,所以p62蛋白的表达量与自噬活性呈负相关[19]。Beclin1是调节自噬的主要分子之一[20],上调Beclin1的表达能提高细胞自噬水平、抑制EMT发生[21],而敲低Beclin1则能明显抑制细胞自噬水平促进EMT的发生[22]。前期研究发现DKD大鼠模型及高糖培养的肾小管上皮细胞模型中Beclin1表达明显降低,自噬受到抑制[7,23]。本研究结果显示,在高糖环境中p62蛋白表达增多,LC3、Beclin1表达减少,进一步证实在高糖环境的肾小管上皮细胞中自噬受到抑制;使用LC3双标腺病毒转染结果显示,在高糖培养的NRK-52E细胞中自噬流被阻滞。RAP刺激是较为常用的自噬活化方法,而CQ是一种常用的自噬抑制剂,可以通过提升溶酶体内pH值进而阻断细胞自噬活性。有研究人员发现,在HK2细胞中使用CQ可拮抗由胆固醇诱导的EMT[24];而使用RAP提高自噬水平可明显延缓EMT的发生[25-27]。本实验使用CQ和RAP刺激高糖培养的NRK-52E,观察调节自噬对EMT的影响,结果证实RAP上调自噬可以部分逆转高糖下的EMT发生和ECM沉积增多,而在CQ组中呈现出了相反的结果。但自噬对EMT调控的机制尚未明确。
Zou等[28]发现在人心脏微血管内皮细胞中,缺氧能抑制p62与Snail1蛋白的相互作用,从而减少自噬-溶酶体途径对Snail1蛋白的降解,促进心内皮细胞间充质转化的发生;RAP刺激则能增强自噬-溶酶体途径对Snail1蛋白的降解,抑制缺氧诱导的心内皮细胞间充质转化。另有研究发现,提高乳腺癌细胞的自噬水平能明显增强自噬-溶酶体途径对Snail1蛋白的降解,从而减少EMT的发生[29]。Snail1属于锌指蛋白转录因子家族的成员,在EMT过程中发挥关键作用,可与E-cadherin启动子的E-box序列结合,抑制E-cadherin的表达,从而启动EMT进程。本研究免疫共沉淀结果显示,Snail1与p62之间存在蛋白相互作用;免疫荧光结果发现,Snail1与自噬小体在细胞中存在共定位。提示Snail1可能通过p62被携带入自噬体中,再与自噬体融合进入溶酶体被降解。因此拟观察在高糖培养的肾小管上皮细胞中,调控自噬水平对Snail1降解速率变化的影响。CHX作为蛋白合成抑制剂可以阻断蛋白的生成,而CHX MG-132则可阻断蛋白通过泛素-蛋白酶体的降解,因此使用CHX和MG-132刺激细胞后,可观察Snail1蛋白通过自噬降解的情况。与对照组相比,上调自噬后Snail1蛋白降解加快,抑制自噬后Snail1蛋白降解减慢,提示Snail1可能通过与车载蛋白p62结合,进入到自噬小体当中,跟随自噬小体进入到溶酶体被降解,并且受到自噬状态的影响。
综上,在DM大鼠肾组织及高糖培养的肾小管上皮细胞中自噬受到抑制,Snaill通过自噬途径降解减少,从而促进了EMT发生,最终导致DN肾纤维化。以上结果对进一步明确EMT的发生机制,从而为寻找抑制其启动、减少ECM的沉积及找寻DKD肾间质纤维化的防治靶点提供了实验基础。
