五汁饮褐变抑制工艺优化
2024-03-12周玮玲李燕燕赵淋仙徐纯艺胡慧玲
周玮玲,李燕燕,邱 菁,赵淋仙,徐纯艺,胡慧玲,游 宇
(成都中医药大学药学院,西南特色中药资源国家重点实验室,四川 成都 611137)
褐变现象是指产品中的多酚、糖、氨基酸等成分经一系列复杂反应后,生成褐色素物质的现象,会严重损害产品外观及有效成分含量[1]。因此,抑制褐变、保全产品活性或营养成分、控制产品质量一直是含鲜品的中药产品、食品及相关领域所关注的重点。
五汁饮源自《温病条辨》,由梨、荸荠、藕、鲜芦根、鲜麦冬5 味鲜品组成,具有养阴生津、清热止渴之功,可解热、止渴、生津[2-3],方中多酚、多糖等成分是该方发挥药效作用的重要物质基础[4-5],但目前相关研究较少[6-8]。预实验发现,五汁饮极易发生褐变现象,其整体颜色变暗并朝红黄方向演变,推测其所含的糖类、酚类成分是参与褐变反应的关键物质,同时鲜品提取液中难以去除的不溶性组分(果胶等) 对其也有催化作用[9],不利于后续制剂、药效学研究,故控制褐变现象、优化前期制备工艺对保护该方药效成分、控制其整体质量尤为重要。本实验优化五汁饮褐变抑制工艺,以期为该方进一步开发应用提供理论依据。
1 材料
1.1 仪器 H/T20M 台式高速冷冻离心机(湖南赫西仪器装备有限公司); RE-52AA 旋转蒸发器(上海亚荣生化仪器厂); Ci7XX0 色差仪[爱色丽(上海) 色彩科技有限公司]; BSA124S 电子分析天平[万分之一,赛多利斯科学仪器(北京) 有限公司]; PS-100A 超声清洗机(深圳洁康超声波清洗器有限公司); 煎药锅(潮州市一壶百饮电器实业有限公司); UV-3300 紫外可见分光光度计(上海美谱达仪器有限公司); JYL-C93T 榨汁搅拌机(山东九阳股份有限公司)。
1.2 试剂与药物 果胶酶(批号02220905,酶活性60 000 U/g,食品级,和氏璧生物科技有限公司);L-半胱氨酸(批号20211128,食品级,河北华阳生物科技有限公司);D-异抗坏血酸钠(批号20211120,食品级,江西省德兴市百勤异VC 钠有限公司); 植酸(批号20211206,食品级,桐乡鑫洋食品添加剂有限公司); 氯化钙 ( 批号20211217,食品级,江苏科伦多食品配料有限公司); 柠檬酸(批号20211211,食品级,潍坊英轩实业有限公司); β-环糊精(批号20211228,食品级,孟州市华兴生物化工有限责任公司); 山梨酸钾(批号20211115,食品级,山东昆达生物科技有限公司)。没食子酸对照品(批号21012903,纯度≥99%,成都普菲德生物技术有限公司); 福林酚(生物级,上海麦克林生化科技有限公司); 无水碳酸钠 (分析纯,成都市科隆化学品有限公司)。鲜麦冬 (无硫) 购于四川绵阳 (批号20220622),鲜芦根购于河南南阳 ( 批号20220614),经成都中医药大学龙飞副教授鉴定为正品; 藕购于湖北洪湖; 荸荠购于安徽芜湖; 皇冠梨购于河北。
2 方法与结果
2.1 复合褐变抑制剂配比优化
2.1.1 褐变抑制率测定 前期实验研究表明,五汁饮在第7 天后褐变反应趋于平稳,故本实验考察抑制剂在7 d 内对整体颜色的保护作用。根据课题组前期研究结果制备五汁饮,选取新鲜、大小均匀、无病虫害、无机械损伤的梨70 g、荸荠30 g、藕20 g,去皮,切块,榨汁,过滤,4 ℃、5 000 r/min 离心20 min,取上清液; 取麦冬5 g、芦根8 g,加入10 倍量蒸馏水浸泡30 min 后武火煮沸,再用文火煎煮60 min,合并3 次滤液,浓缩,冷却至室温,将上清液和滤液合并,纯水定容至100 mL,即得,在4 ℃下放置7 d。选择25 mm 孔径板、透射模式对Ci7XX0 色差仪进行黑白校准,测定亮度值(L∗)、红绿值(a∗)、黄蓝值(b∗),计算褐变指数、褐变抑制率[10-11],公式分别为褐变指数= [(X-0.31) ×100] /0.172 [X= (a∗+1.75×L∗) /(5.645×L∗+a∗-3.012×b∗) ]、褐变抑制率= [(BIX1-BIX2) /(BIX1-BIX0) ] ×100% (BIX0、BIX1、BIX2分别为对照品第0 天、对照品第7 天、样品第7 天的褐变指数)。
2.1.2 单因素试验 根据文献[12-14] 报道及前期预实验结果,选择柠檬酸、氯化钙、D-异抗坏血酸钠、β-环糊精、植酸、L-半胱氨酸作为抑制剂,以褐变抑制率为评价指标考察其抑制作用。其中,L-半胱氨酸属于天然抗酶促褐变物质,对褐变反应有较强的抑制作用[15],将其用量水平设定为0.30% ~0.50%; 植酸具有抗氧化功能,可清除活性氧,同时螯合易于催化氧化反应的二价阳离子(Fe2+、Cu2+等)[16],将其用量水平设定为0.1% ~0.3%; 氯化钙是多酚氧化酶(PPO) 活性抑制剂,其所含的钙离子与PPO 结合后可降低后者活性,从而抑制酶促褐变[17],将其用量水平设定为0.01% ~0.05%;D-异抗坏血酸钠用量水平设定为0.25% ~0.45%; β-环糊精是PPO 活性抑制剂,其内部空腔会与底物形成包合物组织酶后发生反应,从而发挥抑制作用[18],将其用量水平设定为0.20% ~0.40%; 柠檬酸有3 个羧基,能有效络合体系中的Fe2+、Cu2+等金属离子,控制其催化氧化反应[19],但其酸性较强,用量过高时会影响顺应性[20],将其用量水平设定为0.60% ~0.75%。结果见图1。

图1 单因素试验结果Fig.1 Results for single factor tests
2.1.3 Plackett-Burman 试验 以L-半胱氨酸(A)、柠檬酸(B)、植酸(C)、氯化钙(D)、D-异抗坏血酸钠(E)、β-环糊精(F) 用量为影响因素,褐变抑制率(Y) 为评价指标,结果见表1。再采用Design-Expert 8.0.6.1 软件对表1 数据进行回归分析,得方程为Y=80.19 +0.50A-0.63B+0.66C+0.44D+0.60E-0.40F,方差分析见表2,可知柠檬酸、D-异抗坏血酸钠、植酸用量有显著影响(P<0.05)。

表1 Plackett-Burman 试验设计与结果Tab.1 Design and results for Plackett-Burman tests
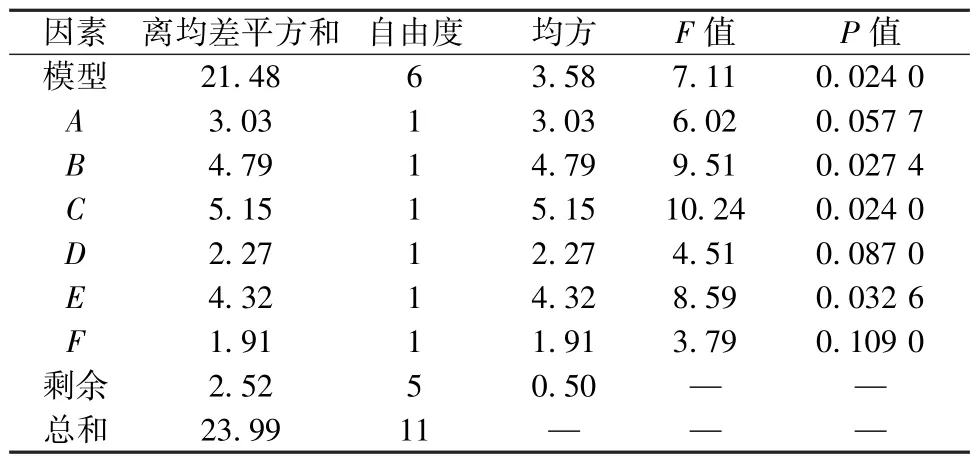
表2 Plackett-Burman 试验方差分析结果Tab.2 Results for analysis of variance for Plackett-Burman tests
2.1.4 Box-Behnken 响应面法 在单因素试验、Plackett-Burman 试验基础上结合 《GB 2760-2014食品添加剂使用标准》[21],采用Design Expert 8.0软件,以植酸(A)、柠檬酸(B)、D-异抗坏血酸钠(C) 用量为影响因素,褐变抑制率(Y) 为评价指标,因素水平见表3,结果见表4。
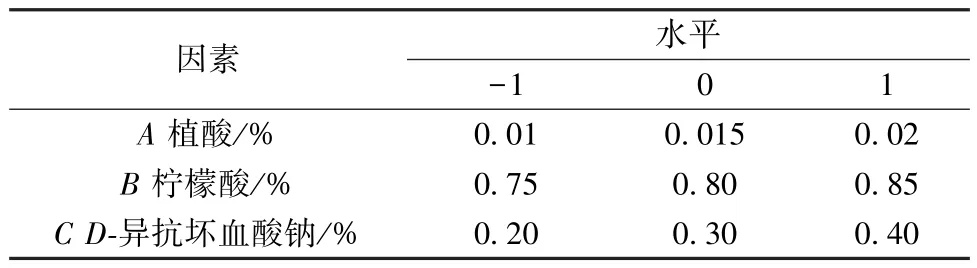
表3 Box-Behnken 响应面法因素水平(Ⅰ)Tab.3 Factors and levels for Box-behnken response surface method (Ⅰ)
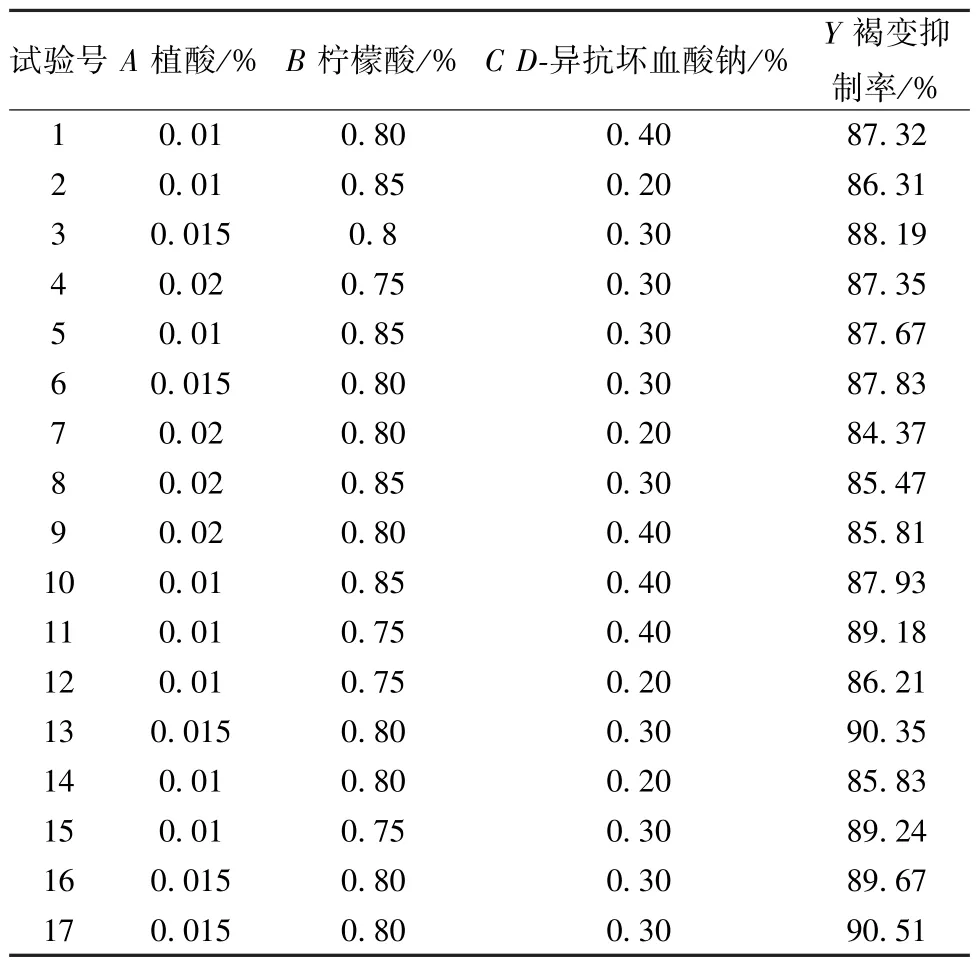
表4 Box-Behnken 响应面法设计与结果(Ⅰ)Tab.4 Design and results for Box-Behnken response surface method (Ⅰ)
采用Design Expert 8.0 软件对表4 数据进行回归分析,得方程为Y=89.31-0.88A-0.57B+0.94C- 0.078AB- 0.012AC- 0.34BC- 1.73A2+0.15B2-1.75C2,方差分析见表5。由此可知,模型P<0.05,具有高度显著性; 失拟项P>0.05,表明模型失拟项不显著; 相关系数R2为0.857 8,表明模型能解释85.78%响应值的变化,可用于预测分析。

表5 Box-Behnken 响应面法方差分析结果(Ⅰ)Tab.5 Results for analysis of variance for Box-Behnken response surface method (Ⅰ)
响应面分析见图2。由此可知,各因素之间存在一定正向交互作用,表现为简单非线性关系; 因素A、C、A2、C2有显著影响(P<0.05); 各因素影响程度依次为C>A>B。最终确定,最优配比为植酸用量0.015%,柠檬酸用量0.75%,D-异抗坏血酸钠用量0.34%,预测褐变抑制率为90.06%。
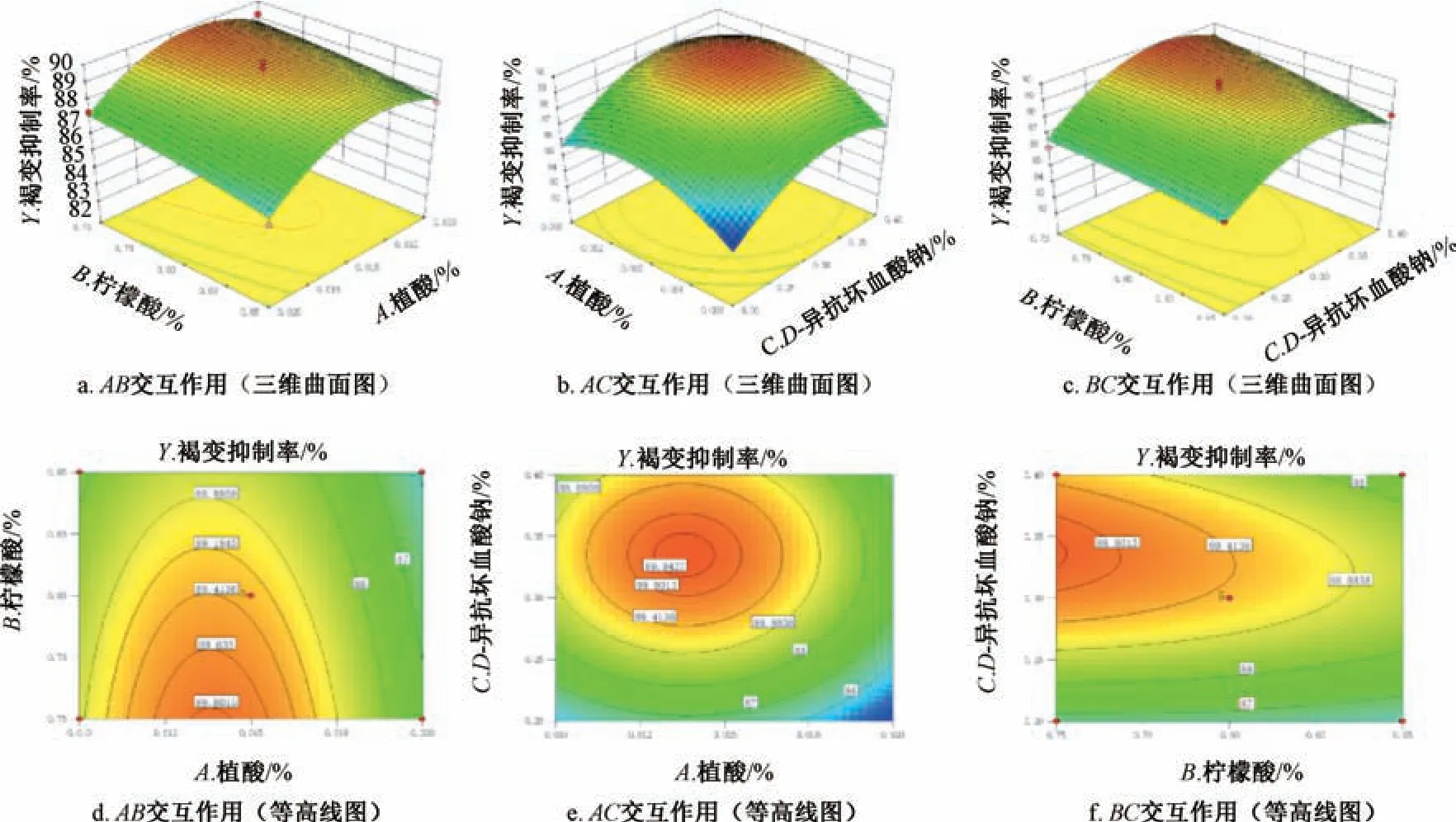
图2 各因素响应面图(Ⅰ)Fig.2 Response surface plots for various factors (Ⅰ)
2.2 酶解澄清工艺优化 五汁饮含有大量花青素类成分,在贮存过程中易受温度、光照等因素影响形成不溶性沉淀物,高速离心法、醇沉法均不能将其完全去除。课题组前期研究表明,果胶酶可有效去除不溶性组分,故本实验选择其作为酶解试剂。
2.2.1 多酚含量测定 参照文献 [22] 报道,采用福林酚法。取0.1 mL 样品,置于10 mL 量瓶中,加入0.5 mL 福林酚试剂、1.5 mL 15%Na2CO3溶液,充分混匀,蒸馏水定容至刻度,75 ℃水浴15 min,在760 nm 波长处测定吸光度,平行3 次。以吸光度为纵坐标(A),对照品质量浓度为横坐标(X) 进行回归,得方程为A=82.607X-0.007 4(R2=0.999 4),在0.000 ~0.007 mg/mL 范围内线性关系良好。
2.2.2 出膏率测定 取20 mL 样品,放到干燥至恒重的蒸发皿中,水浴蒸干,置于105 ℃干燥箱中干燥3 h,每隔1 h 称定质量直至恒重,计算出膏率,公式为出膏率= (干膏质量/药材质量×稀释倍数) ×100%。
2.2.3 澄清度测定 参考文献[23] 报道,以蒸馏水为空白凋零,取澄清后样品,在680 nm 波长处测定吸光度A,计算透光率T(即澄清度),公式为A=-lgT。
2.2.4 Box-Behnken 响应面法 采用Design Expert 8.0 软件,以果胶酶用量(A)、酶解温度(B)、酶解时间(C) 为影响因素,综合评分(Y) 为评价指标,因素水平见表6,结果见表7。
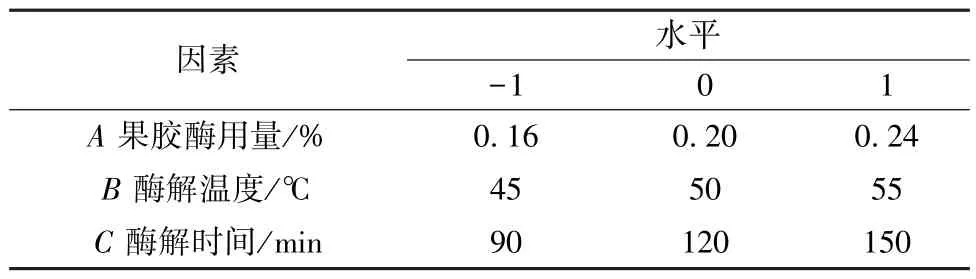
表6 Box-Behnken 响应面法因素水平(Ⅱ)Tab.6 Factors and levels for Box-behnken response surface method (Ⅱ)
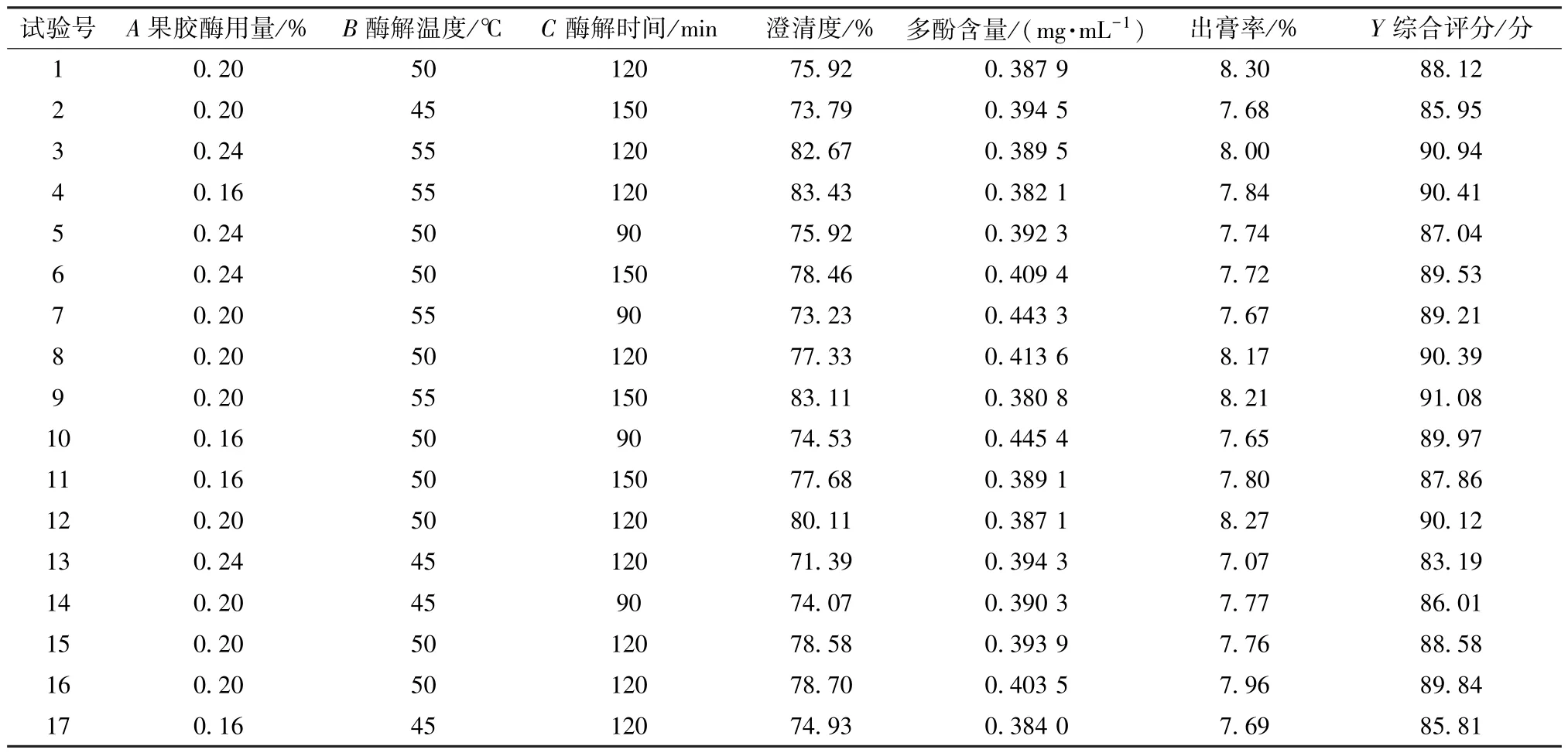
表7 Box-Behnken 响应面法设计与结果(Ⅱ)Tab.7 Design and results for Box-Behnken response surface method (Ⅱ)
采用Design Expert8.0 软件对表7 数据进行回归分析,得方程为Y=89.41-0.42A+2.59B+0.27C+0.79AB+1.15AC+0.48BC-0.64A2-1.18B2-0.17C2,方差分析见表8。由此可知,模型P<0.01,具有高度显著性; 失拟项P>0.05,表明模型失拟项不显著; 相关系数R2为0.919 2,表明模型能解释91.92% 响应值的变化,可用于预测分析。
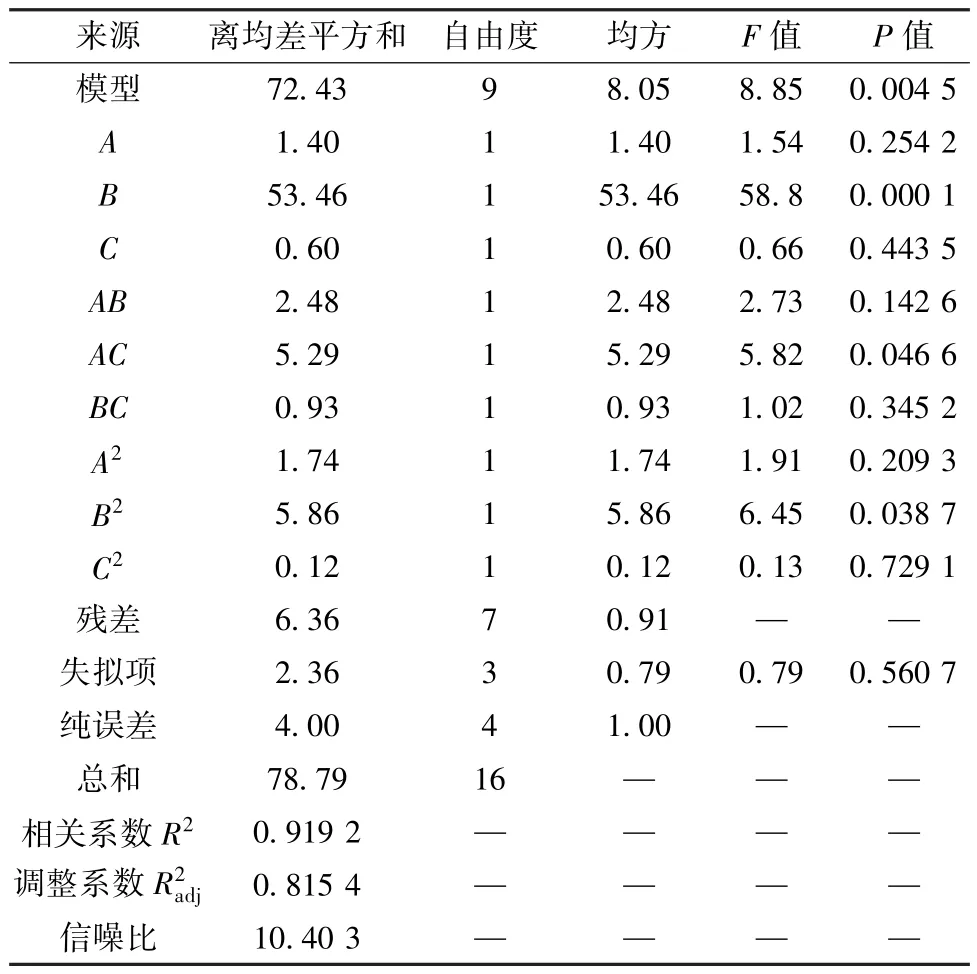
表8 Box-Behnken 响应面法方差分析结果(Ⅱ)Tab.8 Results for analysis of variance for Box-Behnken response surface method (Ⅱ)
响应面分析见图3。由此可知,各因素之间存在一定正向交互作用,其中B、B2、AC有显著影响(P<0.05); 各因素影响程度依次为B>A>C。最终确定,最优工艺为果胶酶用量0.23%,酶解温度54.13 ℃,酶解时间135 min,预测澄清度为80.95%,出膏率为8.11%,多酚含量为0.389 5 mg/mL,综合评分为91.28 分。
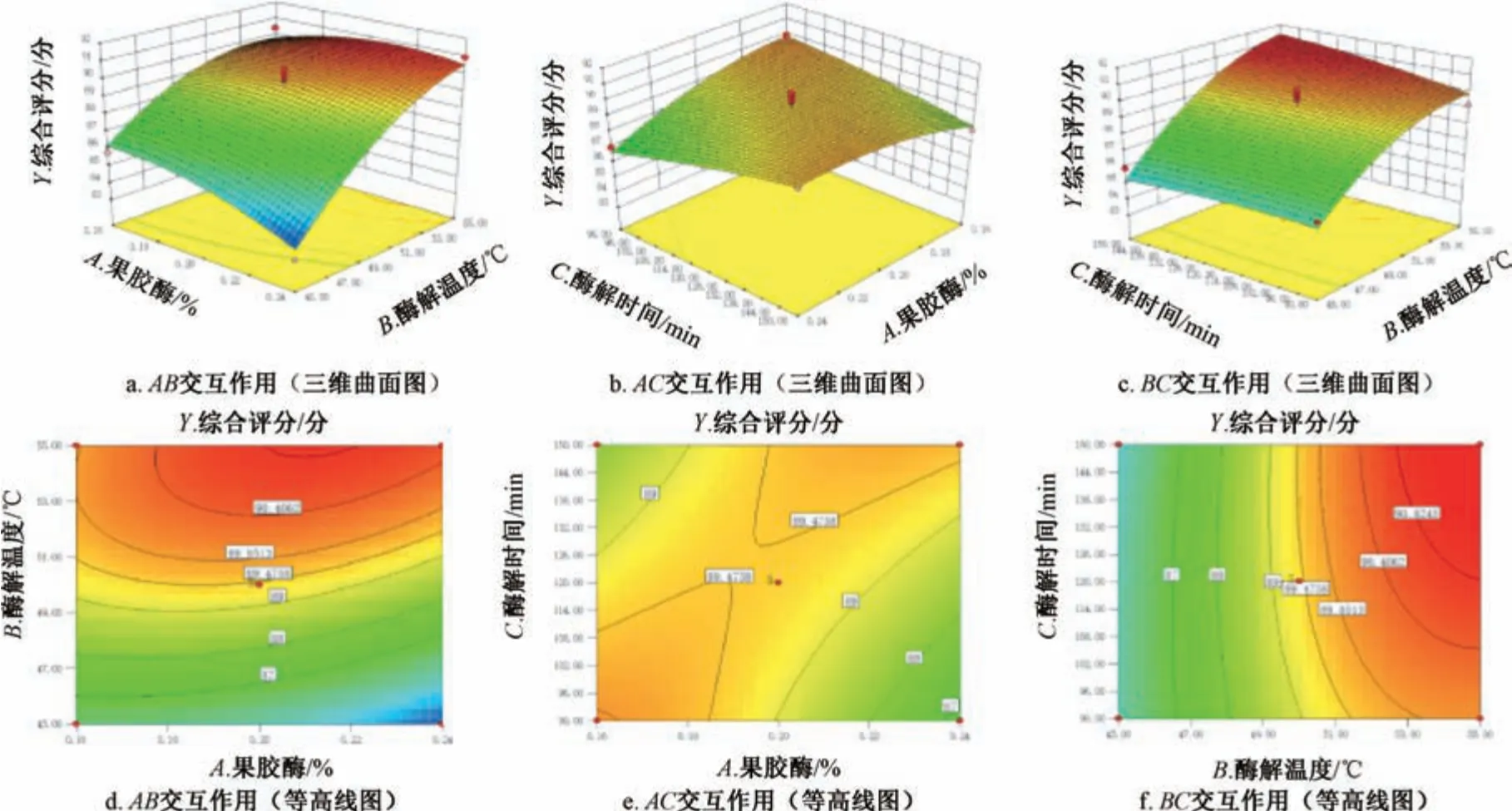
图3 各因素响应面图(Ⅱ)Fig.3 Response surface plots for various factors (Ⅱ)
2.2.5 权重系数确定
2.2.5.1 AHP 法 将澄清度、多酚含量、出膏率作为指标,结合预实验和文献[24] 报道拟定其重要性依次为澄清度>多酚含量=出膏率,构建优先判断矩阵,见表9。结果,上述指标权重系数分别为0.448 15、0.294 44、0.257 41,CR =0.018<0.10,表明三者权重具有一致性。

表9 各指标优先判断矩阵Tab.9 Priority judgment matrices for various indices
2.2.5.2 CRITIC 法 将数据进行无量纲化处理,即X′ij= (Xj-Xmin) /(Xmax-Xmin),并按如下公式计算指标权重,结果见表10。
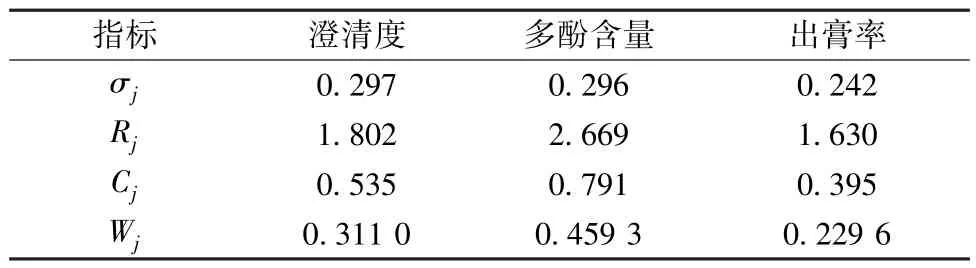
表10 CRITIC 权重计算结果Tab.10 Results for CRITIC weight calculation
2.2.5.3 AHP-CRITIC 复合加权法 在“2.2.5.1”“2.2.5.2” 项基础上计算综合权重W综合ij[25],公式为。结果,澄清度、多酚含量、出膏率综合权重分别为0.428 6、0.363 5、0.207 9。
2.2.5.4 综合评价 分别采用AHP 法、CRITIC法、AHP-CRITIC 复合加权法进行综合评价,结果见表11,可知3 种赋权方法所得综合评分接近。再采用SPSS 26.0 软件对上述结果进行相关性分析,测得AHP 法与AHP-CRITIC 复合加权法之间的相关系数为0.978,CRITIC 法与AHP-CRITIC 复合加权法之间的相关系数为0.936,AHP 法与CRITIC 法之间的相关系数为0.853,均有显著性差异(P<0.05),但在权重系数方面,AHP 法与CRITIC 法之间的相关系数为-0.316,无显著差异(P>0.05),表明两者所展示的信息无叠加,即AHP-CRITIC 复合加权法更科学合理。
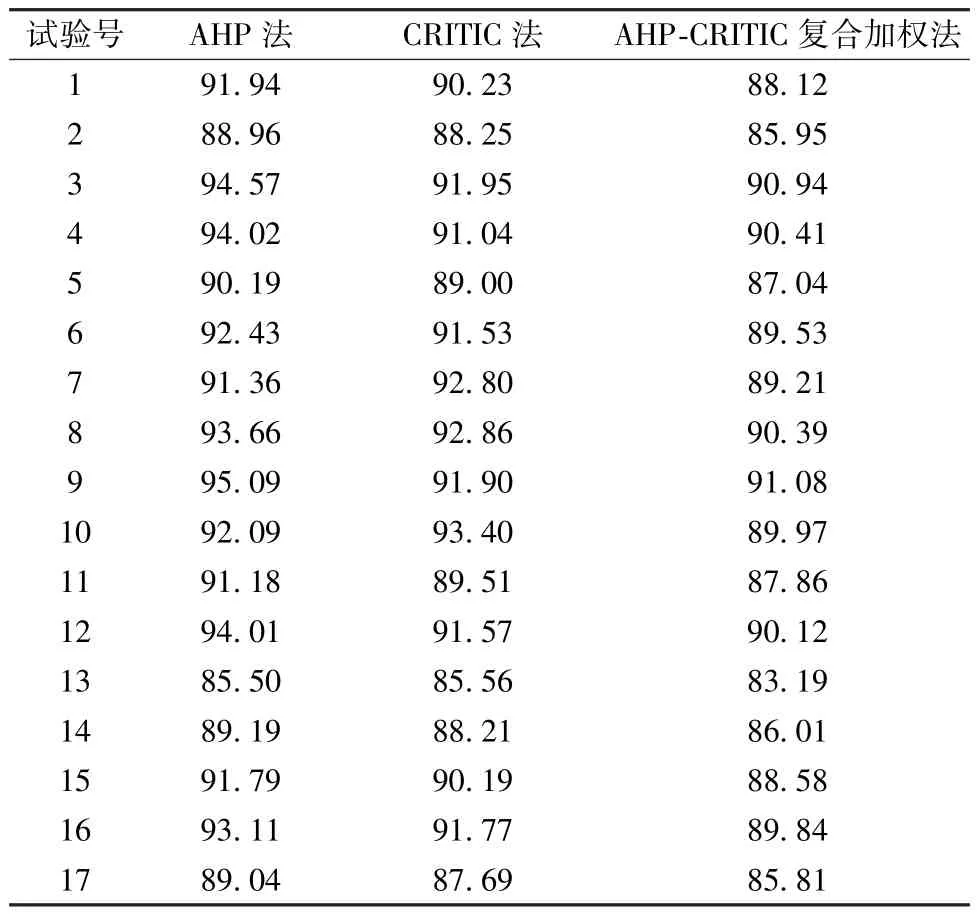
表11 3 种赋权方法综合评分(分)Tab.11 Comprehensive scores for three weighting methods (score)
2.3 验证试验
2.3.1 复合褐变抑制剂配比 按“2.1.1” 项下方法制备3 批样品,按“2.1.4” 项下优化配比添加复合褐变抑制剂,在4 ℃下放置7 d 后测定褐变抑制率,结果见表12。由此可知,平均褐变抑制率为89.54%,与预测值90.06% 接近(相对偏差为0.52%),表明该配方稳定可靠,可有效抑制褐变。

表12 复合褐变抑制剂配比验证试验结果(n=3)Tab.12 Results for verification tests for proportion of composite browning inhibitors (n=3)
2.3.2 酶解澄清工艺 按“2.1.1” 项下方法制备3 批样品,按“2.2.4” 项下优化工艺酶解澄清,测定多酚含量、出膏率、澄清度,计算综合评分,结果见表13。由此可知,平均综合评分为91.42 分,与预测值91.28 分接近(相对偏差为0.77%),表明该工艺稳定可靠,可有效去除不溶物,并保留有效成分。
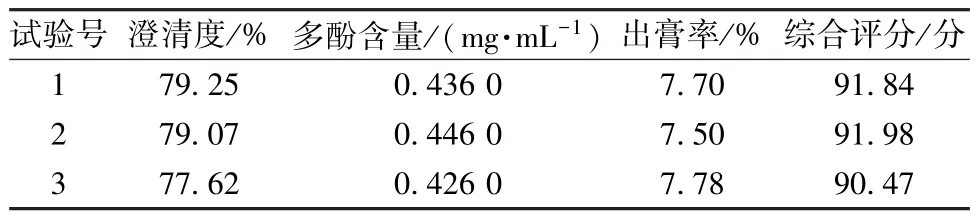
表13 酶解澄清工艺验证试验结果(n=3)Tab.13 Results for verification tests for enzymatic hydrolysis and clarification process (n=3)
2.3.3 整体工艺评价 仅添加复合褐变抑制剂时,样品在贮存后第2 天即出现大量沉淀,摇之不散;在酶解澄清前不添加复合褐变抑制剂时,样品酶解后褐变指数显著升高,样品整体上呈棕褐色; 先添加复合褐变抑制剂再酶解澄清时,样品颜色均一稳定,室温下放置72 h 无沉淀,褐变指数未明显升高,表明两者共同发挥抑制褐变的作用。
3 讨论
3.1 复合褐变抑制剂筛选 研究表明,天然植物和真菌提取物具有抑制褐变的潜力[26-29],但其制备工艺复杂,难以应用于工业化大生产。目前,控制产品褐变的常用方法为添加复合褐变抑制剂,可针对褐变反应不同机制发挥单一或复合的抑制作用[12-19]。本实验在前期文献查阅、市场调研的基础上结合药品、食品相关法规要求,采用Box-Behnken 响应面法优化复合抑制剂配伍,得到最优组成为0.015%植酸,0.75%柠檬酸,0.34%D-异抗坏血酸钠,可有效缓解五汁饮褐变。
3.2 澄清工艺筛选 研究表明,不溶性组分对褐变反应进程具有促进作用[9]。课题组前期发现,合适的澄清工艺对阻止褐变进程具有积极意义,而果胶酶可有效去除五汁饮中不溶性成分; 本实验在此基础上,采用AHP-CRITIC 复合加权法结合Box-Behnken 响应面法优化酶解澄清工艺,得到最优工艺为0.23%果胶酶,酶解时间135 min,酶解温度55 ℃,可有效去除五汁饮中的不溶物,与复合褐变抑制剂共同抑制褐变反应进程。
4 结论
本实验首先采用Box-Behnken 响应面法对相关数据进行建模,对因素不同水平进行分析,再通过AHP-CRITIC 复合加权法进行权重设计,筛选复合褐变抑制剂配方,优化酶解澄清工艺参数,最终得到最优五汁饮褐变抑制工艺。验证试验表明,所得结果真实可靠,工艺稳定可行,可为后续相关产品开发奠定基础。
