肤痒颗粒中9 种成分含量同时测定及其化学模式识别研究
2024-03-12肖春霞黄晓婧李婷婷赵小勤
肖春霞,黄晓婧,许 莉,李婷婷,李 及,赵小勤
(成都市药品检验研究院,国家药品监督管理局中药材质量监测评价重点实验室,四川 成都 610045)
肤痒颗粒由苍耳子(炒、去刺)、地肤子、川芎、红花、白英5 味中药组成,具有祛风活血、除湿止痒功效,用于治疗皮肤搔痒、湿疹、荨麻疹等皮肤病[1],目前该制剂质量执行标准收录于《中华人民共和国卫生部药品标准(中药成方制剂) 》第六册,但只有性状项、理化鉴别项、制剂通则检查项,无专属性质量控制项目[1],而局颁标准中的含量测定项也仅涉及阿魏酸或羟基红花黄色素A,难以有效控制其整体质量[2]。本实验选择肤痒颗粒中苍耳子、红花、川芎、白英特征性成分,包括新绿原酸、咖啡酸、绿原酸、隐绿原酸、羟基红花黄色素A、阿魏酸、洋川芎内酯I、洋川芎内酯H、洋川芎内酯A,采用UHPLC 法测定其含量[3-4],并进行化学模式识别[5-6],以期为更全面地控制该制剂质量提供参考。
1 材料
Waters Acquity H class 超高效液相色谱仪(美国Waters 公司); XPE26 电子天平(瑞士梅特勒-托利多公司,0.001 mg); AUX220 电子天平(日本岛津公司,0.1 mg); SK250H 超声仪(上海科导超声仪器有限公司); 20~200 μL 移液枪(德国Eppendorf 公司); 超纯水制备系统(美国Millipore 公司)。
绿原酸(纯度96.8%,批号110753-201817)、咖啡酸(纯度99.7%,批号110885-201703)、羟基红花黄色素A (纯度93.1%,批号111637-201810)、阿魏酸 (纯度99.4%,批号110773-201915) 对照品均由中国食品药品检定研究院提供; 新绿原酸对照品 ( 纯度≥98%,批号19042305) 由成都普菲德生物技术有限公司提供;隐绿原酸对照品 (纯度99.1%,批号MUST-20042403) 由成都曼斯特生物科技有限公司提供;洋川芎内酯I (纯度≥98.0%,CAS 号94596-28-8,批号CFS202002)、洋川芎内酯H (纯度≥98.0%,CAS 号94596-27-7,批号CFS202001)、洋川芎内酯A (纯度≥98.0%,CAS 号62006-39-7,批号CFS202002) 对照品均由上海源叶生物科技有限公司提供。
乙腈为色谱纯,购自美国Thermo 公司; 磷酸为色谱纯,购自天津市科密欧化学试剂有限公司;甲醇为分析纯,购自广东光华科技股份有限公司;水为超纯水。
肤痒颗粒共120 批,来自6 家企业,具体见表1。
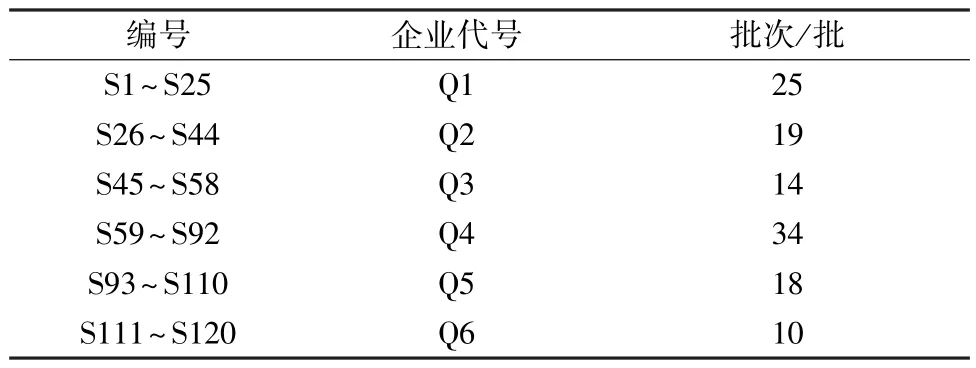
表1 样品信息Tab.1 Information of samples
2 方法与结果
2.1 色谱条件 Waters Acquity UPLC ® BEH C18色谱柱(150 mm×2.1 mm,1.7 μm); 流动相乙腈(A) -0.01% 磷酸 (B),梯度洗脱 (0 ~25 min,3% ~4%A; 25 ~30 min,4% ~10%A; 30 ~40 min,10% ~18% A; 40 ~48 min,18% ~30% A; 48 ~55 min,30% ~50% A; 55 ~58 min,50% ~70% A;58~60 min,70%A); 体积流量0.4 mL/min; 柱温35 ℃; 检测波长0 ~21 min 325 nm,21 ~25 min 390 nm,25~40 min 322 nm,40 ~60 min 278 nm;进样量1 μL。色谱图见图1。
2.2 溶液制备
2.2.1 对照品溶液 精密称取咖啡酸、洋川芎内酯H 对照品适量,25%甲醇制成每1 mL 分别含两者0.638 6、0.286 5 mg 的溶液,作为对照品溶液①; 精密称取洋川芎内酯I 对照品适量,25%甲醇制成每1 mL 含0.804 5 mg 该成分的溶液,作为对照品溶液②; 精密称取洋川芎内酯A 对照品适量,25%甲醇制成每1 mL 含0.743 6 mg 该成分的溶液,作为对照品溶液③; 精密称取新绿原酸、绿原酸、隐绿原酸、羟基红花黄色素A、阿魏酸对照品适量,置于25 mL 量瓶中,25%甲醇溶解,精密加入对照品溶液①、③各1 mL,对照品溶液②2.5 mL,25%甲醇定容至刻度,即得每1 mL 分别含新绿原酸0.203 9 mg、咖啡酸0.025 5 mg、绿原酸0.384 9 mg、隐绿原酸0.403 5 mg、羟基红花黄色素A 0.621 9 mg、阿魏酸0.095 9 mg、洋川芎内酯I 0.080 5 mg、洋川芎内酯H 0.011 5 mg、洋川芎内酯A 0.029 7 mg 的贮备液,精密吸取1.25 mL,置于50 mL 量瓶中,25% 甲醇稀释至刻度,即得每1 mL分别含新绿原酸5.097 5 μg、咖啡酸0.637 5 μg、绿原酸9.622 5 μg、隐绿原酸10.087 5 μg、羟基红花黄色素A 15.547 5 μg、阿魏酸2.397 5 μg、洋川芎内酯I 2.012 5 μg、洋川芎内酯H 0.287 5 μg、洋川芎内酯A 0.742 5 μg 的对照品溶液。
2.2.2 供试品溶液 参考文献[7-8] 报道,精密称取本品粉末1.0 g 或0.6 g (低蔗糖) 或0.3 g(无蔗糖),置于锥形瓶中,精密加入25%甲醇25 mL,称定质量,超声处理30 min,放冷,甲醇补足减失的质量,摇匀,过滤,取续滤液,即得。
2.2.3 阴性样品溶液 按照处方和工艺,分别制成缺红花,缺川芎,缺苍耳子、川芎和白英的阴性样品,按“2.2.2” 项下方法制备,即得。
2.3 方法学考察
2.3.1 线性关系考察 精密吸取“2.2.1” 项下贮备液适量,25%甲醇稀释成系列质量浓度,分别精密吸取1 μL,在“2.1” 项色谱条件下进样测定。以对照品峰面积(Y) 对其进样量(X) 进行回归[6],结果见表2,可知各成分在各自范围内线性关系良好。
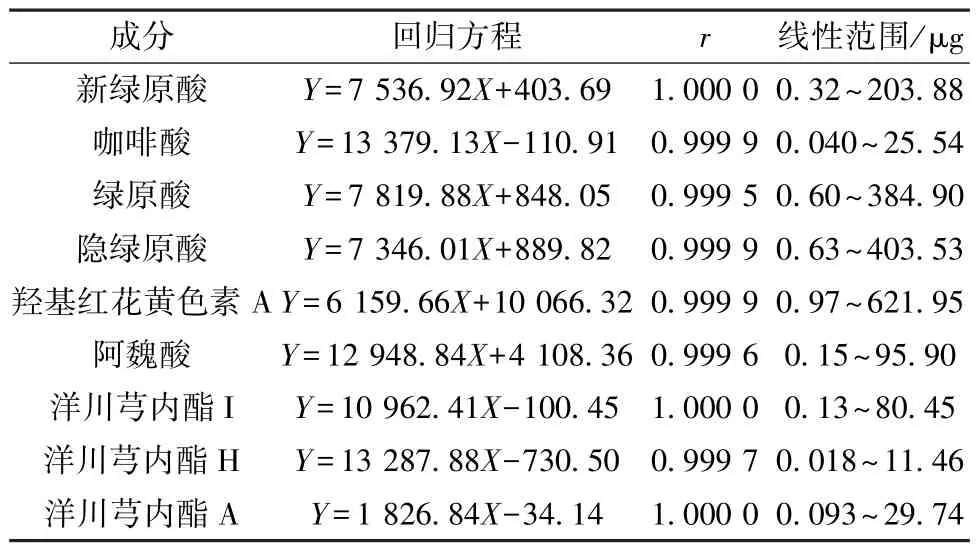
表2 各成分线性关系Tab.2 Linear relationships of various constituents
2.3.2 精密度试验 取“2.2.1” 项下对照品溶液适量,在“2.1” 项色谱条件下进样测定6 次,测得各成分峰面积RSD 分别为新绿原酸0.83%、咖啡酸2.11%、绿原酸0.70%、隐绿原酸0.93%、羟基红花黄色素A 0.92%、阿魏酸0.88%、洋川芎内酯I 0.71%、洋川芎内酯H 0.67%、洋川芎内酯A 1.81%,表明仪器精密度良好。
2.3.3 稳定性试验 精密称取本品(S1) 1 g,按“2.2.2” 项下方法制备供试品溶液,于0、4、8、12、20、24 h 在“2.1” 项色谱条件下进样测定,测得各成分峰面积RSD 分别为新绿原酸0.90%、咖啡酸2.35%、绿原酸0.44%、隐绿原酸0.66%、羟基红花黄色素A 0.81%、阿魏酸0.43%、洋川芎内酯I 0.49%、洋川芎内酯H 0.49%、洋川芎内酯A 1.94%,表明溶液在24 h 稳定性良好。
2.3.4 重复性试验 取同一份本品(S1),研细,精密称取6 份,每份1 g,按“2.2.2” 项下方法制备供试品溶液,在“2.1” 项色谱条件下进样测定,测得各成分含量RSD 分别为新绿原酸2.24%、咖啡酸1.58%、绿原酸1.76%、隐绿原酸2.48%、羟基红花黄色素A 2.83%、阿魏酸2.68%、洋川芎内酯I 1.15%、洋川芎内酯H 1.06%、洋川芎内酯A 2.42%,表明该方法重复性良好。
2.3.5 加样回收率试验 精密称取各成分含量已知的本品(S1) 9 份,每份0.5 g,分为3 组,分别精密加入对照品溶液 (每1 mL 含新绿原酸40.78 μg、咖啡酸5.10 μg、绿原酸76.98 μg、隐绿原酸80.70 μg、羟基红花黄色素A 124.38 μg、阿魏酸19.18 μg、洋川芎内酯I 16.10 μg、洋川芎内酯H 2.30 μg、洋川芎内酯A 5.94 μg) 1、2、3 mL,按“2.2.2” 项下方法制备供试品溶液,在“2.1” 项色谱条件下进样测定,计算回收率。结果,新绿原酸、咖啡酸、绿原酸、隐绿原酸、羟基红花黄色素A、阿魏酸、洋川芎内酯I、洋川芎内酯H、洋川芎内酯A 平均加样回收率分别为97.14%、95.50%、96.80%、96.91%、99.51%、102.25%、94.97%、98.06%、93.89%,RSD 分别为0.85%、1.64%、1.84%、2.38%、2.33%、1.33%、1.75%、1.59%、2.88%。
2.4 样品含量测定 取6 家企业120 批样品,按“2.2.2” 项下方法制备供试品溶液,在“2.1” 项色谱条件下进样测定,计算含量,结果见表3。

表3 各成分含量测定结果Tab.3 Results for content determination of various constituents
然后,以各成分平均含量为指标绘制雷达图[6,9],见图2。由此可知,企业Q1、Q4、Q6 整体轮廓均较大,表明样品中各成分平均含量较高,其中Q1 轮廓基本呈现一个类圆形,表明产品质量良好; Q3 轮廓明显小于其他企业,表明产品可能存在质量较低的风险; Q5 轮廓呈现一个锐尖角形,阿魏酸含量较高,其余成分含量较低,并且该企业执行标准中收载了阿魏酸,虽然严格保证了该成分质量,但忽略了产品整体质量; 同一成分在不同企业样品中的含量差异很大,例如Q4 样品中羟基红花黄色素A 含量是在Q3 样品中的42 倍,阿魏酸含量仅是在Q5 样品中的1/5。
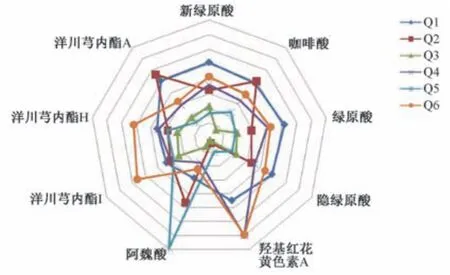
图2 各成分平均含量雷达图Fig.2 Radar chart for average contents of various constituents
2.5 化学模式识别研究
2.5.1 热图聚类分析 以120 批样品中各成分含量为指标,采用Heml-1.0 软件,选择欧式距离、远邻法进行热图聚类分析[10],结果见图3。其中,行代表各成分,列代表样品,通过颜色冷暖(红绿深浅) 来显示各成分含量高低。
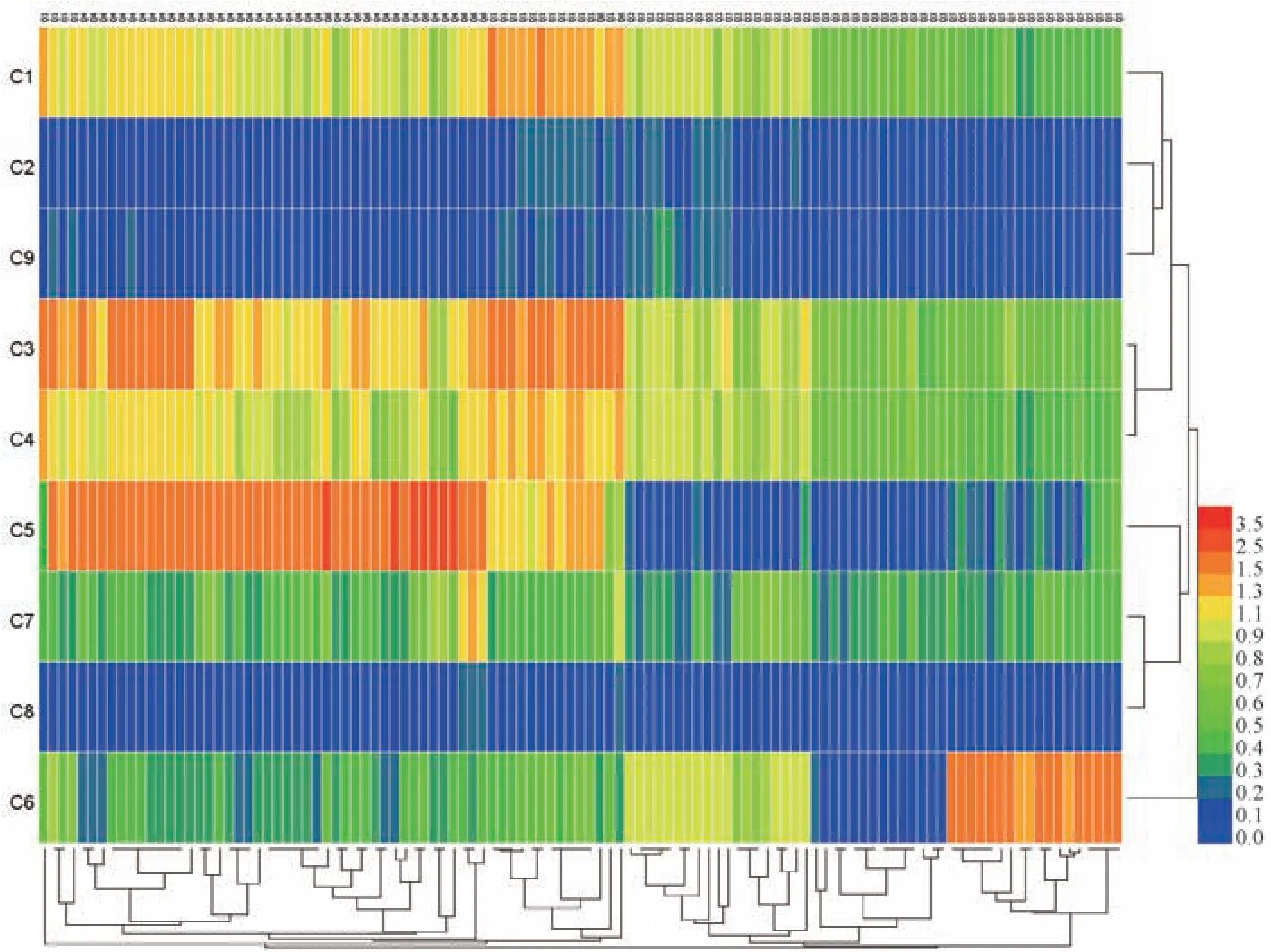
图3 各成分含量热图聚类分析Fig.3 Heatmap clustering analysis of contents of various constituents
由此可知,企业Q1、Q4、Q6 整体条带颜色偏暖,表明样品中各成分含量较高; Q3 整体条带颜色均偏冷,表明样品中各成分含量较低,与图2 一致; Q1、Q4 样品基本各自聚类,而Q6 样品分散于两者分组中,表明其质量一致性较差; 除Q6外,其余企业样品各自聚为一类,表明其各自质量一致性较好,但不同企业样品质量一致性较差;C6 (阿魏酸) 聚为一类,其他成分聚为一类,表明阿魏酸是区分各样品的主要成分[9]。
2.5.2 主成分分析 以各成分含量为变量,采用SIMCA 14.1 软件对120 批样品进行主成分分析[9,11-13],发现贡献率最大的2 个主成分累积贡献率超过64%,可较好地体现肤痒颗粒基本特征和主要信息[14]。因此,本实验以上述2 个主成分为坐标轴构建主成分平面,将多元变量通过降维方式投影在二维平面上,观察样品整体分布情况和各变量对样品分布的贡献[14],结果见图4~5。

图4 主成分分析得分散点图Fig.4 Score scatter plot for principal component analysis
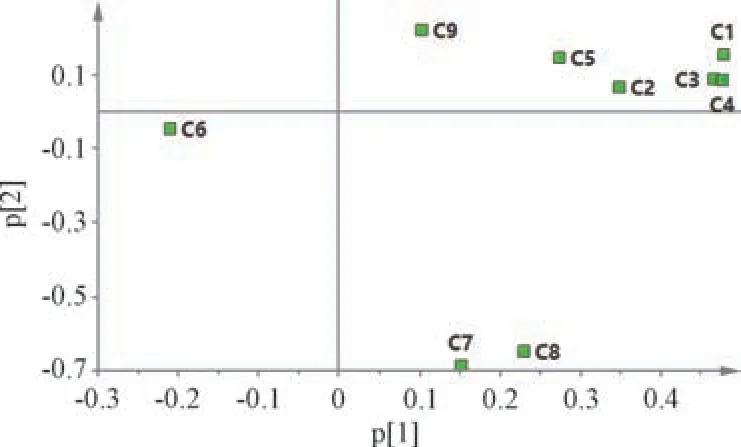
图5 主成分分析载荷图Fig.5 Loading plot for principal component analysis
由此可知,企业Q1 ~Q5 分别出现明显的分类,表明样品质量一致性较好; Q6 分散在Q1、Q4中,表明其质量一致性较差,与图3 一致; C6(阿魏酸) 离原点的距离最远,表明它是不同企业样品质量差异的重要指标[9]。
3 讨论
课题组前期发现,不同企业提供的投料药材红花、川芎主要成分含量差异较大,并且工艺和参数存在较大差异。本实验结果也表明,同一企业生产的不同批次样品之间质量一致性较好,而不同企业生产的存在较大差异,这就需要有关部门强化监管意识,企业采用合格原料药材并严格按照相关标准投料和生产,以期保证药品质量[15]。
中药药效是多种成分的综合效应,作用机制复杂[16],故活性成分越多,含量越高,药效可能越好。本实验查阅文献[17-21] 发现,羟基红花黄色素A 来源于红花,阿魏酸、洋川芎内酯I、洋川芎内酯H、洋川芎内酯A 均来源于川芎,新绿原酸、咖啡酸、绿原酸均来源于苍耳子、川芎、白英,隐绿原酸来源于苍耳子、白英。
4 结论
本实验建立UHPLC 法同时测定6 家企业120批肤痒颗粒中新绿原酸、咖啡酸、绿原酸、隐绿原酸、羟基红花黄色素A、阿魏酸、洋川芎内酯I、洋川芎内酯H、洋川芎内酯A 的含量,覆盖了方中80%的药味,具有较强的代表性,并且采用雷达图、热图聚类分析、主成分分析等化学模式识别手段,能较全面地反映该制剂整体质量情况,从而为其质量控制提供可行的技术参考和客观数据。
