室温钠-硫电池电解液的研究现状与展望(Ⅰ)
2024-03-11侯润乔袁守怡王永刚
侯润乔,袁守怡,王永刚*
(1.复旦大学化学系,上海 200438;2.昆明理工大学冶金与能源学院,云南 昆明 650031)
面对资源有限和环境污染的压力,优化调整能源结构迫在眉睫。包括风力、水力和太阳能等在内的可再生能源正逐步取代现有的化石能源。可再生能源的开发和利用面临着季节间歇性、气候不可控性的问题,因此,储能已成为发展新型能源技术必不可少的关键环节[1]。
如今商业锂离子电池的比能量可达到240 W·h/kg[2],但是与我国《节能与新能源汽车技术路线图2.0》[3]和《新能源汽车产业发展规划(2021-2035年)》[4]提出的目标(比能量大于500 W·h/kg,循环寿命大于6 000 次以及价格低于0.35 元/W)仍有很大距离。为了找到锂离子电池的代替品,人们研发了各种各样类型的电池。
不同于传统的嵌入型电池,转化型电池以高能量密度和低成本的优势引起了人们广泛的研究兴趣。传统嵌入型正极材料包括Li[NixCoyMn1-x-y]O2(NCM)、Li1.2Ni0.2Mn0.6O2、Na3V2(PO4)3(NVP)、Na4Fe3(PO4)2(P2O7)(NFPP)等,涉及Ni、Co、Mn、V 等多种金属元素,以Li+/Na+在正负极之间的可逆嵌入和脱出进行能量转换[5-6]。转化型的锂-硫(Li-S)、钠-硫(Na-S)电池通常采用硫碳复合正极,以硫与硫化锂/钠之间的可逆电化学反应为工作机理[7]。得益于硫的高理论比容量(1 675 mAh/g)和低成本,锂-硫、钠-硫电池的理论比能量分别达2 669 W·h/kg 和1 274 W·h/kg[8],远高于嵌入型电池,同时具有突出的经济成本优势。如图1所示,锂-硫、钠-硫电池的能量成本分别为8.97 元/kW·h 和0.15 元/kW·h,远低于嵌入型的磷酸铁锂-石墨电池和磷酸焦磷酸铁钠-硬碳电池。此外,硫拥有良好的生物相容性,对人体而言,天然单质硫是无毒无害的[9]。

图1 不同电池能量成本的比较Fig.1 Comparison of energy cost of different batteries
锂-硫电池虽然比能量高于钠-硫电池,但发展受到金属锂的高成本(775 000 元/吨)[10]和低地壳丰度(2.2×10-3%)的限制[11]。不仅如此,金属锂主要由碳酸锂制备得来,而碳酸锂生产方法单一[12]。相比之下,钠是地球上第六丰富的元素,广泛分布在地壳中(2.567%)[11],开采和制备更便利,生产工艺更成熟,因此,成本(18 500 元/吨)远低于金属锂[10]。此外,与金属锂不同的是,钠与铝不发生反应,可用轻质便宜的铝箔代替铜箔作为负极集流体应用在钠-硫电池中,进而提高比能量并降低成本[13]。从技术经济和可持续发展的角度来看,钠-硫电池比锂-硫电池更有发展潜力,更有助于缓解资源压力。
最初的钠-硫电池由J.T.Kummer 等[14]研发成型,工作温度为300 ~350 ℃,由熔融钠负极、熔融硫正极和β-Al2O3固体电解质组成,被称为高温钠-硫(HT Na-S)电池。高温钠-硫电池的正负极均处于熔融态,虽然能避免枝晶的形成,但带来了严重的安全问题和高昂的运行成本,使得商业高温钠-硫电池不适用于电动汽车,仅适用于固定电站储能。此外,由于高温钠-硫电池的最终放电产物为Na2S3,比容量仅557 mAh/g(相应的比能量为760 W·h/kg)[15],加之高温钠-硫需要一小部分能量用于维持工作温度,导致可用储能密度较低。2003年,日本NGK 公司开始生产高温钠-硫电池,率先将高温钠-硫电池产业化,然而2011年的火灾却迫使高温钠-硫电池暂时停产[16]。
K.M.Abraham 等[17]发现,甘醇二甲醚可以作为正极液在150~300 ℃下溶解硫和固体Na2Sx(x<3),奠定了中温钠-硫(IMT Na-S)电池的基础。中温钠-硫电池的硫氧化还原机理与高温钠-硫电池类似,正负极同样处于熔融态,因此,在消除枝晶问题的同时,也面对着使用腐蚀性熔融钠的安全问题和较高的维护成本。
直至2006年,可在环境温度(25 ℃)下工作的室温钠-硫(RT Na-S)电池方才问世[18]。相比于高温钠-硫和中温钠-硫电池,室温钠-硫电池显著减少了潜在的安全隐患,并降低了电池的维护成本。此外,室温钠-硫电池实现了从S8到Na2S的完全转变,理论比能量高达1 274 W·h/kg。然而,室温钠-硫电池存在钠枝晶生长、硫正极体积大幅度变化、电子电导率低和多硫化物穿梭效应等问题。目前,研究人员专注于从正极材料设计和电解液优化两个方面来解决这些问题。最近几年,关于室温钠-硫电池电解液改性的研究非常多,但欠缺对改性优化机理和电解液设计原则的相关总结。
本文作者详细讨论了室温钠-硫电池在酯类和醚类电解液中的不同充放电机理,针对室温钠-硫电池的主要挑战——抑制多硫化钠穿梭并改善硫反应动力学,以及构筑稳定固体电解质相界面(SEI)膜并抑制钠枝晶生长,系统综述室温钠-硫电池酯类、醚类电解液和添加剂的研究进展,着重分析优化改性的具体机理。最后,对未来室温钠-硫电池电解液的设计原则提出设想,展望室温钠-硫电池电解液的研究方向。
1 钠-硫电池的充放电机理
钠-硫电池有固-液-固和固-固两种充放电机理,主要取决于负载硫的碳材料。对于孔径小于2 nm 的微孔碳,长链多硫化钠的形成和溶解将被抑制,硫转化机理偏向固-固机理;对于介孔碳和大孔碳,虽然硫载量得到提高,但长链多硫化物的溶解和穿梭效应严重,硫转化机理偏向固-液-固机理。这两种机理适用的电解液亦有所不同。
1.1 固-液-固充放电机理
若硫负载材料的孔径较大(介孔碳和大孔碳),正极中的元素硫以S8的形式存在,则多硫化钠在充放电的过程中将主要经历固-液-固转变。由于酯类电解液的羰基碳将与液相多硫化钠发生严重的亲核反应,适配的电解液为醚类电解液[19]。采用四乙二醇二甲醚(TEGDME)电解液的钠-硫电池的循环伏安(CV)曲线见图2[20],充放电曲线见图3[21]。
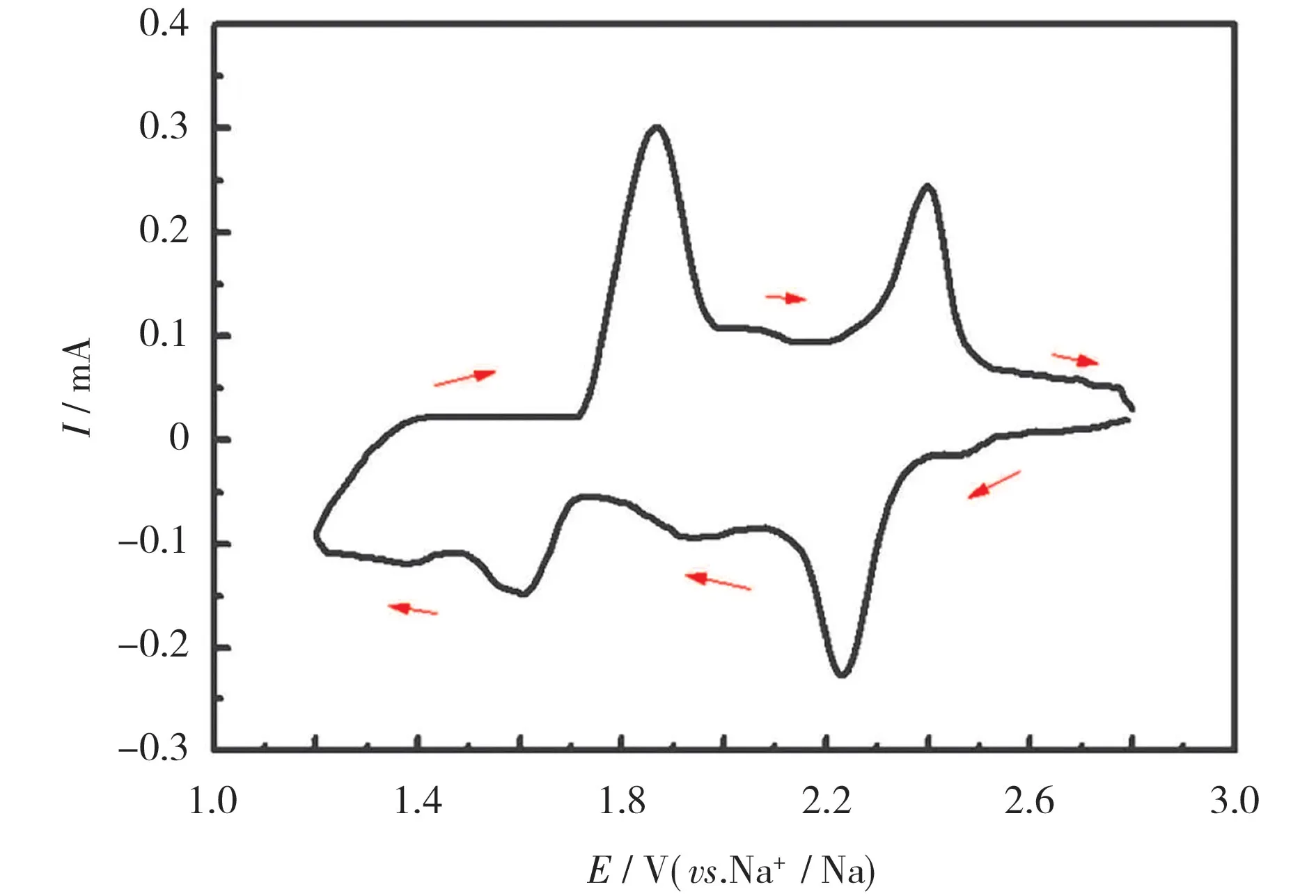
图2 采用醚类电解液1.5 mol/L NaClO4+0.3 mol/L NaNO3/TEGDME 的钠-硫电池的CV 曲线[20]Fig.2 CV curves of sodium(Na)-sulfur(S)battery using ether based electrolyte 1.5 mol/L NaClO4+0.3 mol/L NaNO3/tetraethylene glycol dimethyl ether(TEGDME)[20]
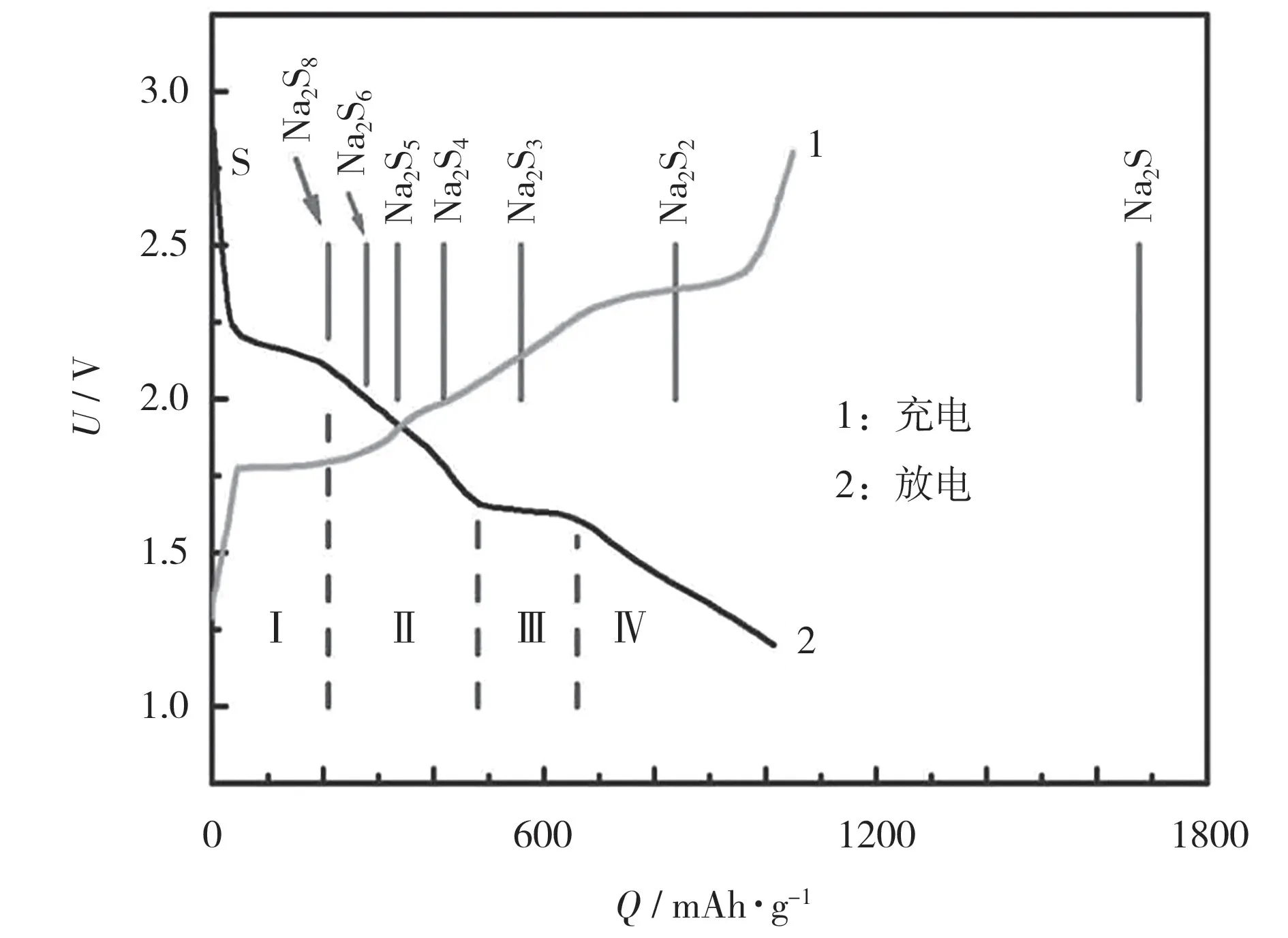
图3 采用醚类电解液1.5 mol/L NaClO4+0.3 mol/L NaNO3/TEGDME 的钠-硫电池的充放电曲线[21]Fig.3 Charge-discharge curves of Na-S battery using ether based electrolyte 1.5 mol/L NaClO4+0.3 mol/L NaNO3/TEGDME[21]
从图2 可知,基于醚类电解液的钠-硫电池在2.20 V 和1.65 V 处有两个明显的还原峰,对应于放电曲线中的两阶段放电平台,因此,整个放电曲线可简单地分为4 个区域[22]:
区域Ⅰ是约2.20 V 的高电压平台,对应从S8到Na2S8的固-液转变:
区域Ⅱ是从2.20 V 到1.65 V 的倾斜曲线,对应从Na2S8到Na2S4的液-液转变:
区域Ⅱ是机理最为复杂的区域,存在着若干种多硫化钠之间的相互转变,可能包括以下反应:
区域Ⅲ是约1.65 V 的低电压平台,对应从Na2S4到Na2S3、Na2S2、Na2S 的液-固转变:
区域Ⅳ是从1.65 V 到1.20 V 的倾斜曲线,对应从Na2S2到Na2S 的固-固转变:
在接下来的充电过程中,短链Na2Sx将分两步转化为长链Na2Sx,最后转化为S8。
图4 中的XRD 图阐明了多硫化物在初始充电和放电过程中的转变[23]。
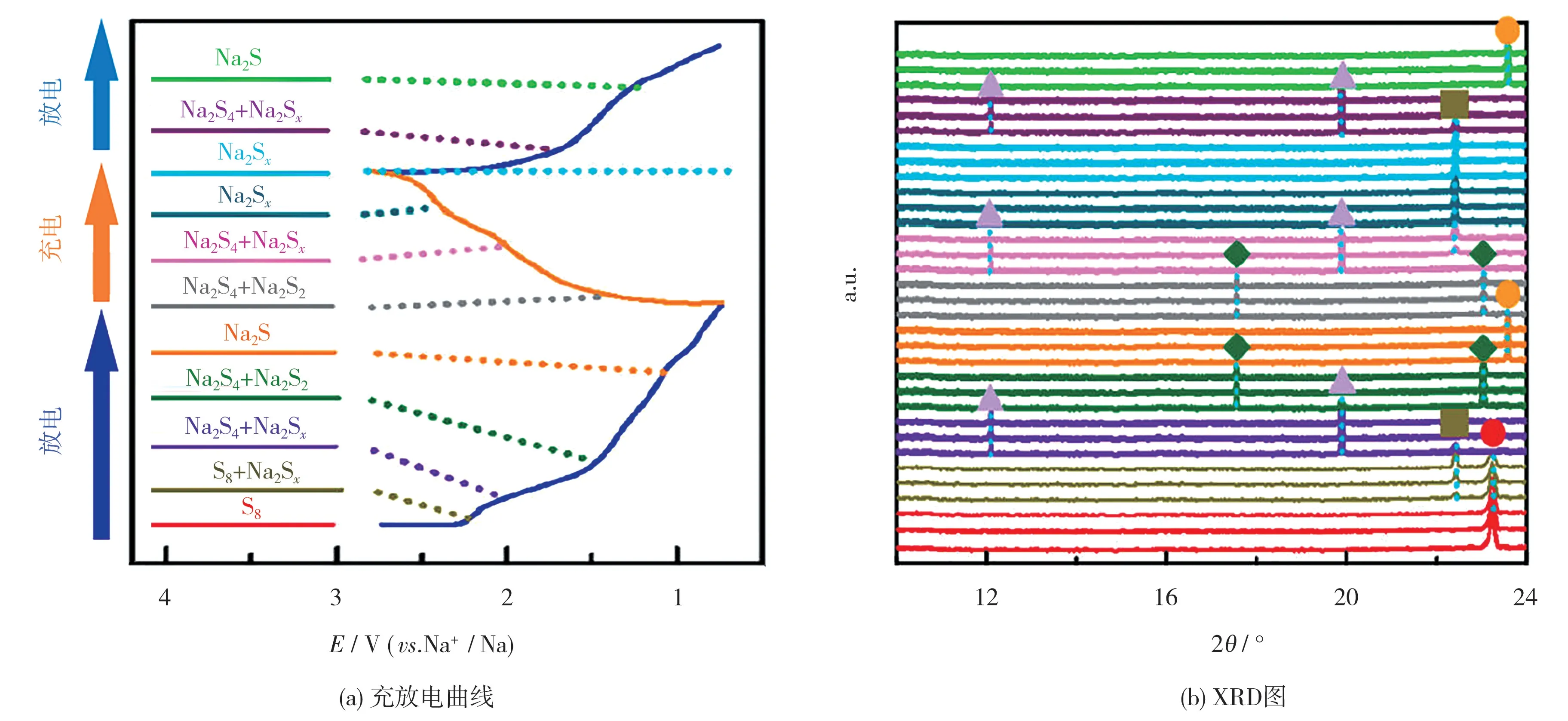
图4 钠-硫电池中硫正极首次循环的充放电曲线及相应的XRD 图[23]Fig.4 Charge-discharge curves and corresponding XRD pattern in the initial cycle of sulfur positive electrode in Na-S battery[23]
长链Na2Sx在醚类电解液中高度可溶,加快了多硫化钠转变的反应动力学,但也造成了严重的穿梭效应,导致电池容量快速衰减。
1.2 固-固充放电机理
如果硫负载材料的孔径比较小,一般是微孔碳(孔径小于2 nm),正极中元素硫以小分子S2~4的形式存在。在充放电过程中,活性硫主要经历S2~4到S22-、S2-的固-固转变(S2~4→Na2S2、Na2S),不存在Na2S8和Na2S6等液相中间体[22]。C.Wu 等[24]制备了具有连续孔分布的多孔碳球作为硫负载材料,具有0.5 ~1.6 nm 的微孔和少量1.8 ~3.2 nm的介孔,在酯类电解液中的充放电曲线见图5,原位XRD 图见图6。
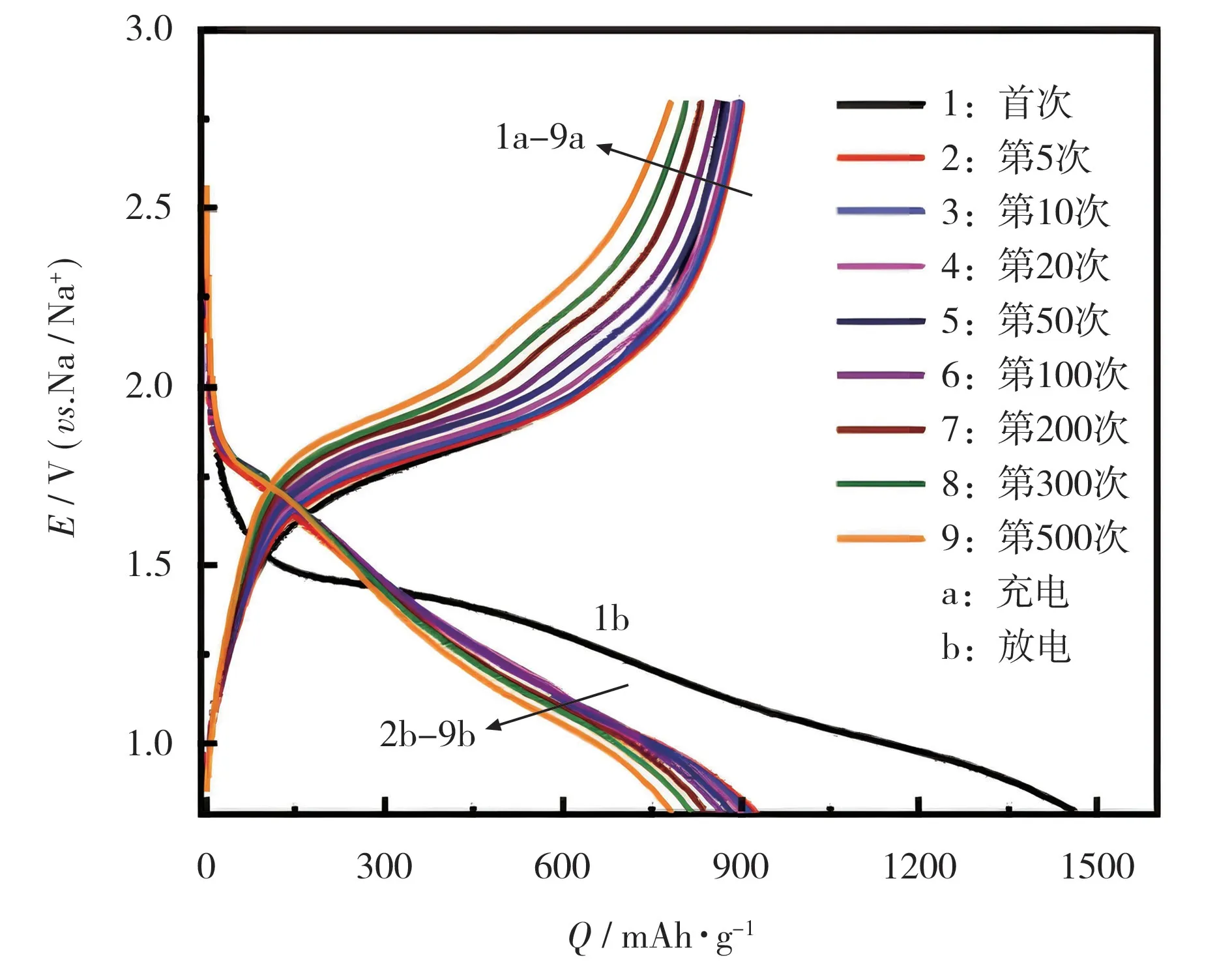
图5 MMPCS-800@S 在0.5 A/g 下的充放电曲线[24]Fig.5 Charge-discharge curves of micro-mesoporous carbon nanospheres(MMPCS)-800@S at 0.5 A/g[24]

图6 MMPCS-800@S 钠-硫电池的原位XRD 图[24]Fig.6 In situ XRD patterns of MMPCS-800@S Na-S battery[24]
从图5 可知,首次放电曲线在1.4 V 以下存在一部分不可逆容量,可能与SEI 膜的形成有关;首次放电电压明显低于后续循环的放电电压,较高的活化能垒可能与小分子S2~4在微孔碳内的重新排列有关[24]。
从图6 可知,在充放电过程中没有液相中间体产生,整个充放电机理是固-固转变机理。与锂-硫电池相比,钠-硫电池酯类溶剂分子与长链多硫化物阴离子之间较少发生亲核反应。Na+较大的离子半径削弱了Na+-多硫化钠离子对的反应活性,并减弱了它们在酯类溶剂中的解离[25]。此外,酯类电解液分解形成的正极电解质相界面(CEI)膜会阻碍电解液溶剂渗入到微孔碳中,并促进正极中的硫发生固-固转变,减少可溶性多硫化钠中间体的生成[26]。
1.3 两种转变机理的总结与比较
H.W.Liu 等[27]的研究表明,储存在硫负载材料孔隙中的硫主要经历固-固转变,而分散在表面的硫则倾向于固-液-固转变,如图7所示。
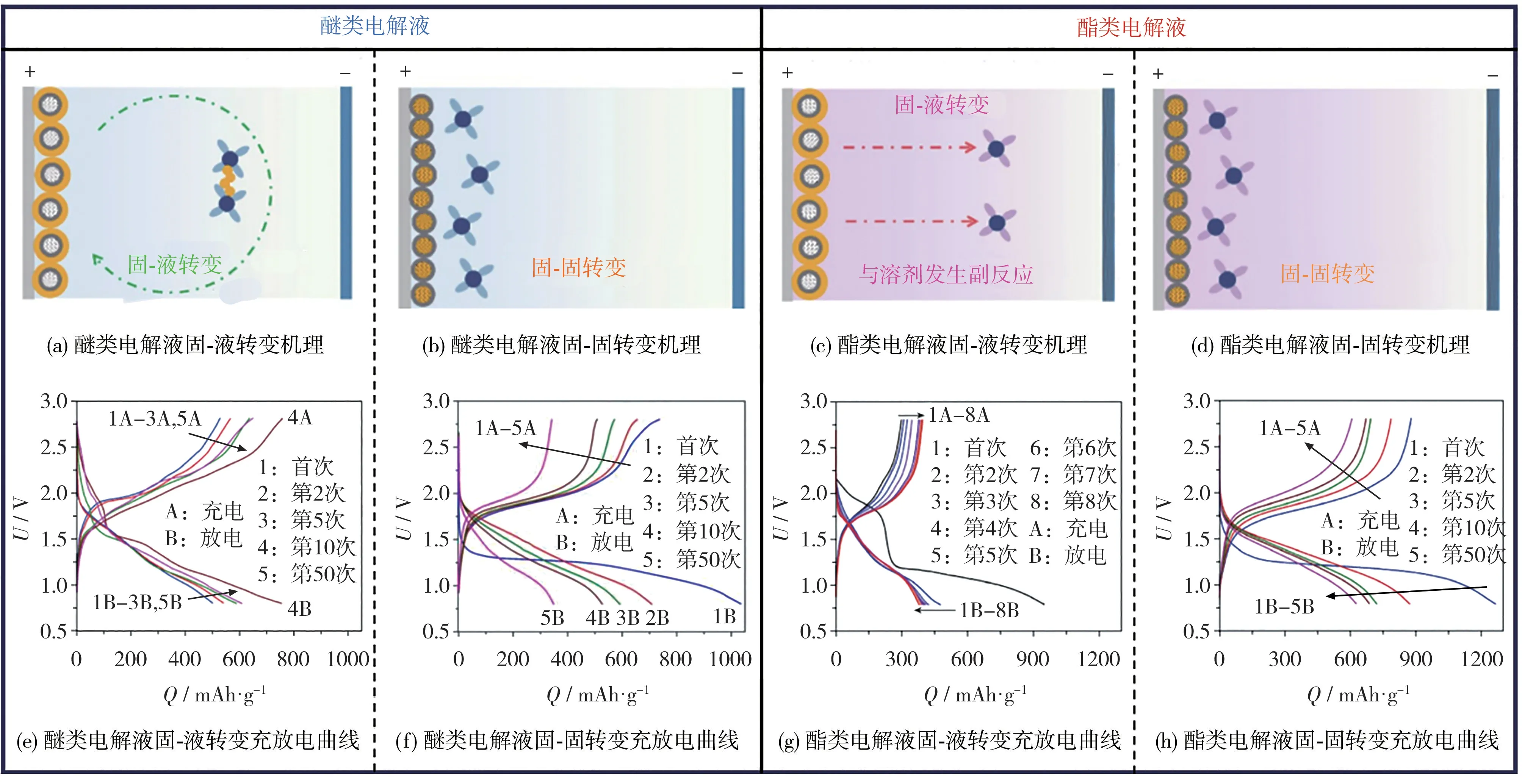
图7 两种转变机理的示意图和充放电曲线[27]Fig.7 Schematic diagram of two transition mechanisms and charge-discharge curves[27]
这两种转变机理具有不同的充放电曲线。固-固转变在电压低于1.8 V 时开始进行,循环后的放电曲线没有明显的平台。然而,固-液转变在1.6 V 左右出现明显的放电平台,CV 曲线拥有1.9 V、1.5 V 和1.0 V 等3 个阴极峰。在醚类电解液中,表面硫直接与溶剂化的Na+结合,生成液相多硫化钠(固-液转变);在酯类电解液中,表面硫发生多硫阴离子与酯类溶剂之间的亲核加成或取代反应,从而导致严重的副反应和快速的容量衰减。封闭硫被封装在负载材料中,并通过离子交换(固-固转变)转化为Na2S,在醚类和酯类电解液中的充放电曲线形状基本相似。
P.Adelhelm 等[28]总结了若干钠-硫电解液文献中的首次充放电数据,如图8所示。
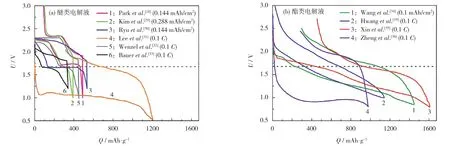
图8 首次循环充放电数据汇总[28]Fig.8 Summary of charge-discharge data in initial cycle[28]
使用醚类电解液的钠-硫电池一般出现一个或两个电压平台,充电过电势稍大于使用同种醚类电解液的锂-硫电池。在醚类电解液中,硫转化反应不完全,钠-硫电池实际比容量偏低,仅有350~550 mAh/g,表明硫没有完全转化为Na2S。一个例外是,D.J.Lee 等[31]使用TEGDME 实现了约1 200 mAh/g 的放电比容量,但放电主要发生在约1.0 V 的电压平台(截止电压为0.5 V)。
使用酯类电解液的钠-硫电池的容量更高、循环寿命更长。充放电曲线与醚类电解液差别较大,通常表现出倾斜曲线,且大部分容量是在低于1.5 V 的电压下释放的。就能量密度而言,如此低的放电电压也不符合人们的要求[28]。
(未完待续)
