蛹虫草有效成分提取及活性分析
2024-03-11刘舒欣曲叶丽姜雯琪王作新赵洪新
芦 叶 李 丽 刘舒欣 曲叶丽 姜雯琪* 王作新 赵洪新*
(1浙江理工大学生命科学与医药学院,浙江杭州 310018;2上海特莱维护肤品股份有限公司,上海 201706)
蛹虫草(Cordyceps militaris)又称黄金草、北虫草,是寄生于昆虫中食用、药用兼具的真菌,属于蛹草科和子囊菌科,与著名中药冬虫夏草具有相似的药理活性[1],是一种药用价值很高的珍稀大型食药用真菌。蛹虫草富含多糖、生物碱、氨基酸、虫草素、虫草酸、甾醇等[2]活性物质,具有保湿、抗氧化、抗炎、抗菌、抗病毒、抗肿瘤、降血糖以及免疫调节等功效。蛹虫草多糖可用于化妆品中,且制作的蛹虫草多糖护肤化妆品稳定、安全、高效[3]。
目前,蛹虫草提取物(Cordyceps militarisextract,CME)的提取方法较多,常用方法有水提法[4]、醇提法[5]、超临界CO2提取法[6]、超声辅助提取法[7]、微波辅助提取法[8]等。通过不同提取方法获取的提取物成分及含量也不同,对应的功效也有所差异。现有文献中,CME的提取方法多采用超声辅助提取法,此法更加简便高效[9]。
笔者采用超声辅助提取制备CME,通过单因素试验和L9正交试验法优化CME提取条件,检测CME中多糖、总黄酮含量并探究其抗氧化性能、保湿性能,为开发蛹虫草系列等特色化妆品奠定理论基础及技术支持。
1 材料与方法
1.1 供试材料
蛹虫草(C.militaris)子实体干品,沈阳虫林密宝北虫草食品科技有限公司提供。
1.2 试剂和仪器
试剂:羟自由基清除能力检测试剂盒Fenton比色法(北京雷根生物技术有限公司);葡萄糖(优级纯,上海麦克林生化科技股份有限公司);芦丁(优级纯,上海源叶生物科技有限公司);其他试剂均为国产分析纯。
主要仪器:SW 30 H超声波清洗器(Elma Schmidt Bauer Limited)、RE-52 AA旋转蒸发器(上海亚荣生化仪器厂)、SHZ-Ⅲ循环水真空泵(上海亚荣生化仪器厂)、ROTINA 380R高速离心机(德国Hettich科学仪器有限公司)、UV756RT紫外可见分光光度计(上海佑科仪器仪表有限公司)、10 A真空冷冻干燥机(赛飞(中国)有限公司)、GDN-300 A恒温恒湿培养箱(宁波扬辉仪器有限公司)、PB-10 pH计(赛多利斯科学仪器有限公司)、Synergy HTX多功能酶标检测仪(美国BIOTEX公司)。
1.3 CME提取工艺优化
1.3.1 单因素提取工艺优化
蛹虫草干品粉碎后过筛(孔径0.178 mm),称1 g蛹虫草粉,与一定体积去离子水混合于锥形瓶中,室温下浸泡24 h。选取适当的提取温度、水料比、提取时间和提取次数进行超声波辅助(35 kHz)提取,提取液真空抽滤,取滤液真空旋蒸,旋蒸后的浓缩液缓慢滴加无水乙醇(浓缩液∶无水乙醇体积(mL)比=1∶4),于4 ℃冰箱静置约12 h。将静置液离心,弃上清,用丙酮充分洗涤沉淀,室温下静置过夜。再用无水乙醇充分洗涤沉淀,后过滤、干燥。将干燥物溶解于40 mL去离子水中,置于-80 ℃冰箱反复冻融,使蛋白质变性、降解,离心后弃沉淀取上清,重复以上操作直至离心后无沉淀析出,初步去除蛋白质。提取液按照体积(mL)比4∶1与sevag试剂(氯仿∶正丁醇=4∶1)混合,在摇床上充分振荡后离心取上清液,上述操作重复5次以上,离心至溶液无中间层出现,彻底去除剩余杂质蛋白。上清液经冷冻干燥处理即可得到蛹虫草提取物(CME)。
以CME提取率为评价指标,比较分析超声辅助提取法提取过程中水(mL)料(g)比(25∶1、30∶1、35∶1、40∶1、45∶1),提取次数(1次、2次、3次、4次、5次),提取时间(30 min、45 min、60 min、75 min、90 min),提取温度(65 ℃、70 ℃、75 ℃、80 ℃、85 ℃)。CME得率计算公式如下:
CME提取率(%)=M1/M2×100%
注:M1为CME的质量,单位为g;M2为蛹虫草干品的质量,单位为g。
1.3.2 正交优化试验
在单因素试验基础上,以水料比、提取次数、提取时间、提取温度4个因素为自变量设计正交试验,确定最佳提取条件。
1.4 生物活性成分测定
1.4.1 多糖含量测定
采用苯酚-硫酸法[10](以葡萄糖为多糖标准品)制作标准曲线,根据标准曲线计算CME的多糖含量。
配制待测液:将0.01 g CME溶于1 mL去离子水中。0.2 mL 5%苯酚溶液加入待测溶液中摇匀,加入1 mL浓硫酸溶液混匀,放入沸水内煮15 min,然后立即放入冰盒中冷却5 min。于紫外分光光度计490 nm处测定OD值,平行测定3组后取平均值。根据标准曲线,计算CME的多糖含量。
1.4.2 总黄酮含量测定
采用亚硝酸钠硝酸铝比色法[11](以芦丁为黄酮标准品)制作标准曲线,根据标准曲线计算CME的总黄酮含量。
配制待测液:将0.01 g CME溶于1 mL 70%乙醇中。60 μL 5%NaNO2溶液加到待测溶液中摇匀并静置5 min,加入60 μL 10%Al(NO3)3溶液混匀,静置5 min,再加入0.8 mL 4%NaOH溶液混匀,最后加入80 μL 70%乙醇混匀,静置15 min。96孔板中每孔加入200 μL,设置3个复孔。于酶标仪510 nm处测定OD值,从而计算出CME的总黄酮成分的含量。
1.5 抗氧化能力测定
1.5.1 羟自由基清除能力测定
分别取0.06 g/L、0.12 g/L、0.24 g/L、0.48 g/L、0.96 g/L、1.92 g/L质量浓度的CME和0.06 g/L、0.12 g/L、0.24 g/L、0.48 g/L、0.96 g/L、1.92 g/L质量浓度的L-抗坏血酸,测定其羟基自由基清除率。根据羟自由基清除能力检测试剂盒Fenton比色法说明书操作,于紫外分光光度计536 nm处测定OD值,三组平行测定后取平均值。根据公式计算各质量浓度L-抗坏血酸和CME的羟自由基清除率:
羟自由基清除率(%)=(A2-A1)/(A0-A1)×100%
注:A2为测定组OD值;A1为对照组的OD值;A0为空白组的OD值
1.5.2 DPPH自由基清除能力测定[12]
分别取0.06 g/L、0.12 g/L、0.24 g/L、0.48 g/L、0.96 g/L、1.92 g/L质量浓度的CME与0.06 g/L、0.12 g/L、0.24 g/L、0.48 g/L、0.96 g/L、1.92 g/L质量浓度的L-抗坏血酸,测定其DPPH自由基清除率。A2组:1 mL样品溶液和1 mL 0.2 mmol/L DPPH-乙醇溶液加到5 mL铝箔覆盖的EP管中混合。A1组:1 mL样品溶液和1 mL乙醇溶液加到5 mL铝箔覆盖的EP管中混合。A0组:1 mL去离子水和1 mL DPPH-乙醇溶液加到5 mL铝箔覆盖的EP管中混合。充分混匀后避光反应0.5 h,于紫外分光光度计517 nm处测定OD值,平行测定3组后取平均值,以L-抗坏血酸作为阳性对照。计算公式如下:
DPPH自由基清除率(%)=[1-(A2-A1)/A0]×100%
1.5.3 ABTS自由基清除能力的测定[13]
分别取0.06 g/L、0.12 g/L、0.24 g/L、0.48 g/L、0.96 g/L、1.92 g/L质量浓度的CME与0.06 g/L、0.12 g/L、0.24 g/L、0.48 g/L、0.96 g/L、1.92 g/L质量浓度的L-抗坏血酸测定其ABTS自由基清除率。按1∶1混合7 mmol/L ABTS水溶液和2.45 mmol/L过硫酸钾溶液,室温避光反应(14±2)h。使用前用无水乙醇稀释约30倍使其在734 nm处OD值为0.68~0.72。A1组:30 μL样品溶液和2.4 mL稀释后的ABTS溶液混合。A2组:30 μL样品溶液和2.4 mL无水乙醇混合。A0组:30 μL无水乙醇和2.4 mL稀释后的ABTS溶液混合。充分混匀后室温下避光孵育10 min,于紫外分光光度计734 nm处测定OD值,平行测定3组后取平均值,以L-抗坏血酸作为阳性对照。计算公式如下:
ABTS自由基清除率(%)=[1-(A1-A2)/A0]×100
1.5.4 总抗氧化能力测定(FRAP法)[14]
采用FRAP法测定CME的总抗氧化能力。配制300 mmol/L醋酸-醋酸钠缓冲液、10 mmol/LTPTZ溶液和20 mmol/L FeCl3,按照10∶1∶1混合成FRAP工作液(现配现用),FRAP工作液使用前放入37 ℃水浴锅中孵育5 min。将80 μL浓度为50~800 μmol/L的FeSO4和0.72 mL FRAP工作液混合,37 ℃孵育4 min,于593 nm处测定OD值,并绘制标准曲线(图1)。测得的FeSO4标准曲线为y=0.0012x-0.0045,相关系数R²=0.9995,其中x为FeSO4浓度,y为吸光值。

图1 FeSO4标准曲线
分别以0.08 mL的体积质量浓度分别为0.06 g/L、0.12 g/L、0.24 g/L、0.48 g/L、0.96 g/L、1.92 g/L的CME样品溶液替代FeSO4标准液,与FRAP工作液混合均匀;同时用0.72 mL无水乙醇替代FRAP工作液,与0.08 mL不同质量浓度的CME样品溶液反应,振荡,37 ℃孵育4 min,于593 nm处测OD值,根据FeSO4标准曲线,求出的相应浓度即为FRAP值[15]。设置3组平行,以L-抗坏血酸作阳性对照。
1.6 保湿能力测定
根据QB/T 4256—2011[16]方法,化妆品及其原料保湿能力通常采取体外法的物理化分析法进行研究,采用称重法评判CME的保湿性。精确称量5.0 000 g去离子水、10% CME、10%甘油于称量瓶中,将称重后的样品分别放入20 ℃相对湿度43%、20 ℃相对湿度85%恒温恒湿培养箱内,分别在1 h、3 h、6 h、9 h、12 h、24 h时称取三者质量,设置3组平行进行测定。保湿率计算公式如下:
保湿率(%)=(M2-M1)/M0×100
注:M2为称量瓶与样品总质量;M1为称量瓶质量;M0为样品质量
1.7 数据处理与分析
均采用Graphpad Prism、Origin 2021处理数据并分析作图,Adobe Illustrator 2020进行图片处理。
2 结果与分析
2.1 单因素试验结果
2.1.1 水料比对CME提取率的影响
随着水料比的增加,CME提取率先升高后降低,由图2a可知,当水(mL)料(g)比从25∶1上升至40∶1时,CME提取率呈逐渐上升趋势,CME提取率从3.88%增加到最大提取率5.33%。但若水料比继续增加,提取率呈下降趋势,其原因可能是水料比的增加使提取体系的传热功能降低,从而不利于提取物的成分溶解[17]。因此选取水料比(mL∶g)35∶1、40∶1和45∶1进行后续正交试验。

图2 CME提取单因素试验结果
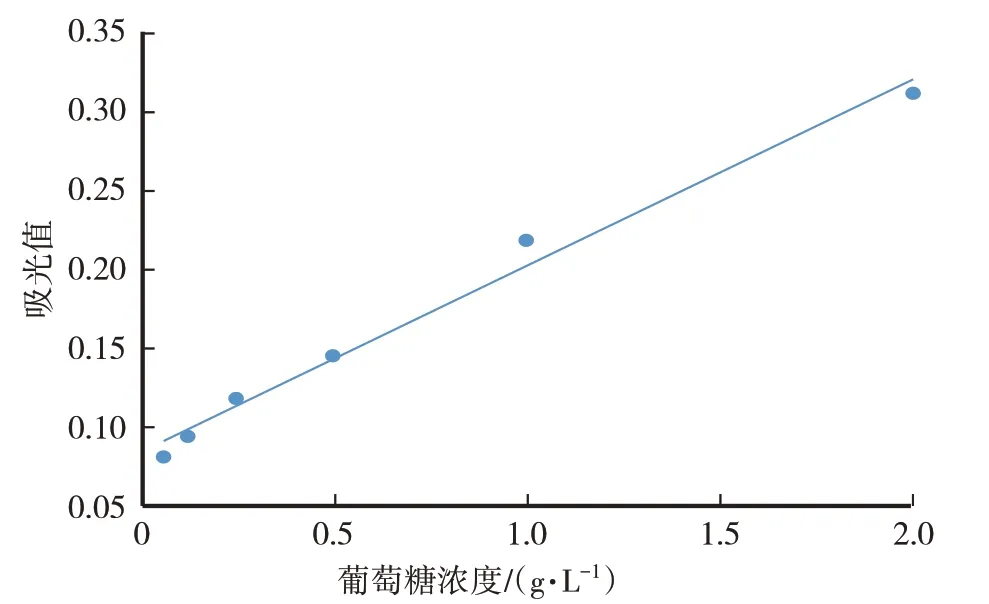
图3 葡萄糖标准曲线
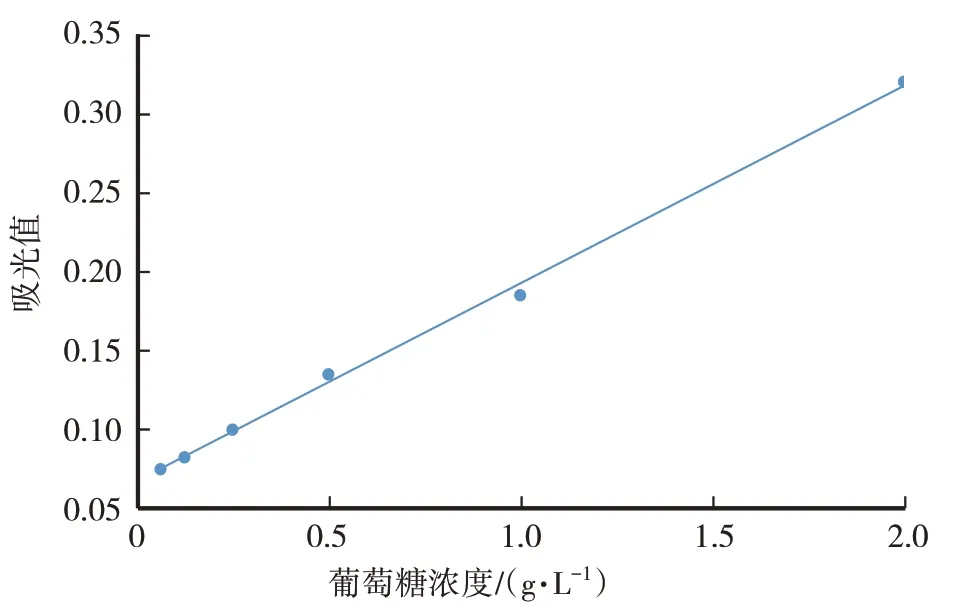
图4 芦丁标准曲线
2.1.2 提取次数对CME得率的影响
随着提取次数的增加,CME提取率先升高后降低,由图2b可知,提取次数≤3次时,CME提取率随提取次数的增加而增加,提取3次时,CME提取率达5.10%,显著高于提取2次时的CME提取率;提取次数超过3次,CME提取率会随着提取次数的增加而略有下降,其原因可能是超过一定提取次数后,CME无法进一步溶解[18]。因此选取提取次数为2次、3次、4次进行后续正交试验。
2.1.3 提取时间对CME提取率的影响
随着提取时间的增加,CME得率先升高后降低,由图2c可知,提取时间从35 min增加到75 min,CME提取率呈逐步上升趋势,由3.88%上升到最大提取率5.01%,呈明显上升趋势。提取时间大于75 min,随提取时间的延长,提取率反而下降。可能在提取时间小于75 min时,超声波的破碎作用可以提高CME的提取率,同时超声波对CME的降解作用影响较小,因此在此时间内CME提取率随时间增加而提高[19]。但在75 min后,较长的时间使CME的降解作用影响变大,反而导致CME得率下降。因此选取提取时间60 min、75 min、90 min进行后续正交试验。
2.1.4 提取温度对CME提取率的影响
随着提取温度的升高,CME提取率先升高后降低,由图2 d可知,随着提取温度升高,CME提取率先上升后下降,提取温度为80 ℃时,CME提取率达到最高,为5.79%。可能原因是60~80 ℃时,随着温度不断升高,溶质分子溶出的速度加快,从而提取率升高[20]。但随着温度继续升高,可能CME结构发生改变,发生副反应等。因此,选取提取温度为75 ℃、80 ℃、85 ℃进行后续正交试验。
2.2 正交试验结果
根据单因素试验结果设计正交试验,见表1。由表2可知,对CME提取率影响最大的是提取温度,其次是水料比、提取次数,提取时间对CME提取率的影响最小。超声辅助提取CME的最佳提取工艺参数为A2B2C2D2,但因为正交试验中没有出现A2B2C2D2,所以进行该条件的补充实验:在A2B2C2D2条件下提取CME,提取率为7.51%,均高于正交试验的所有组合。因此超声波辅助提取CME最佳的提取条件:提取温度为80 ℃、水(mL)料(g)比为40∶1、提取次数为3次、提取时间为75 min为。

表1 试验因素水平及编码

表2 CME正交试验结果
2.3 活性成分测定结果
2.3.1 多糖含量测定
葡萄糖的标准曲线为y=0.1228x+0.0839,R²=0.9877。根据葡萄糖标准曲线,计算CME的多糖含量为67.29%±0.58%。
2.3.2 总黄酮含量测定
芦丁标准曲线为y=5.193 1x+0.063 8,R²=0.998 7。根据芦丁标准曲线,CME总黄酮含量为1.93%±0.06%。
2.4 抗氧化能力测定结果
2.4.1 羟自由基清除能力测定
由图5a可知,在质量浓度为0.06~1.92 g/L时,CME和L-抗坏血酸对羟自由基的清除能力均有明显提升。CME对羟自由基的清除率从53.79%增加到65.04%,L-抗坏血酸对羟自由基的清除率从90.59%增加到98.77%。CME羟自由基的清除能力随质量浓度增加而上升,而L-抗坏血酸羟自由基的清除能力随质量浓度增加而上升的趋势变化较小。试验结果表明,CME与阳性对照L-抗坏血酸相比,CME对羟自由基的清除率较弱,但CME依然表现出较强的清除羟自由基的能力。
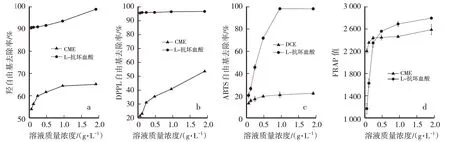
图5 CME抗氧化活性测定结果
2.4.2 DPPH自由基清除能力测定
由图5b可知,在质量浓度为0.06~1.92 g/L时,CME和L-抗坏血酸对DPPH自由基的清除能力均有明显增强的趋势。CME对DPPH自由基的清除率从21.20%增加到53.30%,L-抗坏血酸对DPPH自由基的清除率从95.09%增加到96.24%。CME对DPPH自由基的清除能力随质量浓度增加而上升,而L-抗坏血酸对DPPH自由基的清除能力随质量浓度增加而上升的趋势变化较小。结果表明,CME与阳性对照L-抗坏血酸相比,CME对DPPH自由基的清除率较弱,但CME依然表现出比较强的清除DPPH自由基的能力。
2.4.3 ABTS自由基清除能力测定
由图5c可知,在质量浓度为0.06~1.92 g/L时,CME和L-抗坏血酸对ABTS自由基的清除能力均有明显增强的趋势。CME对ABTS自由基的清除率从11.27%增加到19.98%,L-抗坏血酸对ABTS自由基的清除率从20.27%增加到98.01%。CME对ABTS自由基的清除能力随质量浓度增加而上升,而L-抗坏血酸对ABTS自由基的清除能力随质量浓度增加而上升的趋势变化较小。结果表明,CME与阳性对照L-抗坏血酸相比,CME对ABTS自由基的清除率较弱,但CME依然表现出比较强的清除ABTS自由基的能力。
2.4.4 总抗氧化能力测定(FRAP法)
由图5d可知,在质量浓度为0.06~1.92 g/L时,CME和L-抗坏血酸的总抗氧化能力均有明显增强的趋势。CME对FRAP铁离子的还原能力从2 192.24 μmol/L增加到2 575.75 μmol/L,L-抗坏血酸对FRAP铁离子的还原能力从1 158.62 μmol/L增加到2 782.83 μmol/L。在质量浓度为0.06~0.24 g/L时,CME对FRAP铁离子的还原能力明显强于L-抗坏血酸,但随着质量浓度的增加,L-抗坏血酸对FRAP铁离子的还原能力逐渐强于CME。结果表明,CME与阳性对照L-抗坏血酸相比,CME对FRAP铁离子的还原能力较弱,但CME依然表现出比较强的FRAP铁离子的还原能力。
2.5 保湿能力测定结果
含有3个羟基结构的甘油是非常优秀的保湿剂,以10%的甘油作为参照评价CME的保湿效果。由图6可知,0~24 h,相对湿度为85%条件下,10%CME保湿效果始终优于去离子水但低于10%甘油溶液;在相对湿度为43%条件下,0~9 h,10%CME保湿效果优于去离子水且优于10%甘油溶液,9~24 h时,10%CME保湿效果优于去离子水但略低于10%甘油溶液。当时间为24 h,相对湿度为85%条件下,10%甘油保湿率为97.60%,10%CME保湿率为95.83%;当时间为24 h,相对湿度为43%条件下,10%甘油保湿率为90.60%,10%CME保湿率为87.74%。CME的保湿效果仅略低于甘油,说明CME表现出良好的保湿能力,可以作为良好的保湿剂。
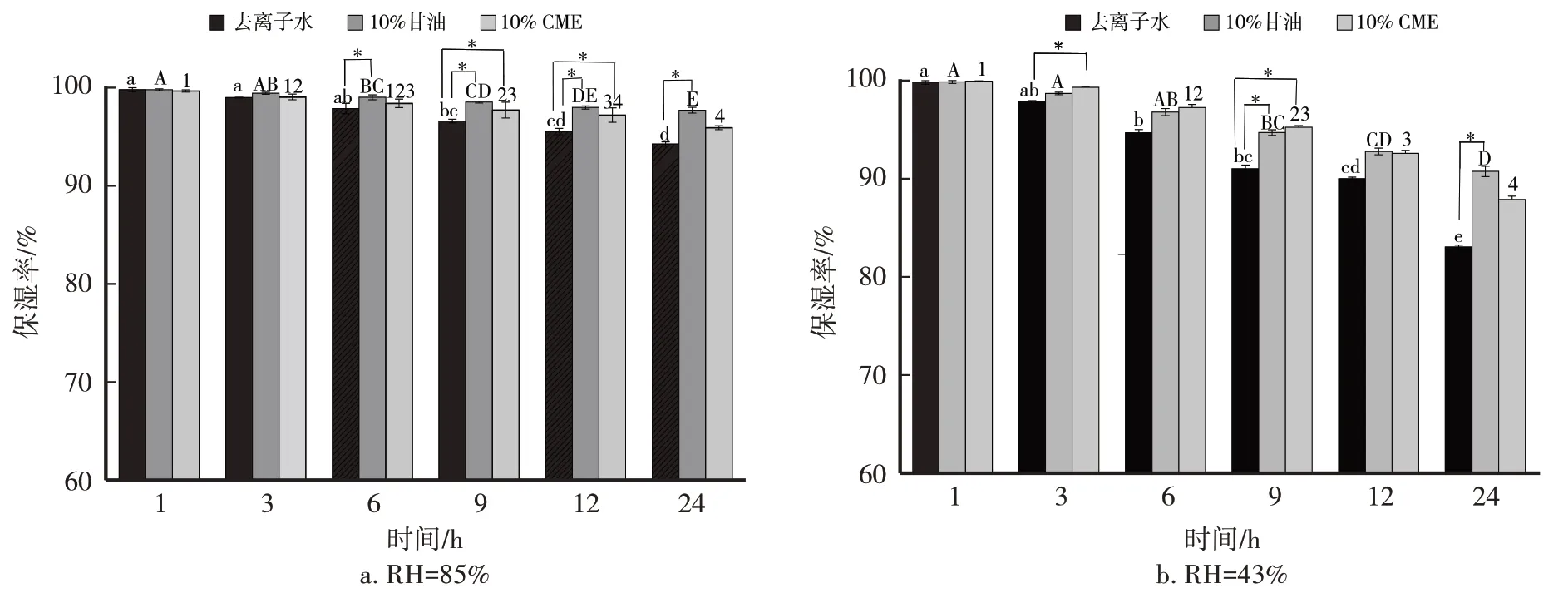
图6 CME保湿能力测定结果
3 小结
采用超声辅助提取珍稀大型食药用真菌蛹虫草有效成分并优化提取条件,确定CME提取率最高达7.51%。影响CME提取率的最主要因素为提取温度。测定CME中的活性成分表明,糖含量可达67.29%,总黄酮含量达1.93%,说明CME大部分组成成分为多糖,可预估CME有良好的保湿及抗氧化功效;CME对羟自由基、ABTS自由基和DPPH自由基的清除能力及铁离子还原能力测定结果表明,在质量浓度为0.06~1.92 g/L时,其清除自由基及还原能力均随质量浓度增加呈上升趋势。当质量浓度为1.92 g/L时,其羟自由基的清除率为65.04%,DPPH自由基的清除率为53.30%,ABTS自由基的清除率为19.98%,铁离子还原能力达到2 575.75 μmol/L,CME表现出良好的抗氧化性。CME保湿效果始终略低于甘油,但在24 h、相对湿度85%条件下,CME保湿率也达到95.83%。说明CME的保湿效果良好。
研究获取抗氧化、保湿效果良好的珍稀大型食药用真菌提取物CME,为中草药抗氧化及保湿能力的研究提供数据支撑,为中草药在化妆品、保健品等领域的开发应用提供参考和借鉴。
