胃康灵胶囊中化学成分在人和大鼠肠道菌群中的代谢比较
2024-03-10曲文华于涵川李晓波
刘 峰,曲文华,彭 颖,于涵川,李晓波*
(1.上海交通大学,上海 200240; 2.黑龙江葵花药业股份有限公司,黑龙江 哈尔滨 150070)
胃康灵胶囊由白芍、白及、三七、甘草、茯苓、延胡索、海螵蛸、颠茄浸膏组成,具有柔肝和胃、散瘀止血、缓急止痛的功效[1],临床主要用于治疗慢性胃炎、胃溃疡等胃肠道疾病。课题组前期采用超高效液相色谱四极杆飞行时间串联质谱(UHPLC-Q-TOF-MS/MS) 法对胃康灵胶囊进行化学成分分析,发现白芍的单萜苷类、甘草的黄酮及其苷类、甘草和三七的皂苷类、延胡索的生物碱类、白及的小分子酸苷类是其主要化学成分[2]。
中药多为口服给药,口服后的中药成分在肠道内会受肠道菌群代谢,从而引起活性成分生物利用度及其药理活性的改变[3-4]。如甘草酸水溶性较大,生物利用度比较低,但是在肠道菌群的作用下可被代谢为甘草次酸,脂溶性增加,抗肝毒性作用更好[5-7]。因此,为全面探究胃康灵胶囊中的化学成分在肠道中的吸收代谢情况,本研究将胃康灵胶囊进行离体人肠道菌群试验,明确其所含成分在肠道中生物转化的一般规律,从而揭示胃康灵胶囊中的化学成分在肠道中的代谢机制。此外,由于药物的吸收易受动物种属差异和病理状态的影响[8-9],本研究还分别比较人与正常大鼠、正常大鼠与胃炎大鼠肠道菌的代谢差异,以期为胃康灵胶囊的体内药效物质基础研究奠定基础。
1 材料
1.1 动物 12 只清洁级雄性SD 大鼠,体质量(160±20) g,购于上海斯莱克实验动物有限责任公司,实验动物生产合格证号SCXK (沪) 2017-0005。所有动物实验均按照《实验动物的护理和使用指南》 进行[10],并经上海交通大学动物伦理委员会批准,实验动物使用许可证号SYXK (沪)2018-0028,动物批准文号为A2019073。大鼠饲养于上海交通大学动物实验中心,温度20 ~26 ℃,相对湿度40% ~70%,12 h/12 h 日夜循环,喂食正常维持饲料,自由饮水。
1.2 试剂与药物 胃康灵胶囊(批号201908012) 由黑龙江葵花药业股份有限公司提供。甘草苷(批号DST181127-009)、异甘草苷(批号DST180314-015)、芹糖甘草苷(批号DST180306-139)、芹糖异甘草苷 (批号DST190102-106)、芒柄花苷(批号DST190114-044)、异甘草素(批号DST190102-166)、甘草素(批号DSTDG001001)、芒柄花素(批号DST180908-006)、甘草酸 (批号DST 180906-008)、甘草次酸 (DST180314-007)、芍药苷 ( 批号DST190303-070)、氧化芍药苷(批号DST180429-080)、芍药内酯苷 ( 批号 DST180419-071)、militarine ( 批号DST190724-025) 对照品均购自成都德思特生物技术有限公司,纯度≥98%; dactylorhin A (批号PRF20031304) 对照品购自成都普瑞法科技开发有限公司,纯度≥98%; 胃蛋白酶试剂盒、BCA 蛋白浓度测试试剂盒均购自南京建成生物工程研究所; 苏木精-伊红染色(HE 染色) 试剂盒购自南京生航生物技术有限公司。乙腈、甲醇、甲酸均为色谱纯,购自上海安谱实验科技股份有限公司。
1.3 仪器 Agilent 1290 超高效液相色谱仪、Agilent 6545四极杆飞行时间质谱仪(美国安捷伦公司); Milli-Q 超纯水系统(美国Millipore 公司)。
2 方法
2.1 造模和粪便样本收集 大鼠适应性饲养7 d 后,按体质量随机分为正常组和胃炎组,每组6 只,胃炎组造模周期为4 周,造模前禁食不禁水12 h,灌胃给药前1 h 撤去水源,灌胃给予56%乙醇(给药质量浓度为8 g/kg) 诱导慢性胃炎的发生,正常组灌胃给予等体积生理盐水,每3 d 1 次。造模第28 天结束12 h 后,用无菌管收集正常、胃炎大鼠粪便,麻醉后取胃组织,冰生理盐水洗去胃内容物后4%多聚甲醛固定36 h,梯度乙醇脱水,透明,石蜡包埋,切片(5 μm),脱蜡,进行HE 染色,倒置显微镜下观察胃组织病理变化。另取新鲜大鼠胃组织,按照胃蛋白酶活性检测试剂盒使用书说明检测胃蛋白酶活性。
2.2 胃康灵胶囊肠道菌孵育
2.2.1 肠道菌液配制 厌氧培养基(GAM) 的配制方法参考文献[11-12] 报道,选取6 个健康志愿者,女性4例,男性2 例,采样前3 个月内未服用任何抗生素或益生菌制剂,粪便收集前均经本人确认自愿参加并签署知情同意书,本研究经上海交通大学Bio-X 中心伦理委员会批准(批准号ML18013)。将收集的新鲜粪便混合,匀质化后在厌氧条件下与GAM (1 g ∶25 mL) 混合,充分涡旋混合后3 层纱布过滤,所得滤液即为人肠道菌液。取“2.1” 项下大鼠粪便,按照人肠道菌液制备方法制备正常/胃炎大鼠肠道菌液。
2.2.2 胃康灵胶囊在人源肠道菌液中孵育 健康人每天正常粪便量为100~300 g (平均200 g),拟定胃康灵胶囊与人粪便比例为4.8 g ∶200 g,胃康灵胶囊与人源肠道菌液比例为4.8 g ∶5 000 mL。取胃康灵胶囊粉末48 mg,加入50 mL 人源肠道菌液,混匀,37 ℃厌氧条件下孵育,分别于0、1、3、6、12、24、48 h 取样1 mL,立即用1.5 倍量水饱和正丁醇萃取3 次,萃取液37 ℃氮气吹干,1.0 mL 70%甲醇复溶,10 000 r/min 离心10 min,即得。取同体积人源肠道菌液单独孵育,制备空白样品。
2.2.3 胃康灵胶囊在鼠源肠道菌液中孵育 以成年男性体质量70 kg、大鼠体质量200 g,设定胃康灵胶囊剂量为每天4.8 g,按照等效剂量折算,大鼠剂量为每天0.086 4 g。雄性大鼠每日大便量为4~11 g (平均7.5 g),因此拟定胃康灵胶囊与大鼠粪便比例为0.086 4 g: 7.5 g,即胃康灵胶囊粉末与人源肠道菌液比例为86.4 mg: 193 mL。取胃康灵胶囊粉末22.4 mg,加入50 mL 正常、胃炎大鼠肠道菌液,混匀,按“2.2.2” 项下方法操作。取同体积大鼠肠道菌液单独孵育,制备空白样品。
2.3 UHPLC-Q-TOF-MS/MS 分析
2.3.1 溶液制备
2.3.1.1 供试品溶液 参考文献[2] 报道,精密称取胃康灵胶囊粉末1.0 g,70%甲醇溶解,超声提取2 次,每次30 min (15、10 mL),3 000 r/min 离心10 min,将上清液转移至25 mL 量瓶中,定容,即得质量浓度为40 mg/mL 的供试品溶液。
2.3.1.2 对照品溶液 取甘草苷、异甘草苷、芹糖甘草苷、芹糖异甘草苷、芒柄花苷、异甘草素、甘草素、芒柄花素、甘草酸、甘草次酸、芍药苷、氧化芍药苷、芍药内酯苷、militarine、dactylorhin A 对照品适量,置于量瓶中,70%甲醇溶解,定容,得质量浓度为1 mL/mg 的贮备液,使用时稀释至50~200 ng/mL,即得。
2.3.2 条件 参考文献[2] 报道。
2.3.2.1 色谱 Agilent Zorbax Eclipse Plus C18色谱柱(2.1 mm×100 mm,1.8 μm); 流动相0.1%甲酸(A) -乙腈(B),梯度洗脱(0 ~8 min,10% ~11% B; 8 ~14 min,11% ~21% B; 14 ~20 min,21% ~27% B; 20 ~24 min,27% ~38% B; 24 ~31 min,38% ~53.5% B; 31 ~38 min,53.5% ~90%B; 38 ~40 min,90% ~10%B); 体积流量0.4 mL/min; 柱温40 ℃; 进样量2 μL。
2.3.2.2 质谱 电喷雾离子源(ESI),负离子模式; MS扫描范围m/z100 ~1 700,MS/MS 扫描范围m/z100 ~1 700; 毛细管电压3 500 V; 干燥气、保护气温度350 ℃;干燥气体积流量8 L/min; 碰撞电压150 V; 碰撞能量5、20、35、50 eV; 雾化器压力50 psi (1 psi=6.895 kPa)。
2.4 统计学分析 通过SPSS 24.0 软件进行处理,数据以(±s) 表示,2 组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 胃康灵胶囊在人源肠道菌液中代谢分析 胃康灵胶囊在人源肠道菌液中孵育不同时间的UHPLC-Q-TOF-MS/MS基峰色谱图见图1。结果显示,人源肠道菌液的基质效应明显强于未经孵育的胃康灵胶囊化学成分的质谱响应; 两者混合共孵育0、1、6、48 h 后,其干扰更显著。因此,后续采用提取离子和对照品比对的方式对胃康灵胶囊在人源肠道菌液中的原型成分进行定性鉴别。
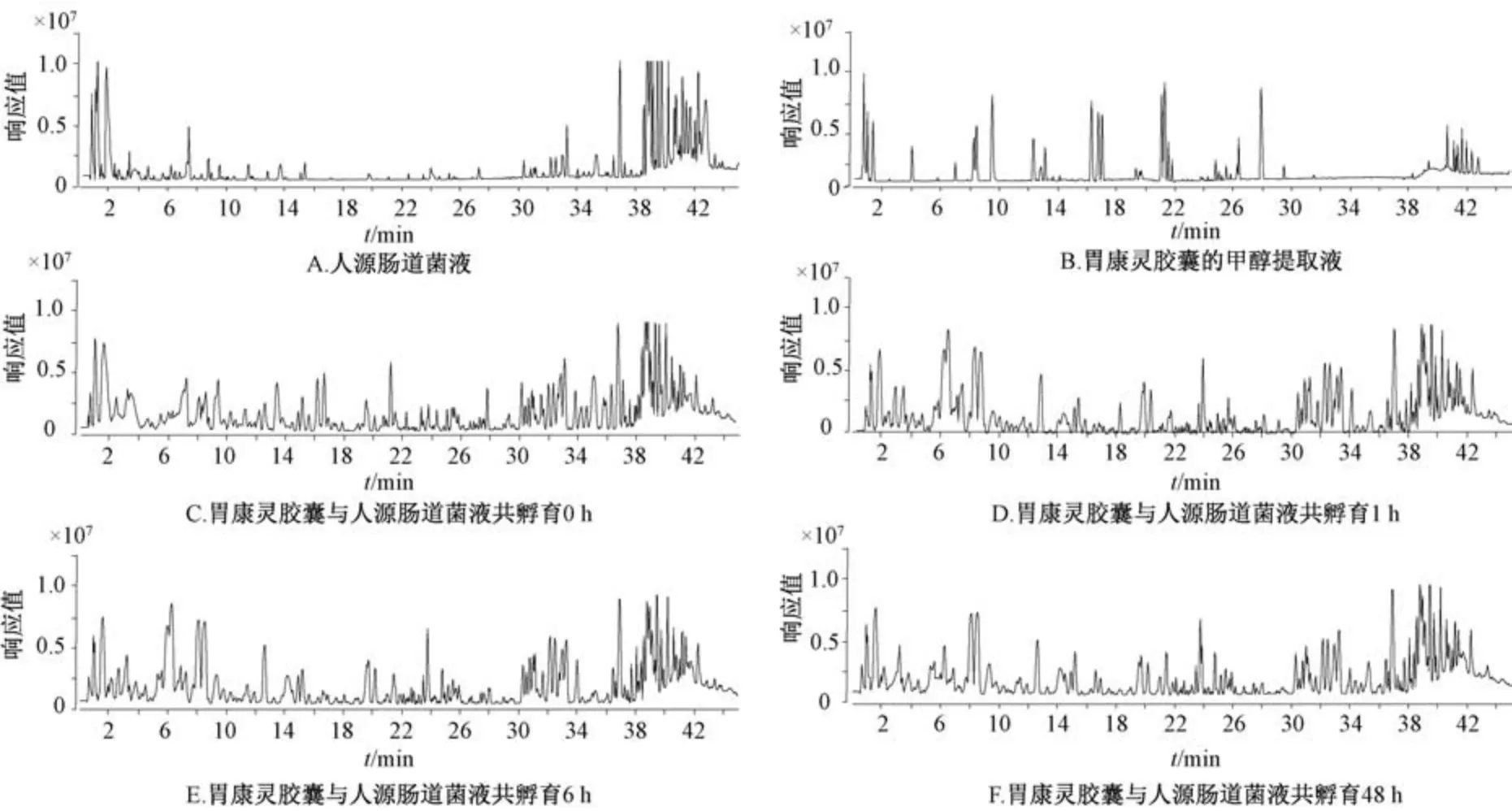
图1 胃康灵胶囊在人源肠道菌液中孵育不同时间的UHPLC-Q-TOF-MS/MS 基峰色谱图
3.1.1 胃康灵胶囊在人源肠道菌液中代谢速率分析 胃康灵胶囊与人源肠道菌液共孵育0、1、6、48 h 的提取离子色谱图见图2,共有15 种原型成分可被检测到,随着孵育时间延长,糖苷类成分相对含量降低,苷元类成分相对含量升高。15 种原型成分在人肠道菌液中的剩余量随时间变化曲线见图3,可知芍药苷在12 h 内即可被完全代谢,氧化芍药苷在48 h 内被完全代谢,而芍药内酯苷在48 h 后仍有16%的剩余(图3A),这3 种成分是胃康灵胶囊中的单萜苷类成分; 甘草苷、芹糖甘草苷、芹糖异甘草苷、芒柄花苷、异甘草苷在3 h 内即可被完全代谢(图3B),它们是胃康灵胶囊中的黄酮苷类成分; 甘草素、异甘草素、芒柄花素是胃康灵胶囊中的黄酮苷元类成分,在与肠道菌液共孵育1 h 后出现急剧增加的现象,随后会被继续代谢减少(图3C),可能是肠道菌液与黄酮苷和苷元共孵育时,脱糖反应快于重排、加氢等反应造成的; dactylorhin A 和militarine 是胃康灵胶囊中的小分子酸苷类成分,在3 h 内即可被代谢完全(图3D); 三萜类成分甘草酸在48 h 可被代谢67% (图3E); 相应的甘草次酸成分在6 h 含量达到平台期,6~48 h 几乎不变(图3F)。

图2 胃康灵胶囊中15 种化学成分与人源肠道菌液共孵育0、1、6、48 h 的提取离子色谱图
3.1.2 胃康灵胶囊在人源肠道菌液中代谢产物分析 建立15 种原型成分的代谢产物库,包括水解、重排、氢化、裂解、去甲基化等反应,使用Aglient Qualitative Workflows 软件进行匹配,共鉴别24 种代谢产物,见表1。M4、M2 的保留时间分别为5.63、3.95 min,准分子离子峰分别为m/z167.035 7、183.025 8,其碎片离子分别为m/z121.029 5、137.024 6,与文献[13] 报道一致,推测该化合物为苯甲酸和4-羟基苯甲酸,是芍药中单萜苷类成分的主要取代基。M6 的保留时间为8.37 min,准分子离子峰m/z为525.161 4[M-H+HCOOH]-、479.156 0 [M-H]-,脱去葡萄糖分子形成碎片离子峰m/z317.102 7,脱去苯甲酰基m/z121.029 4,被离子源轰击重排后得到碎片离子m/z357.120 0、283.082 7,与对照品和文献[13] 报道一致,推测该化合物为芍药内酯苷,其二级质谱图及裂解途径见图4A。M21的保留时间为25.27 min,准分子离子峰为m/z257.081 9[M-H]-,离子源轰击后,酰基两侧C-C 键发生断裂,重排后可产生碎片离子m/z151.039 6、109.092 8、135.008 3、122.037 1,与文献[14-15] 报道一致,推测该化合物为达维荚蒾苷元,其二级质谱图及裂解途径见图4B。M12 的保留时间为16.29 min,准分子离子峰为m/z457.172 3 [MH]-,在负离子模式下可产生碎片离子m/z285.097 9、189.076 1、123.044 5,与文献[16] 报道一致,推测该化合物为手参苷I,其二级质谱图及裂解途径见图4C。另外,其他代谢产物均是采用文献对比或对照品比对的方法进行鉴别。
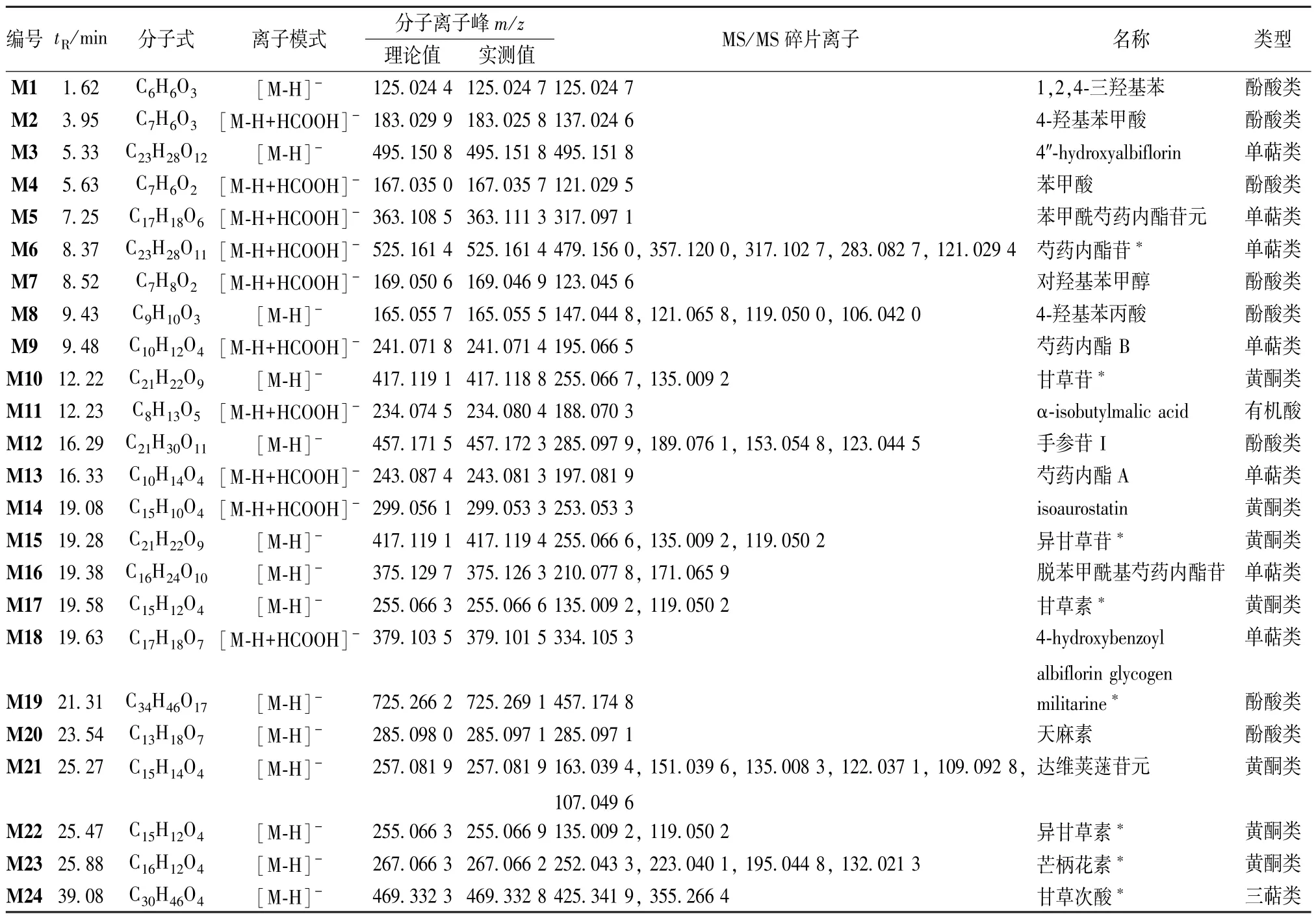
表1 胃康灵胶囊在人源肠道菌液中代谢产物
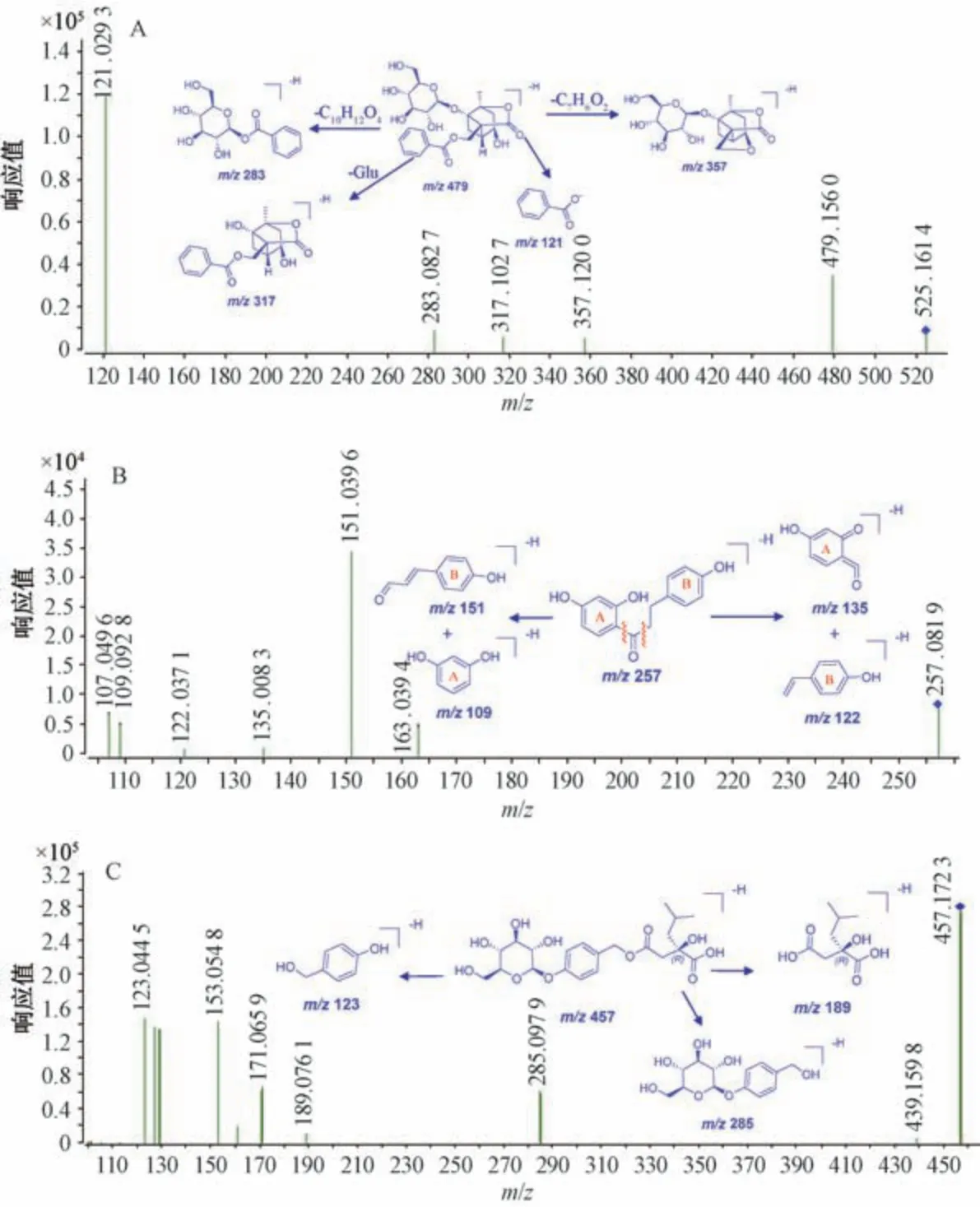
图4 胃康灵胶囊化学成分在人肠道菌液中的代表性代谢产物的二级质谱图及裂解途径
3.1.3 胃康灵胶囊在人源肠道菌液中代谢途径分析 胃康灵胶囊中的糖苷类成分在离体人源肠道菌液中的主要代谢途径为脱糖基,单萜类和和黄酮类还会发生重排、开环、加氢和脱甲基等反应,结合相关文献分析,推测人源肠道菌液中代谢产物的典型代谢途径,见图5。由此可知,芍药苷的2 个C-O 键不稳定,断裂并内酯化生成芍药内酯苷(M6),随着时间延长,继续发生水解、重排等反应,生成苯甲酰芍药内酯苷元 (M5)、脱苯甲酰基芍药内酯苷(M16)、芍药内酯B (M9)、芍药内酯A (M13)、苯甲酸(M4) 等代谢产物[17-19](图5A); 氧化芍药苷与芍药苷具有相同的母核,其代谢途径与芍药苷类似。肠道菌可以迅速水解黄酮糖苷类成分的糖链,产生苷元[20](图5B~5C);芹糖甘草苷依次脱去芹糖和葡萄糖后产生代谢产物甘草苷(M10) 和甘草素(M17),芹糖异甘草苷产生代谢产物异甘草苷(M15) 和异甘草素(M22)[21-22],芒柄花苷脱去葡萄糖产生芒柄花素(M23)[23],继而在肠道菌群中的还原酶系作用下,黄酮苷元C 环上的双键发生还原反应和环裂变反应[20],使甘草素和异甘草素转变为达维荚蒾苷元(M21),达维荚蒾苷元的B 环进一步转化生成羟苯基脂肪酸类物质(M1、M8)[20-21],芒柄花素可发生脱甲基作用产生isoaurostatin (M14)[23],文献[21-22] 报道,甘草酸在人肠道菌液中可脱去葡萄糖产生甘草次酸,甘草次酸不能继续被人肠道菌液继续代谢(图5D),故共孵育6 h 后甘草次酸的含量几乎不变; dactylorhin A 在人肠道菌液中可发生一系列脱糖反应,产生militarine (M19)、手参苷I(M12)、天麻素(M20)、α-isobutylmalic acid (M11)、对羟基苯甲醇(M7) 等产物[16](图5E)。

图5 人肠道菌液中胃康灵胶囊代表性成分的代谢途径
3.2 胃康灵胶囊在人源肠道菌液和鼠源肠道菌液中代谢比较
3.2.1 胃炎大鼠模型塑造及评价 造模期间,正常组大鼠皮毛紧密贴身,色泽光滑有亮度,活动敏捷; 胃炎组大鼠皮毛黯淡无光,两眼无神,造模后均出现行动迟缓、不稳、醉酒、体温下降和嗜睡现象。正常组大鼠胃黏膜结构层次清楚,腺体排列整齐,无充血及出血现象; 胃炎组大鼠胃组织表皮上层有明显损伤,可见大量红细胞于血管外聚集,黏膜上层腺体结构紊乱或坏死,见图6A。与正常组比较,胃炎组大鼠胃组织中胃蛋白酶活性降低(P<0.01),见图6B,说明乙醇诱导的胃炎大鼠模型复制成功。
3.2.2 胃康灵胶囊主要化学成分在人肠道菌液和鼠源肠道菌液中代谢速率比较 胃康灵胶囊中15 种原型成分在人源和鼠源肠道菌液中不同时间的相对剩余量见表2。由此可知,甘草苷、异甘草苷、芹糖甘草苷、异芹糖甘草苷与3种肠道菌液孵育6 h 后即可代谢完全,其代谢速率主要表现为人>正常大鼠、胃炎大鼠>正常大鼠。甘草素在3 种肠道菌液中的相对含量均会出现先增加后降低的趋势,在孵育1 h时,其代谢速率表现为人>正常大鼠>胃炎大鼠,在鼠源肠道菌液中甘草素代谢的程度比人源肠道菌液小。异甘草素在人源肠道菌中的相对含量同样存在先增加后降低的现象,然而,在鼠源肠道菌中的相对含量无明显升高的现象,表明异甘草苷在人源肠道菌液中的脱糖速度大于在鼠源肠道菌液中; 此外,胃炎大鼠肠道菌液孵育12 h 后,异甘草素几乎完全代谢,推测胃炎大鼠肠道菌组成可能发生了变化,加速了异甘草素的转化。芒柄花素在3 种肠道菌液的代谢行为与异甘草素类似。单萜苷类成分相比于黄酮苷类成分,其代谢速度较为缓慢。孵育48 h 后,氧化芍药苷在3 种肠道菌液中可被完全代谢,其代谢速率表现为正常大鼠>人、正常大鼠>胃炎大鼠; 芍药内酯苷的剩余量在正常大鼠为32%,胃炎大鼠为44%,人为16%,在0~48 h,代谢速率表现为正常大鼠>胃炎大鼠,此外,在0~6 h,代谢速率表现为正常大鼠>人,6~48 h 代谢速率表现为人>正常大鼠; 芍药苷的剩余量在正常大鼠为16%,胃炎大鼠约为4%,人几乎完全代谢,在0~3 h,代谢速率表现为人≈正常大鼠,正常大鼠>胃炎大鼠,在3 ~12 h,代谢速率表现为人>正常大鼠>胃炎大鼠,在12 ~48 h,代谢速率表现为人>胃炎大鼠>正常大鼠。dactylorhin A 和militarine 在1 h 内几乎被肠道菌液完全代谢,在快速代谢期内代谢速率表现为胃炎大鼠>正常大鼠>人; 甘草酸在正常大鼠肠道菌液和胃炎大鼠肠道菌液中代谢速率基本一致,均大于在人肠道菌液中的代谢速率。甘草次酸在肠道菌液中代谢速率表现为人>正常大鼠,胃炎大鼠>正常大鼠。
表2 胃康灵胶囊15 种原型成分在不同来源肠道菌液中孵育不同时间的相对剩余量(±s,n=3)
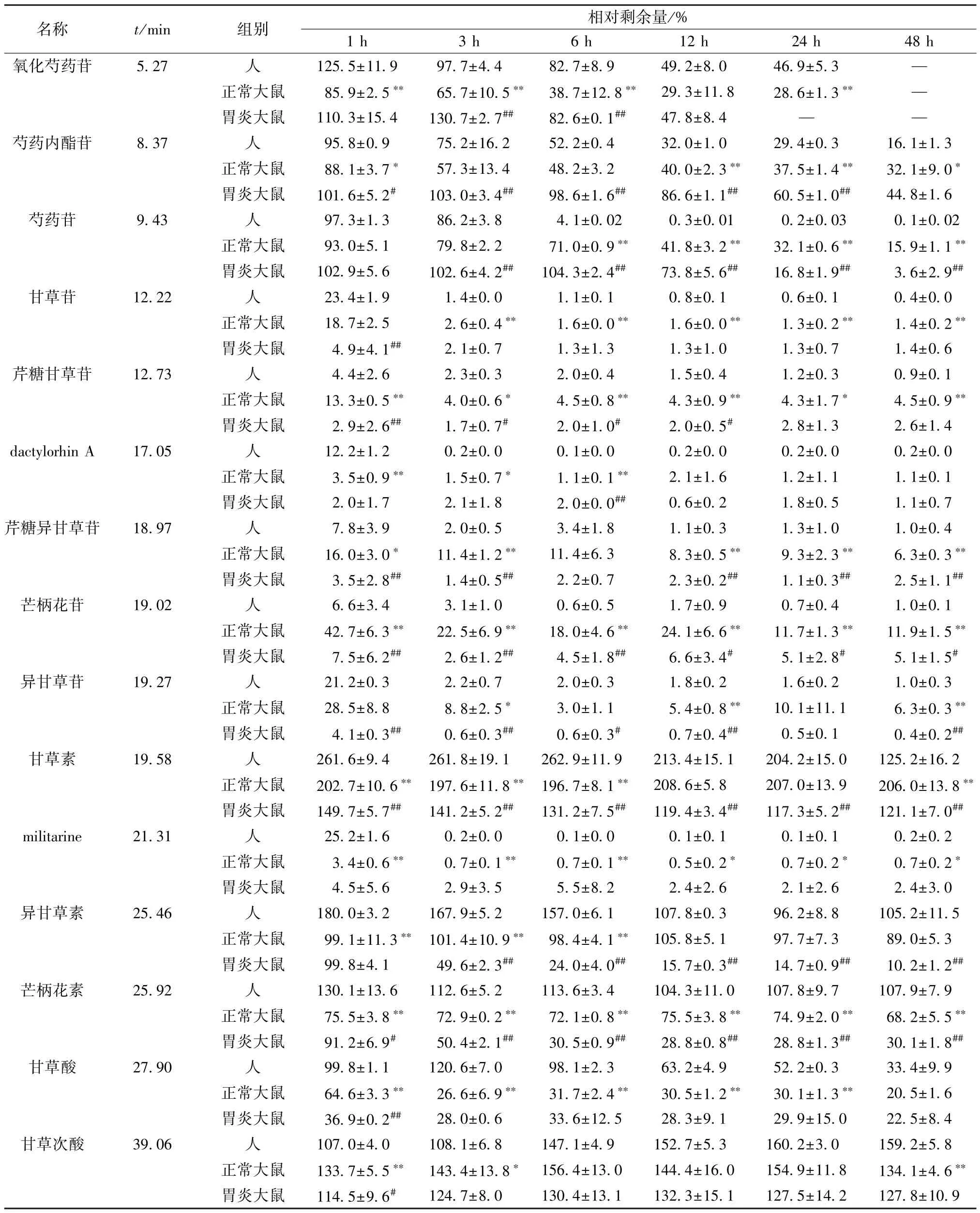
表2 胃康灵胶囊15 种原型成分在不同来源肠道菌液中孵育不同时间的相对剩余量(±s,n=3)
注: 与人肠道菌液比较,*P<0.05,**P<0.01; 与正常大鼠肠道菌液比较,#P<0.05,##P<0.01。
名称t/min组别相对剩余量/%1 h3 h6 h12 h24 h48 h氧化芍药苷5.27人125.5±11.997.7±4.482.7±8.949.2±8.046.9±5.3—正常大鼠85.9±2.5**65.7±10.5** 38.7±12.8** 29.3±11.828.6±1.3**—胃炎大鼠110.3±15.4130.7±2.7##82.6±0.1##47.8±8.4——芍药内酯苷8.37人95.8±0.975.2±16.252.2±0.432.0±1.029.4±0.316.1±1.3正常大鼠88.1±3.7*57.3±13.448.2±3.240.0±2.3**37.5±1.4**32.1±9.0*胃炎大鼠101.6±5.2#103.0±3.4##98.6±1.6##86.6±1.1##60.5±1.0##44.8±1.6芍药苷9.43人97.3±1.386.2±3.84.1±0.020.3±0.010.2±0.030.1±0.02正常大鼠93.0±5.179.8±2.271.0±0.9**41.8±3.2**32.1±0.6**15.9±1.1**胃炎大鼠102.9±5.6102.6±4.2##104.3±2.4##73.8±5.6##16.8±1.9##3.6±2.9##甘草苷12.22人23.4±1.91.4±0.01.1±0.10.8±0.10.6±0.10.4±0.0正常大鼠18.7±2.52.6±0.4**1.6±0.0**1.6±0.0**1.3±0.2**1.4±0.2**胃炎大鼠4.9±4.1##2.1±0.71.3±1.31.3±1.01.3±0.71.4±0.6芹糖甘草苷12.73人4.4±2.62.3±0.32.0±0.41.5±0.41.2±0.30.9±0.1正常大鼠13.3±0.5**4.0±0.6*4.5±0.8**4.3±0.9**4.3±1.7*4.5±0.9**胃炎大鼠2.9±2.6##1.7±0.7#2.0±1.0#2.0±0.5#2.8±1.32.6±1.4 dactylorhin A17.05人12.2±1.20.2±0.00.1±0.00.2±0.00.2±0.00.2±0.0正常大鼠3.5±0.9**1.5±0.7*1.1±0.1**2.1±1.61.2±1.11.1±0.1胃炎大鼠2.0±1.72.1±1.82.0±0.0##0.6±0.21.8±0.51.1±0.7芹糖异甘草苷18.97人7.8±3.92.0±0.53.4±1.81.1±0.31.3±1.01.0±0.4正常大鼠16.0±3.0*11.4±1.2**11.4±6.38.3±0.5**9.3±2.3**6.3±0.3**胃炎大鼠3.5±2.8##1.4±0.5##2.2±0.72.3±0.2##1.1±0.3##2.5±1.1##芒柄花苷19.02人6.6±3.43.1±1.00.6±0.51.7±0.90.7±0.41.0±0.1正常大鼠42.7±6.3**22.5±6.9**18.0±4.6**24.1±6.6**11.7±1.3**11.9±1.5**胃炎大鼠7.5±6.2##2.6±1.2##4.5±1.8##6.6±3.4#5.1±2.8#5.1±1.5#异甘草苷19.27人21.2±0.32.2±0.72.0±0.31.8±0.21.6±0.21.0±0.3正常大鼠28.5±8.88.8±2.5*3.0±1.15.4±0.8**10.1±11.16.3±0.3**胃炎大鼠4.1±0.3##0.6±0.3##0.6±0.3#0.7±0.4##0.5±0.10.4±0.2##甘草素19.58人261.6±9.4261.8±19.1262.9±11.9213.4±15.1204.2±15.0125.2±16.2正常大鼠202.7±10.6** 197.6±11.8** 196.7±8.1** 208.6±5.8207.0±13.9206.0±13.8**胃炎大鼠149.7±5.7##141.2±5.2##131.2±7.5##119.4±3.4##117.3±5.2##121.1±7.0##militarine21.31人25.2±1.60.2±0.00.1±0.00.1±0.10.1±0.10.2±0.2正常大鼠3.4±0.6**0.7±0.1**0.7±0.1**0.5±0.2*0.7±0.2*0.7±0.2*胃炎大鼠4.5±5.62.9±3.55.5±8.22.4±2.62.1±2.62.4±3.0异甘草素25.46人180.0±3.2167.9±5.2157.0±6.1107.8±0.396.2±8.8105.2±11.5正常大鼠99.1±11.3** 101.4±10.9** 98.4±4.1** 105.8±5.197.7±7.389.0±5.3胃炎大鼠99.8±4.149.6±2.3##24.0±4.0##15.7±0.3##14.7±0.9##10.2±1.2##芒柄花素25.92人130.1±13.6112.6±5.2113.6±3.4104.3±11.0107.8±9.7107.9±7.9正常大鼠75.5±3.8**72.9±0.2**72.1±0.8**75.5±3.8**74.9±2.0**68.2±5.5**胃炎大鼠91.2±6.9#50.4±2.1##30.5±0.9##28.8±0.8##28.8±1.3##30.1±1.8##甘草酸27.90人99.8±1.1120.6±7.098.1±2.363.2±4.952.2±0.333.4±9.9正常大鼠64.6±3.3**26.6±6.9**31.7±2.4**30.5±1.2**30.1±1.3**20.5±1.6胃炎大鼠36.9±0.2##28.0±0.633.6±12.528.3±9.129.9±15.022.5±8.4甘草次酸39.06人107.0±4.0108.1±6.8147.1±4.9152.7±5.3160.2±3.0159.2±5.8正常大鼠133.7±5.5** 143.4±13.8* 156.4±13.0144.4±16.0154.9±11.8134.1±4.6**胃炎大鼠114.5±9.6#124.7±8.0130.4±13.1132.3±15.1127.5±14.2127.8±10.9
4 讨论
课题组前期以芍药苷、甘草苷、militarine、人参皂苷(Rb1、Re、Rg1) 和三七皂苷R1 为对照品,建立白芍、甘草、白及和三七药材的“一板多药味” 薄层色谱鉴别方法[24]; 以芍药内酯苷、芍药苷、甘草酸、dactylorhin A 和militarine 为对照品,建立多成分含量测定评价方法[2]。然而,上述成分是否是药效成分有待确认。
依据胃康灵胶囊口服后的胃肠道代谢顺序,本研究首先探索人工胃液和人工肠液对胃康灵胶囊中主要化学成分的影响,证明其未发生明显变化,在此基础上深入探究胃康灵胶囊在人肠道菌液中的代谢变化。胃康灵胶囊中黄酮苷(甘草苷、异甘草苷、芹糖甘草苷、异芹糖甘草苷和芒柄花苷) 与人肠道菌液孵育1 h 即可被代谢90%以上,其相应的苷元含量(甘草素、异甘草素、芒柄花素) 与人肠道菌液孵育1 h 达到顶峰,说明胃康灵胶囊中黄酮苷在肠道菌水解酶作用下可快速转变为相应的苷元,同时预示着黄酮苷及其苷元在体内达峰时间极可能出现在1 h 以内,与文献报道一致[25]。dactylorhin A 和militarine 在肠道菌液中同样被快速代谢,体内达峰时间可能与黄酮苷类似。单萜苷(芍药苷、芍药内酯苷、氧化芍药苷) 在人肠道菌液的代谢相对缓慢,代谢3 h 后含量才会快速下降,说明胃康灵胶囊中单萜苷成分在体内的吸收代谢相对缓慢,而文献报道的单萜苷成分达峰时间在1 h 内[26],推测单萜苷成分受到其他成分的相互作用,其体内过程发生了变化。甘草酸在人肠道菌液的代谢同样相对缓慢,代谢48 h 后仍然有33%的剩余量,其代谢产物甘草次酸在6~48 h 的含量基本趋于平衡,说明肠道菌液不能继续代谢甘草次酸,推测甘草次酸在体内的达峰时间应该出现在6 h 之后。上述结果证实,本课题组前期用于质量控制的化学成分是潜在的药效成分[2,24],然而这些成分的体内药代动力学行为有待实验验证。同时,在快速代谢期比较胃康灵胶囊在人与正常大鼠的代谢情况发现,两者的代谢产物无差异,在代谢速率上,黄酮苷类成分和甘草次酸的代谢速率表现为人>正常大鼠,其他成分的代谢速率表现为正常大鼠>人,这说明使用大鼠进行胃康灵胶囊体内药效物质分析科学可行。同样,比较它们在正常大鼠与模型大鼠的代谢情况发现,单萜苷类成分的代谢速率主要表现为正常大鼠>模型大鼠,其他成分均表现为模型大鼠>正常大鼠,这说明在病理状态下,大鼠对药效成分的吸收速度存在差异,而这种差异需要进一步体内验证。
综上所述,胃康灵胶囊与人源和鼠源肠道菌液共孵育的体外代谢研究为其体内代谢考察奠定了基础。
