交趾黄檀新黄酮类成分及其抗H9c2 心肌细胞缺氧/复氧损伤活性研究
2024-03-10任佳慧郑启万孟晓伟陈兰英刘荣华
任佳慧,郑启万,孟晓伟,庞 妍,陈兰英,刘荣华*
(1.江西中医药大学药学院,江西 南昌 330004; 2.江西中医药大学中药固体制剂制造技术国家工程研究中心,江西 南昌 330006)
交趾黄檀为豆科黄檀属植物,主要分布在泰国、柬埔寨、越南、老挝等东南亚地区,民间常用于治疗血瘀、癌症[1]。交趾黄檀中主要含有黄酮、新黄酮、苯并呋喃类、萜类等成分,其中新黄酮类化合物为黄檀属植物的特征性成分,主要分为4 种亚结构类型(黄檀酚类、苯酰苯类、黄檀内酯类、黄檀醌类)[2],并且具有一定的抗骨质疏松、抗炎、抗肿瘤、抗氧化等活性[3-8],开发前景广阔。据报道,黄檀酚类化合物阔叶黄檀酚对H9c2 心肌细胞缺氧/复氧所致损伤具有较好的保护作用[9-10],因此本研究以交趾黄檀心材为研究对象,采用色谱分离及波谱技术对其二氯甲烷部位的化学成分进行分离及鉴定,并对得到的12 个新黄酮类化合物进行抗H9c2 心肌细胞缺氧/复氧损伤活性研究。
1 材料
Agilent 1260 型高效液相色谱仪(美国Agilent公司); Avance III HD 600 MHz 型核磁共振波谱仪(瑞士Bruker 公司); Sephadex LH-20 (美国GE Healthcare 公司); LC3000 型制备高效液相色谱仪(北京创新通恒科技有限公司); Chromcore 5 μm C18制备液相色谱柱(苏州纳谱分析技术有限公司)。薄层层析、柱层析硅胶(青岛海洋化工有限公司)。石油醚、二氯甲烷、乙酸乙酯、丙酮、甲醇(分析纯,广东西陇化工股份有限公司)。
大鼠H9c2 心肌细胞株(中国科学院上海细胞库)。胎牛血清(美国Gibco 公司); 高糖DMEM培养基、PBS 缓冲液、胰蛋白酶(北京索莱宝科技有限公司); 无糖DMEM 培养基(南京维森特生物技术有限公司); CCK-8 (北京兰杰柯科技有限公司)。葛根素 (成都普思生物科技股份有限公司)。
交趾黄檀购自广西防城港,经江西中医药大学付小梅教授鉴定为豆科黄檀属植物交趾黄檀DalbergiacochinchinensisPierre ex Laness 心材,凭证标本(编号201306)保存于江西中医药大学标本室。
2 提取与分离
取交趾黄檀心材18.35 kg,粉碎后用10 倍量70%乙醇加热回流提取3 次,前2 次为每次3 h,后1 次为2 h,合并提取液,减压浓缩得到总浸膏4.97 kg。取浸膏4.9 kg,加水混悬后依次用石油醚、二氯甲烷、乙酸乙酯、正丁醇萃取,分别得到石油醚萃取部位(15.1 g)、二氯甲烷萃取部位(1 206.8 g)、乙酸乙酯萃取部位(1 670.0 g)、正丁醇萃取部位(560.0 g)。
二氯甲烷部位经硅胶柱分离,以石油醚-乙酸乙酯(10 ∶1~0 ∶1) 梯度洗脱,得到Fr.1 ~Fr.4。Fr.2 (376.3 g) 经硅胶柱分离,以石油醚-乙酸乙酯(50 ∶ 1 ~0 ∶ 1) 梯度洗脱,得到Fr.2.1 ~Fr.2.6。Fr.2.4 经Sephadex LH-20 分离,以二氯甲烷-甲醇(1 ∶1) 洗脱,得到Fr.2.4.1 ~Fr.2.4.6。Fr.2.4.2 经反相制备HPLC 纯化,以甲醇-水(75 ∶25) 洗脱,得到化合物2 (2.1 mg,tR=20.4 min); Fr.2.4.3 经反相制备HPLC 纯化,以甲醇-水(70 ∶30) 洗脱,得到化合物4 (3.4 mg,tR=35.2 min); Fr.2.4.5 经反相制备HPLC 纯化,以甲醇-水(78 ∶22) 洗脱,得到化合物5 (2.7 mg,tR=22.5 min)。Fr.2.5 (80.2 g) 经硅胶柱分离,以石油醚-丙酮(100 ∶1 ~1 ∶1) 梯度洗脱,得到Fr.2.5.1~Fr.2.5.4。Fr.2.5.1 经反相制备HPLC纯化,以乙腈-水 (45 ∶55) 洗脱得到化合物3(2.3 mg,tR=56.2 min); Fr.2.5.3 经反相制备HPLC 纯化,以乙腈-水(45 ∶55~100 ∶0) 梯度洗脱,得到化合物8 (2.3 mg,tR=26.4 min)、10(1.9 mg,tR=42.5 min)。
Fr.3 (46.7 g) 经硅胶柱分离,以石油醚-丙酮(80 ∶ 1 ~1 ∶ 1) 梯度洗脱,得到Fr.3.1 ~Fr.3.4。Fr.3.1 经Sephadex LH-20 纯化,以二氯甲烷-甲醇(1 ∶1) 洗脱,得到化合物1 (7.1 g);Fr.3.2 经反相制备HPLC 纯化,以甲醇-水(63 ∶37) 洗脱,得到化合物6 (1.6 mg,tR=46.8 min)。
Fr.4 (728.4 g) 经硅胶柱分离,以石油醚-乙酸乙酯(20 ∶1 ~0 ∶1) 梯度洗脱,得到Fr.4.1 ~Fr.4.8。Fr.4.2 经反相制备HPLC 纯化,以甲醇-水(75 ∶25) 洗脱,得到化合物7 (2.4 mg,tR=21.4 min)、9 (2.2 mg,tR=39.6 min); Fr.4.4 经反相制备HPLC 纯化,以甲醇-水(78 ∶22) 洗脱,得到化合物11 (2.3 mg,tR=35.2 min); Fr.4.6经反相制备HPLC 纯化,以乙腈-水(72 ∶28) 洗脱,得到化合物12 (3.1 mg,tR=51.3 min)。
3 结构鉴定
化合物1: 白色结晶,易溶于甲醇,分子式C17H18O4,ESI-MSm/z: 285.1 [M-H]-。1H-NMR(600 MHz,CDCl3)δ: 7.19 (1H,dd,J=7.7,1.5 Hz,H-6′),7.13 (1H,td,J=7.9,1.6 Hz,H-4′),6.90 (1H,td,J=7.5,1.1 Hz,H-5′),6.85 (1H,dd,J=8.0,1.1 Hz,H-3′),6.78(1H,s,H-6),6.54 (1H,s,H-3),6.34 (1H,ddd,J=17.1,10.3,5.9 Hz,H-2″),6.01 (1H,s,2′-OH),5.29 (1H,dt,J=10.3,1.5 Hz,=CH2cis),5.22 (1H,s,5-OH),5.21 (1H,d,J=5.8 Hz,H-1″),5.07 (1H,dt,J=17.2,1.6 Hz,=CH2trans),3.90 (3H,s,4-OCH3),3.87(3H,s,2-OCH3);13C-NMR (150 MHz,CDCl3)δ: 122.5 (C-1),149.4 (C-2),97.0 (C-3),145.5 ( C-4),140.1 ( C-5),115.2 ( C-6),129.4 ( C-1′),153.7 ( C-2′),116.3 ( C-3′),128.4 ( C-4′),120.6 ( C-5′),127.7 ( C-6′),40.0 ( C-1″),139.0 ( C-2″),116.8 ( C-3″),57.2 (2-OCH3),56.2 (4-OCH3)。以上数据与文献[11] 报道基本一致,故鉴定为阔叶黄檀酚。
化合物2: 黄色粉末,易溶于甲醇,分子式C18H20O4,ESI-MSm/z: 299.1 [M-H]-。1H-NMR(600 MHz,CH3OD)δ: 7.03 (1H,d,J=7.8 Hz,H-4′),7.00 (1H,d,J=6.9 Hz,H-6′),6.75 (2H,m,H-3′,5′),6.71 (1H,s,H-6),6.60 ( 1H,s,H-3),6.22 ( 1H,m,H-2″),5.42 (1H,d,J=5.7 Hz,=CH2cis),5.12 (1H,d,J=10.2 Hz,H-1″),4.77 (1H,d,J=17.1 Hz,=CH2trans),3.78 (3H,s,4-OCH3),3.68(3H,s,5-OCH3),3.67 (3H,s,2-OCH3);13CNMR ( 150 MHz,CH3OD)δ: 123.4 ( C-1),151.9 (C-2),98.6 (C-3),148.3 (C-4),142.6(C-5),114.2 (C-6),114.7 (C-1′),154.6 (C-2′),118.8 (C-3′),129.0 (C-4′),126.8 (C-5′),129.4 ( C-6′),40.4 ( C-1″),140.3 ( C-2″),114.8 (C-3″),56.2 (5-OCH3),55.8 (2-OCH3),55.4 (4-OCH3)。以上数据与文献[12]报道基本一致,故鉴定为5-O-methyllatifolin。
化合物3: 棕色固体,易溶于丙酮,分子式C17H18O3,ESI-MSm/z: 269.1 [M-H]-。1H-NMR(600 MHz,acetone-d6)δ: 7.28 ~7.16 (5H,m,H-2′~6′),6.75 (1H,s,H-6),6.55 (1H,s,H-3),6.38 (1H,ddd,J=17.1,10.2,7.0 Hz,H-2″),5.17 (1H,d,J=10.2 Hz,=CH2cis),5.11 (1H,d,J=7.1 Hz,=CH2trans),4.97(1H,d,J=17.1 Hz,H-1″),3.74 (3H,s,2-OCH3),3.69 (3H,s,5-OCH3);13C-NMR (150 MHz,acetone-d6)δ: 120.7 (C-1),149.0 (C-2),101.3 (C-3),148.7 (C-4),143.7 (C-5),114.9 (C-6),142.7 (C-1′),128.0 (C-2′,6′),128.4 (C-3′,5′),125.8 (C-4′),47.4 (C-1″),140.9 (C-2″),114.9 (C-3″),56.5 (5-OCH3),55.2 (2-OCH3)。以上数据与文献[13] 报道基本一致,故鉴定为mimosifoliol。
化合物4: 黄色粉末,易溶于甲醇,分子式C18H20O3,ESI-MSm/z: 283.1 [M-H]-。1H-NMR(600 MHz,CH3OD)δ: 7.15 ~7.27 (5H,m,H-2′~6′),6.73 (1H,s,H-6),6.68 (1H,s,H-3),6.30 (1H,ddd,J=17.0,10.2,6.7 Hz,H-2″),5.18 (1H,m,=CH2cis),5.06 (1H,brd,J= 6.0 Hz,H-1″),4.90 ( 1H,m,=CH2trans),3.86 (3H,s,4-OCH3),3.73 (6H,s,2,5-OCH3);13C-NMR (150 MHz,CH3OD)δ:124.9 (C-1),153.1 (C-2),99.8 (C-3),150.0(C-4),144.2 (C-5),115.8 (C-6),144.8 (C-1′),129.1 ( C-2′,6′),129.5 ( C-3′,5′),127.0 ( C-4′),48.7 ( C-1″),142.0 ( C-2″),116.2 ( C-3″),56.8 ( 2-OCH3),56.9 ( 4-OCH3),57.6 (5-OCH3)。以上数据与文献[12]报道基本一致,故鉴定为5-O-methydalbergiphenol。
化合物5: 黄色粉末,易溶于氯仿,分子式C17H18O3,ESI-MSm/z: 269.1 [M-H]-。1H-NMR(600 MHz,CDCl3)δ: 7.18 ~7.26 (5H,m,H-2′~6′),6.75 (1H,s,H-6),6.52 (1H,s,H-3),6.27 (1H,ddd,J=16.9,10.1,6.7 Hz,H-2″),5.20 (1H,d,J=7.8 Hz,=CH2cis),5.09 (1H,d,J=6.6 Hz,H-1″),4.93 (1H,d,J=17.1 Hz,=CH2trans),3.90 (3H,s,4-OCH3),3.73 (3H,s,2-OCH3);13C-NMR (150 MHz,CDCl3)δ: 125.0 (C-1),150.9 (C-2),97.8(C-3),145.5 (C-4),139.7 (C-5),115.7 (C-6),143.7 ( C-1′),128.5 ( C-2′,6′),128.9(C-3′,5′),126.3 (C-4′),47.4 (C-1″),140.8(C-2″),116.3 (C-3″),56.5 (2-OCH3),57.4(4-OCH3)。以上数据与文献[12] 报道基本一致,故鉴定为dalbergiphenol。
化合物6: 黄色粉末,易溶于甲醇,分子式C14H12O4,ESI-MSm/z: 245.1 [M +H]+。1H-NMR(600 MHz,CDCl3)δ: 12.49 (1H,s,2-OH),7.66~7.51 (5H,m,H-2′~6′),7.13 (1H,s,H-3),5.21 (1H,s,H-6),4.00 (3H,s,4-OCH3);13C-NMR (150 MHz,CDCl3)δ: 111.8(C-1),160.1 (C-2),99.9 (C-3),153.8 (C-4),137.7 (C-5),116.7 (C-6),200.0 (C-7),138.2 (C-1′),128.8 (C-2′,6′),128.3 (C-3′,5′),131.5 (C-4′),56.3 (4-OCH3)。以上数据与文献[14] 报道基本一致,故鉴定为cearoin。
化合物7: 黄色粉末,易溶于甲醇,分子式C14H12O4,ESI-MSm/z: 243.1 [M-H]-。1H-NMR(600 MHz,acetone-d6)δ: 12.43 (1H,s,2-OH),7.69 ~7.58 (5H,m,H-2′ ~6′),7.01(1H,s,H-6),6.62 (1H,s,H-3),3.98 (3H,s,5-OCH3);13C-NMR (150 MHz,acetone-d6)δ:112.1 ( C-1),160.9 ( C-2),101.0 ( C-3),139.4 ( C-4),156.6 ( C-5),117.8 ( C-6),200.6 (C-7),139.8 (C-1′),129.2 (C-2′,6′),129.4 ( C-3′,5′),132.2 ( C-4′),56.6 ( 5-OCH3)。以上数据与文献 [15] 报道基本一致,故鉴定为2,4-dihydroxy-5-methoxy-benzophenone。
化合物8: 黄色粉末,易溶于氯仿,分子式C15H14O4,ESI-MSm/z: 257.1 [M-H]-。1H-NMR(600 MHz,CDCl3)δ: 12.68 (1H,s,2-OH),7.75~7.59 (5H,m,H-2′~6′),7.08 (1H,s,H-6),6.65 (1H,s,H-3),4.04 (3H,s,4-OCH3),3.80 (3H,s,5-OCH3);13C-NMR (150 MHz,CDCl3)δ: 110.9 (C-1),161.3 (C-2),100.7 ( C-3),156.9 ( C-4),141.7 ( C-5),114.4 ( C-6),199.6 ( C-7),138.4 ( C-1′),128.4 ( C-2′,6′),128.7 ( C-3′,5′),131.5(C-4′),56.5 (4-OCH3),56.3 (5-OCH3)。以上数据与文献[16] 报道基本一致,故鉴定为2-hydroxy-4,5-dimethoxybenzophenone。
化合物9: 黄色结晶,易溶于丙酮,分子式C14H12O5,ESI-MSm/z: 259.1 [M-H]-。1H-NMR(600 MHz,acetone-d6)δ: 12.43 (1H,s,2-OH),7.64 (2H,d,J=8.6 Hz,H-2′,H-6′),7.11 (1H,s,H-3),7.01 (1H,d,J=8.6 Hz,H-3′,5′),6.59 (1H,s,H-6),3.97 (3H,s,4-OCH3);13C-NMR (150 MHz,acetone-d6)δ:112.2 ( C-1),160.4 ( C-2),101.0 ( C-3),155.9 ( C-4),139.6 ( C-5),115.9 ( C-6),199.3 (C-7),130.7 (C-1′),132.4 (C-2′,6′),117.8 ( C-3′,5′),161.8 ( C-4′),56.5 ( 4-OCH3)。以上数据与文献 [17] 报道基本一致,故鉴定为melannoin。
化合物10: 黄色粉末,易溶于甲醇,分子式C14H12O5,ESI-MSm/z: 259.1 [M-H]-。1H-NMR(600 MHz,acetone-d6)δ: 8.24 (1H,dd,J=7.9,1.5 Hz,H-6′),7.80 (1H,ddd,J=8.6,7.2,1.6 Hz,H-4′),7.59 (1H,s,H-6),7.56(1H,d,J=8.4 Hz,H-3′),7.44 (1H,dd,J=11.1,3.9 Hz,H-5′),7.13 ( 1H,s,H-3),4.07 (3H,s,4-OCH3);13C-NMR (150 MHz,acetone-d6)δ: 116.0 ( C-1),152.3 ( C-2),100.6 ( C-3),155.6 ( C-4),145.4 ( C-5),109.4 ( C-6),175.9 ( C-7),122.2 ( C-1′),157.0 ( C-2′),118.6 ( C-3′),135.0 ( C-4′),124.5 (C-5′),126.8 (C-6′),56.9 (4-OCH3)。以上数据与文献[18] 报道基本一致,故鉴定为2,2′,5-trihydroxy-4-methoxybenzophenone。
化合物11: 白色粉末,易溶于甲醇,分子式C16H12O4,ESI-MSm/z: 267.1 [M-H]-。1H-NMR(600 MHz,acetone-d6)δ: 7.60 ~7.52 (5H,m,H-2′~6′),7.03 (1H,s,H-8),6.86 (1H,s,H-5),6.14 (1H,s,H-3),4.00 (3H,s,7-OCH3);13C-NMR ( 150 MHz,acetone-d6)δ:161.1 ( C-2),112.5 ( C-3),156.2 ( C-4),111.5 ( C-5),144.3 ( C-6),152.5 ( C-7),101.0 ( C-8),150.1 ( C-9),112.8 ( C-10),136.8 (C-1′),129.2 (C-2′,6′),129.7 (C-3′,5′),130.3 (C-4′),56.8 (7-OCH3)。以上数据与文献[19]报道基本一致,故鉴定为黄檀素。
化合物12: 黄色结晶,易溶于氯仿,分子式C16H14O3,ESI-MSm/z: 253.1 [M-H]-。1H-NMR(600 MHz,CDCl3)δ: 7.27 ~7.35 (5H,m,H-2′~6′),6.51 (1H,s,H-3),6.12 (1H,m,H-2″),5.94 (1H,s,H-6),5.30 (1H,d,J=10.1 Hz,=CH2cis),5.02 (1H,d,J=17.1 Hz,=CH2trans),4.96 (1H,d,J=5.7 Hz,H-1″),3.83 (3H,s,4-OCH3);13C-NMR (150 MHz,CDCl3)δ: 151.0 (C-1),186.3 (C-2),107.9(C-3),158.5 (C-4),182.4 (C-5),131.6 (C-6),139.3 ( C-1′),128.6 ( C-2′,6′),128.8(C-3′,5′),127.2 (C-4′),47.0 (C-1″),137.2(C-2″),118.2 (C-3″),56.3 (4-OCH3)。以上数据与文献[11] 报道基本一致,故鉴定为4-甲氧基黄檀醌。
4 抗H9c2 心肌细胞缺氧/复氧损伤活性研究
4.1 H9c2 细胞存活率 取对数生长期H9c2 心肌细胞,以1.0×104/cm2的密度接种于96 孔板上,于37 ℃、5% CO2培养箱中培养24 h,弃去上清液,加入含1 000、100、10、1、0.1 μmol/L 化合物1~12 细胞培养液,每孔100 μL,另设正常细胞对照组,每组6 个复孔,于37 ℃、5%CO2培养箱中培养24 h,弃去上清液,加入10% CCK-8,在450 nm 波长处测定光密度 (OD) 值,计算IC50值。
由表1 可知,化合物6~7、12 对H9c2 细胞有一定的细胞毒性,其余化合物作用后H9c2 细胞存活率高,毒性较小,表明新黄酮中苯酰苯类化合物毒性较强,对H9c2 细胞具有一定的细胞毒性,可能与其羰基未成环有关。
表1 各化合物对H9c2 细胞的IC50值(μmol/L,±s,n=6)Tab.1 IC50 values of various compounds on H9c2 cells(μmol/L,±s,n=6)
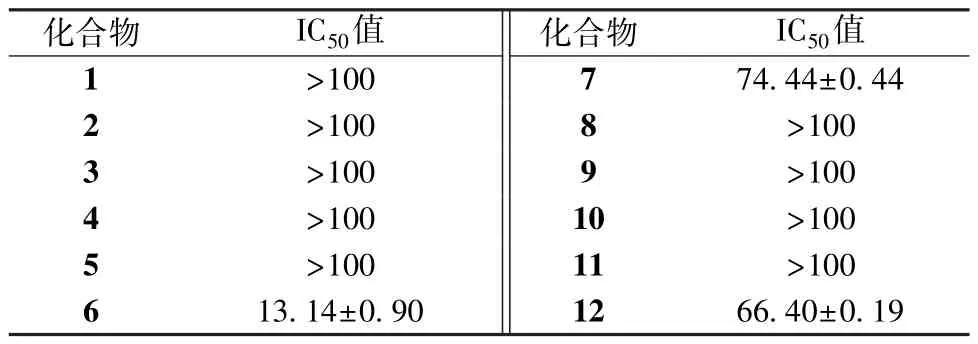
表1 各化合物对H9c2 细胞的IC50值(μmol/L,±s,n=6)Tab.1 IC50 values of various compounds on H9c2 cells(μmol/L,±s,n=6)
化合物IC50值化合物IC50值1>100 774.44±0.44 2>1008>100 3>1009>100 4>10010>100 5>10011>100 6 13.14±0.901266.40±0.19
4.2 H9c2 细胞缺氧/复氧损伤保护作用 取对数生长期H9c2 细胞,以1.0×104/cm2的密度接种于96 孔板上,于37 ℃、5%CO2培养箱中培养24 h,正常组与模型组弃去原培养液,加入10%FBS,给药组加入含不同浓度化合物1 ~12 及50 μmol/L 葛根素(阳性对照) 的10%FBS,于37 ℃、5%CO2培养箱中培养24 h,正常组弃去上清液,加入10%FBS; 模型组弃去上清液,加入无糖DMEM 缺氧液; 给药组弃去上清液,加入含不同浓度化合物1~12 及50 μmol/L 葛根素的无糖DMEM 缺氧液,将模型组与给药组放入缺氧小室缺氧20 h,正常组与模型组弃去上清液,加入10%FBS; 给药组弃去上清液,加入含不同浓度化合物1~12 及50 μmol/L葛根素的10%FBS,于37 ℃、5%CO2培养箱中培养4 h。
细胞缺氧复氧完成后,采用CCK-8 法检测细胞活力,将复氧后的细胞上清液加入10%CCK-8,在450 nm 波长处测定OD 值,计算细胞活力。
由图1 可知,化合物1 的细胞活力较弱,最小有效浓度为5 μmol/L; 化合物2、8、11 最小有效浓度均为1.25 μmol/L,其中化合物8 活性较强;化合物5、7、9、12 最小有效浓度均为0.625 μmol/L,其中化合物5 活性较强; 化合物4、10 最小有效浓度均为0.312 5 μmol/L; 化合物3、6 最小浓度均为0.156 25 μmol/L,其中化合物3 活性最强。
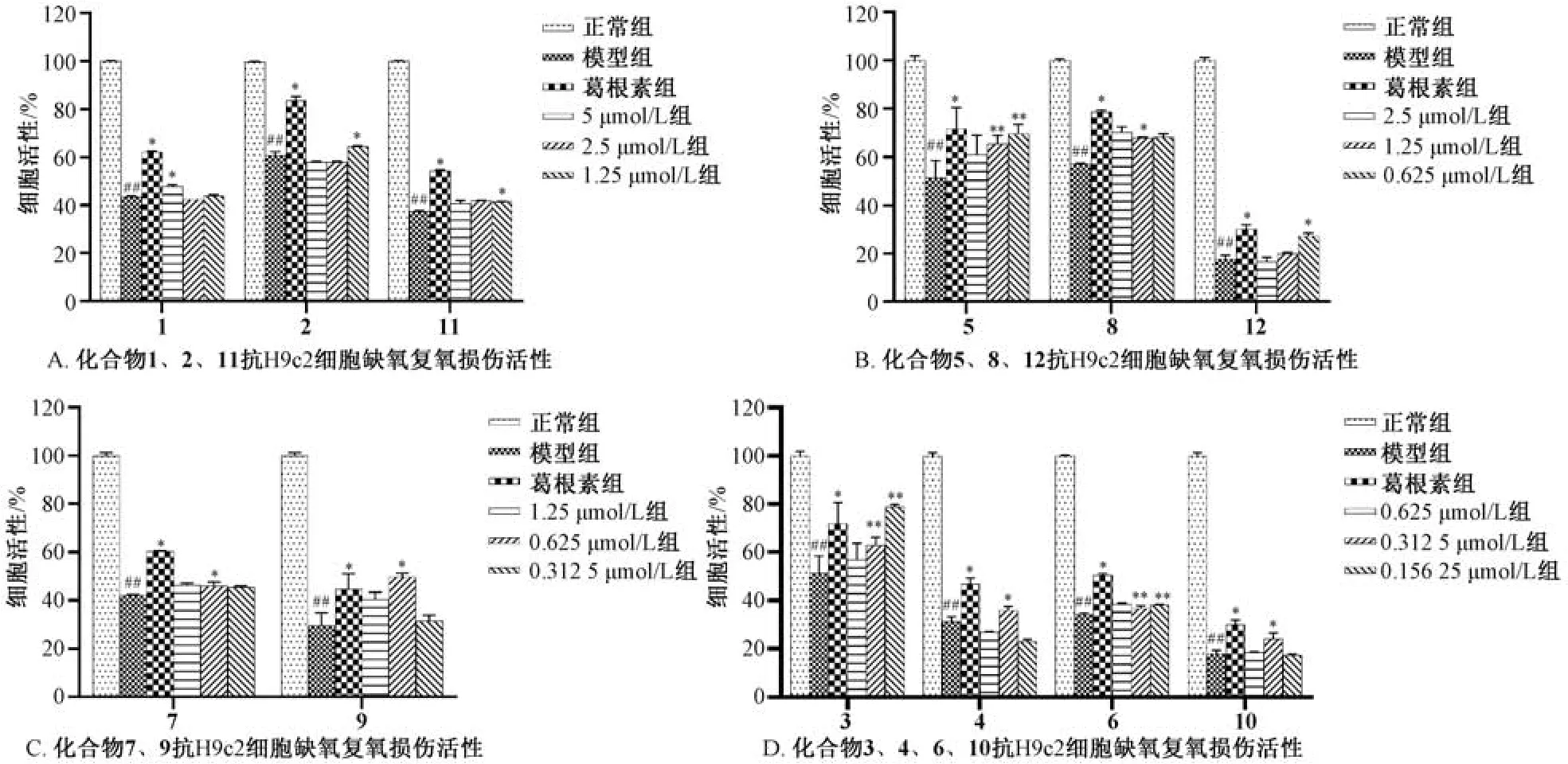
图1 各化合物对H9c2 心肌细胞缺氧/复氧损伤的保护作用Fig.1 Protective effects of various compounds on hypoxia/reoxygenation injury in H9c2 cells
4.3 新黄酮类成分抗H9c2 心肌细胞缺氧/复氧损伤构效关系分析 黄檀酚类化合物(1~5) 结构差异主要为B 环是否存在羟基及A 环4、5 位羟基及甲氧基的取代位置不同,根据化合物1~2、4~5 化学结构及细胞实验结果,发现B 环2′位存在羟基,可能会降低其H9c2 细胞缺氧/复氧保护活性; 分析化合物3 ~5 化学结构及细胞实验结果,推测黄檀酚类化合物A 环4 位存在羟基或者5 位存在甲氧基,均会增强其对H9c2 细胞缺氧/复氧的保护活性。
苯酰苯类化合物(6 ~10) 结构差异主要为B环是否存在羟基,以及A 环4、5 位羟基及甲氧基的取代位置不同,根据化合物6、9 ~10 化学结构及细胞实验结果,发现B 环存在羟基,可能会降低其H9c2 细胞缺氧/复氧保护活性; 分析化合物6~8 化学结构及细胞实验结果,推测苯酰苯类化合物A 环羟基数目增多其抗心肌缺氧/复氧活性增强。
对黄檀酚及苯酰苯类化合物(11~12) 进行构效分析,发现两者B 环存在羟基均会降低其活性,推测羟基取代可能会影响其电子分布及共轭情况,从而影响其极性,降低其对H9c2 细胞缺氧/复氧的保护作用。黄檀内酯及黄檀醌类化合物因缺少同类型化合物,故难以比较其抗H9c2 心肌细胞缺氧/复氧损伤构效关系,但羰基数目增多、羰基是否成环对细胞毒性有较大影响。
4 结论
本研究从交趾黄檀二氯甲烷部位中分离得到12 个新黄酮类化合物,并对其进行抗H9c2 心肌细胞缺氧/复氧损伤活性研究。结果,化合物1 ~5 为黄檀酚类,6~10 为苯酰苯类化合物,11 为黄檀内酯类,12 为黄檀醌类,其中黄檀酚类化合物具有更好的开发价值及药用疗效,其IC50值与最低药物有效浓度间差异大于其余3 类化合物,并且细胞毒性最低,具有更好的用药安全性及更大的药物有效浓度选择范围,有一定的开发价值。分析12 个化合物构效关系得知,黄檀酚类化合物其抗H9c2 细胞缺氧/复氧活性与其骨架中羟基、甲氧基的数目及位置具有密切的关系,B 环中存在羟基可能会降低其活性,A 环中C-4 位存在羟基或C-5 位存在甲氧基都会增强其活性; 苯酰苯类化合物毒性较强,其B 环存在羟基会降低其药物活性,A 环中羟基数目增多反而会增强其活性; 黄檀内酯类化合物11及黄檀醌类化合物12 也表现出较好的抗缺氧/复氧损伤活性。同时,构效关系的研究也可以用于指导系列化合物进行后续合成,对抗心肌缺氧/复氧损伤研究具有一定的意义[20-21]。
