酿酒酵母耐受机制研究进展
2024-03-10崔金娜朱明达刘占英
张 乐,崔金娜,刘 伟,朱明达,刘占英,*
(1.内蒙古自治区发酵产业节能减排工程技术研究中心,内蒙古 呼和浩特 010051;2.生物发酵绿色制造内蒙古自治区工程研究中心,内蒙古 呼和浩特 010051;3.内蒙古工业大学化工学院,内蒙古 呼和浩特 010051)
酿酒酵母(Saccharomyces cerevisiae)是一种芽殖酵母,也是人类了解最早、应用最广泛的一种酵母[1],一般呈圆形、卵形或椭圆形,宽度为2.5~10 μm,长度为4.5~21 μm,细胞无真菌丝,通过重复出芽繁殖,有些细胞发育为子囊,是含1~4 个子囊孢子的子囊菌。酿酒酵母具有发酵能力强、生长周期短及易大规模培养等优点,是重要的工业生产菌种。酿酒酵母在饮料和食品工业中被广泛应用,具有重要的商业意义。在饮料行业,酿酒酵母参与许多发酵饮料的生产,如葡萄酒、啤酒和苹果酒等,酵母菌将糖分解产生乙醇和二氧化碳,赋予了这些产品特有的口味和醇性,其也被用来发酵果汁、茶等,提高了产品的营养和风味,而且,酿酒酵母菌体富含高浓度蛋白质和活性小肽,甘露糖和β-葡聚糖等活性多糖,以及维生素和矿物质多种营养功能成分,在酸奶和面包的发酵中也发挥了关键作用[2]。此外,酿酒酵母作为最常用的真核基因工程表达系统和受体细胞,是基因工程药物、酶制剂和化学品生产的主要菌种[3],但在工业生产过程中,酿酒酵母会受到多种物理、化学和生物胁迫因素的影响,导致生产效率下降。这些胁迫主要包括啤酒、葡萄酒和白酒工业生产所带来的渗透压、乙醇毒性和氧化应激,柠檬酸和乳酸工业生产中所带来的有机酸毒性,食醋酿造生产中高温糖化所带来的温度冲击,以及发酵饲料工业生产中由微生物污染引起的生物胁迫[4]。作为重要的工业菌株和模式生物,酿酒酵母对环境胁迫的耐受机制以及如何提高其环境胁迫的耐受性一直是国内外学者研究的重点。近年来,许多研究专注于探究酿酒酵母耐受机制与相关调控网络,并利用基因工程等技术开发出了耐受性更强的酿酒酵母工业菌株,为酿酒酵母在恶劣工业条件下的应用奠定了基础。本文就酿酒酵母六大主要耐受机制(渗透压、乙醇、高温、有机酸、氧化、SO2)进行综述,以期为提高其在生产中对环境胁迫的耐受性提供参考。
1 酿酒酵母渗透压耐受性
浓醪发酵技术被广泛应用于我国传统发酵食品如豆腐乳的生产中,也适用于淀粉原料的深度发酵和乙醇生产,这种发酵方式不仅能提高生产能力,增加发酵强度,还可以提高设备利用率、减少能源消耗、劳动力成本和工业废水排放[5],利用此技术生产的食品具有醇香型的风味和较长的货架期。然而,在发酵初始阶段,高糖或高盐对酵母细胞产生不可避免的渗透胁迫,该胁迫会导致细胞缩水,抑制细胞活性,进而导致发酵效率降低[6]。对于此种胁迫,酿酒酵母主要通过高渗透性甘油促分裂原活化蛋白激酶(high osmolarity glycerol mitogenactivated protein kinase,HOG-MAPK)途径和离子泵等方式应对[7]。阐明酿酒酵母耐高渗机制有利于利用现代微生物技术对酿酒酵母进行选育,以获得工业生产所需的高性能菌株。
1.1 HOG-MAPK途径
发生高渗胁迫时,酵母细胞会在几秒钟内收缩,在不到1 min的时间内,甘油出口通道蛋白Fps1迅速关闭以防止甘油泄漏,从而使这种兼容渗透物质得以积累[8]。为了恢复渗透平衡,HOG-MAPK途径被激活,Hog1蛋白激酶的磷酸化反应首先导致离子的释放刺激[9],阻断细胞周期并降低翻译能力[10],此外,它还刺激了糖酵解以增加渗透压产生甘油[11],并通过快速调节通道蛋白Fsp1微调甘油含量[12]。酵母细胞的高渗胁迫适应性依赖于甘油积累,一旦细胞内甘油水平达到其最大值的三分之一左右,Hog1蛋白激酶就会去磷酸化,减弱基因表达反应。在渗透性休克发生后,立即观察到的甘油积累主要是由于刺激代谢通路并阻止甘油的外流,同时酵母细胞通过调控甘油通道蛋白的基因微调其甘油含量。
HOG-MAPK途径上游的两个信号感受分支分别为Sln1和Sho1,这两个分支在不同的条件下有不同的作用与分工(图1)。Sho1分支参与了很多其他的信号感应传导,比如氧化胁迫、热胁迫等,Sln1分支则对渗透压胁迫更敏感,其渗透压感应范围更大,在一定的高渗压和极高的盐浓度下都能正常执行功能。
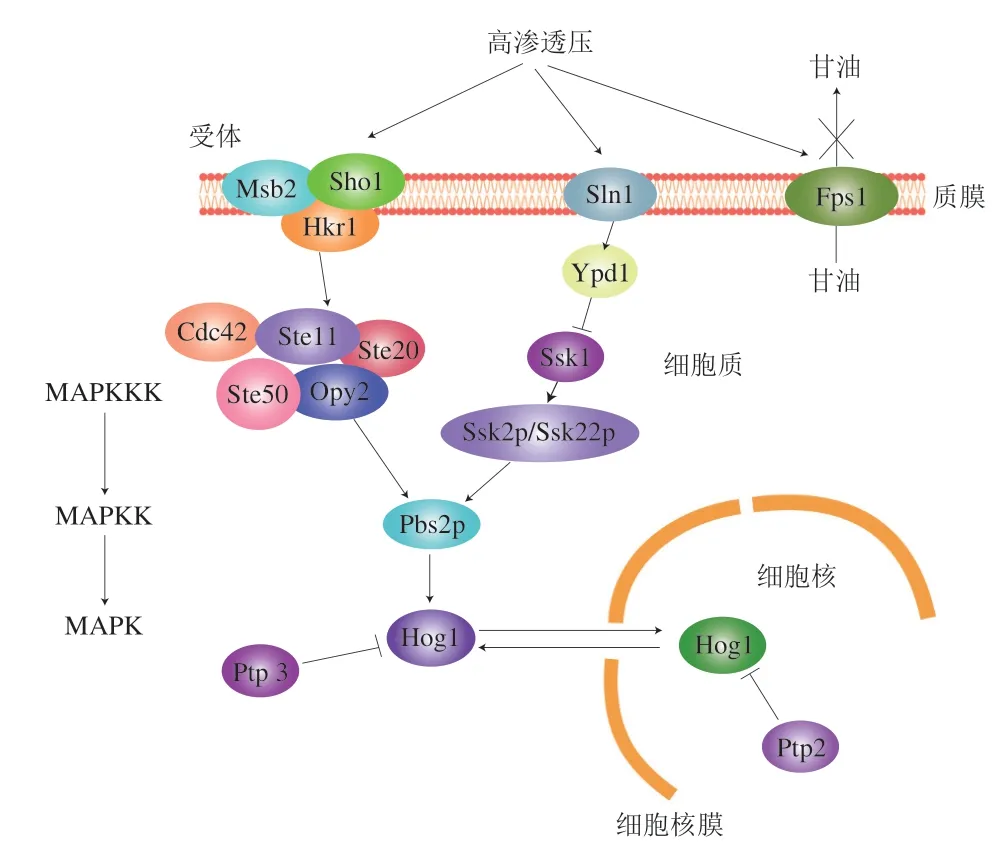
图1 酿酒酵母HOG-MAPK途径信号系统和反应机制Fig.1 The HOG-MAPK pathway signaling system and reaction mechanism in S.cerevisiae
Sho1 分支包括跨膜蛋白Sho1 和假定的渗透传感器Hkr1和Msb2,它是一个MAPKKKSte11、支架MAPKK Pbs2p和Hog1组成的膜相关复合体,该分支还有其他蛋白组分(Cdc42、Ste50、Ste20和Opy2)共同参与运转[13]。在许多真菌中,Sho1模块不与Pbs2连接,因此不参与渗透反应,这表明Sho1模块可能不具有渗透感应的作用,而是根据细胞极性机制在激活中的作用感知与细胞形状和/或细胞表面条件相关的信号[14],信号特异性通过支架蛋白(Sho1、Opy2、Pbs2)和Hog1激酶保证[15]。Sho1的大小变化比一级序列小得多,表明其具有结构而非酶功能。
Sln1分支由多个功能蛋白组成,其中处于最前端的渗透传感器组氨酸激酶Sln1,是一个非常关键的感应蛋白,参与信号转导过程中的负反馈调节。Sln1分支还包括磷转移蛋白Ypd1和响应调节因子Ssk1,两者共同组成一个双组分磷酸转移系统。在酿酒酵母中,渗透传感器组氨酸激酶Sln1通过负反馈调节下游MAPK级联,当Sln1失活时,Hog1被过度激活,导致细胞死亡[16]。以上研究表明,在高渗环境条件,Sln1组氨酸激酶在二聚体内交叉磷酸化,磷酸基团通过Sln1受体和应答调节域以及Ypd1磷酸转移蛋白转移到Ssk1应答调节蛋白,高渗休克导致Sln1激酶失去活性和Ssk1去磷酸化,突变分析支持了上述研究假设,涉及磷脂酶系统的所有步骤。而未磷酸化的Ssk1介导冗余MAPKKKs Ssk2和Ssk22的激活,后者反过来激活Pbs2。这两个信号分支协同作用,使得酵母细胞能够对渗透压变化做出快速而灵活的反应。
1.2 离子稳态机制
在酵母细胞中,不同转运体存在于细胞质膜和细胞器表面上,通过不同的机制介导离子流动。质膜上已知的6 个转运体包括钾离子吸收系统Trk1p和Trk2p、钾离子通道蛋白Tok1p、钙离子通道蛋白Cch1p-Mid1p、Ena1p和Na+反向转运体Nha1p。细胞器表面的转运体包括液泡上的转运蛋白Vcx1p、Pmc1p、Nhx1p,钙离子通道蛋白Yvc1p,细胞核上的Crz1p和高尔基体上的Kha1p。由图2可知,酿酒酵母中K+和Na+的转运是由ATP驱动的主动转运和H+反转运介导的。通常酵母细胞输出Na+并积累K+。Ena1p是一种Na+输出通道蛋白,属于自磷酸化离子和脂质泵的P型ATP酶家族。Ena1的转录是通过钙调神经磷酸酶依赖的机制实现的,并在细胞外高浓度的Na+和Li+条件下诱导[17]。Nhx1p是一种Na+/K+交换剂,通过在液泡中隔离Na+,降低胞质Na+浓度,从而适应高盐介质[18]。

图2 酿酒酵母的离子稳态机制Fig.2 Ion homeostasis mechanism of S.cerevisiae
胞质钙应对离子应激的反应会短暂增加,达到更高的稳态浓度。Yvc1p在胞质溶胶中释放空泡Ca2+,Cch1p-Mid1p介导细胞外环境中的Ca2+内流,以维持胞质Ca2+浓度。同时,作为液泡Na+/H+交换剂的Nhx1p将Na+隔离在液泡中[19]。Pmr1p有助于恢复内质网和高尔基复合体分泌Ca2+。液泡转运蛋白Pmc1p和Vcx1p响应细胞外高离子浓度,将Ca2+导入液泡。然而,作为对细胞外高浓度Ca2+的反应,Vcx1p活性以及可能的vcx1表达,以未知的钙调神经磷酸酶依赖性方式下调[20]。当胞质溶胶中Na+/Li+过量时,钙调神经磷酸酶还上调Ena1p(有助于Na+外排和K+内流)和另一个Na+外流泵Nha1p的表达[21]。酵母中的K+通道是向外整流的Trk1p/Trk2p和Tok1p通道,其优先导致K+流出。有研究表明,在Na+胁迫期间,Tok1p蛋白可能被Hog1p蛋白抑制,这导致细胞膜去极化和Na+流入减少[22](图2)。
2 酿酒酵母乙醇耐受性
酿酒酵母在乙醇生产方面具有卓越的潜力,是酿造酒精饮料(如葡萄酒、啤酒和清酒)的优势发酵菌种[23]。与其他微生物相比,酿酒酵母具有更高的乙醇产量和耐受性,但发酵液中高浓度的乙醇是影响细胞生长和活力、抑制某些关键酶活性、干扰各种细胞代谢以及导致发酵产量和乙醇产量下降的主要因素[24]。
目前已选育出可以耐受更高浓度乙醇的酿酒酵母菌株,其发酵极限可以达到20%(体积分数,下同)以上的乙醇体积分数,这些高产乙醇酵母菌株通过代谢途径的改造和其他抗乙醇毒性机制的提高实现了较高的耐乙醇性。乙醇体积分数超过20%会影响细胞膜完整性,降低质膜流动性和小分子离子的渗透性,导致跨膜电位耗散,并使细胞内环境和液泡酸化。同时,在高浓度下,乙醇也会扰乱蛋白质构象,导致蛋白质变性和功能障碍,例如糖酵解途径中的丙酮酸激酶和己糖激酶受高浓度乙醇影响,活性会显著降低。高浓度乙醇还会影响细胞对葡萄糖、麦芽糖、铵和氨基酸的摄取,从而导致核苷酸、氨基酸和钾的细胞渗漏。提高酿酒酵母的乙醇耐受性可以保证酵母菌在乙醇体积分数超过20%的发酵醪液中具有较好的细胞活性和较高的发酵性能,因此酵母菌的乙醇耐受性成为世界范围内的研究热点。乙醇对酿酒酵母细胞的影响主要体现在细胞膜损伤、蛋白质变性、代谢紊乱和DNA破坏几个方面,而酵母菌通过增加中性脂和甾醇稳定膜结构、表达热休克蛋白(heat shock protein,HSP)修复细胞损伤、激活抗氧化酶和DNA修复系统减轻氧化应激、上调乙醇脱氢酶加速乙醇代谢以及调控细胞内酸碱平衡等机制应对乙醇胁迫,最终恢复正常的生长与发酵功能(图3),这些机制的协同作用赋予了酿酒酵母较强的耐乙醇能力。目前,通过基因工程等手段对酵母菌乙醇耐受性的生物化学和分子生物学机理进行进一步的研究,已鉴定出数百个与乙醇耐受相关的基因,涉及广泛的功能类别,包括蛋白质生物合成、氨基酸代谢、核苷酸代谢、脂质代谢、脂肪酸和麦角甾醇代谢、膜和细胞壁组织合成、脯氨酸生物合成,以及色氨酸生物合成等过程。对乙醇耐受机制的全面解析可以为构建人工设计高乙醇耐受性酵母菌株提供理论基础,以下主要基于综合基因表达分析、基因表达途径和综合抗性以及调控网络的乙醇耐受机制进行阐述。

图3 酿酒酵母的乙醇耐受机制Fig.3 Ethanol tolerance mechanism of S.cerevisiae
2.1 细胞壁及细胞质膜基因
酿酒酵母中乙醇耐受相关的膜和细胞壁基因较多,Auesukaree等[25]通过全基因组测序发现与膜成分相关基因etr1、oar1、sur4、fen1和htd2等参与饱和脂肪酸的代谢,lip5、pdx3、ldb19和opi3等参与脂质和磷脂代谢,这些基因在乙醇胁迫下上调,此外,分别编码细胞壁完整性(cell wall integrity,CWI)途径的MAPKKK和MAPK的bck1和slt2基因对乙醇耐受性至关重要,因此CWI途径参与对乙醇诱导的细胞壁应激反应[26]。在乙醇胁迫后,CWI途径诱导特定细胞壁重塑基因表达,包括fks2、crh1和pir3(分别编码β-1,3-葡聚糖合酶、几丁质转糖基化酶和O-糖基化细胞壁蛋白),最终导致细胞壁结构的重塑。研究表明,smi1基因调控细胞壁的合成,hoc1、ldb7和vma9基因参与甘露糖蛋白生物合成,wsc3、slg1和slt2基因编码激活蛋白激酶C1-MAPK途径的传感器,在乙醇胁迫期间,CWI和HOG途径协同调节特定细胞壁生物合成基因的转录,从而导致细胞壁的适应性变化。Fujita等[27]通过已知的遗传相互作用对已鉴定的乙醇抗性决定因素编码的蛋白质进行聚类,突出了液泡蛋白分选机制、液泡H+-ATPase复合物和过氧化物酶体蛋白质导入机制的重要性,进一步研究发现编码质膜水甘油通道蛋白的fps1基因在乙醇应激抵抗力中的特殊作用,fps1表达的增加也证实了该基因在酵母体内发挥重要作用,最终导致乙醇产量增加。You等[28]发现在乙醇胁迫下多不饱和脂肪酸在细胞中被转化为单不饱和脂肪酸。Stukey等[29]发现在乙醇胁迫下,棕榈油酸和油酸都是由ole1编码的脂肪酸去饱和酶分别通过棕榈酸和硬脂酸的氧和烟酰胺腺嘌呤二核苷酸依赖性去饱和形成,单不饱和脂肪酸、棕榈油酸和油酸是酿酒酵母质膜的关键组成成分,由此可以看出,酿酒酵母通过增加质膜流动性消除乙醇胁迫带来的危害。麦角甾醇是影响细胞质膜流动性的另一关键组分,Teixeira等[30]通过基因缺失突变研究发现在乙醇胁迫过程中,麦角甾醇含量增加,erg2、erg3、erg5、erg6、erg24和erg28等参与麦角甾醇合成的基因全部上调。虽然在乙醇胁迫下,细胞壁和质膜的相关基因已被解析,但其抵御乙醇胁迫的具体机制尚不明确,需要进一步研究阐明由细胞壁和质膜介导的乙醇耐受精确机制。
2.2 氨基酸的合成及转运
在酵母细胞中,脯氨酸和色氨酸具有增强蛋白质稳定性及在蛋白质折叠过程中抑制蛋白质聚集的功能,可以保护细胞免受冷冻、干燥和乙醇的伤害。Sekine等[31]发现编码酿酒酵母γ-谷氨酰蛋白激酶的基因pro1的点突变(D154N)导致细胞对脯氨酸的反馈抑制减弱,脯氨酸过量积累,同时这种酵母突变体的乙醇耐性提高,表明胞内较高的脯氨酸含量对提高酵母细胞乙醇耐受性起到了一定的作用。通过易错聚合酶链式反应得到了pro1的突变体文库,得到了更多因pro1基因突变而导致对脯氨酸反馈抑制不敏感的突变体,同时发现,敲除put1基因(与脯氨酸的分解利用有关),并替换野生型的pro1为突变型的pro1,所得到的突变体细胞内脯氨酸含量比对照组高5 倍,同时乙醇耐性得到提高。Hirasawa等[32]的微阵列分析结果表明,在乙醇耐性高的Sake酵母中,色氨酸合成途径相关的基因表达量较高,进一步研究表明,色氨酸合成酶基因(trp2和trp5)和色氨酸透性酶基因(tat2)的过量表达可以赋予酵母细胞良好的乙醇耐性,向含有5%乙醇的培养基添加100 µg/mL色氨酸后,细胞的生长速率明显提高,这说明色氨酸的添加是赋予酵母细胞乙醇耐性的有效途径。
2.3 HSP及海藻糖的累积
Ogawa等[33]研究发现在乙醇胁迫下诱导的编码HSP的基因表现出与热应激反应相关基因的广泛重叠,这些诱导基因的表达由典型的上调转录反应表现出来。目前确定的显著上调的HSP基因至少包括10 个:hsp12、hsp26、hsp30、hsp31、hsp32、hsp42、hsp78、hsp82、hsp104和hsp150。海藻糖的积累还可以更好地帮助酿酒酵母抵抗乙醇的胁迫。Chandler等[34]发现在乙醇胁迫下,参与海藻糖合成的基因tps1、tps2、tsl1、pgm2和ugp1都显著上调。
3 酿酒酵母高温耐受性
在白酒生产中,淀粉原料首先需要在65~95 ℃条件下糊化和液化,然后进行酵母发酵和蒸馏,发酵温度保持在28~35 ℃。这属于典型的高温糖化发酵过程,可以使原料中的淀粉充分转化为葡萄糖,从而提高原料利用率。耐热酿酒酵母在40 ℃进行发酵,不但能降低冷却成本,而且能减少能耗和二氧化碳排放量,促进催化过程,防止污染[35]。
高温(45~55 ℃)条件下线粒体功能的紊乱会导致严重的细胞损伤,进而导致酵母细胞死亡和自溶,同时,高温自溶还会破坏生物活性化合物,如β-葡聚糖和多肽,从而影响酵母自溶物的抗氧化活性,因此,比较和分析耐热性酵母和传统酵母在酶、核酸、细胞膜结构和功能以及生物合成系统方面的差异是早期酵母耐热机制的研究重点。自从在原核生物和真核生物中发现热休克现象以来,HSP和热休克反应(heat shock response,HSR)成为研究的热点。HSR可加速活性氧(reactive oxygen species,ROS)的产生,包括超氧阴离子自由基、过氧化氢和高活性羟自由基,从而导致氧化损伤,酿酒酵母则会产生相应的抗氧化剂对抗热诱导的氧化应激[36]。最新研究表明,有几种影响因子参与调控酿酒酵母耐热性,包括HSP、海藻糖、ATP酶、泛素和抗氧化酶等[37]。
热胁迫主要分为长期热胁迫和短时热胁迫,在长期热胁迫中,HSP是大部分生物用来抵抗高温的最有效手段,可以保护热损伤蛋白不聚集,使受损蛋白重新折叠,清除不可逆聚集蛋白,提高应激细胞中可溶性蛋白和质子泵的热稳定性。而在短时热胁迫中,主要由热激转录因子(heat shock transcriptionfactor,HSF)调控。如图4所示,在正常生理状态下,HSF保持单体或二聚体状态,酸性激活结构隐藏,没有活性,热激后,无活性的HSF单体或二聚体之间结合形成多聚体,构象发生改变,原来隐蔽的活性结构域被释放出来,与热激元件(heat shock element,HSE)靶基因启动子上长度为5 bp的顺式作用元件结合,其保守序列为nGAAn[38],最后在其他因素(如转录酶、ATP等)的辅助下,转录相关基因,进而翻译成HSP,这种现象被描述为HSR[39]。
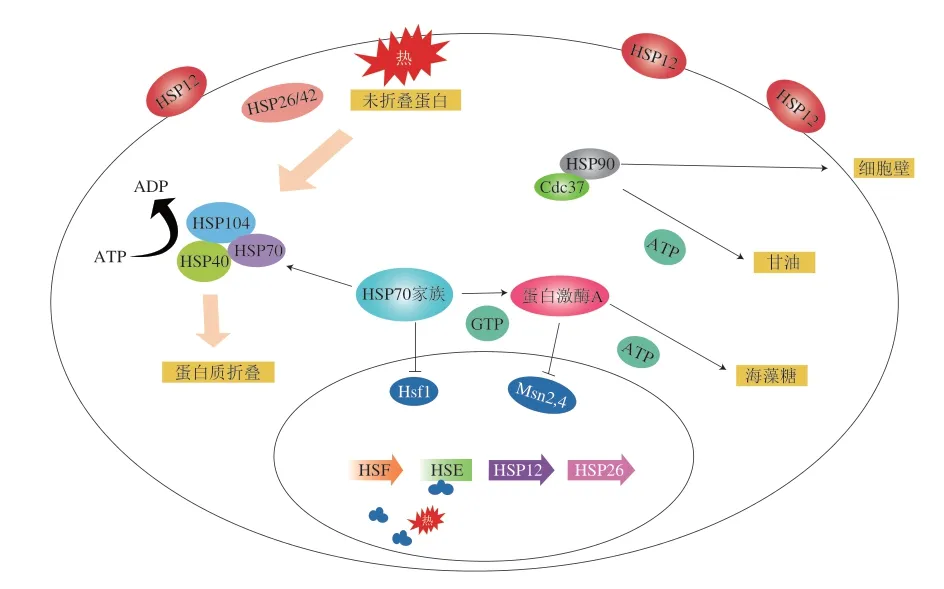
图4 酿酒酵母的短时热应激机理Fig.4 Short-term heat stress mechanism of S.cerevisiae
4 酿酒酵母有机酸耐受性
木质纤维素是自然界中最丰富的可再生资源之一,其水解产物可用于酿酒酵母发酵生产乙醇,能有效缓解紧迫的能源危机和化石燃料燃烧带来的环境污染问题[40]。木质纤维素在水解过程中会产生抑制物,从而导致发酵效率降低[41],这些抑制物主要为有机酸、糠醛、5-羟甲基糠醛等[42],其中,有机酸如柠檬酸、苹果酸、乳酸和乙酸会破坏细胞内酸碱平衡,影响细胞壁和质膜的功能,从而诱导氧化应激和程序性细胞死亡,对发酵菌株具有很高的毒性[43]。因此,阐明酿酒酵母耐酸机理,利用基因工程等技术获得耐酸菌株,对高效木质纤维素生物资源的炼制具有重要意义。
在低pH值条件下(<4.76),有机酸处于未解离(质子化)状态,可以通过Fps1p通道蛋白或简单扩散进入细胞[44],进入细胞质后,酸就会分解成酸根阴离子和质子,如图5所示,当葡萄糖不存在时,酸根离子通过Jen1p或Ady2p通道蛋白进入细胞内,在通过过氧化物体或胞质转化为乙酰辅酶A,之后进入到三羧酸循环;当葡萄糖存在时,细胞质中酸的游离以及酸诱导的细胞膜通透性增加,导致H+内流速率增加,细胞内酸化,从而导致DNA和RNA合成速率降低,代谢活性受到抑制,并破坏维持在细胞膜上的质子梯度,最终导致细胞质酸化并抑制一些重要的代谢过程[45]。为了避免质膜电位的耗散并且维持内部pH值在正常生理值内,酵母细胞依赖于刺激质膜P型H+-ATPase的活性,ATP水解并泵出质子。对辛酸、山梨酸、十二酸、乙酸、甲酸和琥珀酸的反应可以提高质膜P型H+-ATPase活性,这可能是为了抵消亲脂性酸引起的细胞内酸化和质膜电位耗散[46]。同时,存在于液泡膜上的V型H+-ATPase通将质子隔离到液泡腔内,有助于恢复胞质pH值,并抵消酸诱导的跨膜电位在液泡膜上的耗散。Geng Peng等[47]通过蛋白组学分析发现,在酸性除草剂2,4-D胁迫下,细胞内氨基酸的液泡区隔化依赖于功能性V型H+-ATPase,研究表明在弱酸胁迫下,该质子泵有可能起到代谢产物的区隔化作用。
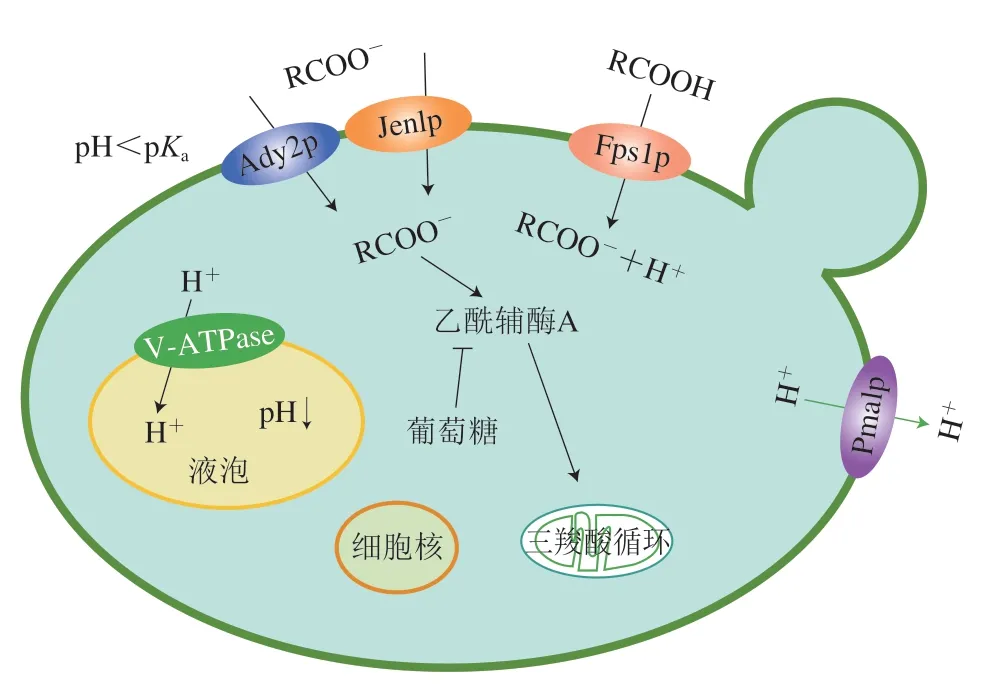
图5 酿酒酵母的耐酸机制Fig.5 Acid tolerance mechanism of S.cerevisiae
5 酿酒酵母抗氧化应激
氧是一种高活性分子,可以形成许多活性自由基,因此又被称为ROS,其在细胞中由呼吸作用、类固醇生长和长链脂肪酸的β-氧化等代谢过程产生[48],此外,ROS还可由电离辐射或环境中存在的氧化还原循环化合物形成。在生物乙醇生产中,高浓度的糖会导致细胞内产生过量的ROS,如超氧阴离子自由基和H2O2等,这会损伤细胞膜、蛋白质和DNA,抑制酵母菌的生长和乙醇发酵[49],当氧化剂浓度超过细胞抗氧化能力时,就会发生氧化应激。酿酒酵母具有酶和非酶两种防御系统保护细胞成分,维持细胞氧化还原状态,阐明酿酒酵母氧化应激机制有利于利用基因工程改造技术提高酿酒酵母的抗氧化能力。非酶防御系统中最典型的物质是L-谷胱甘肽(L-glutathione,GSH),GSH是一种自由基清除剂,其具有氧化还原活性的巯基与氧化剂反应能生成氧化型谷胱甘肽(glutathione disulfide,GSSG)。GSH作为细胞中最丰富的氧化还原清除分子,在维持细胞氧化还原状态中具有非常重要的作用,在酿酒酵母中已经鉴定出与GSH生物合成相关的基因gsh1(编码谷氨酰半胱氨酸合成酶)和gsh2(编码GSH合成酶),并从酵母中分离出了gsh1和gsh2突变体[50]。此外,研究发现野生型gsh1基因是编码线粒体蛋白(Pet5155)基因突变的质量作用抑制剂,这表明GSH在保护细胞,尤其是保护线粒体免受呼吸作用产生的氧化剂的影响方面发挥着重要作用[51]。另一类具有抗氧化性质的物质是金属硫蛋白,其富含半胱氨酸,并可以结合多种不同金属离子,在酿酒酵母中已发现金属硫蛋白由gup1基因编码,并证明其在保护酵母细胞避免受氧化侵害方面发挥重要作用[52]。
酿酒酵母抗氧化防御还包括几种能够清除氧自由基及其产物的酶。过氧化氢酶能够催化H2O2分解为O2和H2O,酿酒酵母中具有两种过氧化氢酶——过氧化氢酶A和过氧化氢酶T,分别由cta1和ctt1编码[53]。过氧化氢酶A位于过氧化物酶体中,其主要生理作用是清除脂肪酸产生的H2O2,过氧化氢酶T位于胞质中,然而,ctt1基因的表达受氧化胁迫、渗透胁迫和饥饿的调控,同时缺乏cta1和ctt1的酵母菌株对H2O2在固定相高度敏感,单过氧化氢酶和双过氧化氢酶突变体都无法对H2O2产生适应性胁迫反应[54]。因此,虽然过氧化氢酶基因仅能被H2O2中度诱导,但这两种过氧化氢酶显然对H2O2都具有防御作用。酿酒酵母还具有两种超氧化物歧化酶(superoxide dismutase,SOD),分别是位于线粒体的Mn SOD(由sod2基因编码)和位于细胞质的Cu/Zn SOD(由sod1基因编码)中,Mn SOD的生理作用是保护线粒体免受呼吸过程中产生的超氧化物的伤害,而在对抗发酵生长过程中外源添加氧化还原循环化合物产生的超氧化物阴离子的毒性方面作用不大,相比之下,Cu/Zn SOD是参与从细胞质中清除超氧阴离子自由基的主要酶,也是过氧化物酶体[55](图6)。

图6 酿酒酵母的氧化应激机理Fig.6 Oxidative stress mechanism of S.cerevisiae
6 酿酒酵母SO2耐受性
SO2具有防腐和抗氧化性能,在酿酒过程中通常作为添加剂加入抑制腐败生物的生长,其通常以偏亚硫酸氢钾或偏亚硫酸钠的形式添加到发酵液中。根据溶液pH值的不同,SO2具有多种存在形式[56],在pH<3时,主要以SO2(pKa1.8)分子的形式存在,在葡萄酒中(3<pH<3.8)主要以亚硫酸氢盐(HS,pKa6.9)的形式存在[57],亚硫酸盐(S)以配体缺失的游离态存在于中性至微碱性条件下(pH 6.5~8.0),这种状态下的可与蛋白质和核酸中的氨基、羰基、巯基等亲核基团发生亲电子加成反应,导致这些生物大分子结构和功能的损伤,从而引起细胞死亡。因此,阐明酿酒酵母耐硫机制有利于利用遗传改造技术提高酿酒酵母耐硫性。
据报道,SO2通过被动扩散渗透微生物质膜,进入微生物细胞后,由于细胞内pH值超过pKa值,SO2分子分解成H,在酿酒酵母细胞内会抑制甘油醛-3-磷酸脱氢酶活性,从而导致ATP消耗、质膜结构扰动以及二硫键断裂导致的蛋白质、维生素或辅酶损伤[58]。酿酒酵母存在多条硫代谢途径,包括硫酸盐还原途径、亚硫酸盐氧化途径、硒代硫代谢途径、同分异构酶途径、谷胱甘肽合成途径、甲硫氨酸合成途径和半胱氨酸合成途径。其中,同分异构酶途径将硫酸盐还原为硫化物,通过硫转运蛋白运输;谷胱甘肽合成途径将硫酸盐合成为GSH,GSH是细胞内重要的抗氧化剂和硫源。这些途径相互配合,保证了细胞硫平衡和多种硫代产物的合成,这也与酵母菌能量代谢、氧化还原状态和抗氧化防御等密切相关。酿酒酵母通过不同的机制应对SO2进入细胞产生的细胞损伤,García-Ríos等[59]发现ssu1基因编码的质膜可以通过泵排出,因此通过过表达ssu1基因可以提高菌株对的耐受性。
7 酿酒酵母其他耐受性
除了上面介绍的几种胁迫应激外,酿酒酵母还存在冷冻胁迫应激、有毒有机溶剂胁迫应激和微生物污染引起的生物胁迫应激。在工业生产过程中,低温和工业副产物等因素会使酵母产生一系列的应激反应,同时在发酵过程中产生的单萜类化合物、糠醛等代谢产物也会引起菌株胁迫反应。研究酿酒酵母对这些胁迫因子的耐受机制非常重要,因为酿酒酵母的性能直接影响到发酵进程和产品的质量。
Kim[60]通过筛选转座子介导的突变文库分离出一株耐受冻融胁迫的菌株,经鉴定,ycp4基因发生失活,此外,该相应基因的缺失和过度表达证实了其与冻融耐受表型有关,能通过降低细胞内ROS水平,激活Msn2,4和Stre介导的基因(如ctt1和hsp12),表现出抗冻融能力。Mertens等[61]通过过表达yap1p基因改善了实验室菌株对木质纤维素水解物或糠醛和5-羟甲基糠醛的耐受。Su Yide等[62]利用甲磺酸乙酯(ethyl methane sulfonate,EMS)诱变技术筛选得到对异丁醇具有较高耐受性的酿酒酵母EMS39,对EMS39菌株进行了转录组学分析,发现酿酒酵母对异丁醇耐受性的提高来源于cwp2和srp4039的过表达。He Xianlin等[63]发现植物乳杆菌的存在可以提高酿酒酵母的乙醇耐受性,其机制包括促进海藻糖、麦角甾醇、某些氨基酸、质子泵、应激反应转录激活剂和热HSP的代谢,抑制细胞内单不饱和脂肪酸的量和ROS的积累。Zhu Liying等[64]采用了一种名为RAndom插入-缺失链交换诱变的新型随机诱变技术操纵酿酒酵母的转录调节剂spt3,以提高菌株对铅的耐受性,并发现在某些胁迫条件下,酿酒酵母细胞内海藻糖的积累对铅抵抗很重要。以上研究为酿酒酵母冷冻的反应机制和改造工业菌种提供了新的启发和思路。
8 结语
酿酒酵母作为工业生产中最常用的菌种,其发酵生产的乙醇、食品和药品在经济社会中发挥着重要作用。然而,在工业生产过程中,酿酒酵母会受到一些环境和代谢压力的限制,导致发酵能力降低,从而影响产品产率。本文重点从渗透压、乙醇、高温、有机酸、氧化和SO26 个方面阐述酿酒酵母的耐受机制,总结了与胁迫因素相关的耐受机制中的关键基因,从研究机制的关联性来看,酿酒酵母对于多种环境胁迫耐受机制具有一定的内在联系,如海藻糖的积累与渗透胁迫、乙醇胁迫和氧化胁迫等多种胁迫因素都有关;从研究的热点来看,研究酿酒酵母一种耐受机制的同时,也应该关注其他耐受机制。通过基因工程等手段获得高耐性菌株的同时,对细胞发酵性能的影响是多方面的,应从不同角度分析以获得更为深刻的认识。
随着现代微生物技术的发展,对酿酒酵母环境胁迫耐受机制的探究已开展多年,研究人员不断发现与胁迫因素相关的新基因,一方面这些结果显示出酵母细胞代谢途径之间的相关性;另一方面也代表了不同的培养条件及遗传背景下酿酒酵母环境胁迫耐受机制的多样性。在基因组学和蛋白组学等分析方法及细胞代谢工程操作手段进一步发展的背景下,对酿酒酵母环境胁迫耐受机制的研究将得到进一步深入和提高,将更有效地控制酵母菌对于多种环境胁迫的耐受性,从而提高细胞的发酵能力和生物转化效率,将酿酒酵母更好地应用于工业生产,提高产品产率。
