混合冷却对宰后黄羽肉鸡能量代谢和品质的影响
2024-03-10徐幸莲赵庭辉梅新成
赵 洋,徐幸莲,赵庭辉,王 鹏,*,梅新成,李 震
(1.南京农业大学食品科技学院,肉品质量控制与新资源创制全国重点实验室,江苏 南京 210095;2.云南省丽江市宁蒗县畜牧工作指导站,云南 丽江 674301)
我国黄羽肉鸡产量占鸡肉总产量的30%,与传统的白羽肉鸡相比,黄羽肉鸡肉质鲜美、滋味浓郁,并且在烹调方式上更加适合东方的烹调习惯。长期以来,黄羽肉鸡的产业链布局多集中在养殖阶段,而后续屠宰及深加工力度明显不足[1]。肉鸡行业经历两次H5N7后,市场上活禽交易逐渐转变为冻品和冰鲜鸡交易。冰鲜鸡是经检验检疫之后,在加工贮运销售过程中始终保持0~4 ℃的冷鲜鸡肉[2]。
预冷是冰鲜鸡加工过程中的关键控制点,预冷处理应在2 h以内将鸡胴体温度降低到0~4 ℃[3]。预冷处理可以对鸡胴体进行有效的清洁,对微生物的活性具有显著抑制作用,并且对肉鸡的品质具有一定的影响[4]。目前肉鸡预冷处理的方式主要有3 种,分别是风冷、水冷和混合冷却(先水冷后风冷)[5],在我国黄羽肉鸡的预冷主要以0~4 ℃冰水处理为主,在欧洲混合冷却在白羽肉鸡上应用更为广泛。混合冷却前半段采用0~4 ℃的冷水处理,后半段在0~4 ℃的隧道中进行风冷处理,所用时间一般长达6000 s[3,6]。与水冷相比,混合冷却对水电资源的消耗更小,在预冷的过程中避免了胴体交叉污染;与风冷相比,混合冷却有更加高效的降温效率,对微生物的活性抑制效果更好[7]。因此,现阶段企业尝试采用混合冷却技术对黄羽肉鸡进行预冷加工。前半段是在0~4 ℃冰水混合物中进行,对胴体进行清洗和冷却;后半段风冷处理,主要是将胴体中心温度在短时间内降低到0~4 ℃[8]。
宰后早期肉鸡主要由无氧糖酵解途径提供能量,由于机体无法从外界获取氧气,肌肉中的能量供应由有氧代谢转变为无氧代谢;随着肌肉中的肌糖原和腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)逐渐消耗,乳酸大量积累导致肌肉pH值快速下降[9],而pH值的变化,会直接影响肌肉的持水力、嫩度、水分含量和组织状态[10]。在无氧呼吸的过程中己糖激酶(hexokinases,HK)、磷酸甘油酸激酶(glyceraldehyde-3-phosphate dehydrogenase,PGK)和乳酸脱氢酶(lactate dehydrogenase,LDH)对无氧糖酵解的反应速率起到主要的调控作用[11]。林珩迅等[12]对比了冰温和冷鲜贮藏猪肉,其中冰温贮藏的猪肉HK、PGK和LDH活性更低,说明温度变化对酶活性具有显著影响。目前鲜有关于调控混合冷却中风冷温度对宰后黄羽肉鸡能量代谢、保水性和嫩度的影响的系统性研究报道。因此,研究混合冷却过程中风冷温度对宰后早期黄羽肉鸡能量代谢和品质的影响,明确不同风冷温度对肉鸡降温速率和品质的影响,可以为黄羽肉鸡加工企业在宰后选择合理的冷却条件提供理论依据。
1 材料与方法
1.1 材料与试剂
85 日龄三黄鸡 南京温氏畜禽有限公司;HK、PGK、LDH、糖原、乳酸和Bradford测定试剂盒 南京建成生物工程有限公司;5-三磷酸腺苷钠盐、5-磷酸腺苷钠盐 美国Sigma Aldrich公司;甲醇(色谱级)、高氯酸 国药集团;0.22 μm过滤器和硝酸纤维膜 美国Millipore公司。
1.2 仪器与设备
M2e多功能酶标仪 德国MD公司;C-LM3B剪切力仪 东北农业大学工程学院;Precellys Evolution冷冻均质机 法国Bertin公司;PD500高速匀浆机 英国Prima公司;Avanti J-E型离心机 美国Beckman Coulter公司;205 pH计 德国Testo公司;MUL-9000纯水机 美国密理博公司;PQ001-低场核磁共振成像分析仪苏州纽迈分析仪器股份有限公司;JK500温度巡视仪常州市金艾联电子科技有限公司;1100超高效液相色谱仪 美国Agilent公司。
1.3 方法
1.3.1 样品采集
本实验选取50 只活体质量为2.45~2.50 kg、禁食8 h的雄性三黄鸡,在南京农业大学白马基地禽加工屠宰线屠宰加工。按照GB/T 19478—2018《畜禽屠宰操作规程 鸡》要求进行电击晕、放血、烫毛、掏膛、喷淋和预冷处理,采用单因子完全随机化设计将肉鸡一共分为6 组,每组8 只,处理组先后采用0~4 ℃水冷处理10 min,再采用0.4 m/s的风冷处理,风冷温度分别为-8、-18、-25、-31 ℃。对照组1采用三段螺旋式逆水冷却,第一段水温为6 ℃、预冷时间10 min;第二段水冷温度为0~4 ℃、预冷时间10 min;第三段冰水混合物将胴体温度降低到4 ℃,每只鸡预冷所用水约为54 L。对照组2为传统混合冷却,混合冷却前半段采用水冷温度0~4 ℃、预冷时间10 min;后半段采用风冷处理,风速为0.4 m/s、温度0~4 ℃。通过温度巡视仪监测温度变化,在鸡胸中心内部温度降低到4 ℃时,将肉鸡从风冷库中取出,取左侧鸡胸肉各5 g放入冻存管中,液氮浸泡,后转入-80 ℃冰箱保存用于能量指标测定。取右侧鸡胸肉保存于4 ℃用于测定水分分布、滴水损失、蒸煮损失、剪切力和pH值。
1.3.2 降温速率测定
参考Rodrigues等[13]的方法,将K型热电偶插入鸡胸中心20 mm的深度,监测胴体温度变化,并以温度巡视仪记录每秒温度变化,温度精确到±0.5 ℃。风冷库内部温度监控装置实时监测温度变化。当胴体中心温度降低到4 ℃时,取出探针保存数据,使用Origin对时间和温度进行数据拟合,建立关于黄羽肉鸡的降温速率模型。
1.3.3 品质指标测定
1.3.3.1 pH值
取宰后1 h鸡胸肉测定pH值,将便携式pH计进行校准后,插入待测样品约1 cm深,每个样品重复测定3 次,结果取平均值。
1.3.3.2 剪切力
将鸡胸肉切割成1 cm×1 cm×8 cm块状,放入真空包装袋中,并在75 ℃水浴锅中加热,直到肌肉内部温度达到70 ℃将肌肉取出,切割成1 cm×1 cm×3 cm块状,使用嫩度仪沿肌纤维垂直方向切断肉条。以牛顿(N)为单位,一块肉条切断3 次,取平均值作为最后结果。
1.3.3.3 蒸煮损失
参考Singh 等[14]的方法并作一定修改。取宰后24 h 鸡胸肉,用滤纸吸干肉块表面汁液,切割成1 cm×1 cm×8 cm的长方体(大约10 g),称鸡胸肉蒸煮前质量m1/g后,然后重新装袋封口,在80 ℃水浴中加热至肉块中心温度达到70 ℃,将袋中蒸煮产生的汁液倒出,流水冷却至室温,将肉取出,用滤纸吸干肉块表面汁液,称蒸煮处理后鸡胸肉质量m2/g;蒸煮损失按式(1)计算。每个样品重复测定2 次,结果取平均值。
1.3.3.4 滴水损失
参照Jemziya等[15]的方法并作一定的修改。取宰后2 h鸡胸肉,切割成1 cm×1 cm×8 cm的长方体(大约10 g),擦干表面水分,称质量m1/g,用铁丝串好吊挂在大杯中,肌纤维方向竖直向下,避免与杯壁接触,用保鲜膜封口,4 ℃冷藏24 h后取出擦干表面水分,再次称质量m2/g。滴水损失按式(2)计算:
1.3.3.5 水分分布
参照陈超杰等[16]的方法进行一定修改。沿肌原纤维方向,将肉切成1.5 cm×1 cm×1 cm的肉条,置入直径为15 mm的核磁小管中,在(32.00±0.01)℃利用CPMG序列进行测定,采用整体迭代分析软件进行数据反演得到水分分布数据。
1.3.4 能量代谢指标测定
1.3.4.1 ATP和AMP含量测定
宰后初期鸡肉中ATP和单磷酸腺苷(adenosine monophosphate,AMP)含量参照Shen等[17]的方法进行测量,并作一定修改。将装有鸡胸肉的冻存管从液氮中取出,每管取1 g鸡胸肉,加入5 mL预冷的7%高氯酸溶液,13500 r/min匀浆2×15 s,中间间隔5 s。4 ℃条件下15000×g离心10 min,取上清液。上清液用0.85 mol/L KOH溶液调节至最终pH 6.8~7.0,4 ℃条件下15000×g离心10 min,去除KClO4,取上清液用0.22 μm滤膜过滤后进样检测。ATP和AMP的含量在1100超高效液相色谱仪上进行测定,检测波长254 nm,86.5%流动相A,13.5%流动相B,流速1 mL/min,进样10 μL。流动相A为磷酸缓冲液(2.5 mol/L四丁基硫酸氢铵、0.04 mol/L磷酸二氢钾、0.06 mol/L磷酸氢二钾,pH 7.0);流动相B为100%甲醇。测定结果采用外标法定量,通过比较保留时间和峰面积对ATP和AMP进行定性和定量分析。
标准曲线的绘制:准确称取25 mg ATP和AMP标准品,定容至100 mL,以此为母液逐级稀释为250、100、50、20、10、5、2、1 μg/mL的核苷酸标准溶液。按照上述色谱分析条件进样,每个浓度进样5 次。以核苷酸质量浓度为横坐标,峰面积为纵坐标绘制标准工作曲线。
1.3.4.2 HK、PGK和LDH活力测定
宰后初期肌肉中的HK、PGK和LDH活力测定均采用试剂盒检测,测定过程严格按照试剂盒说明书操作。
1.3.4.3 肌糖原和乳酸含量测定
宰后初期肌肉中糖原和乳酸含量测定均采用试剂盒检测,测定过程严格按照试剂盒说明书操作。
1.4 数据处理与分析
除特殊说明外,所有数据进行3 次重复,利用SPSS 20.0对数据进行统计分析,结果以表示。采用Duncan多重比较进行显著性方差分析,显著性水平P<0.05。用Origin 8.1软件进行绘图。
2 结果与分析
2.1 降温速率模型
由图1可知,经10 min水冷处理后胴体中心温度降低到25 ℃左右,-8、-18、-25 ℃和-31 ℃风冷降温时间分别为3548、2651、2537 s和2272 s,降温速率分别为0.009、0.012、0.013 ℃/s和0.014 ℃/s;对照组1(传统水冷)处理时间为3513 s,降温速率为0.009 ℃/s;对照组2(传统风冷)降温时间为5271 s,降温速率为0.006 ℃/s;混合冷却中风冷温度为-31℃和-25 ℃分别比对照组1降温时间缩短了35.33%和27.78%;与对照组2相比,缩短了56.90%和51.87%。各处理组之间相比,-8 ℃降温速率最慢;-31 ℃与-25 ℃相比降温时间缩短了10.45%。胴体降温速率与风冷温度呈负相关,风冷温度越低,降温速率越快。
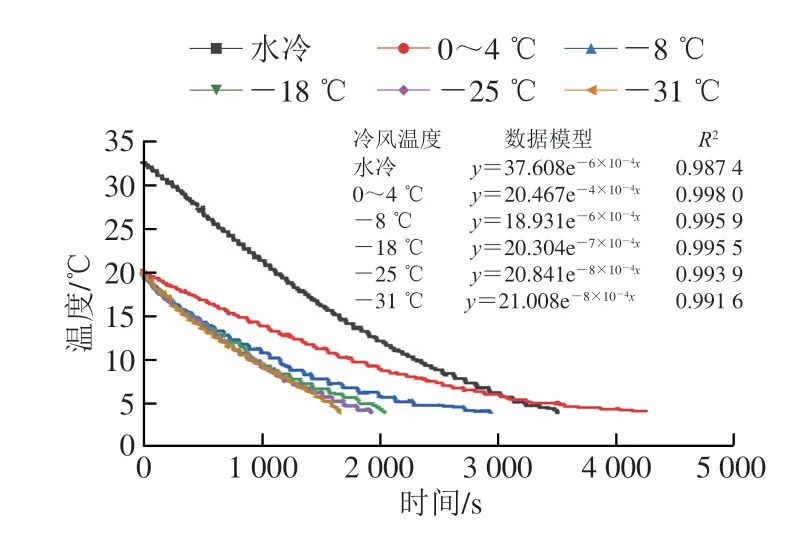
图1 不同风冷温度的降温速率Fig.1 Cooling rates of different air cooling methods
根据温度巡视仪记录的数据,建立了关于黄羽肉鸡的降温速率指数函数模型。风冷温度为-8、-18、-25 ℃和-31 ℃组的指数函数模型分别为y=18.931e-6×10-4x、y=20.304 e-7×10-4x、y=20.841 e-8×10-4x和y=21.008e-8×10-4x。对照组1和对照组2指数函数模型分别为y=37.608e-6×10-4x、y=20.467e-4×10-4x。通过降温速率模型可以准确预测黄羽肉鸡的降温时间,进而提高黄羽肉鸡的生产效率,减少水电资源的消耗。
2.2 风冷温度对鸡肉品质的影响
宰后初期肌肉中pH值的下降速率很大程度上取决于无氧糖酵解反应速率,而快速降低胴体温度可以有效抑制糖酵解中酶的活性,从而延缓肌肉中pH值的下降[18]。如表1所示,对照组1的pH值与-8 ℃处理组无显著性差异(P>0.05);但对照组2的pH值下降程度较大,与处理组之间存在显著性差异(P<0.05)。-8 ℃和-18 ℃降温到0~4 ℃所用时间过长,导致肌肉中pH值下降程度较大;而-25 ℃与-31 ℃处理组pH值最高,与其他处理组差异显著(P<0.05)。说明在宰后初期快速地降低胴体温度可以有效抑制肌肉中pH值的下降。

表1 不同风冷温度对鸡胸肉品质的影响Table 1 Effects of different air cooling temperatures on the quality of broiler breast meat
嫩度是决定鸡肉品质的重要指标,同样也是消费者选购肉制品的重要因素[19]。如表1所示,随着风冷温度的不断降低,剪切力不断升高。其中对照组2剪切力最小,与处理组剪切力差异显著(P<0.05);-31 ℃处理组剪切力最大,并且与其他处理组差异显著(P<0.05)。肉鸡胴体经过快速的降温延缓了肌肉的成熟,导致肌肉的剪切力增大[20]。在冯宪超等[21]的研究中显示,经风冷组处理的肉鸡持水力要优于水冷组,并且剪切力高于水冷组。消费者普遍喜欢咀嚼性更大的黄羽肉鸡,低温风冷对鸡肉剪切力的影响具有积极的意义。
持水力是肌肉的一个重要品质指标,它不仅关系到肌肉的最终产量,也影响肌肉的质量,而滴水损失和蒸煮损失则反映了肌肉的持水能力,宰后初期对胴体快速的降温可以有效改善肌肉的持水力[22]。如表1所示,随着风冷温度的不断降低,肌肉的滴水损失与蒸煮损失不断减少,其中-31 ℃处理组滴水损失最少,-25 ℃和-31 ℃预冷的肌肉滴水损失含量低于-8 ℃处理组和对照组。而-18、-25 ℃与-31 ℃处理组蒸煮损失最少,与其他处理组差异显著(P<0.05)。由于胴体长时间浸泡在水中,肌肉细胞间隙进水导致对照组1滴水损失显著高于处理组(P<0.05);由于对照组2预冷所用时间最长导致持水能力下降,蒸煮损失和滴水损失增大。以上数据说明低温风冷可以改善肌肉的持水力。
2.3 风冷温度对鸡肉水分分布的影响
肌肉中的水分主要由结合水、不易流动水和自由水3 部分组成[23-24]。低场核磁可用于探索肉类中的水分迁移率和水分分布,从而对肌肉的持水能力做出判断[25]。不同风冷温度对鸡肉横向弛豫时间(T2)影响如图2所示,图中3 个峰分别代表3 种水的状态,横向弛豫时间T2b代表与大分子紧密结合的结合水;T21代表不易流动水,主要存在于肌纤维的结构中;而T22代表自由水,主要存在于肌肉表面或者自由散布在细胞外部。

图2 不同风冷温度对鸡胸肉水分分布的影响Fig.2 Effects of different air cooling temperatures on the moisture distribution of broiler breast muscle
肌肉水分分布影响的峰面积见表2,P2b、P21和P22分别表示结合水、不易流动水和自由水的相对面积,以此表示肌肉中不同组分水的相对含量。如表2所示,处理组和对照组之间P2b无显著性差异(P>0.05),说明降温处理对肌肉中的结合水含量影响较小。在P21中-31 ℃和-25 ℃处理组与对照组之间具有显著差异,而对照组P22显著高于处理组(P<0.05)。这可能受两方面因素影响,一方面,肉鸡在宰后初期经风冷处理后胴体温度快速降低,抑制了肌肉中关键酶的活性,延缓糖酵解反应速率,进而改善了肌肉的持水能力,造成处理组不易流动水含量显著高于对照组(P<0.05)。另一方面,风冷处理造成肌肉自由水发生逸散现象,导致自由水含量显著低于对照组(P<0.05)。实验结果表明,低温风冷能显著改善肌肉的持水力。
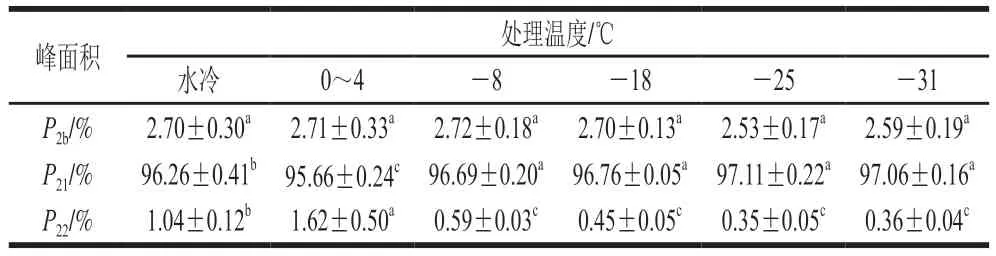
表2 不同风冷温度对鸡胸肉水分弛豫峰面积比例的影响Table 2 Effects of different air cooling temperatures on the relative areas of water relaxation peaks in broiler breast meat
2.4 风冷温度对宰后肌肉能量代谢的影响
动物宰后氧气供应停止,磷酸肌酸作为宰后早期能量供应者,主要通过分解ATP产生AMP供给能量;而AMP/ATP的比例增加会激活AMP依赖的蛋白激酶(adenosine 5’-monophosphate (AMP)-activated protein kinase,AMPK),加快糖酵解反应速率[26-27]。不同风冷温度对宰后鸡胸肉能量代谢的影响如表3所示,在ATP、AMP和AMP/ATP方面,对照组2的ATP含量最低,AMP含量最高,AMP/ATP最高;对照组1与-8 ℃和-18 ℃处理组之间无显著性差异(P>0.05)。-25 ℃和-31 ℃处理组ATP含量最高、AMP含量及AMP/ATP最低。

表3 不同风冷温度对鸡胸肉中ATP、AMP和AMP/ATP比例的影响Table 3 Effects of different air cooling temperatures on ATP content,AMP content and AMP/ATP ratio of broiler breast meat
2.5 风冷温度对HK、PGK和LDH活性的影响
如图3A所示,在宰后初期快速地降低胴体温度可以有效抑制HK和PGK活性,随着风冷温度的降低,HK和PGK活性也逐渐降低,其中对照组1 HK和PGK活性与-8 ℃处理组无显著性差异(P>0.05),对照组2 HK和PGK活性最高;-31 ℃处理组HK活性最低,并且与其他处理组具有显著性差异(P<0.05)。-25 ℃和-31 ℃处理组PGK活性最低,并且与其他处理组具有显著性差异(P<0.05)。HK作为糖酵解过程中第一个不可逆的限速酶,通过分解葡萄糖产生6-磷酸葡萄糖,其作为糖酵解代谢的底物参与产生ATP,并且参与糖原和己糖胺生物合成途径产生糖原[28-29]。在徐昶[30]的研究中,鸡胸肉在宰后60 min内15 ℃处理组HK活性高于4 ℃处理组。PGK是糖酵解过程中关键催化酶,通过分解1,3-二磷酸甘油酸转变成为3-磷酸甘油酸,并产生一分子ATP,对肌肉代谢速率起到关键的调控作用[31]。宰后肌肉中HK和PGK的活性变化直接影响糖酵解的反应速率,当风冷温度降低到-25 ℃以下时可以有效抑制HK和PGK的活性,这对于改善冰鲜鸡肌肉的持水力具有重要意义。
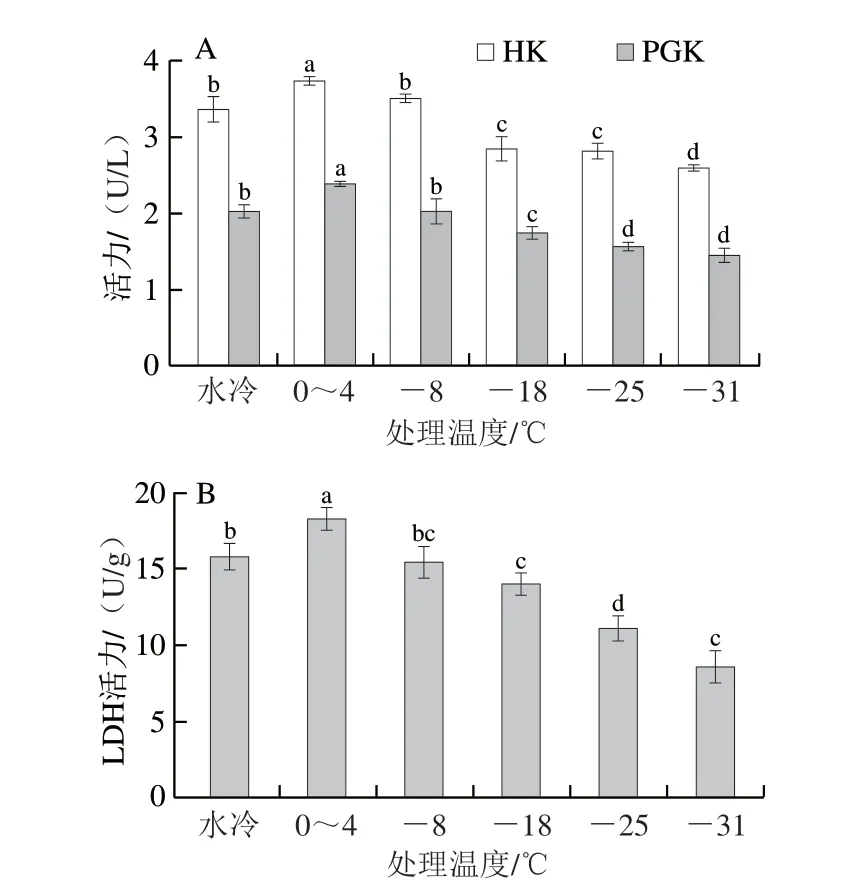
图3 风冷温度对鸡胸肉糖酵解关键酶活性的影响Fig.3 Effects of different air cooling temperatures on the activities of key glycolysis enzymes in broiler breast meat
如图3B所示,随着风冷温度不断降低,LDH活性不断降低。其中对照组1与-8 ℃处理组LDH活性无显著性差异(P>0.05),对照组2 LDH活性最高;-31 ℃处理组LDH活性最低,-25 ℃处理组次之,并且与其他处理组之间具有显著差异(P<0.05)。
LDH作为糖酵解途径的最后一步关键限速酶,对调控糖酵解反应速率发挥着关键作用,在宰后初期肌肉呈酸性,在酸性条件下LDH通过分解丙酮酸产生乳酸[32-33]。LDH在有氧条件下将乳酸转化为丙酮酸,促进机体的代谢过程;在无氧条件下LDH将丙酮酸还原成乳酸,从而进行无氧糖酵解过程。李培迪等[34]选取公羊背长肌进行贮藏实验,发现贮藏前5 d内冷藏组LDH活力显著高于冰温组,说明降低温度可以有效抑制LDH活力。低温风冷可以有效抑制宰后初期肌肉中LDH的活性,降低乳酸的生产速率,延缓肌肉中pH值的下降,这对于改善肌肉品质具有重要意义。
2.6 风冷温度对肌糖原和乳酸含量的影响
肌糖原作为机体能量的主要供应者,在动物屠宰后,通过无氧糖酵解途径分解产生乳酸,在此过程中糖原含量不断减少[35]。如图4A所示,对照组1和-8 ℃处理组糖原含量无显著差异(P>0.05),对照组2糖原含量最低;-25 ℃和-31 ℃处理组糖原含量显著高于-8 ℃和-18 ℃处理组(P<0.05),并且-25 ℃和-31 ℃糖原含量无显著差异(P>0.05)。
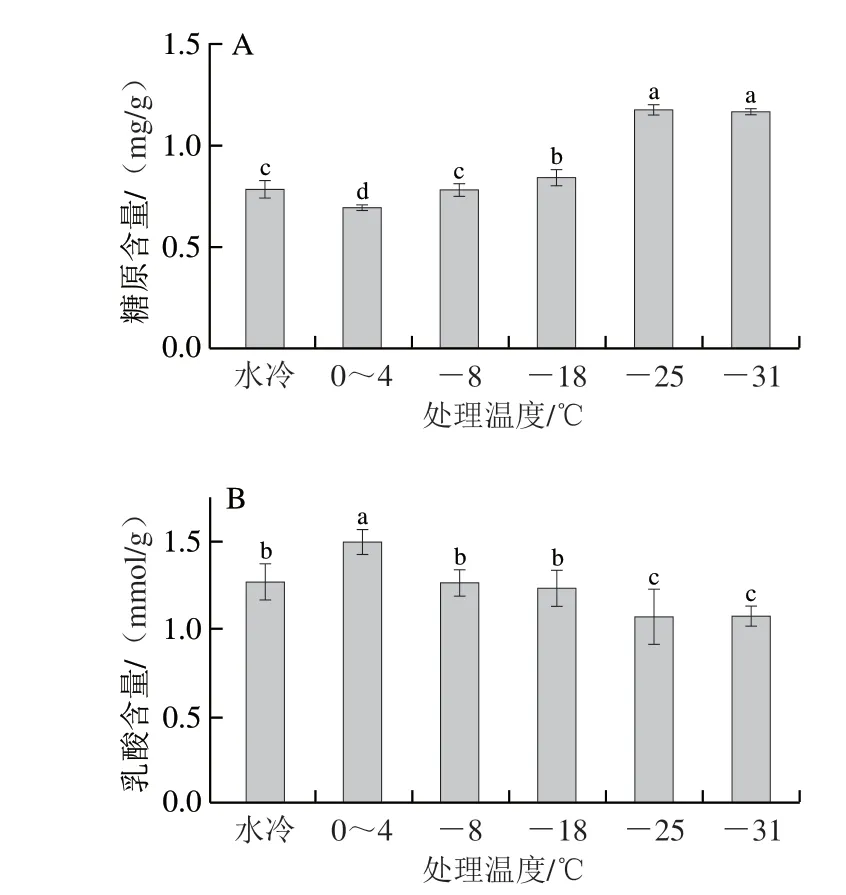
图4 不同风冷温度对鸡胸肉肌糖原(A)和乳酸(B)含量的影响Fig.4 Effects of different air cooling temperatures on the contents of glycogen (A) and lactic acid (B) in broiler breast meat
动物经宰后糖原被不断分解产生乳酸,而乳酸无法通过血液再次转化为葡糖糖,导致乳酸含量不断积累[34]。由图4B所示,对照组1和-8、-18 ℃处理组乳酸含量无显著差异(P>0.05),对照组2乳酸含量最高;-25 ℃和-31 ℃处理组乳酸含量显著低于-8 ℃和-18 ℃处理组(P<0.05),并且-25 ℃和-31 ℃处理组乳酸含量最低。
动物屠宰后主要由磷酸肌酸系统和无氧呼吸系统供给能量,磷酸肌酸系统是宰后早期能量主要供应者,无氧糖酵解是宰后主要的供能方式。宰后肌肉主要通过分解糖原产生乳酸,在此过程中乳酸的产生和糖原的降解速率可以反映糖酵解的速率,由图4可知,当风冷温度降低到-25 ℃以下时,可以有效抑制糖原的分解速率以及乳酸的生产速率,延缓宰后鸡肉的糖酵解速率。
2.7 鸡肉品质指标与生化指标之间的关系
将品质、能量代谢指标进行相关性分析可以进一步评价各指标之间的相关性。图5为鸡胸肉品质指标与能量代谢指标之间的关系。滴水损失和蒸煮损失与HK、PGK和LDH呈极显著正相关(P<0.01),但滴水损失与ATP和糖原呈极显著负相关(P<0.01),蒸煮损失与ATP呈显著负相关(P<0.05),与糖原呈极显著负相关(P<0.01)。pH值与HK、PGK和LDH呈极显著负相关(P<0.01),与乳酸、AMP和AMP/ATP呈显著负相关(P<0.05),与糖原呈极显著正相关(P<0.01)。

图5 鸡胸肉品质指标与生化指标之间的相关性分析Fig.5 Correlation analysis between quality and biochemical indexes of chicken breast meat
糖酵解反应是多种酶共同参与的反应,其中包括3 个关键的限速酶,分别是HK、PGK和LDH。在Gagaoua等[36]的研究中,糖酵解中关键酶的活性与肉的贮藏损失、剪切力以及pH值等品质指标高度相关,其可以作为鲜肉的标志物。本研究结果显示,低温风冷可以有效抑制HK、PGK和LDH的活性,从而延缓糖原的分解速率以及乳酸的生产速率、降低肌肉中pH值的下降速率、减少宰后肌肉中ATP的分解以及AMP的产生,这对延缓糖酵解速率、改善肌肉的持水力具有重要意义。这些研究结果说明可以通过低温风冷来调控宰后鸡肉的糖酵解速率,从而改善鸡肉的品质。
2.8 鸡肉品质指标与生化指标之间的主成分分析(principal component analysis,PCA)
图6、7分别为PC评分图和样品评分图,PC1和PC2分别解释了总方差的93.3%和4.0%,前两个PC能够解释总体方差变异的97.3%,说明原始数据之间具有很强的相关性。由图6可知,滴水损失、蒸煮损失、AMP、AMP/ATP、乳酸、HK、PGK、LDH主要分布在第1象限和第4象限,而pH值、糖原和ATP则在第2象限,说明滴水损失和蒸煮损失与AMP、AMP/ATP、乳酸、HK、PGK、LDH呈现正相关,而与pH值、糖原和ATP呈现负相关。样品PC评分如图7所示,水冷和传统混合冷却(0~4 ℃)以及-8 ℃处理组主要分布在PC1的右端,并且水冷和-8 ℃处理组分布较近,反映出对肌肉持水力和糖酵解具有相似的影响,而-31、-25 ℃和-18 ℃处理组则分布在PC1的左端,说明低温风冷对肌肉持水力和糖酵解速率具有显著影响。

图6 肉鸡胸肉品质与生化指标之间的PCAFig.6 Principal component analysis of broiler breast quality and biochemical indices

图7 肉鸡胸肉品质与生化指标样品PC评分图Fig.7 PC score plot of broiler breast quality and biochemical indexes
3 结论
在混合冷却过程中,-25 ℃和-31 ℃风冷温度延缓了肌肉中pH值的下降速率;抑制了HK、PGK和LDH的活性;延缓了糖原和ATP的消耗速率、乳酸和AMP的生产速率,从而抑制了宰后初期肌肉的无氧糖酵解反应速率。在风速一定的情况下,-25 ℃和-31 ℃预冷的肌肉滴水损失低于-8 ℃处理组和对照组,蒸煮损失低于-8 ℃和对照组,说明风冷温度为-25 ℃和-31 ℃对于抑制宰后初期肌肉的无氧糖酵解反应速率、改善肌肉保水性具有重要意义。在降温速率方面,混合冷却组与对照组相比,风冷温度为-25 ℃以下显著缩短了胴体的冷却时间,提升了胴体的冷却效率。
由于混和冷却中风冷温度为-25 ℃和-31 ℃对改善肌肉的保水性和延缓无氧糖酵解反应速率方面无显著性差异,考虑到工业生产过程中风冷温度为-25 ℃比-31 ℃更少的能耗,因此-25 ℃更适合作为风冷的温度。
