药食同源物协同血管紧张素转化酶抑制肽微胶囊的制备及其降压作用
2024-03-10李晓东周文利贾志斌解庆刚
夏 宇,李晓东,*,刘 璐,周文利,贾志斌,焦 阳,解庆刚
(1.东北农业大学食品学院,乳品科学教育部重点实验室,黑龙江 哈尔滨 150030;2.黑龙江飞鹤乳业有限公司,黑龙江 哈尔滨 150100)
高血压是一种常见的慢性疾病,是导致心脑血管疾病和死亡最主要的危险因素,我国目前约有2亿 人患高血压疾病,《中国高血压预防指南》指出,高血压早期可通过食品进行干预[1]。药食同源物是可以药用的一类食物,具有针对性强、安全性高的特点,并能够有效地减少和预防卡托普利等人工合成的西药引起的如咳嗽、味觉丧失和肾功能损害等多种副作用[2-3]。然而药食同源物在功能性食品中的应用存在几点问题。首先,药食同源物具有苦味,且研究发现其活性成分需要在肠道内释放才能发挥其功效,在胃部的酸性环境中易分解,使得药食同源物本身的作用效果受到影响。其次,药食同源物自身降压效果不显著,但通过相互配伍可显著提高血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制活性[4-5],且药食同源物中活性成分能够提高蛋白的功能特性[6],因此药食同源物与ACE抑制肽协同可进一步提高降压活性。
针对药食同源物存在的问题,本实验首先研究药食同源复合物与ACE抑制肽的复配比例,其次优化包埋工艺制备药食同源物协同ACE抑制肽微胶囊,通过动物实验验证其降压作用及对脏器的保护情况。为降压、稳压食品的开发以及我国传统饮食文化中具有降压、稳压作用食品的挖掘提供一定的参考。
1 材料与方法
1.1 动物、材料与试剂
自发性高血压大鼠(spontaneously hypertensive rats,SHR)(雄性)及Wistar雄性大鼠(WKY),体质量260 g左右,由北京维通利华实验动物技术有限公司提供,动物生产许可证号为:SCXK(京)2020-0001。所有涉及实验动物使用的程序均符合伦理要求。
药食同源物(枸杞、山楂、决明子)西安国豪生物有限公司;ACE抑制肽(序列:Glp-Gly-Leu-Pro-Pro-Arg-Pro-Lys-Ile-Pro-Pro;货号:Apep#144357-25-5;纯度:98%)上海楚肽生物科技有限公司;变性淀粉、麦芽糊精 广州成硕生化试剂有限公司;ACE(CAS号:9015-82-1;比活力≥2.0 U/mg)上海鼓臣生物技术有限公司;胰蛋白酶(3000 U/mg)、胃蛋白酶(3000 U/mg)、脂肪酶(50 U/mg)北京索莱宝科技有限公司;黏蛋白(货号:M885077)上海麦克林生化科技股份公司;大鼠ACE测定试剂盒、大鼠ACE2测定试剂盒、大鼠血管紧张素1-7(angiotensin 1-7,Ang(1-7))测定试剂盒、大鼠血管紧张素II(angiotensin II,Ang II)测定试剂盒 武汉伊莱瑞特生物技术有限公司;HCl、NaCl、无水乙醇等(均为分析级)上海国药集团化学试剂有限公司;免疫组化法抗体:Anti-Angiotensin Converting Enzyme 1 antibody(货号:ab254222)、Goat Anti-Rabbit IgG Antibody(货号:Ap132p)、ACE抗体、ACE2抗体 艾博抗(上海)贸易有限公司。
1.2 仪器与设备
AL-104精密电子天平 梅特勒-托利多仪器(上海)有限公司;BL-6000Y喷雾干燥机 上海比朗仪器制造有限公司;S3400-N扫描电子显微镜 日本日立公司;真空离心浓缩机 美国SP Scientific公司;Hei-VAP型旋转蒸发仪 德国Heidolph公司;冷冻离心机湘仪H1750R;T6新世纪紫外分光光度计 北京普析通用仪器有限公司;小动物气体麻醉机、RBP-1型大鼠血压计 上海玉研科学仪器有限公司。
1.3 方法
1.3.1 药食同源复合物制备及其与ACE抑制肽的复配
分别称取山楂、枸杞及决明子10.0 g冻干后冷冻研磨,经过超微粉碎,过100 目筛,利用75%乙醇溶液浸提,料液比1∶10(g/mL),常温下超声(100 W、20 kHz)提取30 min,即可得到质量浓度为0.1 g/mL药食同源提取物,真空过滤后20 ℃旋转蒸发其中乙醇,过滤,进行冷冻干燥制备冻干粉[7]。冻干粉按枸杞∶山楂∶决明子=4∶1∶1(质量比,下同)制成药食同源复合物。将药食同源复合物与ACE抑制肽按照不同比例(ACE抑制肽∶复合物=4∶0、4∶1、3∶1、2∶1、1∶1、1∶2、1∶3、1∶4、0∶4)进行复配,根据ACE抑制率筛选复配比例。
1.3.2 ACE抑制率的测定
缓冲液的制备:称取12.37 g的硼酸,定容至1 L;称取19.07 g硼砂定容至1 L。取175 mL硼砂溶液和325 mL硼酸溶液混合,利用1 mol/L HCl溶液或1 mol/L NaOH溶液调节pH值至8.3,然后向其中加入17.532 g NaCl,定容至1 L,即可得到0.1 mol/L的缓冲液(pH 8.3,含0.3 mol/L NaCl)。
马尿酰-组氨酰-亮氨酸(N-hippuryl-His-Leu tetrahydrate,HHL)溶液的制备:取适量的HHL,以上述0.1 mol/L的缓冲液溶解,配制成5 mmol/L的HHL溶液,-20 ℃冷冻备用。
ACE粗酶溶液的制备:取0.1 U ACE粗酶,用1 mL 0.1 mol/L的缓冲液溶解,配制成0.1 U/mL的ACE粗酶溶液,-20 ℃冷冻备用。
参考王辉俊等[8]方法,按照表1顺序,将振荡后的混合液在4000 r/min离心15 min,吸取上层乙酸乙酯1 mL,放置在100 ℃的烘箱内烘干30 min,冷却至室温,用3 mL的去离子水溶解,充分振荡,利用紫外分光光度计测定其在228 nm波长条件下的吸光度,每组测定3 组平行,取平均值。ACE抑制率按式(1)计算:
式中:Aa为ACE及ACE抑制剂都存在的条件下(实验组)的吸光度;Ab为ACE抑制剂不参与反应条件下(对照组)的吸光度;Ac为ACE不参与反应条件下(空白组)的吸光度。
1.3.3 药食同源复合物协同ACE抑制肽微胶囊制备工艺的优化
根据前期预实验,以药食同源复合物协同ACE抑制肽为芯材、变性淀粉与麦芽糊精为壁材,以芯壁比、进风温度、固含物(壁材芯材占混合液的比例)、壁材配比(变性淀粉∶麦芽糊精)为影响因素,设计4因素3水平L9(34)的正交试验,如表2所示。以包埋率为评价指标,筛选最佳工艺,并与正交试验中包埋率较高的3 组工艺进行进一步比较分析。
1.3.4 微胶囊包埋率测定方法的确定
1.3.4.1 微胶囊包埋率标准曲线的建立
采用紫外分光光度法[9-10]。分别配制0.05、0.10、0.20、0.40、0.60、0.80 g/mL的药食同源复合液,在200~400 nm波长处间隔0.5 nm进行紫外扫描,确定不同质量浓度间吸光度差异较大的波长,以此波长条件下的紫外吸收对应不同质量浓度做标准曲线[11]。
1.3.4.2 微胶囊包埋率的测定
微胶囊表面芯材的测定。取1.000 g微胶囊置于布氏漏斗中抽滤,抽滤后,用去离子水洗涤漏斗,将两次滤液混合并定容至10 mL,测定其吸光度,并根据标准曲线计算芯材质量m1/g[12]。
微胶囊总含量的测定。取0.020 g微胶囊置于5 mL生理盐水中,待其充分溶解后加入0.2 mol/L磷酸缓冲液5 mL,搅拌30 min使其充分溶解,用20 µm的滤膜过滤,测定其吸光度,并根据标准曲线计算芯材质量m0/g。包埋率按式(2)计算:
1.3.5 微胶囊的微观形态
在扫描电子显微镜样品台上贴双面胶,取少量样品粘上,吹去多余粉末,喷金,在加速电压20 kV时观察微观结构[13]。
1.3.6 微胶囊的苦味测定
利用风味稀释分析法[14]。将各微胶囊配成质量浓度为5 g/mL的溶液,未经包埋的药食同源复合物为空白组,以去离子水∶溶液=1∶1进行梯度稀释,然后随机编号进行盲评。一共20 位感官评价员(男性10 人,女性10 人)参与评分。各组微胶囊样品分别按照5、10、20、30、40 倍进行梯度稀释,以分辨出样品与空白组间明显苦味差异时的最大稀释倍数即为滋味稀释(taste dilution,TD)值,满分为40,分值越高则证明苦味越重。
1.3.7 微胶囊体外释放实验
消化液的制备:按表3顺序加入各项物质后,利用1 mol/L HCl溶液调节胃液的pH值至1.2,利用1 mol/L NaOH溶液调节肠液pH值至8.1[15-16]。

表3 胃肠消化液的制备Table 3 Preparation of simulated gastrointestinal fluids
胃消化:向60 mL胃模拟液中加入15 mg的微胶囊,37 ℃水浴消化2 h,分别在消化时间为0、30、60、90、120 min时收集10 mL消化液,3000 r/min离心10 min,取上清液于-20 ℃冰箱中保存。
肠消化:取上述离心后留下的微胶囊,加入60 mL肠模拟液,37 ℃水浴条件下缓慢搅拌,消化4 h,当消化时间为0、10、20、30、60、90、120、180、240 min时收集10 mL消化液,3000 r/min离心10 min,吸取上清液,储藏于-20 ℃冰箱中。
将冻存的消化液缓慢解冻后,取5 mL消化液与10 mL体积分数75%的乙醇溶液混合,3000 r/min离心10 min,取上清液,通过旋转蒸发仪蒸干后加入10 mL去离子水溶解,以胃模拟液和肠模拟液为空白对照,在233 nm波长条件下测定其吸光度,利用标准曲线测定活性物质的质量浓度,进而根据式(3)计算释放率:
式中:ρ0为微胶囊总复合物质量浓度/(g/mL);ρt为某消化时间复合物质量浓度/(g/mL)。
1.3.8 大鼠血压的测定
选用最佳包埋工艺制备的微胶囊,微胶囊与药食同源复合物的剂量根据《中国药典》中决明子临床用量(2~15 g)及决明子中蒽醌类的得率计算,再依据人和大鼠的体表面积折算法确定[17],对大鼠的处理及分组如表4所示。

表4 大鼠分组及给药量Table 4 Grouping and administration dosages of rats
利用RBP-1型大鼠血压计测量清醒安静状态下各组大鼠尾动脉的收缩压。测量之前加热大鼠10 min使其达到37 ℃,使动脉充盈以便测量[18]。在规定时间由专人测量各组大鼠的血压值,多次测量取平均值,为该鼠所在周的血压值。
1.3.9 实验大鼠的解剖与样本收集
灌胃8 周后禁食不禁水12 h称量体质量后,麻醉取材,如下:
1)血浆:每组3 只大鼠麻醉后仰卧固定于鼠台上,0.5%碘伏消毒,沿腹正中线剪开腹腔,采集的血液4 ℃、3000 r/min 离心20 min,离心后上层淡黄色透明液体即为血浆上清液,-80 ℃保存备用[19]。
2)器官:取左心室、胸主动脉、左肾置于10%甲醛溶液中固定备用,剩余的心脏、右肾、胸主动脉于液氮中冷冻保存备用。
1.3.10 大鼠血浆ACE、ACE2、Ang(1-7)、AngII质量浓度的测定
根据试剂盒中说明书上的方法进行测定。
1.3.11 大鼠心脏、肾脏、胸主动脉中AngII蛋白表达的测定
对心脏、右肾、胸主动脉进行脱蜡、抗原修复、加抗体孵育、洗片、封片,显微镜观察并拍照[20]。利用Image pro plus软件分析,定量结果用密度平均值表示,密度平均值=密度总和/面积总和,将对照组中蛋白质进行标准化处理,从而对其他实验组蛋白进行定量分析[21]。
1.3.12 大鼠胸主动脉、心脏纤维化程度测定
参考胡欢的方法进行Masson染色实验[22],并利用IHCToolbox软件分析纤维化程度。
1.4 数据处理与统计分析
2 结果与分析
2.1 药食同源物与ACE抑制肽复配后的ACE抑制率
如图1 所示,药食同源复合物的ACE 抑制率为69.46%。此外,测定了单个药食同源物的ACE抑制率,分别为山楂43.32%、决明子45.82%、枸杞37.71%,表明药食同源复合物的ACE抑制率明显高于单个药食同源物。同时可以看出,ACE抑制肽本身的抑制活性为71.48%,随着药食同源复合物的加入,ACE抑制效果逐渐增加,在ACE抑制肽∶复合物=1∶2时,ACE抑制率最大,达78.19%,此时ACE抑制效果显著优于单一药食同源物和ACE抑制肽(P<0.05),说明药食同源物与ACE抑制肽协同可提高抑制活性。赵敏等[23]同样发现乳酶解液和中草药复配复合物(山楂∶决明子=1∶1)的混合液具有较高ACE抑制率,出现这一现象的原因可能是药食同源物中的活性成分(如槲皮素、茶多酚等)能够通过影响蛋白质结构从而增强蛋白质的功能特性[6]。综上,药食同源物与ACE抑制肽复配可进一步提高抑制效果。
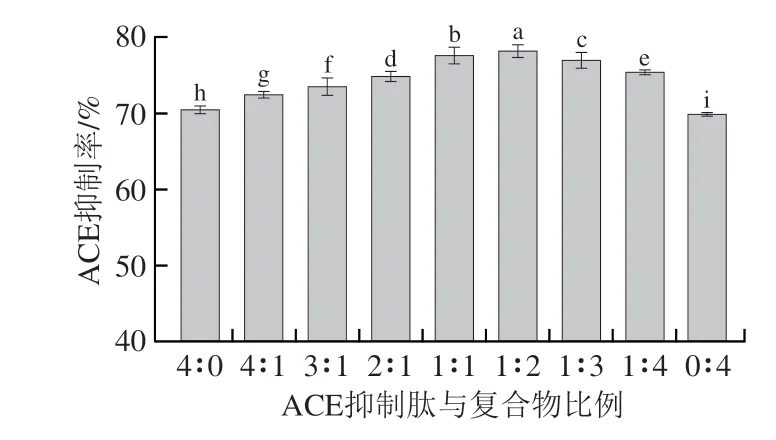
图1 ACE抑制肽与复合物不同比例复配后ACE抑制率结果Fig.1 ACE inhibition rates of blends of ACE inhibitory peptide with the mixture at different proportions
2.2 药食同源物协同ACE抑制肽微胶囊制备工艺的优化
2.2.1 微胶囊包埋率标准曲线的建立
如图2所示,可以发现在波长为233 nm时,不同质量浓度间吸光度差异最大,为1.511。根据233 nm波长处0~0.80 g/mL药食同源复合液的吸光度建立标准曲线,得到R2=0.9902,大于0.9000,线性相关性良好,以此为标准曲线测定微胶囊的包埋率。

图2 紫外分光光度计全波长扫描Fig.2 UV absorption spectra of the microcapsules
2.2.2 正交试验结果分析
正交试验结果分析见表5,方差分析见表6。正交试验所得微胶囊制备的最佳参数为:固含物为10%、进风温度为160 ℃、芯壁比为1∶15、变性淀粉∶麦芽糊精=1∶4,此时微胶囊的包埋率为85.44%。从R值的大小可以看出,影响微胶囊包埋率的主要因素先后顺序为芯壁比>壁材配比>固含物>进风温度。从表6可以发现,固含物、进风温度、芯壁比及壁材配比这4 种因素对活性成分微胶囊包埋率的影响均显著。

表5 正交试验结果与分析Table 5 Results and analysis of orthogonal array design

表6 方差分析表Table 6 Analysis of variance
表7为正交试验所得最佳工艺及包埋率较高的3 种制备工艺,为了确定最佳包埋工艺,研究这4 种工艺方法制备的微胶囊的微观结构、苦味以及体外释放率进一步验证最佳工艺参数[24]。

表7 不同喷雾干燥工艺参数Table 7 Validation of optimized encapsulation parameters
2.2.3 不同微胶囊微观结构分析
如图3所示,不同工艺参数制备的微胶囊微观形态结构有所不同,在2000 倍条件下观察的工艺参数1制备的微胶囊结构呈光滑球型,存在少数微胶囊表面凹陷(图3A),可能是喷雾干燥仪器进风温度变化引起的,也可能是在储存过程中发生的氧化反应所引起的[25],从400 倍扫描电子显微镜图可以看出微胶囊没有明显的破裂现象,包埋效果较好;而图3B~D中微胶囊均存在破裂情况,总体形态结构不如图3A。综合比较,可以得出根据工艺参数1制备的微胶囊的微观结构、破裂情况都相对较好。

图3 不同微胶囊扫描电子显微镜图Fig.3 Scanning electron micrographs of microcapsules prepared under different conditions
2.2.4 不同微胶囊的苦味分析
如图4所示,未经包埋的药食同源复合物(空白组)TD值达34,而经过包埋后微胶囊的TD值均在10左右,其中工艺参数1制备的微胶囊TD值最低,仅为4,与空白组相比苦味显著降低(P<0.05),说明包埋处理可有效解决活性成分的苦味问题,且工艺参数1制备的微胶囊苦味降低程度最明显。

图4 不同微胶囊苦味分析Fig.4 Bitterness analysis of microcapsules prepared under different conditions
2.2.5 不同微胶囊体外释放率
如图5A所示,随着消化时间的延长,4 种微胶囊在胃液中的释放率均逐渐增长,在胃消化120 min时,工艺参数1制备的微胶囊释放率最低,为23.6%,而工艺参数3制备的微胶囊释放率最高,达25.2%,说明工艺参数1制备的微胶囊在胃液中更为稳定,对芯材的保护作用最好,可以实现将大多数活性物质稳定地输送到肠道中。经过胃消化的微胶囊在肠道中进一步被破坏,随着消化时间的延长,活性物质的释放率逐渐增加,在240 min时,4 种工艺制备的微胶囊在肠消化释放率均达到了80%以上,其中工艺参数1制备的微胶囊活性物质释放率为81.4%(图5B)。
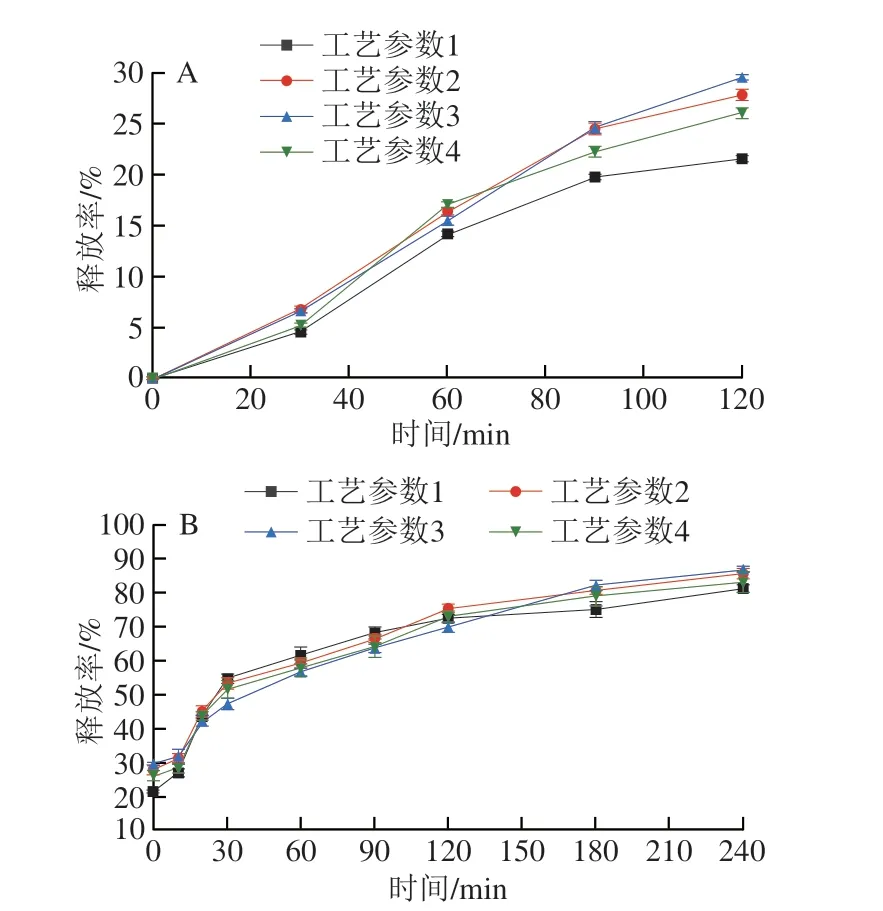
图5 不同微胶囊在模拟胃液(A)和模拟肠液(B)中的释放率Fig.5 Release rates of microcapsules prepared under different conditions in simulated gastric (A) and intestinal (B) juices
综上,工艺参数1制备的微胶囊结构完整,在胃中释放率最低,在肠道中释放率较高。相较于其他工艺制备的微胶囊释放效果更好,可实现活性物质肠道内定点释放[26]。可得出工艺参数1(固含物为10%、进风温度为160 ℃、芯壁比为1∶15、壁材为变性淀粉∶麦芽糊精=1∶4)为制备药食同源协同ACE抑制肽微胶囊的最佳制备工艺。
2.3 药食同源协同ACE抑制肽微胶囊对SHR血压的影响
如图6 所示,灌胃前,模型组收缩压为(175.00±5.58)mmHg,舒张压为(145.00±6.48)mmHg,符合SHR模型的要求;对照组收缩压为(123.00±7.25)mmHg,舒张压为(80.00±9.10)mmHg,符合实验要求[27]。图6A、C中药物组大鼠血压下降较快,且可使血压降低至正常状态,各实验组降压趋势相同,均逐渐下降且在2 周左右趋于稳定,图6B、D中实验组收缩压和舒张压均与模型组存在显著差异(P<0.05),说明药食同源物协同ACE抑制肽可有效低SHR的血压值,且相较于卡托普利降压过程更温和。李晓南等[28]同样发现中药复方配伍酪蛋白水解物对SHR具有降压作用。
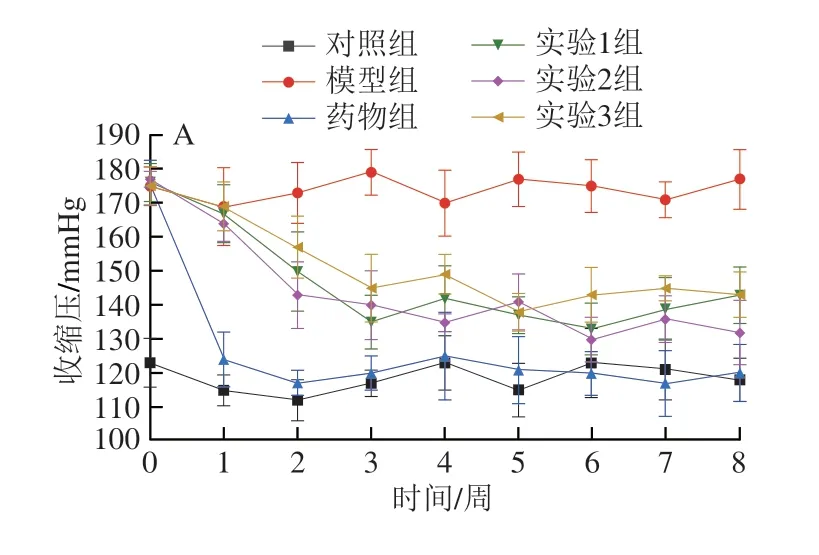
图6 各组大鼠血压值Fig.6 Blood pressure in rats in each group
2.4 大鼠血浆中ACE、ACE2、Ang(1-7)、AngII含量
如图7所示,灌胃8 周后,药物组、实验组大鼠的血浆中Ang(1-7)、ACE2含量较模型组均显著增加(P<0.05),ACE及AngII含量显著降低(P<0.05),肾素-血管紧张素系统(renin-angiotensin system,RAS)两个通路的拮抗作用可以解释这一现象:活性成分抑制了ACE的活性从而抑制了ACE及AngII的生成,系统另一条通路中Ang(1-7)和ACE2因负调节而生成,从而使Ang(1-7)和ACE2含量增加[29]。图7A中,药物组、实验组与模型组相比ACE含量均显著下降(P<0.05),但与对照组相比仍存在差异。3 组实验组相比,实验2组大鼠血浆中ACE含量最低。图7B中,实验组与模型组、对照组相比ACE2含量均有显著差异(P<0.05),3 组实验组相比,实验2组大鼠血浆中ACE2含量显著高于实验1、3组。图7C中各组大鼠血浆Ang(1-7)含量与图7B情况相似,药物组、实验组与模型组相比均可显著提高Ang(1-7)含量(P<0.05),且实验2组中Ang(1-7)含量显著高于实验1、3组。图7D中各组大鼠的AngII含量与图7A情况相似。

图7 各组大鼠血浆中ACE(A)、ACE2(B)、Ang(1-7)(C)和AngII(D)的含量Fig.7 Contents of ACE (A),ACE2 (B),Ang(1-7) (C) and AngII (D) in the plasma of rats from each group
综上,药食同源物协同ACE抑制肽能够抑制ACE,影响RAS中其他活性因子含量从而达到降低血压的效果,并且协同后对ACE的抑制效果较单一药食同源复合物、ACE抑制肽更显著。
2.5 大鼠心脏、肾脏、胸主动脉中AngII蛋白表达
RAS既存在于循环系统中,也存在于血管、心脏、中枢、肾脏和肾上腺等组织器官中,共同参与调节血压的平衡[30],AngII位于细胞间隙,为棕色或棕褐色[31],如图8所示,与对照组相比,模型组中大鼠胸主动脉、心脏及肾脏组织切片上AngII的阳性表达增多。如图9所示,与模型组相比,药物组及实验组中大鼠AngII在胸主动脉、心脏和肾脏中的表达明显减少(P<0.05),说明药食同源复合物及其协同ACE抑制肽均能减少AngII在靶器官中的表达。同时,实验2组中大鼠心脏、肾脏及胸主动脉的AngII含量均显著低于实验1、3组(P<0.05),且在肾脏中,实验2组比药物组中大鼠的肾脏中AngII蛋白表达抑制效果更明显。综上,药食同源物协同ACE抑制肽能够影响大鼠心脏、肾脏、胸主动脉中的RAS,达到降压的效果。
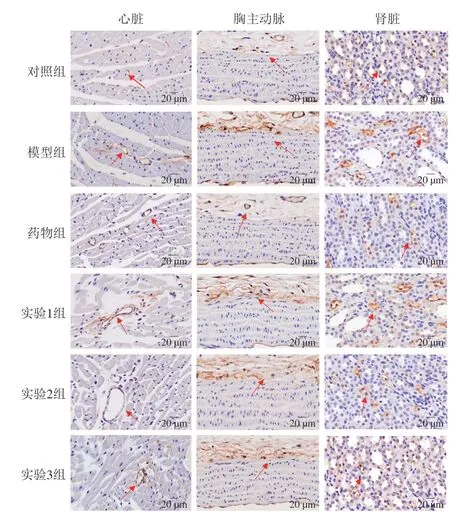
图8 各组大鼠心脏、肾脏、胸主动脉中AngII蛋白表达图Fig.8 AngII protein expression patterns in the heart,kidney and thoracic aorta of rats from each group

图9 各组大鼠心脏、肾脏、胸主动脉中AngII相对蛋白表达量Fig.9 Relative expression levels of AngII protein in the heart,kidney,and thoracic aorta of rats from each group
2.6 大鼠心脏纤维化程度
Masson染色法是用于显示组织中纤维的染色方法之一,经过染色处理不同组织呈现出不同的颜色,其中胶原纤维、黏液、软骨呈蓝色;肌纤维、纤维素和红细胞呈红色;细胞核呈蓝黑色[32-33]。如图10所示,相较对照组,模型组中大鼠心脏间质周围蓝色区域明显,说明纤维化程度明显增加。对胶原阳性面积统计分析,发现与模型组相比,3 个实验组SHR心脏间质胶原的形成均显著减少(P<0.05),其中实验1组大鼠心脏间质的胶原形成情况与药物组无显著差别(P>0.05),实验3组中大鼠改善情况最明显。综上,药食同源物协同ACE抑制肽可明显改善SHR因血压引起的心脏纤维化现象(P<0.05)。

图10 各组大鼠心脏间质Masson染色图(A)及心脏纤维化程度(B)Fig.10 Masson staining images of the cardiac interstitium (A) and degree of cardiac fibrosis (B) in rats from each group
2.7 大鼠胸主动脉纤维化程度
如图11所示,与对照组比较,模型组胶原纤维明显增加,同时有胶原浸润的现象,胶原纤维分散且不稳定。实验组中大鼠胸主动脉形态均匀,外膜的胶原纤维沉积减少,弹性肌纤维顺序齐整,分布较为均匀,中膜细胞相互间的胶原现象明显减少。且实验组胸主动脉纤维化程度与模型组相比显著下降(P<0.05),其中实验3组胸主动脉纤维化程度最低。说明药食同源物协同ACE抑制肽能够有效改善SHR胸主动脉的纤维化情况,可通过影响血管的重构和重塑、生成从而对血管起到修复的作用,缓解和保护因高血压疾病对血管的损害。

图11 各组大鼠胸主动脉Masson染色图(A)及胸主动脉纤维化程度(B)Fig.11 Masson staining images of thoracic aorta (A) and degree of thoracic aorta fibrosis (B) of rats from each group
3 结论
本实验首先研究药食同源复合物(枸杞∶山楂∶决明子=4∶1∶1)与ACE抑制肽的协同效果,当两者质量比为2∶1时的ACE抑制率达到最高,利用混合壁材(变性淀粉∶麦芽糊精=1∶4)进行包埋,当进风温度160 ℃、芯壁比1∶15、固含物10%时,微胶囊的包埋率最高且结构形态饱满,使活性物质在胃液中得到有效保护并在肠道中充分释放,且苦味显著降低。其次,动物实验说明药食同源物协同ACE抑制肽能够通过抑制ACE的活性影响RAS,从而显著降低SHR的血压(P<0.05),其对ACE、AngII等关键酶的作用效果优于单一药食同源复合物及ACE抑制肽,并且能够显著降低SHR心脏及主动脉的纤维化程度(P<0.05),改善因高血压疾病引起的脏器损伤,对心脏和血管重构起到积极作用。
