甘薯萌芽性与贮藏期块根内源激素变化及淀粉代谢的关系
2024-03-10李玉洁王宁孟亚依海雪邢会贤柳洪鹃史春余司成成
李玉洁 王宁 孟亚依 海雪 邢会贤 柳洪鹃 史春余 司成成

摘 要:以萌芽性差異显著的5个甘薯品种济徐23、烟薯25、红香蕉、泰中6号和心香为试验材料,在贮藏期间定期取样分析块根中内源激素变化及碳水化合物代谢,贮藏结束后在小拱棚内排种育苗,调查出苗情况。结果表明:济徐23、烟薯25和红香蕉萌芽较早,采苗数量显著多于泰中6号和心香。贮藏结束、排种前,济徐23、烟薯25和红香蕉块根中的淀粉含量和支链淀粉含量显著高于泰中6号和心香,济徐23、烟薯25和红香蕉淀粉含量和支链淀粉含量较高主要是由于贮藏期间块根淀粉和支链淀粉含量降低幅度较小所致。济徐23、烟薯25和红香蕉块根中总淀粉酶和α-淀粉酶活性显著高于泰中6号和心香,济徐23、烟薯25和红香蕉块根中α-淀粉酶活性较高主要是由于贮藏期间增加幅度较大所致。贮藏结束、排种前,与泰中6号和心香比较,济徐23、烟薯25和红香蕉块根中GA3含量较高、IAA含量较低、GA3/ABA和ZR/IAA较高。即贮藏结束、排种前,块根中淀粉和支链淀粉含量高、α-淀粉酶活性高、内源GA3含量高及IAA含量低是其萌芽性好的生理指标。
关键词:甘薯;萌芽;淀粉;淀粉酶;激素中图分类号:S531 文献标识码:A
Endogenous Hormone Content and Starch Metabolism of Storage Roots During Storage and Its Relationship with Germination in Sweet Potato
LI Yujie1, WANG Ning 1, MENG Yayi 1, HAI Xue 1, XING Huixian 1, LIU Hongjuan 2, SHI Chunyu 2, SI Chengcheng 1.2*
1. Hainan University, Haikou, Hainan 570228, China; 2. Shandong Agricultural University, Taian, Shandong 271018, China
Abstract: Five sweet potato cultivars with significant differences in germination, Jixu 23, Yanshu 25, Red Banana, Taizhong No. 6 and Xinxiang, were used as the test materials. During the storage period, samples were taken regularly to analyze the changes of endogenous hormones and carbohydrate metabolism in the storage roots. Storage roots after storage were planted for seedlings in small arch sheds and investigated. The results showed that Jixu 23, Yanshu 25 and Red Banana germinated earlier, and the number of seedlings picked was significantly more than that of Taizhong 6 and Xinxiang. At the end of storage and before seeding, the starch content and amylopectin content of storage roots in Jixu 23, Yanshu 25 and Red Banana were significantly higher than those of Taizhong No. 6 and Xinxiang, Jixu 23, Yanshu 25 and Red Banana. Higher content of amylopectin and amylopectin was mainly due to the smaller decrease during storage. The total amylase and α-amylase activity of storage roots in Jixu 23, Yanshu 25 and Red Banana were significantly higher than that of Taizhong No. 6 and Xinxiang, and the α-amylase activity of storage roots in Jixu 23, Yanshu 25 and Red Banana were higher than that of Jixu 23, Yanshu 25 and Red Banana. This is mainly due to the larger increase during storage. At the end of storage and before seeding, compared with Taizhong No. 6 and Xinxiang, Jixu 23, Yanshu 25 and Red Banana had higher GA3 content, lower IAA content, and higher GA3/ABA and ZR/IAA of storage roots. That is, at the end of storage and before seeding, high starch and amylopectin content, high α-amylase activity, high endogenous GA3 content, and low IAA content in storage roots are physiological indicators of good germination.
Keywords: sweet potato; germination; starch; amylase; hormone
DOI: 10.3969/j.issn.1000-2561.2024.02.016
甘薯[Ipomoea batatas (L.) Lam.]是世界上重要的薯类作物,种植面积仅次于马铃薯和木薯,兼有粮食作物和经济作物的特点,具有适应性强、产量高和营养丰富等特点[1]。育苗是甘薯生产中的首要环节,为甘薯生产提供足够数量的健壮秧苗是育苗的主要任务,萌芽性强甘薯品种往往出苗早、出苗多、苗质壮,能满足生产上适时早栽、苗全苗壮的要求,是保证甘薯高产的前提[2]。已有研究表明,一定数量的种薯在一定时间内能够繁殖的秧苗数量及其秧苗素质与种薯本身的萌芽性[3-4]、育苗期间的生态条件[2-3]及其管理措施[5-6]等都有关系。进一步的研究表明,不同甘薯品种的发芽数量与其排种时块根中的碳水化合物含量呈正相关[7],其中块根的淀粉含量对其萌芽性影响最大[8]。张原箕等[9]依据甘薯萌芽过程中无新的β-淀粉酶合成的试验结果,推断甘薯萌芽应是排种时β-淀粉酶作用的结果;而唐君等[10]在甘薯贮藏期间高温愈合处理的试验中发现α-淀粉酶活性与薯块发芽存在一定的正相关性。因此,甘薯块根贮藏期间的淀粉代谢特点及其对萌芽性的影响还有待深入研究。作物种子萌发过程中碳水化合物的代谢,不但需要淀粉酶的催化作用,还与内源激素的变化有关[11]。虽有研究表明,甘薯块根发芽过程中吲哚乙酸(IAA)和赤霉素(GA3)均显著增加,脱落酸(ABA)呈显著下降或一直处于较低水平[12]。但甘薯块根贮藏过程中内源激素变化及淀粉代谢对其萌芽性影响的研究尚未见报道。本研究选用萌芽性差异显著的5个甘薯品种,通过测定块根贮藏期间淀粉及其组分含量变化、淀粉酶活性变化以及内源激素含量变化,分析块根贮藏期间内源激素含量变化及淀粉代谢与萌芽性的关系,旨在阐明不同品种甘薯萌芽性存在差异的生理机制。
1 材料与方法
1.1 材料
试验选用淀粉型品种济徐23(J23),食用型品种烟薯25(Y25)、红香蕉(HXJ)、泰中6号
(T6)和心香(XX)进行不同甘薯品种萌芽性差异比较及生理机制探究试验。其中,济徐23、烟薯25和红香蕉萌芽性较好,泰中6号和心香萌芽性较差。5个品种甘薯同时种植同时收获,生育期为130 d。收获后,种薯贮藏于半地下的发券窖中,贮藏期间地窖内的温度为10~15 ℃,空气相对湿度为80%~90%,CO2浓度不高于5%。
在贮藏后140 d,每个品种选出12.5 kg中等大小的健康种薯,且数量相似,在小拱棚内育苗,排种密度为12.5 kg/m2,重复3次。棚内温度控制在(28±3)℃,苗床湿度控制在(80±5)%,排种35 d后调查萌芽性。
1.2 方法
在贮藏后0、70、140 d取具有代表性的无病虫害及损伤的种薯、切片,一部分用封口袋密封后液氮罐中速冻,最后转入-40 ℃超低温冰柜中保存,用于酶和激素测定;另一部分置于105 ℃杀青30 min、60 ℃烘干,用于直链淀粉、支链淀粉和总淀粉含量测定。
1.2.1 萌芽性调查 在排种后35、45、55 d,分别拔取株高≥20 cm的秧苗,统计秧苗数量,称取秧苗鲜重,计算单位面积的采苗数量和百株鲜重。
1.2.2 淀粉含量测定 块根淀粉含量的测定采用蒽酮比色法,参考何照范[13]的方法。称取样品0.1 g,加入9.2 mol/L高氯酸,在恒温水浴锅中(型号hh-4,常州国华电器有限公司,中国)沸水提取淀粉。然后加入硫酸蒽酮混合液,在沸水中煮10 min后冷却至室温,并测定620 nm处的吸光度。
1.2.3 直、支链淀粉含量测定 双波长比色法,参考何照范[13]的方法。称取样品0.1 g,加入KOH后沸水浴30 min,用蒸馏水定容至50 mL。吸取样品液2.5 mL,加入蒸馏水,并调pH至3.5,加入碘试剂;以蒸馏水为CK。均定容至50 mL,分别于474.028、615.385、718.552、549.321 nm波长下测定吸光度。
1.2.4 淀粉酶活性测定 采用3,5-二硝基水杨酸(DNS)法。参考邱天越[12]的方法。(1)酶液制备:取样品0.5 g,以pH 5.6柠檬酸缓冲液匀浆,离心(1000 r/min)后上清液即为酶液。(2)淀粉酶总活性:0.05 mL酶液2份,各加入pH 5.6柠檬酸缓冲液。测定管在40 ℃水浴中,先加入1%淀粉溶液,5 min后,立即加入NaOH溶液。对照管中先加入NaOH溶液,以钝化酶活性,再加入1%淀粉溶液。(3)α-淀粉酶活性测定:0.5 mL酶液2份,置于70 ℃水浴,钝化β-淀粉酶,各管加入pH 5.6的柠檬酸缓冲液。将测定管置于40 ℃水浴10 min,加入40 ℃預热的1%淀粉溶液,摇匀,置于40 ℃保温,加入NaOH溶液。对照管中先加入NaOH溶液,以钝化酶活性,再加入1%淀粉溶液。在酶作用后的测定管溶液及对照管溶液中均加入2 mL显色剂,置沸水浴中煮沸5 min,取出冷却,以蒸馏水稀释至40 mL。于540 nm波长下测定酶活力,以每分钟生成麦芽糖的质量(mg)为一个酶活单位[mg/(min·g)]。其中,β-淀粉酶活性=淀粉酶总活性-α-淀粉酶活性。
1.2.5 内源激素(GA3、IAA、ABA、ZR)含量测定 参照何钟佩[14]的酶联免疫吸附法(ELISA),试剂盒由中国农业大学提供,抗体与抗原之间存在高度专一性,故测定时各种激素之间不存在干扰现象。测定时把一定量的激素标样加入样品,与样品同步提取,计算回收率,结果均在88%以上,表明测定结果是可信的。样品处理方法为:称取种薯块根顶部0.5 g于液氮中速冻,用80%甲醇溶液[含二叔丁基对甲苯酚(BHT)1 mmol/L]匀浆,4 ℃提取4 h,4000 r/min离心15 min,沉淀用80%甲醇重复提取3次,合并上清液,氮气吹干,PBSTG溶解定容,用于ELISA测定。
1.3 数据处理
采用新复极差法(Duncans)和DPS(Data Processing System)v7.05数据处理系统进行方差分析检验,采用Microsoft Excel 2019软件作图。
2 结果与分析
2.1 育苗期间不同甘薯品种的采苗数量及其鲜重
由表1可知,排种后35 d,济徐23、烟薯25和红香蕉已经有大量达到采苗标准的秧苗,而泰中6号和心香尚无达到采苗标准的秧苗;济徐23、烟薯25和红香蕉各个时期的采苗量和总采苗量均显著多于泰中6号和心香。在3个采苗量多的品种中,济徐23在排种后35 d的采苗量最多,而红香蕉在排种后45、55 d的采苗量最多,且济徐23的总采苗量显著高于烟薯25和红香蕉,说明淀粉型品种萌芽性更好。济徐23、泰中6号和心香的平均百株鲜重较高,而烟薯25和红香蕉的平均百株鲜重较低。4个食用型品种之间比较,泰中6号和心香的平均百株鲜重显著高于烟薯25和红香蕉,这与烟薯25和红香蕉单位面积的秧苗数量显著多于泰中6号和心香有关。不过,所有品种的百株鲜重均在500 g以上,属于生产上的壮苗[8]。
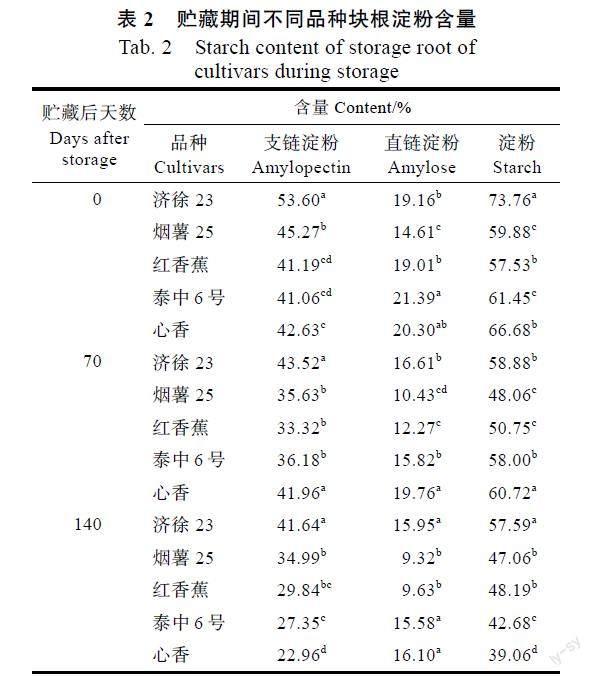
2.2 贮藏期间块根淀粉含量变化
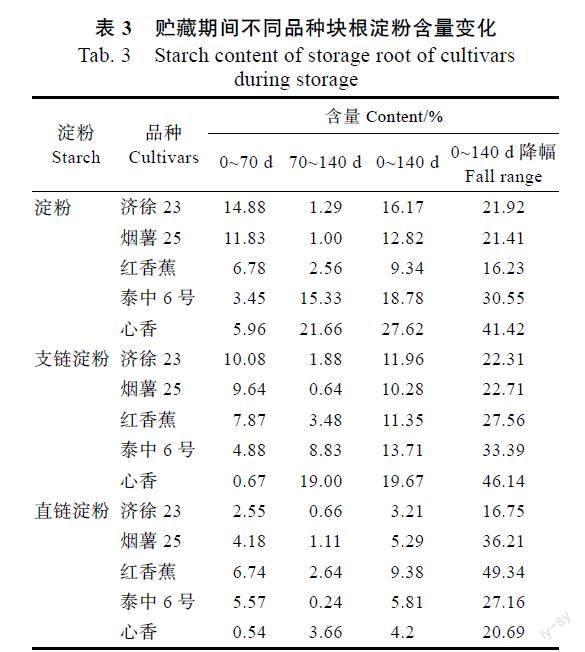
从表2可以看出,贮藏结束、排种前(贮藏后140 d),萌芽性较好的济徐23、烟薯25和红香蕉块根中淀粉含量和支链淀粉含量较高,而萌芽性较差的泰中6号和心香块根中淀粉含量和支链淀粉含量较低。根据贮藏前后块根淀粉含量的变化(表3)可以发现,济徐23、烟薯25和红香蕉3个品种的降幅较小,分别为21.92%、21.41%和16.23%;泰中6号和心香块根淀粉含量的降幅较大,分别为41.42%和30.55%。贮藏前后各个品种块根支链淀粉含量的变化特点与总淀粉含量一致。贮藏期间济徐23、烟薯25和红香蕉块根总淀粉和支链淀粉含量的快速下降主要发生在贮藏0~70 d之间,而泰中6号和心香块根总淀粉和支链淀粉含量的快速下降主要发生在贮藏70~140 d之间。
2.3 贮藏期间块根淀粉酶活性变化
从图1可以看出,随贮藏期时间的延长,块根中总淀粉酶活性和β-淀粉酶活性先增高后降低;泰中6号和心香块根α-淀粉酶活性变化不大,而济徐23、烟薯25和红香蕉块根α-淀粉酶活性大幅度增加。在贮藏结束、排种前,济徐23、烟薯25和红香蕉块根的总淀粉酶活性和α-淀粉酶活性显著高于泰中6号和心香。4个食用型品种之间比较,烟薯25和红香蕉块根的β-淀粉酶活性显著高于泰中6号和心香;但济徐23块根的
β-淀粉酶不但低于烟薯25和红香蕉,而且低于泰中6号。
2.4 贮藏期间块根内源激素含量变化
从表4可以看出,随贮藏时间延长,块根中GA3含量都是先下降后升高;贮藏结束、排种前,萌芽性好的济徐23、烟薯25和红香蕉块根中GA3含量显著高于萌芽性差的泰中6号和心香。随贮藏时间延长,块根中ABA含量升高,贮藏结束、排种前,萌芽好的济徐23、烟薯25和红香蕉块根中ABA含量显著低于萌芽性差的泰中6号,但萌芽较差的心香块根中ABA含量最低。随贮藏时间延长,块根中IAA含量先下降后升高;贮藏结束、排种前,萌芽性好的济徐23、烟薯25和红香蕉块根中IAA含量显著低于萌芽性差的泰中6號和心香。随贮藏时间延长,块根中ZR含量升高;贮藏结束、排种前,淀粉型品种济徐23块根的ZR含量显著高于食用型甘薯品种,萌芽较差的泰中6号和心香块根的ZR含量显著低于萌芽较好的济徐23和烟薯25。
贮藏结束、排种前(140 d),济徐23、烟薯25和红香蕉块根中GA3/ABA、ZR/IAA值均明显大于泰中6号和心香,且济徐23块根中GA3/ ABA、ZR/IAA值显著大于烟薯25和红香蕉(图2)。
3 讨论
3.1 甘薯块根贮藏期间淀粉代谢与萌芽性的关系
COLLINS等[7]的研究表明,在相同的育苗条件下,不同甘薯品种的出苗量与排种前块根中的碳水化合物含量呈正相关。王庆美等[8]的研究进一步指出,块根出苗量及秧苗素质与块根营养成分含量关系密切,其中对块根萌芽性影响最大的是淀粉,并认为块根淀粉含量高的品种萌芽性较强。本研究结果表明,在贮藏结束、排种前,萌芽性较好的济徐23、烟薯25和红香蕉块根中淀粉含量较高,萌芽性较差的泰中6号和心香块根中淀粉含量较低,与前人的研究结果一致。本研究同时发现,在贮藏结束、排种前,萌芽性较好的品种块根中支链淀粉含量较高,萌芽性较差的品种块根中支链淀粉含量较低;萌芽性较差的品种块根中淀粉含量和支链淀粉含量较低的主要原因是贮藏期间特别是贮藏后期(贮藏70~140 d)块根淀粉和支链淀粉含量大幅度下降所致。
在淀粉酶的作用下,淀粉逐渐被水解为小分子可溶性糖是薯块发芽过程中的关键步骤[10, 15-16]。张原箕等[9]根据在甘薯块根中的淀粉酶主要是β-淀粉酶,且发芽过程中无新同工酶出现的试验结果,推测排种期β-淀粉酶在甘薯块根萌芽过程中承担着重要的生理功能;而唐君等[10]在甘薯贮藏期间高温愈合处理的试验中发现α-淀粉酶活性与薯块发芽存在一定的正相关性。本研究结果表明,在贮藏结束、排种前,萌芽性较好的济徐23、烟薯25和红香蕉块根的总淀粉酶活性和α-淀粉酶活性显著高于萌芽性较差的泰中6号和心香。虽然4个食用型品种之间比较,萌芽性较好的烟薯25和红香蕉块根β-淀粉酶活性显著高于萌芽性较差的泰中6号和心香;但萌芽性最好的济徐23块根β-淀粉酶不但低于烟薯25和红香蕉,而且低于泰中6号。因此,本研究认为,排种前块根α-淀粉酶是影响块根萌发出苗的关键酶。因为支链淀粉主要由α-淀粉酶完全降解[17],所以排种前块根支链淀粉含量和α-淀粉酶活性高的品种一方面具有丰富的水解底物,另一方面有利于加快支链淀粉的水解速率,这是该类品种块根萌芽性好的生理原因之一。
3.2 甘薯块根贮藏期间内源激素变化与淀粉代谢的关系
在禾谷类作物中发现GA和ABA的生物学功能存在拮抗作用[18],GA可诱导α-淀粉酶基因表达,提高α-淀粉酶活性,使淀粉水解为萌芽供能[19-20];而ABA抑制α-淀粉酶基因表达[21],可使淀粉积累。CTK是种子萌发过程中GA生物学功能的促进因子,ZR是CTK的主要组分[22]。细胞分裂素和生长素在植物生长发育中起着重要的作用[23],较高比例的CTK/IAA促进不定芽形成[24]。另外,已有研究证实GA浸种可以促进甘薯萌芽[25-26]。本研究具有类似结果,甘薯中萌芽性好的济徐23、烟薯25和红香蕉块根中有较高的GA3含量和较低的IAA含量,同时有较高的GA3/ABA和ZR/ IAA值。萌芽性较好的济徐23、烟薯25和红香蕉块根GA3/ABA值高均与GA3含量较高、ABA含量较低有关,虽然心香块根中ABA含量最低,但GA3含量也最低,故GA3/ABA低,所以,各品种块根中保持较高GA3/ABA值的途径主要通过较高的GA3含量;烟薯25和红香蕉块根ZR/ IAA值高与IAA含量较低有关,而济徐23块根ZR/IAA值高与IAA含量较低和ZR含量较高均有关系,即淀粉型品种块根保持较高ZR/IAA值的途径与食用型品种并不完全相同。本研究认为,所有萌芽性好的甘薯品种α-淀粉酶活性高都与块根中具有较高的GA3水平有关,而萌芽性好的淀粉型品种α-淀粉酶活性高可能还与块根中具有较高的ZR和较低的ABA水平有关。
4 结论
育苗排种时,块根中较高含量的淀粉尤其是支链淀粉作为底物,较高含量的内源GA3诱导α-淀粉酶活性的提高,同时,较低含量的内源IAA、较高的GA3/ABA和ZR/IAA值,也促使淀粉分解加剧,为萌芽提供充足的能量,利于甘薯萌芽。故可将淀粉和支链淀粉含量高、α-淀粉酶活性高、内源GA3含量高、内源IAA含量低及GA3/ABA和ZR/IAA值高作为判定甘薯萌芽性强弱的生理指标。因此,本研究结果可为促进甘薯萌芽提供外源激素选择理论依据,为强萌芽性甘薯育种提供方向。
参考文献
[1] 王欣, 李强, 曹清河, 马代夫. 中国甘薯产业和种业发展现状与未来展望[J]. 中国农业科学, 2021, 54(3): 483-492.WANG X, LI Q, CAO Q H, MA D F. Current status and future prospective of sweetpotato production and seed industry in China[J]. Scientia Agricultura Sinica, 2021, 54(3): 483- 492. (in Chinese)
[2] 陈慧芳. 甘薯发芽特点及苗床管理[J]. 陜西农业科学, 2010, 56(6): 104-106.CHEN H F. Sweetpotato germination and seedbed management[J]. Shaanxi Journal of Agricultural Sciences, 2010, 56(6): 104-106. (in Chinese)
[3] 张菡, 魏鑫, 王良平. 不同育苗方式对甘薯种苗质量的影响研究[J]. 耕作与栽培, 2013(1): 25.ZHANG H, WEI X, WANG L P. Effects of different seedling rearing methods on the quality of sweet potato seedlings[J]. Tillage and Cultivation, 2013(1): 25. (in Chinese)
[4] 马辉. 几个特色甘薯品种萌芽习性分析[J]. 作物杂志, 2004(1): 19-20.MA H. Analysis on germination behavior of several characteristic sweet potato varieties[J]. Crops, 2004(1): 19-20. (in Chinese)
[5] 魏猛, 李洪民, 唐忠厚, 张爱君, 史新敏, 陈晓光. 甘薯立柱式无土育苗模式研究初报[J]. 南方农业学报, 2013, 44(3): 407-410.WEI M, LI H M, TANG Z H, ZHANG A J, SHI X M, CHEN X G. Preliminary reporton column soilless raising seedlingin sweetpotato[J]. Journal of Sourth Agricultural, 2013, 44(3): 407-410. (in Chinese)
- 陳翻身. 甘薯酿热温床双膜覆盖两段育苗技术[J]. 现代农业科技, 2006(2): 58-59.CHEN F S. Sweet potato hot bed double film cover two stage seedling technology[J]. Mordern Agricultural Science and technology, 2006(2): 58-59. (in Chinese)
[7] COLLINS W W, 孙桂华. 甘薯发芽过程中碳水化合物的变化[J]. 园艺与种苗, 1992(1): 56.COLLINS W W, SUN G H. Carbohydrate changes during sweet potato germination[J]. Horticulture & Seed, 1992(1): 56. (in Chinese)
- 王庆美, 张立明, 王建军, 王大箴. 块根主要营养成分对甘薯品种萌芽性的影响[J]. 山东农业科学, 1998(1): 7-9.WANG Q M, ZHANG L M, WANG J J, WANG D Z. Influence of main nutrients in storage root on budding of sweetpotato[J]. Journal of Shandong Agricultural Science, 1998(1): 7-9. (in Chinese)
- 张原箕, 张华, 赵力, 张巧兰, 詹昌玲, 张亚利. 甘薯块茎中β-淀粉酶同工酶特性及其在萌芽过程中的组织分布[J].农产品加工(学刊), 2006(10): 53-56.ZHANG Y J, ZHANG H, ZHAO L, ZHANG Q L, ZHAN C L, ZHANG Y L. The distribution of β-amylase and its characteristics of isoenzyme in germinating sweetpotato[J]. Academic Periodical of Farm Products Processing, 2006(10): 53-56. (in Chinese)
- 唐君, 周志林, 赵冬兰, 曹清河. 甘薯贮藏过程淀粉酶活性变化及对薯块芽萌发的影响[J]. 福建农业学报, 2010, 25(6): 699-702.TANG J, ZHOU Z L, ZHAO D L, CAO Q H. Change of amylase content in storage ang its effect on germination of sweetpotato[J]. Fujian Journal of Agricultural Science, 2010, 25(6): 699-702. (in Chinese)
- 李韦瑶, 肖汇川, 张碧莹, 李杰, 苏滢淼, 崔国文, 秦立刚. 不同激素对山韭种子萌发特性的影响[J]. 种子, 2022, 41(6): 76-83. LI W Y, XIAO H C, ZHANG B Y, LI J, SU Y M, CUI G W, QIN L G. Effects of different hormones on seed germination characteristics of Aliiium senescens L.[J]. Seed, 2022, 41(6): 76-83. (in Chinese)
- 邱天越. 甘薯块根发芽过程主要成分的变化规律及其与发芽特性的关系[D]. 杭州: 浙江农林大学, 2019.QIU T Y. Variation of main components in sweet potato storage roots during feimination and its relationship with germination property[D]. Hangzhou: Zhejiang A&F University, 2019. (in Chinese)
- 何照范. 粮油籽粒品质极其分析技术[M]. 北京: 农业出版社, 1985: 7.HE Z F. Grain quality and analytical techniques of grain and oil[M]. Beijing: Agricultural Publishing House, 1985: 7. (in Chinese)
[14] 何钟佩. 作物激素生理及化学控制[M]. 北京: 中国农业大学出版社, 1996.HE Z P. Physiological and chemical control of crop hormones[M]. Beijing: China Agricultural Univesity Press, 1996. (in Chinese)
- 谢逸萍, 李洪民, 王欣. 贮藏期甘薯块根淀粉酶活性变化趋势[J]. 江苏农业学报, 2008(4): 406-409.XIE Y P, LI H M, WNAG X. Changes of amylase activities in sweetpotato to roots during storage[J]. Jiangsu Journal of Agricultural Science, 2008(4): 406-409. (in Chinese)
- 邹雪, 丁凡, 余韩开宗, 罗万宇, 陈年伟, 刘丽芳, 余金龙, 王西瑶. 植物源抑芽物质对延长甘薯贮藏期的作用效果[J]. 核农学报, 2019, 33(3): 530-537.ZOU X, DING F, YU H K Z, LUO W Y, CHEN N W, LIU L F, YU J L, WANG X Y. Effect of sprout Iinhibitors derived from plants on prolonging storage period of sweetpotato[J]. Journal of Nuclear Agricultural Science, 2019, 33(3): 530-537. (in Chinese)
- 刘国琴, 张曼夫. 生物化学[M]. 北京: 中国农业大学出版社, 2011.LIU G Q, ZHANG M F. Biological chemistry[M]. Beijing: China Agricultural Univesity Press, 2011. (in Chinese)
- LI Z, LUO X, WANG L, SHU K. Abscisic acid insensitive 5 mediates light–ABA/gibberellin crosstalk networks during seed germination[J]. Journal of Experimental Botany, 2022 (14): 4674-4682.
- 李淵, 李红钰, 逄世峰, 李政, 张浩, 王英平. GA和ABA调控人参种子休眠的生理机制探究[J]. 分子植物育种, 2023, 21(12): 4036-4042.LI Y, LI H Y, PANG S F, LI Z, ZHANG H, WANG Y P. Research on the physiological mechanism of GA and ABA regulating ginseng seed dormancy[J]. Molecular Plant Breeding, 2023, 21(12): 4036-4042. (in Chinese)
- 李燕, 汝姣, 姬越, 姚红艳, 罗充. GA处理下咖啡黄葵种子萌发及与α-淀粉酶相关性研究[J]. 种子, 2017, 36(3): 80-83.LI Y, RU J, JI Y, YAO H Y, LUO C. Study on the germination of A. esculentys seeds and the relationship between germination and α-amylase[J]. Seed, 2017, 36(3): 80-83. (in Chinese)
- 胡国富, 李韦瑶, 肖汇川, 崔国文, 宋雪, 韦银珠, 苏滢淼, 秦立刚. ABA和GA3对山韭种子萌发、生理特性及内源激素含量的影响[J]. 草地学报, 2022, 30(9): 2399-2406.HU G F, LI W Y, XIAO H C, CUI G W, SONG X, WEI Y Z, SU Y M, QIN L G. Effects of ABA and GA3 on seed germination, physiological and endogenous hormone contents of Aillium senscens L.[J]. Acta Agrestia Sinica, 2022, 30(9): 2399-2406. (in Chinese)
[22] ZHU Q, LI B, LIU X, SHAN N, SUN J, ZHANG H, HUANG Y, XIAO Y, ZHOU Q . Uncovering the mechanism preliminarily of formation and development of taro corm in vitro by morphological physiology and transcriptomic analysis[J]. Scientia Horticulturae, 2022, 291: 110575.
[23] XUE W, LIU N, ZHANG T, LI J, CHEN P, YANG Y, CHEN S. Substance metabolism, IAA and CTK signaling pathways regulating the origin of embryogenic callus during dedifferentiation and redifferentiation of cucumber cotyledon nodes[J]. Scientia Horticulturae, 2022, 293: 110680.
[24] SRISKANDARAJSH S, PRINSEN E, VACELAV M, DOBREV P, SEREK M. Regenerative capacity of Cacti Schlumbergera and Rhipsalidopsis in relation to endogenous phytohormones, cytokinin oxidase dehydrogenase, and peroxidase activities[J]. Journal of Plant Growth Regulation, 2006, 25(1): 79-88.
[25] 史文卿, 司成成, 史春余, 劉化学. 赤霉素浸种对甘薯块根萌芽性的调控效应[J]. 山东农业科学, 2017, 49(6): 71-73.SHI W Q, SI C C, SHI C Y, LIU H X. Regulation effects of seed soaking with gibberellin on budding property of sweetpotato storage root[J]. Journal of Shandong Agricultural Science, 2017, 49(6): 71-73. (in Chinese)
[26] 武小平, 丁健, 郭建芳, 武忠, 贾新宇, 卢建红. 赤霉素与高温催芽处理对甘薯块根萌芽性的影响[J]. 安徽农业科学, 2019, 47(14): 15-17.WU X P, DING J, GUO J F, WU Z, JIA X Y, LU J H. Effects of gibberellin and high temperature germination promotion on root germination of Dioscorea esculenta (Lour.)[J]. Journal of Anhui Agricultural Science, 2019, 47(14): 15-17. (in Chinese)
