杧果铁还原酶(FRO)编码基因的鉴定与表达模式分析
2024-03-10韩广栋孙丰沛任姿颖曹晶雯高爱平黄建峰宋志忠
韩广栋 孙丰沛 任姿颖 曹晶雯 高爱平 黄建峰 宋志忠


摘 要:鐵(Fe)是植物生长发育的必需微量元素之一,参与植物体内多种生命活动和代谢过程。有关铁素吸收、转运和分配吸收的分子机制研究主要体现在一年生模式作物,果树中铁吸收与转运相关基因的生物学功能依然未知。本研究从二倍体杧果桂热82中克隆并鉴定了11个铁还原酶(FRO)编码基因,命名为MiFRO1~MiFRO11;除MiFRO1缺失Motif2~Motif5基序外,其他MiFROs均含有10个典型的Motif基序,除MiFRO3具有独特的三级结构外,其他MiFROs拥有相近的三级结构;11种不同科、属植物FRO蛋白的氨基酸水平一致性约为42.07%,MiFROs的氨基酸水平一致性约为62.43%;系统进化树表明MiFROs倾向于单独聚集在一起,在系统发育树上与其他10种植物的同源蛋白进化距离较远;实时荧光定量PCR表明MiFRO8在杧果树体中的整体表达水平最高,MiFRO4、MiFRO5、MiFRO8和MiFRO11在成年树体新生叶片和嫁接苗叶片中的表达量最高,MiFRO6和MiFRO7在成年树体新生韧皮部和嫁接苗茎部的表达水平最高,MiFRO1和MiFRO10在幼果的表达水平最高,MiFRO2和MiFRO9在嫁接苗根部的表达量最高,而MiFRO3在盛开期花朵中的表达量最高。此外,MiFROs在根部易受缺铁和NaCl胁迫的诱导而显著增加;MiFRO3、MiFRO5和MiFRO8受高铁毒害的抑制,表达量降低;MiFRO2、MiFRO5、MiFRO7受ABA胁迫,其表达量增加;MiFRO1、MiFRO5受PEG胁迫,其表达量增加,MiFRO2、MiFRO6和MiFRO7受低温(4 ℃)抑制,其表达量降低,但MiFROs对热胁迫(45 ℃)不敏感。本研究为明确杧果铁的吸收与转运机制提供基因资源,并为解析热带作物果树铁素营养与高效利用奠定理论基础。
关键词:杧果;铁吸收;铁还原酶;非生物胁迫;表达模式中图分类号:S667.7 文献标识码:A
Identification and Expression Pattern Analysis of Ferric Reduction Oxidase Encoding Genes in Mango
HAN Guangdong1*, SUN Fengpei1*, REN Ziying1, CAO Jingwen1, GAO Aiping2, HUANG Jianfeng2, SONG Zhizhong1,3**
1. Engineering Research Institute of Agriculture and Forestry, Ludong University / Key Laboratory of Molecular Module-based Breeding of High Yield and Abiotic Resistant Plants in Universities of Shandong, Yantai, Shandong 264025, China; 2. Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China; 3. Department of Plant Science, University of Cambridge, Cambridge CB2 3EA, England
Abstract: Iron (Fe) is one of the essential trace mineral elements in plants to maintain normal growth and development that plays an important role in various life processes. Researches towards molecular mechanism of Fe uptake, transport and distribution are mainly focused on the annual model plants. Biological functions of genes towards Fe uptake and transport in fruit trees are still unknown. In this study, 11 ferric reduction oxidase encoding genes (FROs) were isolated and identified from diploid mango Guire 82, named by MiFRO1–MiFRO11. All mango FRO had ten typical motifs except for MiFRO1 lacking Motif2–Motif5. All mango FRO possessed similar tertiary structure, with the exception that MiFRO3 exhibited distinct tertiary structure. The amino acid sequences of FRO from 11 plants shared an overall identity of 42.07%, while mango FRO shared an overall identity of 62.43%. Phylogenetic tree analysis showed that mango FRO were prone to be closely clustered together lonely, which was far away from the homologs of the other ten plants in genetic distance. Quantitative real-time PCR (qRT-PCR) analysis showed that MiFRO3 was the most abundant expressed gene during different parts of Guire 82 mango on the whole. In particular, MiFRO4, MiFRO5, MiFRO8 and MiFRO11 were highly expressed in the leaves of both mature trees and grafted seedlings. MiFRO6 and MiFRO7 were highly expressed in phloem or stem, MiFRO1 and MiFRO10 were highly expressed in young fruits, MiFRO2 and MiFRO9 were highly expressed in seedling roots, while MiFRO3 was highly expressed in full bloom flowers. In addition, expression of FRO in mango roots were mainly induced under iron depletion and NaCl stress, respectively, while MiFRO3, MiFRO5 and MiFRO8 were significantly reduced under iron toxicity. Expression of MiFRO2, MiFRO5 and MiFRO7 were increased under ABA treatment, and MiFRO1 and MiFRO5 were enhanced under PEG treatment. Expression of MiFRO2, MiFRO6 and MiFRO7 were decreased under low temperature (4 ℃). However, FRO changed little under heat stress (45 ℃) in mango roots. This study would provide gene resources to elucidate the molecular mechanisms of Fe uptake and transport in mango, and lay a theoretical foundation to reveal Fe nutrition and high utilization in tropical fruit crops.
Keywords: mango; Fe uptake; ferric reduction oxidase; abiotic stress; expression pattern
DOI: 10.3969/j.issn.1000-2561.2024.02.001
鐵(Fe)是植物细胞中必不可少的微量元素之一,作为铁硫蛋白和细胞色素的组成成分,参与植物光合作用、呼吸作用、植物激素合成、DNA修复和氨基酸、嘌呤代谢等多种代谢途径[1-4]。园艺学中,铁肥施放与果树的生长、发育、果实品质形成和产量密切相关,土壤缺铁不利于果树的生长和发育,特别是石灰性土壤中缺铁现象更为明显,直接影响作物产量和品质的降低[5-8]。
土壤中的铁大多为Fe3+,植物对Fe3+的利用微乎其微[5, 7-9]。植物中,有关铁吸收、转运和分配的分子机制研究主要集中在拟南芥(Arabi dopsis thaliana)、水稻(Oryza sativa)等模式植物中[5-6, 9],果树作物中的研究较少。植物正常生长所需铁浓度为10–9~10–4 mol/L,然而,在正常pH土壤中Fe2+和Fe3+的浓度通常不超过10–15 mol/L,远远不能满足植物正常生长和发育的需求[6, 9]。ROMHELD等[10]最早提出了2种植物根际的铁吸收机制:吸收机制Ⅰ,即通过定位于根细胞膜表面的H-ATP酶向根际分泌H+,降低周围土壤pH,促进Fe3+的溶解,并通过铁还原酶(ferric reduction oxidase, FRO)将根系周围的Fe3+被还原为Fe2+,再通过Fe2+转运蛋白(ferrous iron transporter, IRT)进入根系被植物吸收利用[5-6, 9-10],多见于双子叶植物和非禾本科单子叶植物;吸收机制Ⅱ,即通过一系列的酶促反应合成和分泌麦根酸类物质,与根际的Fe3+形成螯合物,由专一的铁载体吸收途径被根系吸收利用,常见于禾本科单子叶植物。近期研究表明,水稻中同时存在吸收机制Ⅰ和吸收机制Ⅱ[5-6, 9-11]。
近几年,国内外学者有关FRO吸收铁的分子机制研究主要集中在拟南芥[10, 12]和水稻[11]等一年生模式植物。最早在拟南芥根中克隆获得AtFRO2,将其在铁还原酶缺陷的突变体fro互补表达后有效缓解了缺铁胁迫对突变体植株生长的抑制作用,并显著增强了互补株系根表面的FRO活性[13-14]。水稻OsFRO1和OsFRO7主要在旗叶中高量表达,且在转录水平均受NaCl、PEG、高温、重金属等非生物胁迫的调控,OsFRO1的RNAi干涉株系生长受抑制,铁含量、叶绿素含量和活性氧(reactive oxygen savaging, ROS)清除能力均显著降低[11]。然而,果树学中铁吸收与转运的分子机制未知,仅在资阳香橙(Citrus junos cv. Ziyang xiangcheng)[15]和小金海棠(Malus xiao jinensis cv. Cheng et Jiang)[16]中鉴定出FRO同源基因,热带作物中有关铁营养与高效利用的分子基础依然空白。
杧果(Mangifera indica)是全球知名的热带果树作物之一,基因组已完成测序[17]。本研究以桂热82杧果为材料,克隆杧果FRO基因并鉴定其生物信息学特征,明确杧果FRO基因的组织特异性表达特征及其在转录水平对缺铁、铁毒害、ABA、NaCl、PEG、低温和热胁迫的响应差异,为研究杧果铁的吸收与利用的分子机制提供基因资源,并为解析杧果铁素营养动态与高效利用奠定理论依据。
1 材料与方法
1.1 材料
供试材料为5年生桂热82杧果和1年生嫁接幼苗,由中国热带农业科学院热带作物品种资源研究所提供。分别采集5年生桂热82杧果的1年生新叶(2019年4月1日)、新生韧皮部(2019年4月1日)、新生根(2019年4月1日)、盛开期花朵(2019年4月1日)、幼果(2019年5月1日)和成熟果实(2019年8月1日),液氮冷冻后保存于–80 ℃超低温冰箱备用。按照李又欢等[18]、张璐等[19]和SONG等[20]的方法,以1/2 MS液体培养基为对照条件,利用1年生桂热82嫁接幼苗进行缺铁(0 μmol/L FeNa-EDTA)、高铁(500 μmol/L FeNa-EDTA)、ABA(200 ?mol/L)、10% PEG 6000(w/V)、NaCl(200 mmol/L)、低温(4 ℃)和高温(45 ℃)胁迫,处理48 h后[17-21],采集根部和叶片材料用于转录水平的表达差异分析。
1.2 方法
1.2.1 杧果FRO家族基因克隆 以拟南芥8个FRO蛋白的氨基酸序列为参考[10, 12],在杧果基因组数据库[17]中检索潜在的杧果FRO家族蛋白,下载氨基酸序列及其编码基因的CDS(coding sequence)序列,检索结果在Pfam(http://pfam. xfam.org/search)在线软件预测功能结构域。根据杧果FRO基因的CDS序列设计上下游引物,提取1年生桂热82嫁接幼苗的RNA,通过Prime- ScriptTM RT reagent Kit反转录试剂盒(TaKaRa,大连)合成第一链cDNA作为模板,利用Prime STARTM HS DNA聚合酶(TaKaRa,大连)扩增杧果FRO基因,送生工生物工程(上海)股份有限公司进行测序验证。
1.2.2 生物信息学分析 通過李又欢等[18]和GAO等[21]描述的方法,利用ProtParam(http:// expasy.org/tools/protparam.html)在线软件分析杧果FRO蛋白的氨基酸数目、等电点、脂肪系数、总亲水平均数GRAVY(grand average of hydropathicity)、不稳定指数等理化性质;运用SignalP 4.0 (http://www.cbs.dtu.dk/services/SignalP-4.0/)在线软件分析杧果FRO蛋白的信号肽存在情况;利用Phyre 2(http://www.sbg.bio.ic.ac.uk/phyre2/ html/page.cgi?id=index)在线软件预测杧果FRO蛋白的三级结构。
1.2.3 系统发育树分析 根据GAO等[21]和ZHANG等[22]的方法,下载杧果(漆树科)、拟南芥(十字花科)、番茄(Solanum lycopersicum,茄科)、玉米(Zea mays,禾本科)、水稻(禾本科)、蒺藜苜蓿(Medicago truncatula,豆科)、落花生(Arachis hypogaea,豆科)、大豆(Glycine max,豆科)、葡萄(Vitis vinifera,葡萄科)、资阳香橙(芸香科)和小金海棠(蔷薇科)11种植物FRO同源蛋白的氨基酸序列,利用ClustalX 2.0软件对其进行氨基酸序列一致性比对分析,利用MEGA 13.0软件中的邻接法(Neighbor-joining,NJ)构建11种植物FRO同源蛋白的系统发育树,分析不同植物FRO同源蛋白的遗传进化关系。
1.2.4 实时荧光定量PCR分析 参考文献[18-23]的方法,利用NCBI/Primer-BLAST在线软件设计杧果FRO家族基因的特异性表达引物(表1),以杧果Actin为内参,通过ABI 7500实时荧光定量PCR仪检测杧果FRO家族基因在不同组织部位的特异性表达特征及其在转录水平上对缺铁、高铁、ABA、PEG 6000、NaCl、低温和高温等非生物胁迫的响应差异。借助SYBR Green(TaKaRa,大连)荧光染料进行PCR反应。反应程序为:95 ℃预变性30 s;95 ℃变性5 s,58 ℃退火34 s,40个循环;最后72 ℃延伸10 s。由实时荧光定量PCR仪获得的Ct值经内参基因Actin均一化处理,采用2–ΔΔCT法计算相对表达量,通过Log2法计算胁迫处理前后表达倍数的变化,并通过HemI软件绘制表达倍数变化的热图。
1.3 数据处理
利用SPSS 13.0软件(SPSS Chicago,美国)对本研究的数据进行显著性分析,杧果幼苗在胁迫处理与对照条件2个独立样品间进行t-检验。
2 结果与分析
2.1 杧果FRO家族基因的鉴定与克隆
通过BLAST同源比对法,在杧果数据库里
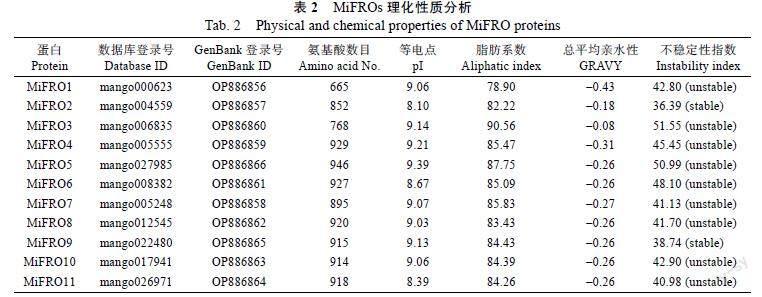
检索到11个潜在的铁还原酶蛋白,Pfam注释为Ferric reductase,功能结构域包括NADPH oxi dase、FAD-binding domain和Oxidoreductase sig nature domain等,均属于典型的铁还原酶的保守功能域(图1)。GO生物学功能注释为deto xification(GO:0098754),证实均为铁还原酶编码基因,命名为MiFRO1~MiFRO11。下载MiFROs的CDS电子序列,设计上下游引物进行PCR扩增,测序验证后提交NCBI获得Genbank登录号(表2)。
2.2 植物FRO同源蛋白系统发育树分析
多重序列比对结果表明,11种植物FRO蛋白之间具有较高的同源性,氨基酸水平具有42.07%的一致性,11个杧果FRO蛋白在氨基酸水平具有62.43%的一致性(图1),核苷酸水平具有57.78%的一致性。下载杧果、拟南芥、番茄、水稻、玉米、大豆、蒺藜苜蓿、落花生、葡萄、资阳香橙和小金海棠等11种植物FRO同源蛋白的氨基酸序列[5-16]进行系统发育树分析,结果表明,MiFROs集中聚集在一起,且与其他10种植物同源蛋白在系统发育树上距离较远,大豆、蒺藜苜蓿和落花生3种豆科植物的FRO同源蛋白在遗传进化距离最近,葡萄、资阳香橙和小金海棠3种果树作物FRO同源蛋白聚在一起,水稻和玉米2种禾本科植物FRO同源蛋白在遗传距离上更为相近(图2)。
2.3 MiFROs的理化性质与高级结构分析
理化性质分析结果详见表2,所有MiFROs的等电点(pI)>7.00,含有的碱性氨基酸较多;MiFROs的脂肪系数均小于100,且GRAVY亲水指数均小于0,均为亲水蛋白;信号肽分析表明MiFROs均不具有信号肽。稳定性分析表明MiFRO2和MiFRO9的不稳定指数小于40,为稳定蛋白,其他MiFROs的不稳定性指数大于40,均为不稳定蛋白(表2)
Motif分析结果表明,MiFROs含有10个不同的典型Motif基序,其中,MiFRO1仅含有6个(Motif1、Motif6~Motif10)基序,缺失4个(Motif2~Motif5)基序,而其他MiFROs拥有全部10个Motif基序(图3A)。除Motif10含有32个特征氨基酸数目外,其他10个Motif均含有50个特征氨基酸数目(图3B);
蛋白质高级结构预测结果表明,MiFROs三级结构存在差异,其中,MiFRO1、MiFRO2、MiFRO6和MiFRO7具有相似的三级结构,MiFRO4、MiFRO5、MiFRO8、MiFRO9、MiFRO10和MiFRO11具有相似的三级结构,而MiFRO3具有独特的三级结构,与其他MiFRO成员的三级结构差异较大(图4)。
2.4 MiFRO家族基因组织特异性表达分析
实时荧光定量PCR分析结果表明,MiFRO
家族基因在5年生桂热82杧果的新生叶片、新生韧皮部、盛开期花朵、幼果、熟果和1年生嫁接苗的叶片、茎部和根部等多种组织中均有表达,且表达量差异显著(图5)。MiFRO8在所有检测组织中的整体表达水平最高,其次是MiFRO11和MiFRO6,而MiFRO1和MiFRO2的整体表达水平相对最低。此外,4个基因(MiFRO4、MiFRO5、MiFRO8和MiFRO11)在杧果不同检测组织中的表达趋势相似,均在成年树体新生叶片和嫁接苗叶片中的表达量最高,远高于其他检测组织中的表达量,2个基因(MiFRO6和MiFRO7)在成年树体新生韧皮部和嫁接苗茎部的表达量最高,2个基因(MiFRO1和MiFRO10)在幼果的表达水平最高,2个基因(MiFRO2和MiFRO9)在嫁接苗根部的表达量最高,而MiFRO3在盛开期花朵中的表达量最高。
2.5 幼苗MiFROs对不同非生物胁迫的差异响应
以1年生桂热82嫁接苗为材料,通过实时荧光定量PCR分析MiFROs在杧果根部对缺铁、铁毒害、ABA、PEG 6000、NaCl、低温和热胁迫等非生物胁迫的响应特征。结果表明:MiFRO家族基因对缺铁和NaCl胁迫最为敏感,其中,8个基因(MiFRO1、MiFRO2、MiFRO3、MiFRO4、MiFRO5、MiFRO7、MiFRO8和MiFRO10)受缺铁胁迫的影响,在根部的表达水平显著增加,7个基因在根部对NaCl胁迫有响应,其中5个基因(MiFRO1、MiFRO2、MiFRO5、MiFRO7和MiFRO10)被显著诱导,其表达水平增加,2个基因(MiFRO6和MiFRO11)被显著抑制,其表达水平降低;3个基因(MiFRO3、MiFRO5和MiFRO8)受铁毒害抑制,在根部的表达水平显著
降低;3个基因(MiFRO2、MiFRO5和MiFRO7)和2个基因(MiFRO1和MiFRO5)分别受ABA和PEG胁迫的诱导,其表达水平显著增加;此外,MiFRO2、MiFRO6和MiFRO7在根部受低温(4 ℃)胁迫抑制,其表达表达水平降低,然而,MiFROs在根部對热胁迫(45 ℃)无响应,其表达水平均无显著变化。4个基因(MiFRO1、MiFRO2、MiFRO5和MiFRO7)在根部至少对3种非生物胁迫有响应,其中,尽管MiFRO5在杧果中的整体表达水平相对较低,但其对5种胁迫处理有响应,MiFRO2和MiFRO7在杧果根部的表达量极低,但对4种非生物胁迫有响应;MiFRO9在嫁接苗根部的表达量相对较高,且最为稳定,对本研究所设置的7种非生物胁迫均无响应(图6)。
3 讨论
铁元素与果实品质和产量密切相关[1-4]。然而,相关研究集中在生理生化层面,有关果树铁素营养和高效利用的分子机制研究较少。杧果作为双子叶植物,其根际对铁的吸收属于机制Ⅰ[5-10],然而,杧果有关铁吸收与转运的分子机制依然未知。本研究从杧果中克隆并鉴定了11个MiFROs,数量远多于拟南芥(8个)和葡萄(6个)中同源基因的数量[9, 20],表明在不同植物之间的FRO同源家族基因的数目存在差异。此外,不同科属植物的FRO同源蛋白在遗传进化关系上存在差异,同属于禾本科或豆科的植物FRO同源蛋白倾向于紧密聚在一起,然而,相较于本研究所选的多种禾本科、豆科、茄科和十字花科植物,MiFROs
倾向于单独聚集在一起,在系统发育树上与其他植物的同源蛋白距离较远,表明木本果树铁还原酶可能具有与常见的一年生植物中同源蛋白的生物学功能有所差异。除了MiFRO1缺失4个特征Motif基序和MiFRO3具有独特的三级结构外,其他MiFROs具有相同的Motif基序和相近的三级蛋白结构,表明特征Motif、蛋白三级结构和进化关系上相近的铁还原酶(如MiFRO8、MiFRO9、MiFRO10和MiFRO11)可能具有相似的生物学功能,但仍需进一步的分子生物学实验证实。
前人研究表明玉米ZmFRO2[24]、水稻OsFRO1和OsFRO7[11]、资阳香橙CjFRO1[15]、小金海棠MxFRO4和MxFRO6[16]均在叶片中高量表达,与之相一致的是,本研究发现MiFRO4、MiFRO5、MiFRO8和MiFRO11均在成年杧果树体新生叶片和嫁接苗叶片中高量表达,再次表明FRO基因可能在植物叶片中铁素的吸收与转运过程中发挥重要作用。此外,本研究发现MiFRO3在盛开期花朵中的表达量最高,表明该基因可能直接参与杧果花朵中铁素转运或利用过程,而MiFRO1和MiFRO10在杧果的幼果中高量表达(远高于其他检测的组织),表明这2个基因可能在杧果发育初期这一关键时期维持果实中的铁素动态与平衡,但需进一步的生物学功能验证。这些发现充分表明MiFROs具有典型的组织特异性表达特征,分别在不同组织/器官中各司其职、发挥铁还原酶的作用。
本研究表明MiFROs在转录水平的表达易受缺铁处理的调控,8个基因在嫁接苗根部受缺铁胁迫,其表达水平显著增加,推测MiFRO在缺铁胁迫下更倾向于被诱导激活,以便最大程度地发挥根中铁还原酶的生物功能,进而调动和富集更多的铁元素,以便维持或保障杧果树体中依赖于铁的基本的生命活动的运作。因此,FRO基因表达水平的增高可能是杧果响应环境缺铁的关键信号之一。此外,受铁毒害抑制,MiFRO3、MiFRO5和MiFRO8基因在杧果根部的表达量显著降低,但受缺铁胁迫诱导而增加,表明这3个基因可能是杧果树体中具有活性的铁还原酶蛋白,其活性直接受外界铁素供应水平的调控,这些结果与拟南芥[21]、玉米[14]、资阳香橙[15]和小金海棠[16]中有关FRO基因响应铁素供应水平的报道相一致。NaCl和ABA为典型的渗透胁迫物质,已有研究表明小金海棠MxFRO4和MxFRO6的表达易受NaCl胁迫的影响[16],而水稻OsFRO1和OsFRO7在转录水平极易受NaCl和PEG的调控,且OsFRO7在转录水平易受ABA胁迫诱导,而OsFRO1在转录水平对ABA无响应[11]。与之相类似的是,本研究发现MiFRO1、MiFRO2、MiFRO5、MiFRO7和MiFRO10受NaCl胁迫显著诱导而增加,而MiFRO6和MiFRO11受NaCl胁迫显著抑制而降低,与此同时,MiFRO2、MiFRO5和MiFRO7在根部受ABA处理诱导而显著增高,再次表明MiFRO2、MiFRO5和MiFRO7这3个基因可能在杧果响应和调节渗透胁迫方面发挥关键作用,为进一步研究MiFRO的功能与调控机理奠定了理论基础。此外,MiFRO1和MiFRO5在根部受PEG显著诱导而增加,初步表明了这2个基因倾向于参与杧果对干旱胁迫的响应机制,但仍需进一步的生物学功能验证。
杧果是典型的热带果树作物,其在温带和寒冷地区的生长适应性很差,本研究发现杧果FRO在根部的表达均不受热处理(45 ℃)的影响,表明,杧果铁还原酶的活性不易受高温天气的影响,在45 ℃极端环境条件下依然可以稳定的发挥功能,进而保障杧果树体中一些需铁的代谢途径或生命活动,在一定程度上解释了杧果之所以作为典型的热带果树作物在热带和亚热带地区广泛分布和栽培的事实。此外,MiFRO2、MiFRO6和MiFRO7在根部的表达量受低温(4 ℃)抑制而降低,表明,在低温胁迫条件下杧果的生命活力下降,特别依赖于铁元素的代谢活动可能直接受到抑制,这几个MiFROs通过降低自身的活性进而适应或耐受低温胁迫对杧果生长的影响。值得注意的是,MiFRO9在杧果树体中的整体表达水平较为适中,其在根部的表达量最高(远高于其他检测的组织),且不受本研究设定的7种非生物胁迫的调控,表明该铁还原酶蛋白可能持续稳定地地发挥自身活性,进而有效地参与杧果树体中铁元素的吸收和转运过程。
参考文献
[1] LILL R. Function and biogenesis of iron-sulphur proteins[J]. Nature, 2009, 460(7257): 831-838.
[2] BARTO L L, ABADIA J. Iron nutrition in plants and rhizospheric microorganisms[M]. New York: Springer-Ver lag, 2006: 85-101.
[3] BALK J, PILON M. Ancient and essential: the assembly of iron–sulfur clusters in plants[J]. Trends in Plant Science, 2011, 16: 218-226.
[4] COUTURIER J, TOURAINE B, BRIAT J F, GAYMARD F, ROUHIER N. The iron-sulfur cluster assembly machineries in plants: current knowledge and open questions[J]. Frontiers in Plant Science, 2013, 4: 259.
- 张妮娜, 上官周平, 陈娟. 植物应答缺铁胁迫的分子生理机制及其调控[J]. 植物营养与肥料学报, 2018, 24(5): 1365-1377.ZHANG N N, SHANGGUAN Z P, CHEN J. Molecular physiological mechanism and regulation of plant responses to iron deficiency stress[J]. Journal of Plant Nutrition and Fertilizers, 2018, 24(5): 1365-1377. (in Chinese)
- 李俊成, 于慧, 杨素欣, 冯献忠. 植物对铁元素吸收的分子调控机制研究进展[J]. 植物生理学报, 2016, 52(6): 835-842.LI J C, YU H, YANG S X, FENG X Z. Research progress of molecular regulation of iron uptake in plants[J]. Plant Physiology Journal, 2016, 52(6): 835-842. (in Chinese)
- TAGLIAVINI M, ABADIA J, ROMBOL? A D, ABAD?A A, TSIPOURIDIS C, MARANGONI B. Agronomic means for the control of iron deficiency chlorosis in deciduous fruit trees[J]. Journal of Plant Nutrition, 2000, 23: 2007-2022.
- TAGLIAVINI M, ROMBOL? A D. Iron deficiency and chlorosis in orchard and vineyard ecosystems[J]. European Journal of Agronomy, 2001, 15: 72-92.
- KOBAYASHI T, NISHIZAWA N K. Iron uptake, translocation, and regulation in higher plants[J]. Annual Review of Plant Biology, 2012, 63: 131-152.
- ROMHELD V, MARSCHNER H. Evidence for a specific uptake system for iron phytosiderophores in roots of grasses[J]. Plant Physiology, 1986, 80(1): 175-180.
- MUHAMMAD I, JIN X Q, SHALMANI A, ALI M, YI S, GAN P F, LI W Q, LIU W T, CHEN K M. Comparative in silico analysis of ferric reduction oxidase (FRO) genes expression patterns in response to abiotic stresses, metal and hormone applications[J]. Molecules, 2018, 23: 1163
- ROBINSON N J, PROCTER C M, CONNOLLY E L, GUERINOT M L. A ferric-chelate reductase for iron uptake from soils[J]. Nature, 1999, 397: 694-697.
- WU H. Molecular and biochemical characterization of the Fe (III) chelate reductase gene family in Arabidopsis thaliana[J]. Plant and Cell Physiology, 2005, 46(9): 1505-1514.
- 李利敏, 吴良欢, 马国瑞. 植物吸收铁机理及其相关基因研究进展[J]. 土壤通报, 2010, 41(4): 994-999.LI L M, WU L H, MA G R. The progress on iron-absorbing mechanism and related gene in plant[J]. Chinese Journal of Soil Science, 2010, 41(4): 994-999. (in Chinese)
- 姚利晓, 陈善春, 何永睿. 资阳香橙铁螯合还原酶基因家族的克隆和分析[C]//中国园艺学会, 中国农业科学院蔬菜花卉研究所. 中国园艺学会2014年学术年会论文摘要集. 2014.YAO X L, CHEN S C, HE Y R. Cloning and analysis of ferric reduction oxidase family genes in Ziyang xiangcheng[C]//Chinese Society for Horticultural Science, Institute of Vegetables and Flowers, Chinese Academy of Agricultural Sciences. Summary collection of papers from the 2014 academic annual conference of the Chinese Society for Horticultural Science, 2014. (in Chinese)
- 周正一. 苹果属小金海棠铁还原酶基因MxFRO4、MxFRO6的克隆与功能分析[D]. 哈尔滨: 东北农业大学, 2021.ZHOU Z Y. Isolation and functional analysis of ferric reductase gene MxFRO4 and MxFRO6 in Malus xiaojinensis[D]. Harbin: Northeast Agricultural University, 2021. (in Chinese)
- WANG P, LUO Y, HUANG J F, GAO S H, ZHU G P, DANG Z G, GAI J T, YANG M, ZHU M, ZHANG H K, YE X X, GAO A P, TAN X Y, WANG S, WU S Y, CAHOON E B, BAI B B, ZHAO Z C, LI Q, WEI J Y, CHEN H R, LUO R X, GONG D Y, TANG K X, ZHANG B, NI Z G, HUANG G D, HU S N, CHEN Y Y. The genome evolution and domestication of tropical fruit mango[J]. Genome Biology, 2020, 21: 60.
- 李又欢, 鲍中齐, 高爱平, 黄建峰, 王力敏, 张洪霞, 宋志忠. 杧果NFU家族基因的克隆、鉴定及其对非生物胁迫的响应分析[J]. 热带作物学报, 2022, 43(7): 1313-1321.LI Y H, BAO Z Q, GAO A P, HUANG J F, WANG L M, ZHANG H X, SONG Z Z. Cloning and identification of NFU family genes in mango and responsive analysis to abiotic stresses[J]. Chinese Journal of Tropical Crops, 2022, 43(7): 1313-1321. (in Chinese)
- 张璐, 宗亚奇, 徐维华, 韩蕾, 孙浈育, 陈朝晖, 陈松利, 张凯, 程杰山, 唐美玲, 张洪霞, 宋志忠. 葡萄Fe-S簇装配基因的鉴定、克隆和表达特征分析[J]. 中国农业科学, 2021, 54(23): 5068-5082.ZHANG L, ZONG Y Q, XU W H, HAN L, SUN Z Y, CHEN Z H, CHEN S L, ZHANG K, CHENG J S, TANG M L, ZHANG H X, SONG Z Z. Identification, cloning, and expression characteristics analysis of Fe-S cluster assembly genes in grape[J]. Scientia Agricultura Sinica, 2021, 54(23): 5068-5082. (in Chinese)
- SONG Z Z, YANG Y, XU J L, MA R J, YU M L. Physiological and transcriptional responses in the iron-sulphur cluster assembly pathway under abiotic stress in peach (Prunus persica L.) seedlings[J]. Plant Cell Tissue & Organ Culture, 2014, 117(3): 419-430.
- GAO Y C, YU C Y, ZHANG K, ZHANG H X, ZHANG S Y, SONG Z Z. Identification and characterization of the strawberry KT/HAK/KUP transporter gene family in response to K+ deficiency[J]. Acta Physiologiae Plantarum, 2021, 43: 1.
- ZHANG Y, SHI X M, LIN S Z, WANG J P, TANG M L, HUANG J F, GAO A P, ZHANG H X, SONG Z Z. Heterologous expression of the MiHAK14 homologue from Mangifera indica enhances plant tolerance to K+ deficiency and salinity stress in Arabidopsis[J]. Plant Growth Regulation, 2022, 98: 39-49.
- 韓蕾, 李俊林, 高爱平, 黄建峰, 李建召, 宋志忠. 杧果钾通道基因MiSPIK的克隆、表达与功能分析[J]. 生物技术通报, 2022, 38(10): 164-172.HAN L, LI J L, GAO A P, HUANG J F, LI J Z, SONG Z Z. Cloning, expression and functional analysis of potassium channel gene MiSPIK in Mangifera indica[J]. Biotechnology Bulletin, 2022, 38(10): 164-172. (in Chinese)
- 乔孟欣, 李素贞, 陈景堂. 玉米铁还原酶基因ZmFRO2的功能分析[J]. 生物技术通报, 2020, 36(11): 9-20.QIAO M X, LI S Z, CHEN J T. Functional analysis of ferric reductase gene ZmFRO2 in maize[J]. Biotechnology Bulletin, 2020, 36(11): 9-20. (in Chinese)
