油茶IDD基因家族鉴定与生物信息学分析
2024-03-10陈健鑫吴峰婧琳魏玉倩杨娅琳马焕成杨红玉伍建榕
陈健鑫 吴峰婧琳 魏玉倩 杨娅琳 马焕成 杨红玉 伍建榕

摘 要:油茶(Camellia oleifera)是山茶科(Theaceae)的一種特有的油料植物,具有重要的观赏价值和经济价值,随着油茶的集约化种植,病虫害大量发生,加之良种选育滞后,严重制约着油茶产业的发展。INDETERMINATE DOMAIN(IDD)家族是高等植物中一类保守的转录因子,通过介导植物内源激素进而调控植物的基础免疫反应。为鉴定油茶中IDD基因家族成员,本研究以油茶全基因组信息为参考,通过IDD基因家族保守结构域鉴定了29个油茶CoIDD基因家族成员,进一步明确了各基因的结构、理化性质、系统进化关系、亚细胞定位。通过RT-PCR克隆到1个与AtIDD4/5/6同源的CoIDD4基因,明确了其理化性质、表达模式及核定位信号,同时分析了其启动区顺式作用元件的类型。研究结果表明,29个CoIDD基因家族成员分为4个亚组,平均亲水系数均小于0,属于亲水性蛋白,且亚细胞定位均位于细胞核内;克隆到CoIDD4基因的全长ORF框包含1620 bp碱基,编码539个氨基酸,主要在叶片和花器官中表达;该基因启动子区顺式作用元件主要是参与光响应和植物激素响应元件两大种类。综上所述,本研究在油茶中鉴定了29个IDD基因家族成员,其中CoIDD4基因与AtIDD4/5/6亲缘关系较近,推测其可能参与油茶激素信号转导和基础免疫反应调节等进程,为油茶IDD转录因子功能解析提供理论基础,也为油茶的抗性优良品种选育及分子育种提供参考依据。
关键词:油茶;IDD基因家族;生物信息学分析;植物激素;抗性调控中图分类号:S432 文献标识码:A
Identification and Bioinformatics Analysis of IDD Gene Family in Camellia oleifera
CHEN Jianxin1, WU Fengjinglin1, WEI Yuqian1, YANG Yalin1, MA Huancheng2, YANG Hongyu3*, WU Jianrong1,2*
1. College of Biodiversity Conservation, Southwest Forestry University / Key Laboratory of Forest Disaster Warning and Control in Universities of Yunnan Province, Kunming, Yunnan 650224, China; 2. College of Biodiversity Forestry, Southwest Forestry University / Key Laboratory of Biodiversity Conservation in Southwest China, State Forestry Administration, Kunming, Yunnan 650224, China; 3. College of Agronomy and Life Sciences, Kunming University, Kunming, Yunnan 650214, China
Abstract: Camellia oleifera is a unique oil plant of Theaceae, which has important ornamental value and economic value. With the intensive planting of Camellia, many diseases and pests occur. In addition, the delayed breeding of improved varieties seriously restricts the development of the Camellia industry. INDETERMINATE DOMAIN (IDD) family is a kind of conservative transcription factors in higher plants, which regulate the basic immune response of plants by mediating plant endogenous hormones. In order to identify the members of IDD gene family in C. oleifera, 29 members of CoIDD gene family were identified through the conserved domain of IDD gene family with reference to the whole genome information of C. oleifera, and further clarified the structure, physical and chemical properties, phylogenetic relationship, and sub cell localization of each gene. The CoIDD4 gene homologous to AtIDD4/5/6 was cloned by RT-PCR, and its physicochemical properties, expression mode and nuclear localization signal were clarified. At the same time, the types of cis acting elements in its promoter region were analyzed. The results showed that 29 CoIDD gene family members were divided into 4 subgroups, with average hydrophilicity coefficients less than 0, belonging to hydrophilic proteins, and subcellular localization was located in the nucleus; The full-length ORF frame cloned into CoIDD4 gene contained 1620 bp base and encoded 539 amino acids, which were mainly expressed in leaf and flower organs; The cis acting elements in the promoter region of the gene were mainly involved in light response and plant hormone response elements. In conclusion, this study identified 29 IDD gene family members in C. oleifera, among which CoIDD4 gene was closely related to AtIDD4/5/6. It is speculated that CoIDD4 gene may be involved in the process of hormone signal transduction and basic immune response regulation of C. oleifera, which would provide a theoretical basis for the functional analysis of IDD transcription factors in C. oleifera and provide a reference basis for the selection and molecular breeding of superior resistant varieties of C. oleifera.
Keywords: Camellia oleifera; IDD gene family; bioinformatics analysis; plant hormone; resistance regulation
DOI: 10.3969/j.issn.1000-2561.2024.02.003
油茶(Camellia oleifera)是山茶科(Theaceae)山茶属(Camellia)的一种灌木或中乔木,是我国一种特有的油料植物。油茶在我国有悠久的种植和栽培历史,从长江流域到华南地区等14个省份被广泛的栽培[1]。鲜榨茶油中富含不饱和脂肪酸以及多酚、黄酮、原花青素、总三萜和木脂素等活性物质,是一种高质量、耐储存的健康食用油[2]。油茶在云南有悠久的种植历史,主栽的品种是白花油茶和腾冲红花油茶,截至2019年底,云南省共发展油茶23万hm2,综合产值7.9亿元,位列全国第11位[3-4]。随着油茶集约化种植和油茶产业的快速发展,加之良种选育滞后及栽培管护技术落后导致油茶病虫害发生严重,目前,油茶病虫害的防控仍是以化学防治为主的单一防治措施,一方面病原物的抗药性逐渐增强,另一方面也给生态环境和人类健康带来了负面影响。因此,油茶抗逆相关基因亟需解析。
INDETERMINATE DOMAIN(IDD)基因家族是C2H2型锌指蛋白转录因子的一类,IDD基因家族的保守N端以DNA结合域(不定域)为特征,包含2个C2H2和2个C2HC锌指结构域,植物中的IDD基因通过与多种蛋白质相互作用,与激素级联重叠,控制或调节植物的生长发育与抗逆反应应答[5]。ID-domain基因最初由玉米中1个典型的开花基因INDETERMINATE1(ID1)而被报道[6],ID1基因编码1个包含4个锌指单元的核蛋白,具有C2H2型锌指蛋白的结构特点,在植物中通过ID1基因的ID-domain所定义的基因家族成为了C2H2型锌指蛋白的一个亚族,即IDD锌指蛋白家族。在拟南芥(Arabidopsis thaliana)中发现了16个IDD成员,命名为AtIDD1-16,构建基于氨基酸的系统发育树发现,AtIDD4、AtIDD5和AtIDD6位于同一进化支内,且IDD4与IDD6关系较近,二者氨基酸的一致性为64%,3个IDD基因氨基酸序列的一致性为53%,3个蛋白的氨基酸序列在ID-domain区域的一致性高达96%[7-8]。研究发现AtIDD4基因与根系的发育和叶片极性有关并参与DELLA相互作用,AtIDD5基因是一类与DELLA相互作用的蛋白;AtIDD6基因与根系的发育有关[9],idd4拟南芥缺失突变体表现了对丁香假单胞的抗性,揭示了AtIDD4作为水杨酸(Salicylic acid, SA)信号通路的负调控因子,参与植物激素信号网络转导途径和基础免疫反应[10]。随着基因组测序技术和分子生物学技术的发展,已有多个物种中的IDD家族成员被鉴定并报道了其重要的生物学功能。通过IDD家族的保守结构域在毛竹(Phyllostachys edulis)中鉴定了32个具有完整IDD-domain的成员,证实PheIDD21受蔗糖诱导后是侧调控芽发育的关键因子[11]。甘蓝型油菜(Brassica napus)在我国食用油产业中具有举足轻重的地位,在油菜中鉴定了58个候选IDD蛋白,其中Bna.A08IDD7a基因通过介导赤霉素(Gibberellin, GA)和生长素(auxin, IAA)的信号转导过程而参与根系生长的调控[12]。
IDD基因家族在植物生长发育、植物激素信号转导通路及基础免疫调控中具有重要作用,但在油茶中鲜有研究报道。本研究基于油茶基因组数据鉴定IDD基因家族成员,明确各个基因间的系统发育关系,并利用生物信息学方法分析IDD基因家族蛋白的理化性质、Motif预测、亚细胞定位等情况,同时鉴定并克隆AtIDD4/5/6的同源基因CoIDD4及分析其表达特征,为后续油茶分子育种和抗病品种的选育提供重要理论依据。
1 材料与方法
1.1 材料
供试植物:本研究所用油茶采集自云南省德宏州梁河縣油茶种植基地。选取长势一致的1年生油茶实生苗的叶片组织用于CoIDD基因的克隆,选取梁河县翁冷村12~15年生油茶,分别收集叶、花、果实和根系组织用于CoIDD基因表达模式分析。每个组织至少收集3套生物学模板,收集后立刻用液氮速冻,于–80 ℃长期保存。
参考基因组及参考序列:油茶全基因组(ASM2231669v1)信息下载自NCBI数据库(https://www.ncbi.nlm.nih.gov/data-hub/genome/GCA_022316695.1/)[13],拟南芥IDD基因家族氨基酸序列及核苷酸序列下载自TAIR数据库(https://www.arabidopsis.org)。
供试试剂:TRIZOL、Ex Taq、10×Ex Taq Buffer、dNTP Mixture、DH5a感受态细胞、pMD? 19-T Vector Cloning Kit,PrimeScriptTM IV 1st strand cDNA Synthesis Mix购买自TaKaRa宝生物工程(大连)有限公司。
1.2 方法
1.2.1 油茶IDD基因家族成员鉴定 在TAIR(https://www.arabidopsis.org)数据库中下载拟南芥IDD基因家族16个成员的氨基酸序列,建立本地种子序列数据库,利用BLAST软件将拟南芥IDD基因家族氨基酸序列与油茶蛋白质组序列数据库进行比对。筛选后的油茶蛋白质序列在NCBI数据库中进行blastp并分析其结构域,将未含有C2H2结构域的蛋白质剔除。同时将获得的氨基酸序列比对到油茶的转录组数据库(https:// github. com/Hengfu-Yin/CON_genome_data)和基因组数据库,获得转录本序列和基因组序列用于后续分析。
候选的家族成员通过ExPASy(https://web. expasy.org/protparam/)数据库中的ProtParam工具,对CoIDD4蛋白的氨基酸大小、分子質量、等电点基本信息进行分析,并通过Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)进行亚细胞定位预测,若蛋白定位于细胞核内,则通过NoD(http://www.compbio.dundee.ac.uk/ www-nod/form_action_seqInput.jsp)预测分析其核定位序列。
1.2.2 油茶IDD基因家族系统发育树构建 利用MEGA 9软件将拟南芥和油茶IDD基因家族成员cDNA序列和氨基酸序列进行多重比对,并通过邻接法(neighbor-Joining, NJ)构建系统发育树,设置Bootstrap值为1000。
1.2.3 油茶IDD基因家族保守结构域(motif)分析 保守结构域是蛋白质中能够折叠成特定三维结构的一段相对区域,其结构亚单位称为基序(Motif),蕴含了各自的遗传进化信息。利用MEGA 9软件将拟南芥和油茶IDD基因家族氨基酸序列进行多重比对,通过MEME(http://meme- suite.org/tools/ meme)在线软件对拟南芥与油茶IDD基因家族序列进行motif搜索,设置分析motif数值为10,并绘制相应保守域结构的logo图。
1.2.4 油茶IDD4蛋白结构预测分析及系统发育分析 通过Phyre2(http://www.sbg.bio.ic.ac.uk/ phyre2/html/help.cgi?id=help/faq)在线软件预测分析拟南芥AtIDD4/5/6蛋白和油茶CoIDD4蛋白的三级结构,以此分析其蛋白质的三维结构。将CoIDD4基因在NCBI数据库中进行BLAST分析,选取同源性较高的序列进行系统发育分析,利用MEGA中的NJ法构建系统发育树,Bootstrap值设为1000。
1.2.5 油茶IDD4基因启动子顺式作用元件分析及功能预测 根据油茶全基因组序列信息,利用TBtools提取CoIDD4基因序列上游长度为2 kb的启动子序列,并将其上传到PlantCARE(http:// bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行预测分析。
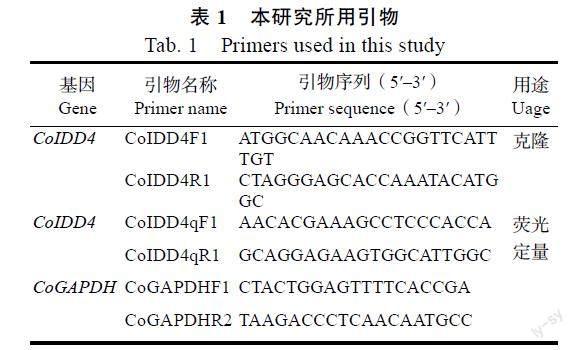
1.2.6 油茶IDD4基因ORF克隆及表达模式分析 将筛选得到的拟南芥AtIDD4/5/6基因的同源基因CoIDD4的氨基酸比对到油茶的转录组数据中,通过NCBI数据库在线工具ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)对该序列进行开放阅读框(ORF)预测,并通过Primer 5软件设计扩增全长的引物(表1)。利用TRIZOL提取油茶叶片总RNA,通过NanoDrop 2000测定RNA浓度和纯度,合格样品利用PrimeScriptTM IV 1st strand cDNA Synthesis Mix反转录合成第一链cDNA,以此为模板扩增CoIDD4基因的全长片段。扩增产物连接到pMD 19-T载体后转化大肠杆菌DH5a感受态细胞,挑取阳性克隆子送昆明擎科生物有限公司测序,将插入片段正确的阳性克隆保存于–80 ℃超低温冰箱。
提取油茶植株的叶、花、果实和根系组织总RNA并反转录合成cDNA,以油茶3-磷酸甘油醛脱氢酶基因(GAPDH)为内参[14],通过qPCR检测CoIDD4基因在油茶不同组织内的表达模式。
2 结果与分析
2.1 油茶IDD基因家族成员鉴定及系统发育分析
利用拟南芥IDDs基因的氨基酸序列在油茶蛋白组数据库初步筛选出35条候选序列,通过NCBI数据库进行blastp分析去除不含C2H2结构域的序列后,最终获得29个油茶IDD基因家族成员,暂命名为CoIDD1~29(表2)。CoIDD基因家族29个成员的理化性质分析表明,29个IDD家族成员编码氨基酸长度在280~570个之间,氨基酸长度存在较大的变化;相对分子质量介于32027.26~63201.23 Da之间;等电点(pI)介于5.44~9.52之间,其中pI<7的酸性氨基酸有4个;pI>7的碱性氨基酸有25个;不稳定系数介于37.23~69.44之间,有1个成员不稳定系数小于40,属于稳定蛋白,其余成员均属于不稳定蛋白;29个CoIDD家族成员的平均亲水系数均小于0,属于亲水性蛋白,且亚细胞定位均位于细胞核内。
采用邻接构建的拟南芥和油茶的IDD基因家族氨基酸序列的系统发育树共分为4个进化支(图1)。第Ⅰ进化支由CoIDD23/24/26/28/29五个成员组成,第Ⅱ进化支由CoIDD5/19/21/22/27五个成员组成,前2个分支首先从IDD基因家族中分离出来,主要由油茶IDD家族成员组成,不含有拟南芥IDD家族成员,因此属于油茶中特有的IDD蛋白。由拟南芥AtIDD14/15/16和油茶CoIDD14/15五个成员共同组成了第Ⅲ进化支,进化距离较近。第Ⅳ分支由众多拟南芥AtIDDs蛋白和油茶CoIDDs蛋白共同组成,其中CoIDD6/7/17/18在该分支中更早的被分离出来,CoIDD4与AtIDD4/5/6处于同一进化亚支内,亲缘关系较近。由此可见,油茶中存在与拟南芥IDD蛋白进化距离较近的同源IDD蛋白,同时CoIDD蛋白与AtIDD蛋白也显示了较为明显的分化。
2.2 油茶IDD基因家族保守结构域分析
通过MEME软件分析IDD家族蛋白质的保守结构域的结果表明,油茶CoIDD蛋白与拟南芥AtIDD蛋白存在相似的保守结构域。AtIDD基因所包含保守的ID-domain区域,含有一组4个串联的锌指结构(ZF1~4)[15]。在CoIDD蛋白的10个保守motif中,motif 1(RFVCEICNKGFQRDQ NLQLHRRGHNLPWK)最为保守(每个Motif中不同位置处出现的氨基酸种类越少,说明该位置处保守性越高),该motif为IDD家族第1个锌指结构ZF1;motif 2(YAVQSDWKAHSKTCGTR EYRCD)为IDD家族第3个锌指结构ZF3;motif 3(CVHHDPSRALGDLTGIKKHFCRKHGEKKW)为IDD家族第2个锌指结构ZF2;motif 4为IDD家族第4个锌指结构ZF4(图2)。
油茶和拟南芥IDD蛋白的保守结构域联合分析结果表明,拟南芥和油茶IDD蛋白结构域特征分化与共同构建的系统发育树总体趋势相吻合(图3)。motif 1~4代表了IDD家族中4个串联的锌指结构(ZF1~4)为最保守的结构,在油茶和拟南芥IDD蛋白中保守存在(图4)。
位于系统发育树第Ⅲ进化支的拟南芥AtIDD14/15/16和油茶CoIDD14/15特异存在motif 10(RQ IEJAELEFANAKRIRQQAQAELEKAQALKEQATKKISSTIMQITCHSO);位于第Ⅰ~Ⅱ进化支内的成员缺少了motif 5(GNPDPDAEVIALSPKTLMA TN)和mtif 9(GGGNDGLTRDF LGVG),这些亲缘关系较近的蛋白中特异性存在或缺失的区段可能行使着特殊且重要的生物学功能。
2.3 CoIDD4理化性质及结构分析
拟南芥AtIDD4/5/6在拟南芥生长发育中扮演着重要的角色,通过系统发育和motif分析,在油茶中鉴定到1个AtIDD4/5/6的同源基因,命名为CoIDD4。CoIDD4与AtIDD4/5/6存在高度相似的保守结构域(图3,图4)。通过ORF finder搜索发现CoIDD4的全长ORF框包含1620 bp碱基,编码539个氨基酸,与AtIDD4/5/6相似,该蛋白属于碱性不稳定亲水性蛋白质,且亚细胞定位均位于细胞核内(表3)。
通过Phyre2软件分析AtIDD4/5/6和CoIDD4的二级结构,结果表明CoIDD4和AtIDD4/5/6拥有相似的二级结构,主要由无规则卷曲(random coil)、α-螺旋(α-helix)和β-折叠(β-strand)构成,无转角结构。Phyre2预测的三级结构模型与二级结构相吻合(图5)。
通过Plant-mPLoc软件分析显示CoIDD4和AtIDD4/5/6亚细胞定位均位于细胞核内。通过NoD分析核定位序列,结果表明,CoIDD4的N端具有核定位信号(nuclear localization signal,NLS),其序列预测可信度最高的2条序列分别为HRRGHNLPWKLKQKNTKEVVKRKVYLC(可信度为0.85)和DLTGIKKHFFRKHGEKKYKCEKCS KKYAVQSDWK(可信度为0.90)。而AtIDD4/5/6在靠近N端的一个核定位为KKKR或者KRKR,但该核定位信号在CoIDD4中并未完全吻合(图6)。
2.4 CoIDD4系统发育分析
CoIDD4基因及其同源性较高的序列的系统发育分析结果显示(图7),用于构建系统发育树的物种氨基酸序列共分为两大进化支,CoIDD4与山茶(Camellia sinensis)IDD5以100的自展支持率具为第一进化支内的一个小分支内,证实CoIDD4与CsIDD5具有高度的同源性。CoIDD4与毛果杨(Populus trichocarpa)、可可树(Theobroma cacao)、麻风树(Jatropha curcas)、橡胶树(Hevea brasiliensis)、木薯(Manihot esculenta)和荷花(Nelumbo nucifera)的IDD5基因共聚为第一进化支内,具有一定的亲缘关系。另外,芒果(Mangifera indica)、开心果(Pistacia vera)、蓖麻(Ricinus communis)和榴莲(Durio zibethinus)的IDD5基因与花生(Arachis hypogaea)的IDD4基因共同聚为第二进化支,与CoIDD4亲缘关系较远。
2.5 CoIDD4基因启动子顺式作用元件分析
对CoIDD4起始密码子上游2000 bp的启动子区域序列进行顺式作用元件分析,结果发现,CoIDD4启动子区包括13种类型的顺式作用元件,其中CAAT-box和TATA-box两类核心顺式作用元件所占比例最大,其余順式作用元件按功能可分为植物激素响应元件、光响应元件和防御响应元件几大类。其中光响应元件所占比例最大,如G-box、GT1-motif、TCCC-motif、GTGGC-motif和3-AF1 binding site等。另外植物激素响应元件也占有较大的比例,如参与脱落酸(ABA)响应的ABRE元件,参与赤霉素(GA)响应的TATC-box元件,参与水杨酸(SA)响应的TCA-element元件和参与生长素(IAA)响应的TGA-element元件(图8)。上述研究结果表明,CoIDD4存在调节光信号通路和植物激素信号通路的潜能,推测CoIDD4基因发挥着和AtIDD4相似的生物学功能,即通过调控植物内源激素信号转导通路进而调控油茶的基础免疫反应。
2.6 CoIDD4基因克隆及表达分析
通过RT-PCR分别从油茶的叶片组织中扩增到CoIDD4基因ORF框的全长编码序列,经TA克隆测序后各获得一条1620 bp的特异性片段(图9)。将该序列在油茶基因组内进行BLAST分析,结果显示,该基因为油茶CON1个体12号染色体的一段基因(CM039316.1)。在全长转录组中比对到一条mRNA链(47 367 005~47 370 434 bp)(genemark-HiC_scaffold_12-processed-gene-473.55- mRNA-1),包括2个外显子(exon),其中exon1为47 370 076~473 704 34 bp,exon2为47 367 005~ 47 368 265 bp;存在2个蛋白编码区(CDS);其中CDS1包括47 370 076~47 370 434 bp,CDS2包括47 367 005~47 368 265 bp。
采用RT-qPCR分析CoIDD4基因的组织表达情况,结果表明,在内参基因表达量较一致的情况下,CoIDD4基因在油茶的各个组织中均有表达,且在叶片及花组织中表达量较高,而在根、茎及果组织中表达量较微弱(图10)。推测CoIDD4基因在油茶叶片和花器官中发挥重要的作用。
3 讨论
本研究通过拟南芥IDD基因家族保守结构域,在油茶全基因组范围内鉴定了29个油茶IDD基因家族成员,同时通过RT-PCR克隆了与AtIDD4/5/6亲缘关系较近的CoIDD4基因,分析其理化性质、结构和表达模式,以期为油茶的良种选育及抗性研究提供理论基础。
作为植物中C2H2家族的一个亚家族成员,IDD基因家族已经在多个物种中被鉴定,且启动子区富含与植物激素响应与逆境和抗性响应相关的顺式作用元件,在调控植物生长发育和基础免疫反应中具有重要的作用[6, 9, 15-17]。在油茶中还尚未见IDD基因家族的报道,基于油茶全基因组数据和前人对IDD基因家族的研究结果,本研究在油茶中鉴定了29个IDD家族成员,相对于模式植物拟南芥中16个IDD家族成员,油茶IDD基因的数量出现了增加,这可能与油茶长期人工栽培进行品种杂交和长期适应外界环境有关。对CoIDD家族成员的鉴定主要依据其高度保守的基因结构域,通常认为AtIDD家族所包含保守的ID-domain区域,含有一组4个串联的锌指结构(ZF1-4)[14],在对拟南芥和油茶IDD家族成员保守结构域分析时发现,motif1-4所指代的ZF1-4在AtIDD和CoIDD均保守存在,这4个motif是参与DNA-蛋白质或蛋白质-蛋白质互作所必需的模块,能准确地识别靶标并进行转录调控。其他特殊的motif在不同的亚组中特异性存在或缺失是导致基因功能出现分化的原因,这些特殊的基序可能在转录因子调控下游靶标基因的过程中发挥着重要的作用。
根据油茶和拟南芥IDD家族共建的系统发育树,油茶的29个IDD基因家族成员大致分为5个亚组,除前2个亚组中不包含拟南芥IDD家族基因,其他每个亚族均含有拟南芥和油茶的IDD基因,揭示了大多数CoIDD基因与拟南芥AtIDD基因存在一定的进化保守性。通常而言,处于同一进化支的基因或蛋白,若相互存在较高的相似性序列,则可推测它们具有相似的生物学功能,因此,通过拟南芥和油茶IDD蛋白序列相似性预测和探讨油茶IDD蛋白的功能是基因功能研究的重要切入点。已有研究证明拟南芥AtIDD4/5/6可能与根系的发育和叶片极性有关,并参与DELLA相互作用从而调控GA信号转导通路[9],另一方面,V?LZ等[10]学者证实拟南芥idd4缺失突变对丁香假单孢菌(Pseudomonas syringae)抗性提高,转录组及染色质免疫共沉淀(chromatin immunoprecipitation assay,ChIP)提示IDD4作为SA的负调控因子,参与植物激素信号网络转导途径,作为基础免疫应答和病原相关分子特征激活植物的免疫反应。本研究克隆并鉴定到1个与AtIDD4/5/6亲缘关系较近的的CoIDD4基因,该基因与AtIDD4/5/6构成一小进化亚支,可能与AtIDD4/5/6具有相似的生物学功能。通过qRT-PCR发现CoIDD4基因主要在油茶的叶片组织和花器官中表达,这与AtIDD4/5/6的表达模式存在一定的相似性[7],推测CoIDD4与AtIDD4功能相似,通过介导内源植物激素信号转导通路参与油茶的基础免疫进程。
顺式作用元件是参与植物转录调控的重要分子开关,处于通路的上游转录因子通过靶向作用于下游基因启动子区的顺式作用元件,激活下游基因的表达,从而发揮下游基因的作用。本研究预测了CoIDD4基因起始密码子上游2 kb的启动子区域的顺式作用元件,一方面与光响应相关的作用元件反复出现多次,显示了CoIDD4在光响应过程中具有重要的作用;另一方面在该区域中还有一定数量的植物激素响应元件,包括响应GA、IAA、ABA和SA的作用元件,其中SA信号通路常被认为是植物免疫反应调节中重要的信号通路,植物受病原体攻击后,SA的合成加速,并在植物体内迅速积累,激活下游基因的表达进而引发植物的SAR反应[17],CoIDD4启动子区域中包括了参与SA响应的作用元件,表明CoIDD4可能参与SA信号转导通路,但CoIDD4是否参与SA积累或通过SA信号通路参与油茶免疫调控还有待进一步验证。
参考文献
[1] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1998, 49(3): 13.Editorial Committee of Flora of China, Chinese Academy of Sciences. Flora of China[M]. Beijing: Science Press, 1998, 49(3): 13. (in Chinese)
[2] HE X S, XU L C, PAN C, GONG C, WANG Y J, LIU X L, YU Y C. Drought resistance of Camellia oleifera under drought stress: changes in physiology and growth characteristic[J]. PLoS One, 2020, 15(7): e0235795.
[3] 陳福, 郭晓春, 刘倬志, 张林涛. 云南省油茶产业高质量发展探析[J]. 现代农业科技, 2020(12): 252-255.CHEN F, GUO X C, LIU Z Z, ZHANG L T. Analysis on high-quality development of Camellia oleifera industry in Yunnan province[J]. Modern Agricultural Science and Technology, 2020(12): 252-255. (in Chinese)
[4] 郑静楠, 鹿杉, 郑进烜. 云南省油茶产业发展现状与对策研究[J]. 林业调查规划, 2021, 46(2): 114-117.ZHENG J N, LU S, ZHENG J X. Development status and countermeasure of Camellia oleifera industry in Yunnan province[J]. Forest Inventory and Planning, 2021, 46(2): 114-117. (in Chinese)
[5] YOSHIDA H, HIRANO K, SATO T, MITSUDA N, NOMOTO M, MAEO K, KOKETSU E, MITANI R, KAWAMURA M, ISHIGURO S, TADA Y, OHME- TAKAGI M, MATSUOKA M, UEGUCHI-TANAKA M. DELLA protein functions as a transcriptional activator through the DNA binding of the indeterminate domain family proteins[J]. PNAS, 2014, 111(21): 7861-7866.
[6] SINGLETON W R. Inheritance of indeterminate growth in maize[J]. Journal of Heredity, 1946, 37(2): 61-64.
[7] 张喜贤. 拟南芥锌指蛋白AtIDD4在花丝伸长过程中的作用[D]. 昆明: 云南大学, 2014.ZHANG X X. The role of Arabidopsis zinc finger protein AtIDD4 in filament elongation[D]. Kunming: Yunnan University, 2014. (in Chinese)
[8] 乔菊香. 拟南芥转录因子AtIID5和AtIDD6在花丝伸长过程中的作用分析[D]. 昆明: 云南农业大学, 2019.QIAO J X. Functional analysis of Arabiddopsis transcription factor AtIDD5 and AtIDD6 in filament elongation[D]. Kunming: Yunnan Agricultural University, 2019. (in Chinese)
[9] COELHO C P, HUANG P, LEE D Y, Brutnell T P. Making roots, shoots, and seeds: IDD gene family diversification in plants[J]. Trends in Plant Science, 2018, 23(1): 66-78.
[10] V?LZ R, KIM S K, MI J N, RAWAT A A, VELUCHAMY A, MARIAPPAN K G, RAYAPURAM N, DAVIERE J M, ACHARD P, BLILOU I, AL-BABILI S, BENHAMED M, HIRT H. Indeterminate-domain 4 (IDD4) coordinates immune responses with plant-growth in Arabidopsis thaliana [J]. PLoS Pathogens, 2019, 15(1): 1007499.
[11] 陳骄羽. 毛竹IDD基因家族与笋芽发育的相关性研究[D]. 杭州: 浙江农林大学, 2020.CHEN J Y. The correlation between IDD gene family and development of shoot/bud in Phyllostachys edulis[D]. Hangzhou: Zhejiang Agriculture and Forestry University, 2020. (in Chinese)
[12] 段回春. 甘蓝型油菜IDD基因家族成员鉴定及Bna.A08IDD7a基因功能分析[D]. 重庆: 西南大学, 2020.DUAN H C. Genome-wide identification of the INDETERMINATE DOMAIN (IDD) gene family in rapeseed and gene function analysis of Bna. A08IDD7a[D]. Chongqing: Southwest University, 2020. (in Chinese)
[13] LIN P, WANG K L, WANG Y P, HU Z K, YAN C, HUANG H, MA X J, CAO Y Q, LONG W, LIU W X, LI X L, FAN Z Q, LI J Y, YE N, REN H D, YAO X H, YIN H F. The genome of oil-Camellia and population genomics analysis provide insights into seed oil domestication[J]. Genome Biology, 2022, 23(1): 14.
[14] SEKALSKA B, CIECHANOWICZ A, DOLEGOWSKA B, NARUSZEWICZ M. Optimized RT-PCR method for assaying expression of monocyte chemotactic protein type 1 (MCP-1) in rabbit aorta[J]. Biochemical Genetics, 2006, 44(3/4): 133-143.
[15] ENGLBRECHT C C, SCHOOF H, B?HM S. Conservation, diversification and expansion of C2H2 zinc finger proteins in the Arabidopsis thaliana genome[J]. BMC Genomics, 2004, 5(1): 39.
[16] 李云富, 王靜贤, 杜艳芳, 邹华文, 张祖新. 玉米开花期相关的Indeterminate domain (IDD)蛋白家族基因的鉴定[J]. 作物学报, 2019, 45(4): 499-507.LI Y F, WANG J X, DU Y F, ZOU H W, ZHANG Z X. Identification of Indeterminate domain protein family genes associated with flowering time in maize[J]. Acta Agronomica Sinica, 2019, 45(4): 499-507. (in Chinese)
[17] MOORE J W, LOAKE G J, SPOEL S H. Transcription dynamics in plant immunity[J]. Plant Cell, 2011, 23(8): 2809-2820.
