油棕果实发育和采后脂肪酸合成转录代谢差异分析
2024-03-10吴秋妃杨程张淑岩韦露冯美利李睿周丽霞曹红星
吴秋妃 杨程 张淑岩 韦露 冯美利 李睿 周丽霞 曹红星
摘 要:油棕(Elaeis guineensis Jacq.)是世界上生產效率最高的产油植物,果实发育是形成产量的基础,但采收24 h后会出现酸败现象,严重影响棕榈油品质,目前对果肉发育和采后的游离脂肪酸代谢物合成差异的关键调控基因及途径尚未明确。本研究以油棕果实为实验材料,果实取自授粉后95 d(MS1)﹑125 d(MS2)、185 d(MS3)、采收后24 h(MS4)、采收后36 h(MS5)5个时期。采用第二代高通量转录组学技术(RNA-Seq)和液相色谱串联质谱代谢组学技术(LC-MS/MS),对其发育和采后的果实进行转录组和代谢组测定与分析。结果表明:无籽种油棕在脂肪酸积累中后期不饱和脂肪酸显著高于饱和脂肪酸,在油棕果实发育过程中,LACS4、LACS4-X1、FATA、FATB、KASⅠ、KASⅡ、SAD1在果肉中高表达且与果肉中油酸、亚油酸、棕榈酸、棕榈油酸、硬脂酸、亚麻酸呈正相关关系,DGAT、PDAT在果肉中高表达且与上述6种脂肪酸含量呈负相关关系,说明上述酶基因的表达可能对油棕果实脂肪酸的合成和累积分别具有促进和抑制作用,推测LACS4、LACS4-X1、FATA、FATB、KASⅠ、KASⅡ、SAD1可能是不饱和脂肪酸含量较高的关键基因;在果实采后贮藏过程中,GDSL2、GDSL7、SAD2、LACS9酶基因和GDSL1、KAT分别与油酸呈极显著正、负相关关系,与棕榈酸、棕榈油酸、硬脂酸、亚油酸、亚麻酸呈负、正相关,推测在酸败过程GDSL2、GDSL7、SAD2、LACS9酶基因可能促进油酸生成,抑制棕榈酸、棕榈油酸、硬脂酸、亚油酸、亚麻酸合成,GDSL1、KAT酶基因反之,推测GDSL2、GDSL7、SAD2、LACS9可能是导致油棕采后酸败的关键基因。本研究结果旨在利用分子生物技术提升高不饱和脂肪酸含量和改变脂肪酸组成提供备选基因,为筛选高不饱和脂肪酸和耐贮藏的品种提供理论参考。
关键词:油棕;游离脂肪酸;合成;转录组学;代谢组学中图分类号:S565.9 文献标识码:A
Differential Analysis of Fatty Acid Synthesis, Transcriptional Metabolism During Fruit Development and Postharvest in Oil Palm
WU Qiufei, YANG Cheng, ZHANG Shuyan, WEI Lu, FENG Meili, LI Rui, ZHOU Lixia, CAO Hongxing*
Coconut Research Institute, Chinese Academy of Tropical Agricultural Sciences / Hainan Key Laboratory of Tropical Oil Crops Biology, Wenchang, Hainan 571339, China
Abstract: Oil Palm (Elaeis guineensis Jacq.) is the most efficient oil-producing plant in the world. Fruit development is the basis of yield formation, but rancidity occurs after 24 h of harvesting, which seriously affecting the quality of palm oil. At present, the key regulatory genes and pathways for the differences in the synthesis of free fatty acid metabolism in pulp development and postharvest fruits have not been identified. In this study, oil palm fruits were collected from 95 days (MS1), 125 days (MS2), 185 days (MS3), 24 h (MS4) and 36 h (MS5) after pollination. The second generation high-throughput transcriptomics (RNA-Seq) and liquid chromatography-tandem mass spectrometry (LC-MS/MS) were used to analyze the transcriptomes and metabolomes of the fruits during the development and postharvest storage. The unsaturated fat of oil palm was significantly higher than that of fatty acid during the middle and late stages of fatty acid accumulation, LACS4, LACS4-X1, FATA, FATB, KASⅠ, KASII, SAD1 were highly expressed in pulp and were positively correlated with oleic acid, linoleic acid, palmitic acid, palmitoleic acid acid, stearic acid and linolenic acid, DGAT and PDAT were over-expressed in the pulp and negatively correlated with the content of the six fatty acids, indicating that the expression of the above-mentioned genes may promote and inhibit the synthesis and accumulation of the fatty acids in oil palm fruit, respectively, suggesting that LACS4, LACS4-A1, FATA, FATB, KASⅠ, KASII and SAD1 may be the key genes with high content of unsaturated fat during postharvest storage. GDSL2, GDSL7, SAD2, LACS9 genes and GDSL1, KAT were positively and negatively correlated with oleic acid, and negatively and positively correlated with palmitic acid, palmitoleic acid acid, stearic acid, linoleic acid and linolenic acid, respectively, suggesting that GDSL2, GDSL7, SAD2 and LACS9 might promote oleic acid production and inhibit palmitic acid, palmitoleic acid acid, stearic acid, linoleic acid and linolenic acid production during rancidity, while GDSL1 and KAT might inhibit linolenic acid production, suggesting that GDSL2, GDSL7, SAD2 and LACS9 are the key genes causing oil palm rancidity after harvest. The aim of this study is to provide candidate genes for improving unsaturated fat content and altering fatty acid composition by using molecular biotechnology, and to provide theoretical reference for screening unsaturated fat and storability varieties.
Keywords: oil palm; free fatty acids; synthesis; transcriptomics; metabolomics
DOI: 10.3969/j.issn.1000-2561.2024.02.002
油棕是世界上产油效率最高的热带木本油料作物,其产油量可达9 t/hm2。在中国,油棕主要分布在海南、云南、广东等地区[1]。棕榈油是世界上生产、消费和贸易最大的植物油,可做食用油、高级人造奶油、肥皂、润滑油等,用途非常广泛[2]。油棕果实的中果皮积累的油脂高达90%[3]。棕榈油主要含棕榈酸、硬脂酸等饱和脂肪酸(saturated fatty acid, SFA)和油酸、亚油酸等不饱和脂肪酸(unsaturated fatty acid, UFA)。在油棕果实发育和成熟阶段,脂肪酶活性增加4100倍[4],果实采收后高脂肪酶活性促进释放游离脂肪酸(FFA),使油迅速酸化,油棕果穗采后24 h之内需加工处理,否则游离脂肪酸含量升高,引起棕榈油酸败,油品变差[5]。
目前已有研究表明,编码长链脂肪酰基辅酶A合成酶(long chain acyl-CoA synthetase, LACS)、脂酰-酰基载体蛋白硫酯酶(fatty acyl-ACP thioesterase, FAT)、β-酮酰ACP合酶(β-ketoacyl-ACP synthase, KAS)、二酰甘油乙酰转移酶(diacylglycerol acyltransferase, DGAT)、磷脂二酰甘油酰基转移酶(phospholipid diac ylglycerol acyltransferase, PDAT)、硬脂酰-酰基载体蛋白脱饱和酶基因(stearoyl-ACP desaturase, SAD)、GDSL脂肪酶(GDSL esterase/lipase, GDSL)、3-酮脂酰辅酶A硫解酶(3-ketoacyl-CoAthiolase, KAT)等基因调控脂肪酸合成。LACS在脂质合成和降解过程中发挥关键作用[6],EgLACS4、EgLACS9与油棕油脂代谢有关[7];FAT分为FATA和FATB两类,在脂肪从头合成途径发挥重要作用,AtFATB在SFA合成中至关重要[8],而AtFATA把油酸从ACP载体上水解成游离脂肪酸,催化质体中脂肪酸的生物合成过程中硬脂酸和油酸的形成[9],EgFATB基因的表达促进油棕果肉中游离脂肪酸的生物合成[10];KAS是启动脂肪酸合成的关键酶,KASⅡ酶催化C16:0-ACP转化为C18:0-ACP,决定C16和C18脂肪酸比例。DGAT是甘油三酯合成途径中的限速酶,对植物甘油三酯和脂肪酸的积累至关重要[11];PDAT是植物三酰甘油(TAG)合成的关键酶。大多数植物质体中合成的脂肪酸主要是油酸[12],重组油棕中果皮的油脂合成中,EgDGAT和EgPDAT功能相似,且发挥重要作用[13];参与糖酵解、三羧酸循环和脂肪酸生物合成途径的EgKASI、EgKAS基因在高产油棕中表达上调[14];油料作物脂肪酸合成與代谢机制研究,可提高油料作物的含油量、品质和提取重要的脂肪酸代谢物[15];饱和脂肪酸所占比例的提高是由于不饱和脂肪酸减少所致[16];KAT在脂肪酸合成和分解代谢中起至关重要的作用,是脂肪酸β-氧化的最后一步;通过分子育种或基因工程的手段下调AtGDSL酶基因家族的表达可提高油料作物种子油脂含量[17]。EgSAD1促进油酸的合成[18],EgSAD1可能催化棕榈酸转化为不饱和脂肪;随着果实成熟,油棕不饱和脂肪酸含量升高,饱和脂肪酸含量下降,更高的C18:C16水平和更高的去饱和脂肪酸是通过降低“坏脂质”饱和棕榈酸(C16:0)水平获得更健康棕榈油的2个关键育种目标[19];油棕油酸含量与棕榈酸呈极显著负相关,预示着棕榈酸含量的下降可能会促使油酸含量的升高[20]。
不同类型油棕的不饱和脂肪酸含量差异显著,实验室前期研究结果显示无籽型油棕不饱和脂肪酸高达70%。目前,关于油棕脂肪酸的变化与不同发育时期的关系及调控其脂肪酸合成的关键基因的研究较少,当前研究主要集中在自然发育阶段[21-22],且油棕脂肪酸代谢相关的研究多集中在脂肪酸种类组成和关键基因的表达调控上,而果实发育及采后贮藏过程中关键酶基因与游离脂肪酸含量的关系的研究鲜有报道。本研究采用转录代谢联合分析油棕果实发育和采后贮藏过程中游离脂肪酸代谢物的差异变化和差异基因,初步确定油棕果实中调控游离脂肪酸合成的关键候选基因,为筛选高不饱和脂肪酸和抗酸败的品种提供理论参考,也可作为油脂品质遗传改良的优异靶标。
1 材料与方法
1.1 材料
供试材料为无籽型油棕果实,采自海南省文昌市中国热带农业科学院椰子研究所基地。选取3个自然发育时期[授粉后95 d(脂肪酸积累初期,MS1)、125 d(脂肪酸积累迅速增长期,MS2)和185 d(脂肪酸积累稳定期即采后0 h,MS3)]和2个采后贮存时期[采后24 h(MS4)、采后36 h(MS5)]的样品,每个样品3个生物学重复。将采集的样品立刻置于液氮中冷却,并保存于?80 ℃冰箱中备用。
1.2 方法
1.2.1 脂质和酸败代谢组的测定及分析 参照张淑岩等[10]的方法,获得不同样本的质谱分析数据后,对其进行定性和定量分析。通过正交偏最小二乘法判别分析和差异倍数值相结合的方法筛选组间差异代谢物。对各游离脂肪酸代谢物含量归一化处理,并进行聚类热图分析,得到各种代谢物含量的变化趋势。
1.2.2 总RNA提取及高通量测序 使用植物总RNA提取试剂盒提取油棕RNA。对构建好的测序文库进行质检,库检合格后,用Illumina HiSeq平台进行测序。
1.2.3 转录组数据分析及差异表达基因分析 使用HISAT2将原始序列与参考基因组进行比对,采用DESeq 2软件包分析差异表达基因(differentially expressed genes, DEGs),筛选阀值为错误发现率(false discovery rate, FDR)<0.05且|log2Fold Change|≥1。对筛选出的差异表达基因进行KEGG生物途径显著性富集分析。
1.2.4 转录组学和代谢组学联合分析 京都基因与基因组百科全书(KEGG)既是系统分析基因功能的数据库,也是系统分析代谢功能的数据库。将获得的差异基因及代谢物同时映射到KEGG通路上,利用基因和代谢物在所有样本中的定量值进行相关性分析,选取相关性系数≥0.7的差异基因和差异代谢物用于后续分析。通过KEGG富集通路找到关键的候选基因并通过NCBI(https://www.ncbi.nlm.nih.gov/)数据库对酶基因进行注释。
1.3 数据处理
使用SPSS 20.0软件对数据进行单因素方差分析(ANOVA)和差异显著性检验(Duncans法)。
2 结果与分析
2.1 油棕果肉的游离脂肪酸合成和酸败分析
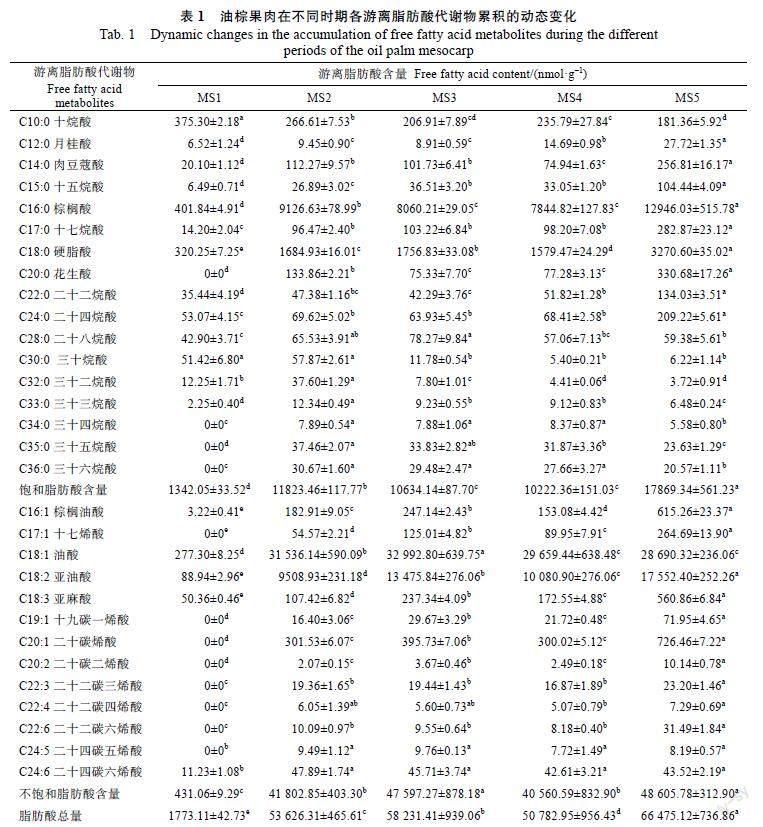
2.1.1 油棕游离脂肪酸含量在不同发育时期的动态分析 由表1可知,油棕果中游离脂肪酸代谢物主要是由棕榈酸(palmitic acid,C16:0)、硬脂酸(stearic acid,C18:0)等17种饱和脂肪酸和棕榈油酸(palmitoleic acid,C16:1)、油酸(oleic acid,C18:1)、亚油酸(linoleic acid,C18:2)等13种不饱和脂肪酸组成。在油棕果肉生长发育过程中,脂肪酸积累初期,即MS1期,主要以饱和脂肪酸(SFA)为主,占总脂肪酸的75.69%;脂肪酸积累中后期(MS3期),不饱和脂肪酸(UFA)为主要的脂肪酸类型,占总脂肪酸的81.74%;MS3~MS5不饱和脂肪酸占总脂肪酸比例呈下降趋势,其中MS5期时,该比值下降至73.12%,而饱和脂肪酸,在MS5时期上升至26.88%(图1A)。在MS1~MS3时期,UFA/SFA呈上升趋势,于MS3时期达到最高值4.48,MS4~MS5时期,UFA/SFA呈下降趋势,在MS5期为2.72(图1B)。游离脂肪酸总含量及UFA总含量在MS1~MS3阶段逐渐增加,而在MS4阶段呈现下降趋势,而在MS5阶段又急剧升高,分别达到66 475.12 nmol/g和48 605.78 nmol/g。SFA含量在MS2时期先显著增加后缓慢降低,而在MS5阶段又上升至17 869.34 nmol/g(图1C)。油酸、亚油酸、硬脂酸在MS1~MS3阶段含量显著升高,其中,油酸含量在MS4~MS5时期均减少,而亚油酸与硬脂酸含量在MS4阶段减少,却在MS5阶段显著增加。棕榈酸含量在MS1~MS2时期增加,MS3~MS4时期减少,而MS5时期其含量又增加(图1D)。
2.1.2 油棕果肉不同发育和酸败时期的游离脂肪酸代谢物差异分析 将油棕果实MS1~MS5时期进行两两比较,得到不同分组间游离脂肪酸代谢物的变化(图2A)。MS1与MS2~MS5的两两比较中,上调的差异代谢物分别为24、23、23、25个,下调的差异代谢物分别为0、1、2、1个;MS2与MS3~MS5的比较中上调的差异代谢物分别是2、0、14个,而下调的差异代谢物分别为2、2、2个;MS3与MS4、MS5的比较显示上调差异代谢物为0、13个,下调的分别有1、1个;MS4 vs MS5显示有且仅有13个上调的差异代谢物。通过韦恩图分析发现,MS1 vs MS4与MS1 vsMS5存在差异代谢物最多,为24个;MS1 vs MS4与MS2 vs MS5存在13个差异代谢物;MS1 vs MS4与MS3 vs MS5存在11个差异代谢物;MS3 vs MS4与MS4 vs MS5存在12个差异代谢物;MS1 vs MS5与MS2 vs MS5存在14个差异代谢物;MS1 vs MS5和MS3 vs MS5存在12个差异代谢物;MS2 vs MS5和MS3 vs MS5存在14个差异代谢物(图2B)。
对油棕果肉MS1~MS5时期的各游离脂肪酸代谢物的含量进行聚类分析,结果显示,经过Z-score归一化处理的30种游离脂肪酸被分为2组。在第1组(Group 1)中,3种游离脂肪酸在MS1~MS5的變化呈下降趋势,即在MS1和MS2时期的含量较高,而MS5时期含量最低。第2组(Group 2)27种游离脂肪酸含量在MS1~MS5时期总体呈现上升趋势,其中,MS1时期含量最低,而MS5时期达最高值(图3)。由此可知,MS4为游离脂肪酸降解稳定时期,MS5为游离脂肪酸快速降解时期,判别依据为油酸、亚油酸、亚麻酸、棕榈酸、硬脂酸、棕榈油酸的含量变化。
2.2 不同发育阶段的显著差异表达基因分析
将MS1~MS5时期的转录组文库的原始Reads进行数据过滤、比对和拼接以及将样品进行两两分组比较,依据筛选标准,分别得到显著上调和下调的DEGs。如图4所示,MS1与MS2~MS5、MS2与MS3~MS5、MS3与MS4~MS4及MS4 vs MS5的比较结果表明,上调DEGs分别为:2681、3046、3128、3580、1982、2387、

图4 油棕果肉不同时期的差异基因统计
Fig. 4 Differential gene statistics of oil palm pulp in different periods
2902、858、1397、876个;下调DEGs分别为:3584、4110、5243、5254、2299、4347、4269、2487、2476、389个(图4A)。随着果肉的成熟,DEGs数量先上升再下降且表达下调基因的占比逐渐增加;随着果实的酸败时间增加,表达下调的DEGs数量增加,且下调的基因数量始终大于上调基因的数量,说明大部分基因的表达呈现下降趋势。根据上述两两分组比较的结果绘制韦恩图(图4B),结果显示,在MS1~MS5时期各分组间共同存在1710个DEGs。
2.3 代谢组学和转录组学关联分析
采用KEGG联合分析脂肪酸代谢组及转录组数据,结果显示,30种游离脂肪酸中,有17种存在显著差异,这些脂肪酸分别注释到脂肪酸代谢、亚油酸代谢、脂肪酸降解、脂肪酸生物合
成及不饱和脂肪酸的生物合成等代谢通路上。其中,棕榈油酸、油酸、棕榈酸等6种游离脂肪酸注释到脂肪酸生物合成途径中,脂肪酸代谢和脂肪酸降解途径中仅发现棕榈酸这一类脂肪酸。不饱和脂肪酸的生物合成途径相关的游离脂肪酸包括油酸、亚油酸等6种UFA与棕榈酸、硬脂酸等5种SFA。通过比较差异表达基因的代谢途径,脂肪酸生物合成途径中富集了57个显著差异表达基因,脂肪酸代谢途径中富集了71个显著差异表达基因,脂肪酸降解途径中富集了50个显著差异表达基因,亚麻酸代谢途径中富集了59个显著差异表达基因(图5)。从脂肪酸生物合成、脂肪酸代谢、脂肪酸降解、不饱和脂肪酸生物合成、α-亚麻酸代谢5条途径上共99个显著差异表达基因,挑选了32个显著差异基因用于后续分析。
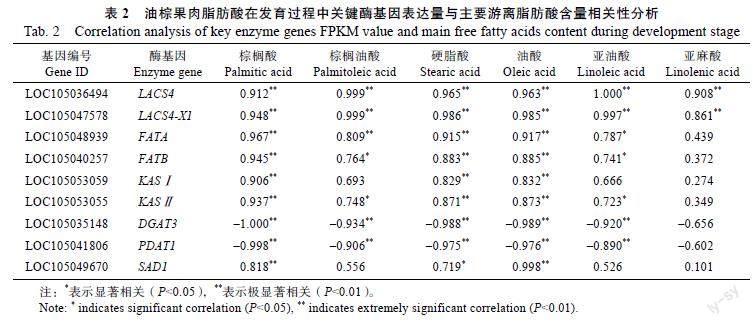
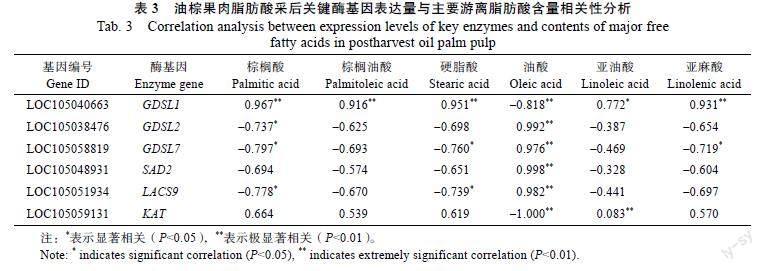
根据32个显著差异表达基因的Nr注释结果发现,油棕果MS1~MS5过程中高表达量的酶基因有LACS、FAT、KAS、DGAT、PDAT、SAD、GDSL、KAT。从15个关键基因表达量动态变化可知,在MS1~MS3时期,LACS4、LACS4-X1酶基因表达量的变化趋势基本一致,均在MS3时期高表达;FATA、FATB、KASⅠ、KASⅡ、SAD1酶基因表达先上调后下调,最高表达出现在MS2时期;DGAT、PDAT表达量变化趋势呈先降低后升高,在MS1时期最高,MS2时期最低。在MS3~MS5阶段,随着采后储藏时间延长,GDSL2、GDSL7基因表达量降低,MS5时期达到最低,GDSL1、KAT基因的表达与之相反;LACS9、SAD2基因在MS3期表达显著上调,在MS4时期后表达显著下调(图6~图8)。
将15个酶基因与筛选到的差异代谢物进行相关性分析(表2和表3),结果表明,15个关键酶基因的表达量与油棕果实的6种主要游离脂肪酸含量呈显著相关性。在MS1~MS3时期,LACS4、LACS4-X1、FATA、FATB、KASⅠ、KASⅡ、SAD1的表达与油酸、亚油酸、棕榈油酸、棕榈酸、硬脂酸、亚麻酸含量呈显著正相关,即这7个酶基因的表达对油棕果实脂肪酸的合成和累积具有促进作用;DGAT、PDAT的表达与之相反,起到抑制作用。在MS3~MS5时期,GDSL1、KAT酶基因在油棕果实中高表达,与棕榈酸、棕榈油酸、硬脂酸、亚油酸及亚麻酸这5种脂肪酸含量呈正相关,与油酸呈显著负相关;GDSL2、GDSL7、SAD2、LACS9表达与上述5种脂肪酸含量呈负相关,与油酸呈极显著正相关。说明GDSL1、KAT的表达对这5种游离脂肪酸合成具有促进作用,对油酸合成具有抑制作用;而GDSL2、GDSL7、SAD2、LACS9的表达抑制5种游离脂肪酸积累,而促进油酸合成。
3 讨论
油棕含油量与脂肪酸代谢相关酶基因表达水平有关[12]。油棕果实收获后,高活性的脂肪酶会导致果肉产生大量游离脂肪酸,当游离脂肪酸含量大于5%时,将严重影响商品油的质量[8]。本研究中,在自然发育过程中,不饱和脂肪酸占比呈
上升趋势,采后储藏过程中,不饱和脂肪酸占总脂肪酸含量比呈下降趋势,可能是在油棕果实贮藏过程中脂质在脂肪酶的催化作用下发生水解反应,游离脂肪酸发生降解,转化为其他物质。
UFA/SFA在自然发育时期呈上升趋势,酸败过程中,SFA与UFA总量在采后24 h降到最低,而在采后36 h时升高且高于刚采收时,推测24 h为油棕氧化酸败的临界点,需要后期实验进一步验证。
前人研究发现BnLACS4与AtLACS9参与甘蓝型油菜及拟南芥种子脂质生物合成[23-24]。本研究表明LACS4、LACS4-X1表达量与油棕果实成熟度密切相关,LACS4正向调控6种游离脂肪酸合成。LACS9对6种游离脂肪酸的调控表现出多效性,即高表达LACS9促进油酸合成,而抑制其他5种游离脂肪酸的合成。TcFATA和TcFATB1表达量与可可果实中的油酸及棕榈酸含量呈正相关[25],而干扰拟南芥AtFATB1基因的表达,会降低棕榈酸和总饱和脂肪酸的含量[8],本研究与前人研究结果一致,即LACS9表达高,油酸含量也增加;FATA和FATB表达量变化趋势与棕榈酸和总饱和脂肪酸含量变化趋势相同,说明FATA和FATA可能是调控棕榈酸和总饱和脂肪的关键酶基因。KASⅡ在许多植物中被证实能催化C16脂肪酸延长,生成了C18脂肪酸,进而促进不同脂肪酸之间的转换。在拟南芥、烟草、大豆中过表达KASⅡ基因,可以显著提高硬脂酸、油酸、亚麻酸含量,降低棕榈酸含量[26-27],本研究结果与前人研究大体一样,说明KAS酶将油棕脂肪酸C16催化为C18。AsPDAT和AsDGAT共同调控白沙蒿种子TAG的合成,过表达的DGAT2、PDAT促进亚油酸的积累[28]。本研究结果显示,随着果实成熟,不饱和脂肪酸含量升高,饱和脂肪酸含量下降。DGAT、PDAT表达量随着油棕果实成熟而下降,与6个游离脂肪酸呈负相关,这与前人报道的不同,表明DGAT、PDAT在油棕中具有与其他物种不同的调控模式。SAD在调控植物油脂中饱和脂肪酸与不饱和脂肪酸的比例中发挥重要作用[29],提高SAD基因表达水平,可增加油酸含量[30]。本研究中,自然发育过程中SAD1随着果实成熟表达量上升,不饱和脂肪酸上升,饱和脂肪酸下降,棕榈酸变化趋势相同,预示着SAD1可能催化棕榈酸转化为不饱和脂肪酸。随着采后时间增加,SAD2表达下调,联合代谢分析显示该基因与油酸呈显著正相关,说明SAD2低表达阻碍油棕果实油酸合成。GDSL基因能够分解油脂,通过提高其表达量可提高油料作物种子油脂含量[17, 31-32]。GDSL还参与小麦胚芽脂质水解酸败反应[33]。本研究中,GDSL1与油酸呈极显著负相关关系,即随着采后時间延长,其表达量上升,暗示GDSL1抑制油棕果实油酸氧化速率。本研究发现油棕GDSL家族中的GDSL1和GDSL2、GDSL7的作用不同,且GDSL1表达量明显高于GDSL2和GDSL7,这可能是导致采后油棕果实油酸下降的关键原因,预示同一家族基因可能存在不同的生物学功能。KAT基因编码分解硫解酶,在脂肪酸合成和分解代谢中起到至关重要的作用。研究发现,抑制金藻中KAT基因的表达量可提高其脂肪酸的含量[34]。本研究中,KAT随着采后时间增加,其表达量上升,而油酸含量下降,预示KAT是影响油棕果实采后油酸氧化的关键酶之一。
综上所述,推测LACS4、LACS4-X1、SAD1上调在果实发育过程中促进不饱和脂肪酸合成,DGAT、PDAT下调可能与不饱和脂肪酸积累密切相关,FAT和KAS基因家族促进脂肪酸积累;GDSL1、KAT可能是抑制油酸氧化的关键酶基因,LACS和SAD基因家族在油棕自然发育和采后贮藏中同时调控脂肪酸代谢。本研究筛选出的LACS4、LACS4-X1、SAD1、GDSL1、DGAT、PDAT有望作为油棕油脂品质遗传改良的关键候选基因,为培育高不饱和脂肪酸和抗酸败油棕品种提供理论基础。
参考文献
- 熊惠波, 李瑞, 李希娟, 范海阔, 马子龙. 油棕产业调查分析及中国发展油棕产业的建议[J]. 中国农学通报, 2009, 25(24): 114-117.XIONG H B, LI R, LI X J, FAN H K, MA Z L. Investigation analysis and the advice of palm industry in China[J]. Chinese Agricultural Science Bulletin, 2009, 25(24): 114-117. (in Chinese)
- SUNDRAM K, SAMBANTHAMURTH R, TAN Y A. Palm fruit chemistry and nutrition[J]. Asia Pacific Journal of Clinical Nutrition, 2003, 12(3): 355-362.
- DUSSERT S, GUERIN C, ANDERSSON M, FOT T, TRANBARGER T J, PIZOT M, SARAH G, OMORE A, DURAND-GASSELIN T, MORCILLO F. Comparative transcriptome analysis of three oil palm fruit and seed tissues that differ in oil content and fatty acid composition[J]. Plant Physiology, 2013, 162(3): 1337-1358.
- MORCILLO F, CROS D, BILLOTTE N, NGANDO-EBO NGUE G F, DOMONHEDO H, PIZOT M, CUELLAR T, ESPEOUT S, DHOUUIB R, BOURGIS F, CLAVEROL S, TRANBARGER T J, NOUY B, ARONDEL V. Improving palm oil quality through identification and mapping of the lipase gene causing oid deterioration[J]. Nature Communications, 2013, 4(1): 1-8.
- 雷新濤, 曹红星. 油棕[M]. 北京: 中国农业出版社, 2013.LEI X T, CAO H X. Oil palm[M]. Beijing: China Agricultural Press, 2013. (in Chinese)
- FULDA M, SHOCHEY J, WERBER M, WOLTER F P, HEINZ E. Two long-chain acyl-CoA synthetases from Arabidopsis thaliana involved in peroxisomal fatty acid beta-oxidation[J]. Plant, 2002, 32(1): 93-103.
- 陈红. 油棕长链脂肪酰基CoA合成酶(LACS)基因克隆及功能分析[D]. 海口: 海南大学, 2018.CHEN H. Cloning and functional analysis of long chain fatty acyl-CoA synthase (LACS) gene from oil palm[D]. Haikou: Hainan University, 2018. (in Chinese)
- BONAVENTURE G, SALAS J J, POLLARD M R, OHLROGGE J B. Disruption of the FATB gene in Arabidopsis demonstrates an essential role of saturated fatty acids in plant growth[J]. The Plant Cell, 2003, 15(4): 1020-1033.
- WANG Q, HUANG W D, JIANG Q, LIAN J P, SUN J L, XU H, ZHAO H X, LIU Z L. Lower levels of expression of FATA2 gene promote longer siliques with modified seed oil content in Arabidopsis thaliana[J]. Plant Molecular Biology Reporter, 2013, 31(6): 1368-1375.
- 张淑岩, 傅小鹏, 冯美利, 张安妮, 张为圣, 韦露, 杨其存, 曹红星. 油棕果肉和核仁游离脂肪酸合成的转录代谢差异机制分析[J/OL]. 分子植物育种: 1-12 [2023-12-29]. http://kns.cnki.net/kcms/detail/46.1068.S.20220916.1052.012.html.ZHANG S Y, FU X P , FENG M L, ZHANG A N, ZHANG W S, WEI L, YANG Q C, CAO H X. Analysis of the differential dechanism of transcription and metabolism in the synthesis of free fatty acid in the mesocarp and kernel of oil palm[J/OL]. Molecular Plant Breeding: 1-12 [2023-12-29]. http://kns.cnki.net/kcms/detail/46.1068.S.20220916.1052.012.html. (in Chinese)
- 郭宁馨, 张丽玲, 张雅坤, 葛星辰, 刘永琪, 任雪梅, 高建华, 韩渊怀. 谷子DGAT基因家族分析及基于WGCNA发掘甘油三酯合成与调控相关基因[J]. 山西农业大学学报(自然科学版), 2021, 41(5): 1-12.GUO N X, ZHANG L L, ZHANG Y K, GE X C, LIU Y Q, REN X M, GAO J H, HAN Y H. Analysis of millet DGAT gene family and discovery of genes related to triglyceride synthesis and its regulation based on WGCNA[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2021, 41(5): 1-12. (in Chinese)
- 石鹏, 曹红星, 金龙飞. 油棕分子育种[M]. 北京: 中国农业出版社, 2019.SHI P, CAO H X, JIN L F. Oil palm molecules[M]. Beijing: China Agricultural Press, 2019. (in Chinese)
[13] TRANBARGER T J, DUSSERT S, JOET T, ARGOUT X, SUMMO M, CHAMPON A, CROS D, OMORE A, NOUY B, MORCILLO F. Regulatory mechanisms underlying oil palm fruit mesocarp maturation, ripening, and functional specialization in lipid and carotenoid metabolism[J]. Plant Physiology, 2011, 156: 564-584
[14] WONG Y C, TEH H F, MEBUS K, OOI T E K, KWONG Q B, KOO K L, ONG C K, MAYES S, CHEW F T C, APPLETON D R, KULAVEERASINGAM H. Differential gene expression at different stages of mesocarp development in high and low-yielding oil palm[J]. BMC Genomics, 2017, 18(1): 1-13.
[15] 陳四龙. 花生油脂合成相关基因的鉴定与功能研究[D]. 北京: 中国农业科学院, 2012.CHEN S L. Identification and functional study of genes related to peanut oil synthesis[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012. (in Chinese)
[16] 韩立英. 高油玉米青贮中脂肪酸的降解与抑制[D]. 北京: 中国农业大学, 2014.HAN L Y. Degradation and inhibition of fatty acids in high oil corn silage[D]. Beijing: China Agricultural University, 2014. (in Chinese)
[17] CHEN M, DU X, ZHU Y, WANG Z, HUA S J, LI Z L, GUO W L, ZHANG G P, PENG J R, JIANG L X. Seed fatty acid reducer acts downstream of gibberellin signalling pathway to lower seed fatty acid storage in Arabidopsis[J]. Plant, Cell and Environment, 2012, 35(12): 2155-2169.
[18] GUERIN C, THIERRY J, SERRET J, LASHERMES P, VAISSAYRE V, AGBESSI M D T, THIERRY B, SEVE RAC D, AMBLARD P, TREGEAR J, TRISTAN D G, MORCILLO F, DUSSERT S. Gene coexpression network analysis of oil biosynthesis in an interspecific backcross of oil palm[J]. Plant Journal, 2016, 87(5): 423-441.
[19] JIN J J, SUN Y W, QU J, SYAH R, LIM C H, ALFIKO Y, RAHMAN N, SUWANTO A, YUE G, WONG L, CHUA N H, YE J. Transcriptome and functional analysis reveals hybrid vigor for oil biosynthesis in oil palm[J]. Scientific Reports, 2017, 7(1): 1-12.
[20] LI J, YANG Y D, SUN X W, LIU R, XIA W, SHI P, ZHOU L X, WANG Y, WU Y, LEI X T, XIAO Y. Development of intron polymorphism markers and their association with fatty acid component variation in oil palm[J]. Frontiers in Plant Science, 2022, 13: 885418.
[21] XIAO Y, XIA W, MASON A S, CAO Z Y, FAN H K, ZHANG B, ZHANG J L, MA Z L, PENG M, HUANG D Y. Genetic control of fatty acid composition in coconut (Cocos nucifera), African oil palm (Elaeis guineensis) and date palm (Phoenix dactylifera)[J]. Planta, 2018, 249(2): 333-350.
[22] XIA W, LUO T T, DOU Y J, ZHANG W, MASON A S, HUANG D Y, HUANG X L, TANG W Q, WANG J H, ZHANG C Y, XIAO Y. Identification and validation of candidate genes involved in fatty acid content in oil palm by genome-wide association analysis[J]. Frontiers in Plant Science, 2019, 10: 1263.
[23] TAN X L, ZHENG X F, ZHANG Z Y, WANG Z, XIA H C, LU C M, GU S L. Long-chain acyl-coenzyme a synthetase 4 (BnLACS4) gene from Brassica napus enhances yeast lipid contents[J]. Journal of Integrative Agriculture, 2014, 13(1): 54-62.
[24] KATAVIC V, SHI L, YU Y Y, ZHAO L F, HAUGHN G W, KUNSTL J. Investigation of the contribution of oil biosynthetic enzymes to seed oil content in Brassica napus and Arabidopsis thaliana[J]. Canadian Journal of Plant Science, 2014, 94(6): 1109-1112.
[25] 李付鹏, 邓云梅, 伍宝朵, 秦晓威, 闫林, 赖剑雄. 可可FAT基因家族进化及表达模式分析[J]. 热带作物学报, 2020, 41(5): 947-954.LI F P, DENG Y M, WU B D, QIN X W, YAN L, LAI J X. Analysis of coco FAT gene family evolution and expression pattern[J]. Chinses Journal of Tropical Crops, 2020, 41(5): 947-954. (in Chinese)
[26] 孙墨楠. 大豆GmKASⅡ家族基因的克隆及功能鉴定[D]. 长春: 吉林大学, 2022.SUN M N. Cloning and functional identification of GmKASII family genes in soybean[D]. Changchun: Jilin University, 2022. (in Chinese)
[27] 郝青婷. 陸地棉β-酮脂酰-ACP合成酶Ⅱ(KASⅡ)家族基因鉴定与功能分析[D]. 太原: 山西农业大学, 2018.HAO Q T. Identification and functional analysis of β-ketoacyl-ACP synthase II (KASII) family genes in upland cotton (Gossypium hirsutum L.)[D]. Taiyuan: Shanxi Agricultural University, 2018. (in Chinese)
[28] 南淑珍. 白沙蒿种子发育过程中脂质和生育酚积累及转录调控研究[D]. 兰州: 兰州大学, 2021.NAN S Z. Accumulation and transcriptional regulation of lipids and tocopherols in Artemisia sphaerocephala during seed development[D]. Lanzhou: Lanzhou University, 2021. (in Chinese)
[29] MCKEON T A, STUMPF P K. Purification and characterization of the stearoyl-acyl carrier protein desaturase and the acyl-acyl carrier protein thioesterase from maturing seeds of safflower[J]. Journal of Biological Chemistry, 1982, 257(20): 12141-12147.
[30] 黄春颖, 黄有军, 吴建峰, 黄仁, 栾雨濛, 张深梅, 王正加, 张启香, 黄坚钦. SAD和FAD家族基因调控山核桃不饱和脂肪酸组分配比[J]. 园艺学报, 2018, 45(2): 250-260.HUANG C Y, HUANG Y J, WU J F, HUANG R, LUAN Y M, ZHANG S M, WANG Z J, ZHANG Q X, HUANG J Q. SAD and FAD genes regulate the unsaturated fat distribution of hickory[J]. Journal of Horticulture, 2018, 45(2): 250-260. (in Chinese)
[31] MA R, YUAN H, AN J, HAO X Y, LI H B. A Gossypium hirsutum GDSL lipase/hydrolase gene (GhGLIP) appears to be involved in promoting seed growth in Arabidopsis[J]. PloS One, 2018, 13(4): e0195556.
[32] 李志蘭. 拟南芥与油菜GDSL类脂肪酶基因的insilico分析及其对种子油脂积累影响的研究[D]. 杭州: 浙江大学, 2014.LI Z L. In silicoanalysis of GDSL lipase like genes in Arabidopsis and rape and their effects on seed oil accumulatio[D]. Hangzhou: Zhejiang University, 2014. (in Chinese)
[33] 严永红, 郑召君, 李波, 李进伟. 小麦胚芽贮藏期内脂质水解酸败机理解析[J]. 中国油脂, 2021, 46(2): 41-47.YAN Y H, ZHENG Z J, LI B, LI J W. Mechanism of lipid hydrolysis and rancidity during wheat germ storage[J]. Chinese Oils, 2021, 46(2): 41-47. (in Chinese)
[34] 岳燕燕, 万文文, 梁科鹏, 黄一江, 田金虎, 陈计峦, 郑立, 郑明刚. 球等鞭金藻CCMM5001两种硫解酶基因对不同浓度生物素的响应表达[J]. 海洋湖沼通报, 2013(3): 89-94.YUE Y Y, WAN W W, LIANG K P, HUANG Y J, TIAN J H, CHEN J L, ZHENG L, ZHENG M G. Expression of two thiolases genes in isochrysis galbana CCMM5001 in response to different biotin concentrations[J]. Ocean and Marsh Bulletin, 2013(3): 89-94. (in Chinese)
