血小板与淋巴细胞比值检测在表皮生长因子受体突变型晚期非小细胞肺癌早期诊断和靶向治疗中的应用价值
2024-03-09陈文强
陈文强
(钦州市第一人民医院呼吸内科,广西 钦州 535099)
非小细胞肺癌(non-small cell lung cancer,NSCLC)是一种常见的恶性肿瘤疾病,多数患者确诊时已发展至晚期,无法得到及时治疗[1]。目前临床治疗表皮生长因子受体(EGFR)突变型晚期 NSCLC 主要采用 EGFR酪氨酸激酶抑制剂(EGFR-TKI)靶向治疗方式,但在预后评估方面还未形成统一标准[2]。小板与淋巴细胞比值(PLR)能够评估患者机体炎症情况,其水平升高往往说明患者预后并不理想[3]。该检测方式的获取样本的难度低、检测时间少、费用相对便宜,因此临床常用来诊断肺癌及评估预后[4]。基于此,本研究对PLR检测在EGFR 突变型晚期NSCLC早期诊断、靶向治疗中的应用价值进行探讨与分析,现报道如下。
1 资料与方法
1.1 一般资料回顾性选取2021年8月至2023年3月钦州市第一人民医院收治的120例EGFR突变型晚期NSCLC患者为观察组,选取同期入院的60例健康体检者为对照组。观察组研究对象中男性84例,女性36例;年龄50~80岁,平均年龄(69.67±4.74)岁。对照组研究对象中男性43例,女性17例;年龄52~85岁,平均年龄(70.34±4.52)岁。两组研究对象一般资料比较,差异无统计学意义(P>0.05),组间具有可比性。本研究经钦州市第一人民医院医学伦理委员会批准。观察组纳入标准:①符合《中华医学会肿瘤学分会肺癌临床诊疗指南(2019版)》[5]中的相关诊断标准;②临床资料完整无缺漏,此前没有实施过化疗、放疗;②体力状况评分(PS)[6]在0~2分之间。排除标准:①入组前出现全身性感染疾病或出血症状;②存在其他严重恶性肿瘤;③存在自身免疫性疾病。
1.2 治疗方法观察组研究对象采用靶向治疗:口服吉非替尼片(南京优科制药有限公司,国药准字号H20213070,规格:0.25 g×10片)或厄洛替尼片(南京优科制药有限公司,国药准字号 H20213492,规格:0.15 g×10片),1次/d、1片/次。患者出院后,每月进行随访以及门诊复查,随访时间截止为靶向治疗后6个月。
1.3 观察指标① PLR 水平。抽取研究对象空腹静脉血3 mL,采用全自动血细胞分析仪(深圳雷杜生命科学股份有限公司,粤械注准 201722221133,型号:Hemaray86)检测血小板计数、淋巴细胞计数,并计算两者比值。②PLR检测、肿瘤标志物、CT诊断的诊断效能。灵敏度=真阳性/(真阳性+假阴性)×100%;特异度=真阴性/(真阴性+假阳性)×100%。③临床病理指标。一般资料包括患者的吸烟史、肿瘤部位分型等;临床病理指标包括患者疾病的临床、T、N分期等,采用单因素分析法分析外周血PLR与EGFR突变型晚期NSCLC患者临床病理特征的关系。④疗效评价。按照《实体瘤疗效评价标准(RECIST)指南1.1版》进行评估[7],完全缓解:经检查确认患者体内无肿瘤残留;部分缓解:与治疗前相比,肿瘤最大直径的缩减幅度>1/2;病情稳定:治疗后患者肿瘤最大直径较治疗前有一定减小,肿瘤最大直径增长<1/4;病情进展:治疗后患者肿瘤最大直径的增加幅度≥1/4且≤1/2,或患者体内有新的病灶出现。客观缓解率=完全缓解率+部分缓解率;疾病控制率=100%-病情进展率。⑤无进展生存期(progression-free survival,PFS)与总生存期(overall survival,OS)。以接受治疗至病情进展或是患者死亡为无进展生存期,以患者确诊时间至患者死亡为总生存期。⑥多因素回归分析影响EGFR突变型晚期NSCLC患者PFS的危险因素。
1.4 统计学分析应用SPSS 22.0统计学软件进行数据处理。计量资料以[例(%)]表示,组间采用χ2检验;绘制受试者工作特征(ROC)曲线;生存曲线采用Kaplan-Meier法实施,以Log-rank检验;以Cox 比例风险回归分析晚期NSCLC患者无进展生存期影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 观察组与对照组研究对象PLR比较观察组研究对象PLR水平(178.58±11.37)%高于对照组(117.46±5.76)%,差异有统计学意义(t=39.163,P<0.05)。
2.2 PLR检测、肿瘤标志物检测、CT诊断的诊断效能比较PLR检测、肿瘤标志物检测、CT诊断均具有较高的灵敏度与特异度,三项联合检测的灵敏度与特异度高于单独检测,见表1。
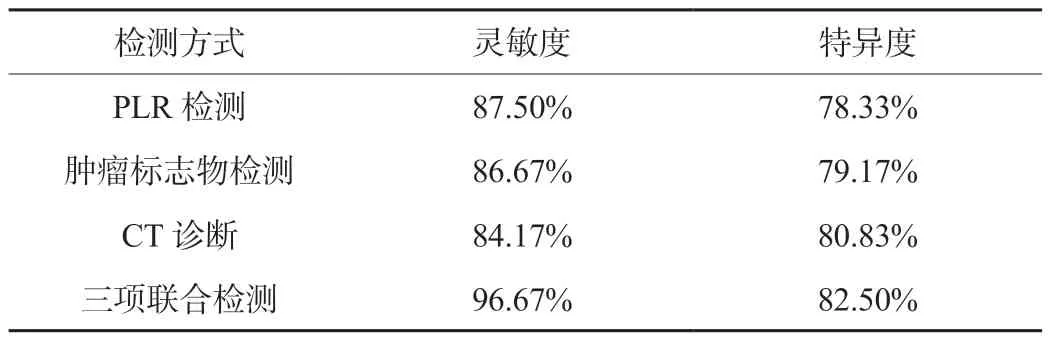
表1 PLR检测、肿瘤标志物检测、CT诊断的诊断效能比较
2.3 PLR与NSCLC患者临床病理特征的单因素分析在给予患者靶向治疗前,120例受试者PLR为40.69~285.97。ROC曲线分析结果显示,PLR预测晚期NSCLC患者1年预后的AUC为0.753[95%CI(0.599,0.897)],最佳截断值为 94.58。根据最佳截断值,将患者分为低PLR组(PLR水平低于94.58,58例),高PLR组(PLR水平在94.58及以上,62例),见图1.。单因素分析结果显示:不同PLR水平的患者在吸烟、肿瘤部位分型、组织分化T分期、N分期方面比较,差异均有统计学意义(均P<0.05),见表2。
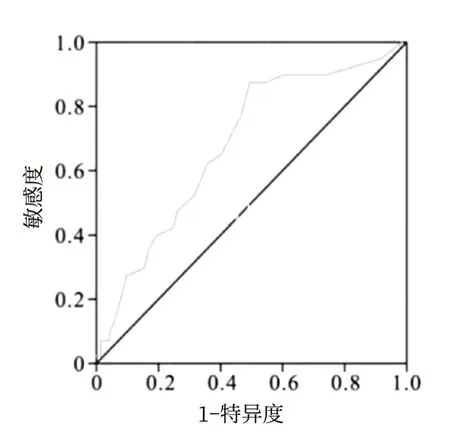
图1 EGFR突变型晚期NSCLC患者PLR值的ROC曲线

表2 PLR与EGFR突变型晚期NSCLC患者临床病理特征的单因素分析
2.4 低PLR组与高PLR组EGFR突变型晚期NSCLC患者近期疗效比较低PLR组患者客观缓解率、疾病控制率均高于PLR组,差异均有统计学意义(均P<0.05),见表3。
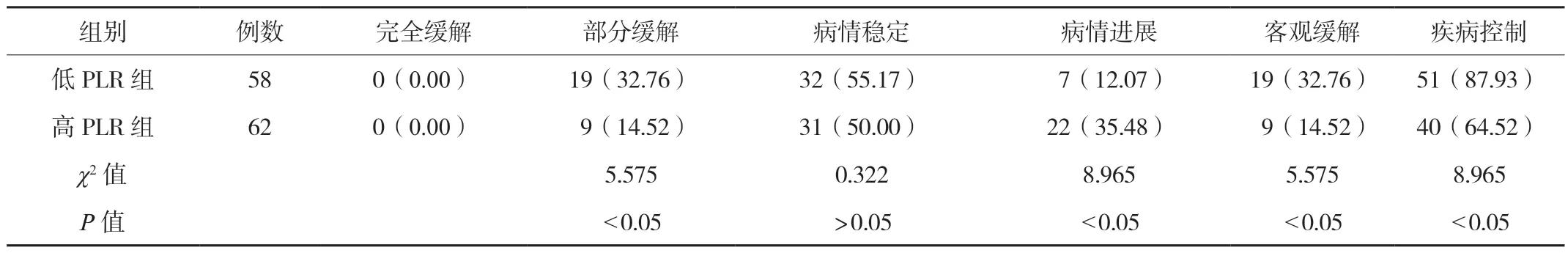
表3 低PLR组与高PLR组NSCLC患者近期疗效比较
2.5 低PLR组与高PLR组EGFR突变型晚期NSCLC患者中位无进展生存期和总生存期比较治疗前中位无进展生存期:低PLR组为12.54个月(95%CI:9.17~12.769),高PLR组为7.35个月(95%CI:5.136~8.894);治疗前中位总生存期:低PLR组23.69个月(95%CI:17.318~24.634),高PLR组为16.94个月(95%CI:11.924~20.462),经Log-Rank检验,低PLR组的中位总生存期、中位无进展生存期均更长,差异有统计学意义(P<0.05),见图2、3。

图2 PLR与EGFR突变型晚期NSCLC患者中位无进展生存期的关系
2.6 EGFR突变型晚期NSCLC患者 PFS影响因素的Cox 比例风险回归分析因变量为患者的无进展生存期,自变量为患者的临床资料(赋值:①性别:女=0,男=1;②年龄:<60岁=0,≥60岁=1;③临床分期:ⅢB期=0,Ⅳ期=1;④分化程度:低分化=0,高中分化=1;⑤发病部位:中心型=0,外周型=1;⑥PLR:<94.58=0,≥94.58=1),使用Cox回归模型进一步分析,结果显示影响EGFR突变型晚期NSCLC患者PFS的独立危险因素为患者的分化程度与PLR指标水平(均P<0.05),见表4。
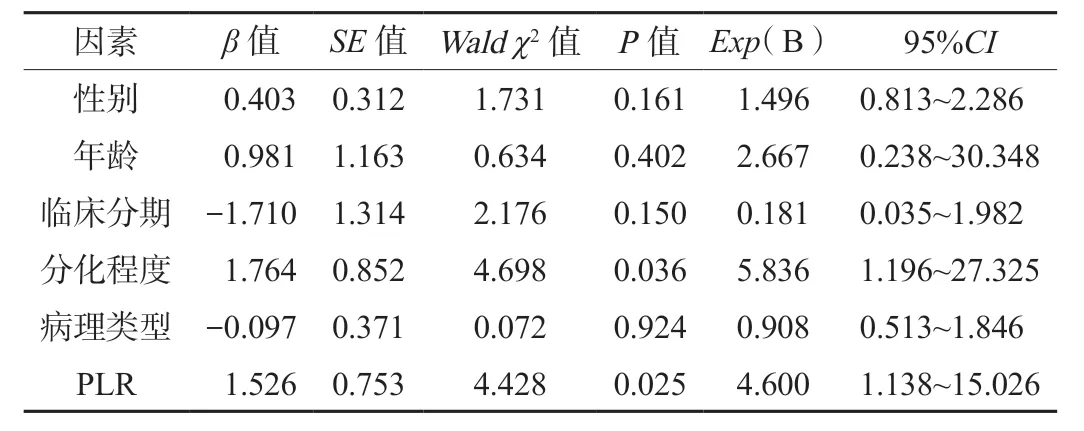
表4 EGFR突变型晚期NSCLC患者 PFS影响因素的Cox 比例风险回归分析
3 讨论
对恶性肿瘤患者来说,血小板增多是一种较为常见的现象,血小板反应蛋白的释放会导致肿瘤细胞黏附性提升,出现高凝状态,因此在肿瘤与机体相互作用时机体内的反应性血小板水平提升[8]。本研究结果显示,观察组研究对象PLR水平明显高于对照组,提示PLR检测可对患者进行早期诊断。分析原因为肿瘤细胞的发生发展与其自身存在相关性,还与其微环境状态有关。在炎症与免疫过程中,PLR会导致患者发生应激反应,使微环境状态出现变化,进而造成肿瘤细胞的生长、侵袭及转移[9]。本研究结果显示PLR检测、CT检查、肿瘤标志物检测均拥有较高的敏感度与特异度,同时三者联合检测的敏感度与特异度明显高于单独检测,可见在EGFR突变型NSCLC患者诊断过程中,采用联合检测的方式更能对疾病进行早期诊断,实现对肺部病变良恶性的鉴别,有助于临床对EGFR突变型NSCLC进行及时的治疗与干预。
本研究单因素分析结果显示,不同PLR水平的患者在吸烟、肿瘤部位分型、组织分化、T分期、N分期等方面存在较大的差异,说明在评估患者的肿瘤疾病的恶性程度方面,临床分期、肿瘤部位、肿瘤分化程度可以发挥较好的作用。多因素分析结果显示,患者的无进展生存期会受到分化程度及PLR的影响。可见在NSCLC患者的预后中,炎症反应和机体的免疫系统扮演重要角色。分析原因为,肿瘤早期呈现为一种高分化状态,随着疾病的发展会逐渐向低分化状态进展,其在发展过程中会不断对周围组织与限制进行突破,不断进行增殖与转移。因此在患者体内,其肿瘤分化程度越低,说明肿瘤发展时间越长,会导致患者的恶心严重程度不断提高,进一步促使临床分期也不断提升[10]。这些因素都说明在对患者进行肿瘤早期诊断、靶向治疗效果及预后的预测过程中,PLR能够起到很好的参考及指导作用[11]。本研究结果显示低PLR组患者的客观缓解率、疾病控制率均高于高PLR组;同时两组研究对象在治疗前的中位总生存期、中位无进展生存期对比结果显示,低PLR的中位总生存期、中位无进展生存期更高。上述结果可见与高PLR组相比,低PLR组的生存优势更大。这主要是因为PLR水平越低,说明患者的肿瘤恶性程度越低,因此患者体内微环境受肿瘤细胞影响更小,通过治疗能够取得更好的治疗效果。
综上所述,若是EGFR突变型NSCLC患者的PLR水平较低,其靶向治疗的临床效果会更好,对患者的预后更有利。PLR在EGFR突变型NSCLC患者中的表达水平较高,具有较高的诊断效能。
