南京椴花化学成分鉴定及不同发育时期黄酮类化合物差异分析
2024-03-08王欢利王奇志严灵君汤诗杰
原 晓,王欢利,王奇志,3,黄 犀,严灵君,汤诗杰,3*
(1 南京中医药大学,南京 210023;2 江苏省中国科学院 植物研究所,南京 210014;3 江苏省植物资源研究与利用重点实验室,南京 210014)
椴树属(TiliaLinn.)隶属于锦葵科(Malvaceae)椴树亚科(Tilioideae),落叶乔木,主要分布于温带及亚热带地区,全球共23种,东亚17种,其中中国特有15种。绝大多种分布于黄河流域以南,五岭以北广大温带及亚热带地区,只有少数种分布于北回归线以南或华北及东北地区。另外,在20 世纪90年代,中国东北、华北及华东等地相继开展了欧美椴树品种的引种工作,包括心叶椴(TiliacordataMill.)和阔叶椴(T.platyphyllosScop.)等品种[1]。椴树栽培历史悠久,具有优良的观赏及经济价值,是优良的蜜源、材用、药用、纤维用及园林观赏植物[2]。南京椴作为华东地区特色的乡土树种,具有良好的生长适应性及开发应用前景。随着南京椴繁殖及栽培技术的突破,目前江苏省的南京椴苗木数量已初具规模。然而,在现有资源基础上,开发南京椴相关产品,为苗木产业提质增效具有十分积极的作用。
欧洲药典9.0中有关椴树花(Tiliaeflos)的专论介绍,将其定义为采自T.platyphyllosScop.、T.cordataMill.、T.×vulgarisHayne(syn.T.×europaeaL.)的整枝干花或其混合物[3]。在中医上用于治疗偏头痛、癔病、肝胆疾病、动脉硬化性高血压、支气管炎等,同时可作为镇静剂、利尿剂、祛痰剂以及发汗剂。欧洲委员会将其列为食品香料的天然来源(N2 类)[4]。此外,菩提茶具有保湿和收敛性,可作为化妆品的原料[5]。迄今为止,该属植物中已分离到上百种天然产物,包括黄酮类(flavonoids)、有机酸(organic acids)、萜类(terpenes)、挥发油类(essential oils)、生物碱类(alkaloids)、甾体类(steroids)、烷烃类(alkanes)、糖类(saccharides)和苯丙素类(phenylpropanoids)等。
椴树花的主要成分为黄酮类化合物[5]。Frezza等在银毛椴花序中鉴定出13种化合物,主要由黄酮类化合物组成,其次是有机酸和五环三萜类化合物[6]。Karioti等在阔叶椴花序中鉴定到31种化合物,黄酮类化合物及其衍生物有23种[5]。小叶椴花中总黄酮含量达到13.32 mg/g[7],Fawzy等在小叶椴中鉴定并分离得到6种酚类物质(山奈酚、槲皮素、牡荆素、山奈酚 3-O-α-鼠李糖苷、槲皮素 3-O-β-半乳糖苷和山奈酚3-O-芸香糖苷)[8]。黄酮类化合物最初被命名为维生素P,具有维持毛细血管通透性的作用[9];同时,黄酮类化合物可以干扰肿瘤细胞的增殖和转移,抑制肿瘤组织血管的形成,诱导肿瘤细胞自噬或凋亡,并阻止肿瘤的侵袭[10];其次,黄酮类化合物具有清除自由基、调节脂蛋白、保护线粒体和改善心肌细胞纤维化,对心血管疾病具有治疗潜力[11];另外,在控制体重和肥胖方面有潜在的作用,如黄酮类化合物对α-葡萄糖苷酶和胰脂肪酶功能有抑制作用[12]。也有研究表明,黄酮类化合物不仅具有清除活性氧(reactive oxygen species)能力,还可以作为信号分子激活防御相关的信号通路[13]。
南京椴(T.miquelianaMaxim.)作为江苏省的乡土树种,其花器官的化学成分尚未展开详细研究,研究用UPLC-MS/MS鉴定南京椴花的化学成分,分析不同发育阶段花中差异代谢物含量变化规律,为后续用多组学手段探究椴树花中重要药用化合物的代谢通路及调控机制解析奠定基础,同时为椴树花的采收提供理论依据。
1 材料和方法
1.1 植物材料与处理
试验材料:选取种植于江苏省中国科学院植物研究所种植园(32.05°N,118.83°E)的10年生南京椴植株,设置3 个生物学重复(3 个南京椴单株)。依据花朵形态将采样期共分为5期(图1):始蕾期(2022年4月25日,A)、中蕾期(5月14日,B),末蕾期(6月2日,C)、盛花期(6月2日,D)和败花期(6月10日,E)。样品采集后以锡箔纸包裹,液氮速冻后置于55 ℃烘箱内脱水至恒重,随即存放于-20℃冰箱保存备用。

图1 南京椴花不同时期采集的样本A.始蕾期;B.中蕾期;C.末蕾期;D.盛花期;E.败花期。比例尺代表1 cm。Fig.1 Phenotypic traits of T.miqueliana Maxim.flowers at various developmental stagesA.Bud initiation stage.B.Middle bud stage.C.Final bud stage.D.Flower-opening stage.E.Final flowering period.The bar in the top-left corner represents 1 cm.
1.2 试剂与仪器
甲醇(色谱级)、乙腈(色谱级)。标准品:对香豆酸(sangon biotech,A506158-0250)、绿原酸(中检所110753-200413)、原儿茶酸(Y-031-130711)、儿茶素(E-011-130816)、槲皮素(中检所,100081-200907)、芦丁(中检所,100080-9504)、黄芩苷(中检所,110715-200514)。
液质联用仪(Agilent 1260 UPLC-DAD-6030 ESI-QTOF,美国Aglient 公司)、超声波清洗仪(KQ-400DE,昆山禾创超声仪器有限公司)、真空干燥箱(GZX-9070MBE,上海博讯实业有限公司)、电子计重秤(ACS-10,凯丰集团有限公司);1/10 000电子天平(瑞士Mettler-Toledo AE240,瑞士苏黎世梅特勒—托利多集团)、纯水机(SPING-S5i,南京妙之仪电子科技有限公司)、一次性带针注射器(1 mL,江阴市医疗器械有限公司)、一次性针式过滤器(0.45 μm,津腾实验设备有限公司)、移液枪(100~1 000 μL,Dragonlab)、高通量组织研磨机(LISK-48,南京立思高仪器有限公司)。
1.3 化合物提取及成分鉴定
1.3.1 供试品、标准品制备
选取盛花期(D)样本为试验材料,准确称量0.1 g南京椴花,按照1∶15料液比加入50%甲醇溶液,在350 W 下超声提取20 min,取出后冷却室温,补足溶液并摇匀,用0.22 μm 滤膜过滤后备用。
对照品贮备液:称取1 mg对香豆酸、绿原酸、原儿茶酸、儿茶素、槲皮素、芦丁6种对照品,配制1 mg/mL储备溶液。
1.3.2 LC-MS/MS
液质联用仪,美国安捷伦Agilent 1260 UPLCDAD-6030 ESI-QTOF MS;LC-MS色谱柱,Agilent InfinityLab Poroshell 120 EC-C18(3.0 mm×100 mm,2.7 μm);流动相:水(0.1%甲酸,A 相)、乙腈(B相);梯度洗脱程序:0 min,8%B;0~10 min,8%B;10~20 min,8%B~13%B;20~50 min,13%B~35%B;50~70 min,35%B~100%B。流速0.3 mL/min;进样量5 μL;柱温30 ℃。质谱条件:质谱检测器ESI离子源,负离子模式;全扫范围100~1 700 m/z;雾化器压力344 738 Pa;干燥气流速10 mL/min;干燥气温度350 ℃;毛细管电压3 500 V;碎裂电压190 V。
1.3.3 数据处理
用agilent mass hunter qualitative analysis software (Version 10.0)对LC-MS数据文件进行初步评估,通过比对标准品、自建数据库、本地数据库(PCDL公共数据库)和文献资料,根据保留时间、分子离子峰、碎片离子峰和紫外吸收等鉴定南京椴花中的代谢物。
1.4 不同发育期间椴树花代谢组份分析
1.4.1 样品处理
真空冷冻干燥后的植物材料研磨并准确称取0.1 g粉末置于离心管,溶解在50%甲醇溶液中,在30 ℃下加入1.5 mL溶剂超声萃取20 min,随后将试管在室温下以10 000 r/min离心10 min,上清液用0.22 μm 滤膜过滤并转移到色谱进样瓶中,用于LC-MS/MS分析。选取黄芩苷Baicalin 化合物作为内标,购买自中国食品药品鉴定研究院(110715-200514),浓度为0.05 mg/mL。
1.4.2 数据处理
用Agilent MassHunter Profinder(Version 10.0)和MPP(mass profiler professional,Version 15.1)对南京椴花不同期液质检测数据开展批量预处理,提高数据分析的质量。用SIMCA 14.1 (Umetrics,瑞典)软件进行主成分分析(principal component analysis,PCA)、偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)和正交偏最小二乘判别分析(orthogonal partial leastsquares discrimination analysis,OPLS-DA)。用OriginPro 2023进行聚类分析(hierarchical clustering analysis,HCA),用SPSS 27.0 软件进行显著性差异分析。
2 结果与分析
2.1 南京椴花中化合物成分鉴定
用超高效液相色谱-串联质谱法对南京椴花进行UPLC-MS/MS分析。解析负离子模式下南京椴花醇提物一、二级质谱图,比对数据库和文献,根据分子离子峰、碎片离子峰、保留时间、紫外吸收波长等指标对化合物进行鉴定,初步分析得到46种化合物(见表1)。有机酸及其衍生物13种;香豆素及其衍生物4种;1种酯;类黄酮28种,包括4种黄酮,16种黄酮醇,5种黄烷-3-醇和3种二氢黄酮。
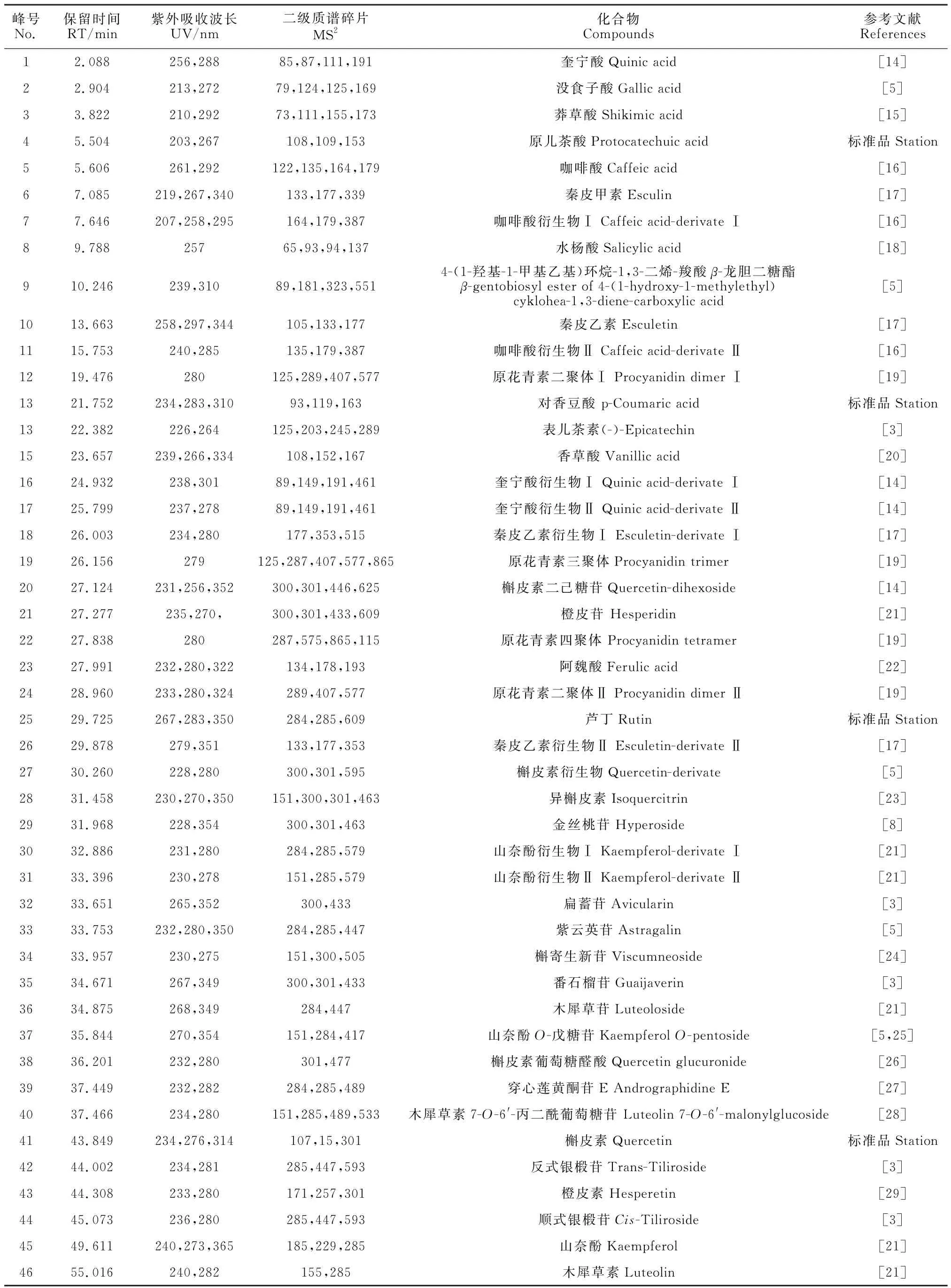
表1 南京椴花化合物鉴定Table 1 Identification of compounds from flowers of T.miqueliana Maxim.
2.2 主成分分析和OPLS-DA分析
用MPP软件对不同期液质检测数据进行均一化处理,根据P<0.05结合差异性倍数(FC≥2)筛选组间差异代谢物,在5个时期南京椴花中共筛选出差异代谢物620种。为了分析样品组内和组间的变异度,对15个样本进行PCA 分析(图2)。
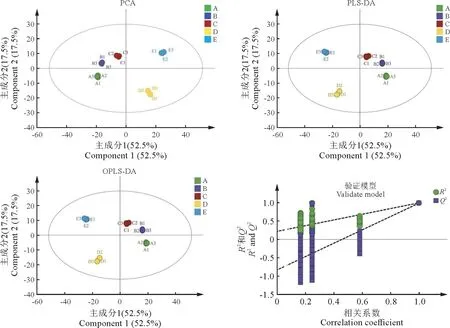
图2 PCA 分析、PLS-DA 分析、OPLS-DA 分析和OPLS-DA 验证模型图中的数字(1-3)表示5个时期样本的3个生物学重复。Fig.2 Analysis of PCA,PLS-DA,OPLS-DA and validation model of OPLS-DAThe numbers (1-3)i n the figure represent the three biological replicates of samples from five different periods.
5个样品之间的总体化合物差异主成分分析结果显示:第一和第二主成分分别占52.5%和17.5%的差异,化合物组分的差异对不同时期样品的特征解释率为70.0%(PC1+PC2),基本可以反映南京椴花的主要特征信息;样品组内变异度均较小,说明实验重复性好;不同期样本呈分离趋势,说明组间差异较大;与蕾期相比,开花后代谢物变化明显,其中盛花期(D)和败花期(E)明显区别于其他期。
为了阐明南京椴花中代谢物在不同时期的变化规律,用(图2)PLS-DA 和OPLS-DA 模型对5个不同样本中化合物种类和丰度进行整合,以确定不同阶段化合物的差异。在OPLS-DA 模型中,自变量拟合指数(R2X)、因变量拟合指数(R2Y)和模型预测指数(Q2)值分别为0.94、0.997和0.989,表明该模型的高精度和稳定性,以及解释样本变化的可靠性[30]。OPLS-DA 置换检验结果表明模型不存在拟合现象,可用于后续代谢物的筛选工作。蕾期到花期代谢物组间差异显著,由此推测,盛花期是南京椴花代谢产物发生显著变化的分界点。
2.3 黄酮类化合物聚类分析
目前,已经从不同的来源分离出5 000多种黄酮类化合物,并确定了它们的结构。椴属中已被报道的黄酮类化合物约有80种。根据OPLS-DA 模型的变量重要性投影(variable importance in projection,VIP)鉴定差异代谢物[31],设置VIP值大于1,在5个时期花中共筛选得到244种差异代谢物,进一步得到26种黄酮类差异代谢物(图3),包括4种黄酮,分别是田蓟苷、芹菜素-7-O-葡萄糖醛酸、木犀草素和木犀草苷;10种黄酮醇,分别是阿福豆苷、山奈苷、槲皮苷、芦丁、槲皮素-3-O-葡萄糖-7-O-鼠李糖苷、鼠李秦素、番石榴苷、山奈酚、异槲皮素和槲皮素;5种二氢黄酮,分别是橙皮苷、新橙皮苷、柚皮苷、圣草酚和圣草酚-O-己糖苷;1种二氢黄酮醇,是花旗松素;5种黄烷-3-醇,分别是表儿茶素、原花青素A2、原花青素三聚体Ⅰ、原花青素三聚体Ⅱ、原花青素三聚体Ⅲ;1种异黄酮,是奥洛波尔。
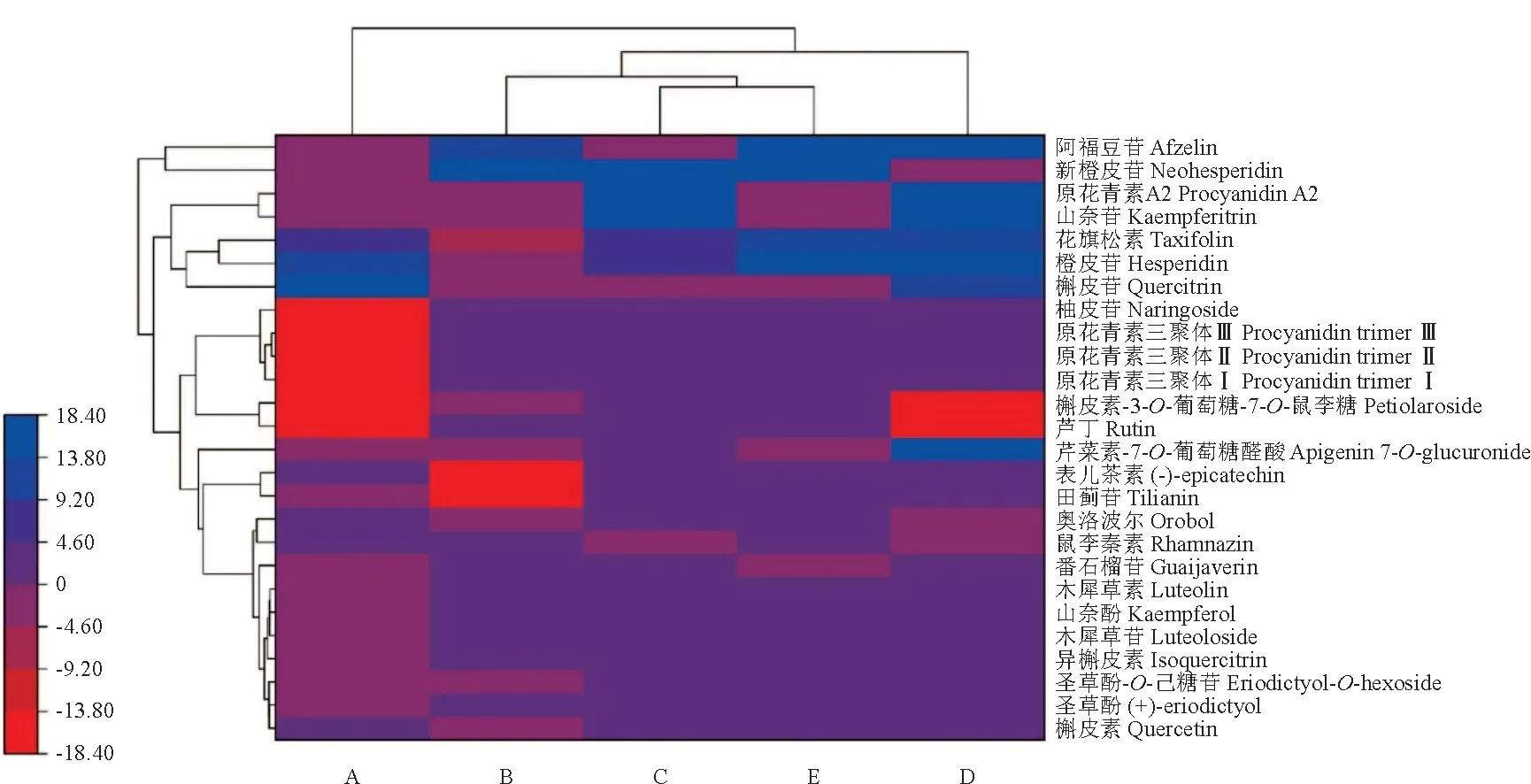
图3 26种关键黄酮类化合物在5个时期内含量变化Fig.3 Variation of the content of 26 flavonoids within five stages
阿福豆苷含量在A 和C 期较低,在B、D 和E期升高。新橙皮苷、芦丁和槲皮素-3-O-葡萄糖-7-O-鼠李糖苷含量在A 和D 期比其他期较低,在B、C和D 期含量均有所升高。原花青素 A2和山奈苷含量在C和D 期最高,A、B和E期含量降低。花旗松素、橙皮苷和槲皮苷呈现先降低后上升趋势,在A期含量较高,B 和C 期稍有降低,D 和E 期含量又升高。芹菜素-7-O-葡萄糖醛酸含量在D 期显著区别于其他时期,含量最高。
原花青素三聚体Ⅰ、Ⅱ和Ⅲ 3种黄烷-3-醇和柚皮苷在生长阶段有着相同的变化趋势,在A 期含量最低,随后含量升高并保持稳定。
奥洛波尔和鼠李秦素含量在南京椴花的整个生长周期内无明显变化,在D期略有降低;番石榴苷、山奈酚、木犀草素、木犀草苷、异槲皮素含量在B、C、D和E期略高于A期;槲皮素、圣草酚和圣草酚-O-己糖苷含量在C、D和E期稍高于前两期;表儿茶素和田蓟苷含量在B期降低,其他时期含量基本无明显变化。
聚类热图结果(图3)显示,26种黄酮类化合物含量变化主要呈现以下5种趋势:(1)随着时间延长差异代谢物含量呈升高趋势,且在盛花期(D)含量较高,包括槲皮素、异槲皮素、山奈酚、木犀草素、木犀草苷、原花青素三聚体,Ⅰ、原花青素三聚体Ⅱ、原花青素三聚体Ⅲ、柚皮苷、圣草酚和圣草酚-O-己糖苷。(2)随时间延长含量先升高后降低,原花青素A2、山奈苷、番石榴苷、芹菜素-7-O-葡萄糖醛酸、芦丁和槲皮素-3-O-葡萄糖-7-O-鼠李糖苷,前4 种化合物在D 期含量较高,后2种化合物在A 和D 期含量最低。(3)随时间延长含量先降低后升高,表儿茶素、田蓟苷、槲皮苷、橙皮苷、花旗松素和鼠里秦素,前5种化合物在A 和D 期含量相对较高,鼠里秦素在D 期略有降低。(4)随时间延长含量先升高后降低再升高,阿福豆苷在D 期含量相对较高,新橙皮苷在D 期含量降低。(5)随时间延长含量呈先降低后升高再降低,奥洛波尔在D 期含量有所降低。
2.4 黄酮类化合物显著性分析
对不同时期南京椴花中黄酮类化合物进行单因素方差分析,表2显示了26种黄酮类化合物在5个时期内相对平均含量。多重比较分析表明,这些化合物在不同时期花中含量差异显著(P<0.05),说明发育状态是判断南京椴花中次级代谢物含量的重要因素。
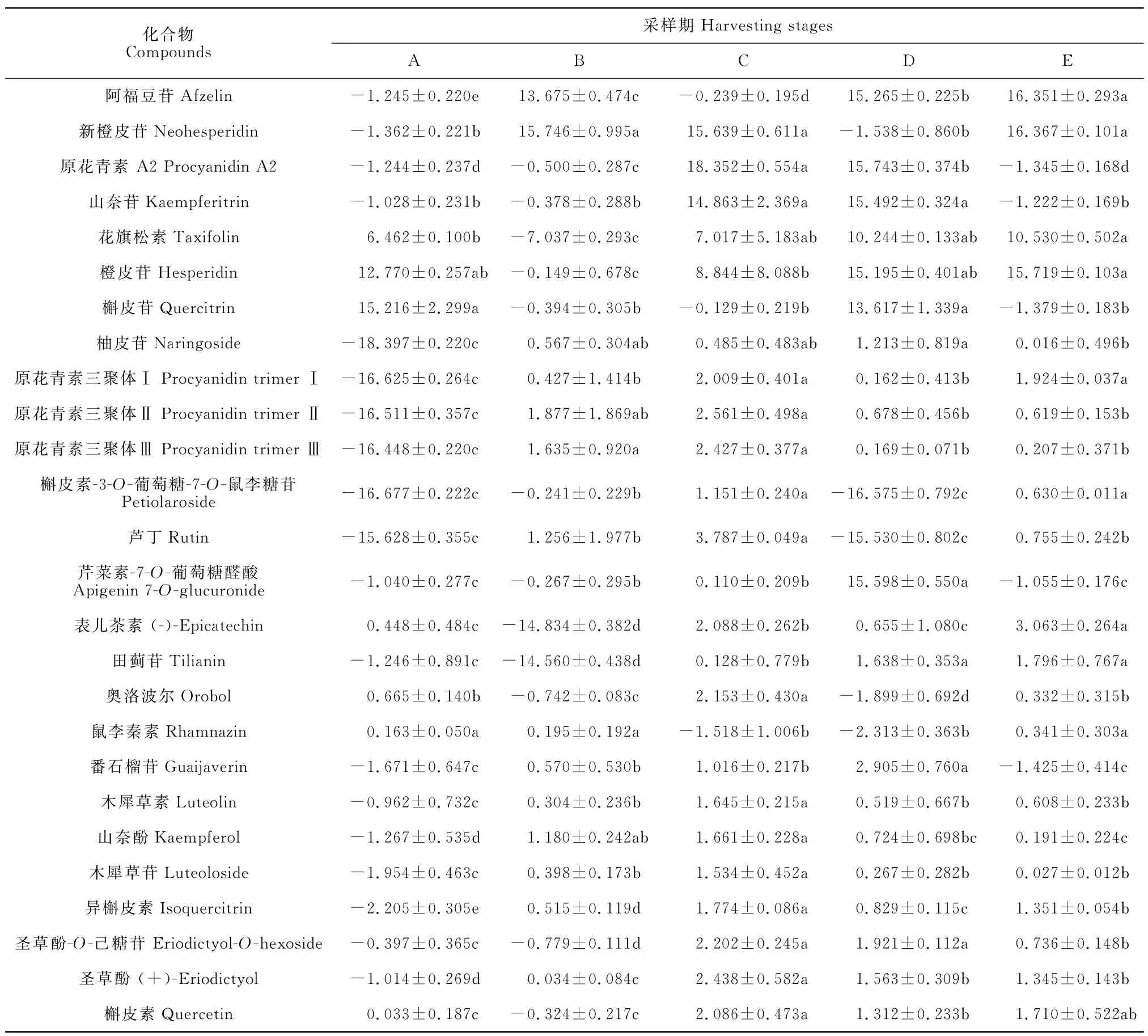
表2 不同时期花中黄酮类化合物相对含量平均值Table 2 Mean values of flavonoid relative content in inflorescences at different time periods
A 期橙皮苷和槲皮苷含量最高,分别为12.770,15.216;B期新橙皮苷、柚皮苷、原花青素三聚体、鼠里秦素和山奈酚含量最高,分别为15.746,0.567,1.756,0.195,1.180;C 期新橙皮苷、原花青素 A2、山奈苷、花旗松素、柚皮苷、原花青素三聚体、芦丁、槲皮素-3-O-葡萄糖-7-O-鼠李糖苷、奥洛波尔、山奈酚、木犀草素、木犀草苷、槲皮素、异槲皮素、圣草酚和圣草酚-O-己糖苷16种化合物含量最高,分别为15.639,18.352,14.863,7.017,0.485,2.332,1.151,3.787,2.153,1.645,1.661,1.534,1.774,2.202,2.438,2.086;D 期山奈苷、花旗松素、橙皮苷、槲皮苷、柚皮苷、芹菜素-7-O-葡萄糖醛酸、田蓟苷、番石榴苷和圣草酚-O-己糖苷9种化合物含量最高,分别为15.492,10.244,15.195,13.617,1.213,15.598,1.683,2.905,1.921;E 期阿福豆苷、新橙皮苷、花旗松素、橙皮苷、原花青素三聚体、槲皮素-3-O-葡萄糖-7-O-鼠李糖苷、表儿茶素、田蓟苷、鼠里秦素和槲皮素含量最高,分别是16.351,16.367,10.530,15.719,1.924,0.630,3.063,1.796,0.341,1.710。
3 讨论
黄酮类化合物是椴树属植物的主要次生代谢产物[32],目前,已经从椴树属植物中发现约80种黄酮类化合物。Pavlovic'等基于高分辨质谱仪(HRMS)在4种椴树花序样本中初步鉴定了46种代谢产物,包含14种酚酸及其衍生物、24种黄酮类化合物及其衍生物和8种原花青素[23]。Ziaja等在5种椴树花序中检测到42种酚类化合物,并用儿茶素、表儿茶素、蒙花苷和4种槲皮素衍生物对心叶椴(Tilia cordataMill.)、阔叶椴(TiliaplatyphyllosScop.)、Tilia×vulgarisHayne、银毛椴(TiliatomentosaMoench.)、美洲椴(TiliaamericanaL.)5 个椴树种进行了区分[3]。本研究基于UPLC-MS/MS在南京椴花中检测到46种化合物,包括13种有机酸(9种酚酸及其衍生物);4种香豆素及其衍生物;1 种酯;28种类黄酮(4种黄酮,16种黄酮醇,5种黄烷-3-醇,3种二氢黄酮)。此外,通过比对标准品,在南京椴花中检测到芦丁的存在,可将其与银毛椴花进行区分;并未检测到儿茶素的存在,此前研究已证明美洲椴花中无儿茶素[3]。
Szücs等通过分析阔叶椴苞片整个发育期间的代谢组变化,发现苞片在早期发育阶段含有大量的儿茶素衍生物和黄酮苷,在果实生长阶段含有丰富的秦皮苷和奎宁酸衍生物[14]。练冬梅等研究发现,黄秋葵花黄酮从花蕾期至花谢期呈现出累积过程,花谢期黄酮含量达到最高[33]。邵郅胜等研究表明欧李叶片的各酚类物质含量随着生长期推进均呈现先升高后降低的趋势,均于果实膨大期达到最高[34]。本文着重研究南京椴花不同时期黄酮类化合物的含量变化。OPLS-DA 分析结果显示,盛花期是南京椴花中代谢物发生显著变化的分界点,现蕾期和开花期代谢物差异较大。显著性分析可知,黄酮类化合物含量在不同时期花中差异显著(P<0.05)。在黄酮醇生物合成途径上[35],山奈苷、阿福豆苷和槲皮苷这3种化合物显著积累,在盛花期含量极高,Fawzy等通过角叉菜胶诱导的大鼠足肿胀法表明山奈酚及衍生物、槲皮素及衍生物有强烈的抗炎作用[8];相反,槲皮素-3-O-葡萄糖-7-O-鼠李糖苷和芦丁2种槲皮素衍生物在盛花期含量极低。原花青素A2和原花青素三聚体等黄烷-3-醇类化合物含量在末蕾期最高,前者在盛花期含量也较高,Czerwinska等分离和鉴定了小叶椴花中的10种原花青素,都能减少N-甲酰-甲硫氨酰-亮氨酰-苯丙氨酸(f-mlp)刺激的中性粒细胞产生的活性氧且大多数都能抑制脂多糖(LPS)诱导的IL-8释放[36];表儿茶素在败花期含量最高,Lee等研究发现表儿茶素对谷氨酸诱导的HT22细胞神经毒性具有明显的保护作用[37]。橙皮苷和花旗松素含量在发育后期增加,橙皮苷已经被证明有降脂[38]和神经保护活性[39];花旗松素可用于治疗胃癌[40]和脊髓损伤[41]。芹菜素-7-O-葡萄糖醛酸含量在盛花期最高,Hu等研究表明该物质可抑制LPS 诱导的炎症反应[42]。绝大多数黄酮类化合物含量在末蕾期或盛花期达到最高,末蕾期的标志性化合物是原花青素A2,盛花期的标志性化合物是芹菜素-7-O-葡萄糖醛酸,末蕾期和盛花期均具有采收价值。
4 结论
该研究基于UPLC-MS/MS检测和自建数据库对南京椴花化学成分进行鉴定,初步分析得到46种化合物,包括13种有机酸(9种酚酸及其衍生物);4种香豆素及其衍生物;1种酯;28种类黄酮(4种黄酮,16种黄酮醇,5种黄烷-3-醇,3种二氢黄酮)。多元分析结果表明,蕾期到花期代谢物组间差异显著,盛花期是南京椴花中代谢物发生显著变化的分界点。多重比较分析表明,26种黄酮类化合物含量在5个时期花中差异显著(P<0.05),阿福豆苷、山奈苷、槲皮苷、橙皮苷、花旗松素和芹菜素-7-O-葡萄糖醛酸含量在盛花期相对较高,槲皮素-3-O-葡萄糖-7-O-鼠李糖苷和芦丁含量在始蕾期和盛花期极低,原花青素 A2和3种原花青素三聚体含量在末蕾期较高。因此,发育状态可作为判断南京椴花中次级代谢物含量的重要因素,后续可借助转录组学揭示有效成分的生物合成途径,筛选南京椴花中药理活性成分调控基因并验证其功能。
