表达SmERF1 调节烟草种子大小及耐盐性
2024-03-08化文平孔维维韩立敏曹晓燕
化文平,孔维维,韩立敏,曹晓燕
(1 陕西学前师范学院 生命科学与食品工程学院,西安 710061;2 陕西师范大学 生命科学学院,西北濒危药材资源开发国家工程实验室,药用资源与天然药物化学教育部重点实验室,西安 710062)
乙烯响应因子(ethylene-responsive factor,ERF)是植物特有的一大类转录因子,越来越多的研究表明,ERF家族成员参与植物的各类生物或非生物的胁迫反应[1]。在拟南芥中AtORA59和AtERF1能激活PDF1.2基因表达从而提高对胁迫的抗性[2];过表达GmERF113可以激活抗性基因PR1和PR10-1,增强大豆对大豆疫霉菌的抗性[3];过表达MnERF2可以显著提高桑树对干旱胁迫的耐受性[4];MsERF40和MsERF05在新疆野苹果抗腐烂病过程中发挥重要作用[5]。
药用植物丹参(SalviamiltiorrhizaBunge)以干燥根茎入药,被广泛应用于心脑血管疾病的治疗。目前已从丹参基因组数据库中鉴定得到79个ERF转录因子[6],但仅SmERF6、SmERF1L1、SmERF73、SmERF128和SmERF115的功能被探明与丹参酮和丹酚酸的合成调控相关[7-10],SmORA1主要与植物的抗病性相关[11]。前期研究发现SmERF1(Gen-Bank No.KC405081.1)在丹参中可以调节丹参的抗性[12],为进一步探究SmERF1功能,该研究在模式植物烟草中过表达SmERF1,发现它不仅调节植物激素合成,调节转基因烟草的抗性,而且还影响植物种子大小,预示在植物农艺学性状改良方面存在一定潜能。
1 材料和方法
1.1 植物材料培养
把烟草(Nicotianatabacum)种子种植于含有蛭石、草木灰的花盆中,每周浇水1次,培养室内保持湿度60%,温度22 ℃,每日光照16 h。1月龄的烟草幼苗用于转基因操作。鉴定得到的转基因烟草在MS培养基上继代培养6周后,进行炼苗,移栽在含腐殖质土的花盆中,在人工气候箱培养直至种子成熟。培养条件:24 ℃,湿度60%,每日光照14 h。收集种子(T0)在花盆中种植,幼苗经PCR 鉴定后直至种子成熟获得T1代种子;T1代烟草种子同样条件种植,并再次进行PCR 鉴定,成熟后获得T2代烟草种子。
1.2 转基因烟草种子分析和转基因株系获得
用体式显微镜观察比较T2代烟草种子大小,并称量T2代种子的千粒重。以同批种植收获的未转基因的烟草种子为对照,分析转基因烟草种子变化。
用Gateway的方法构建表达SmERF1的植物表达载体pO-ERF[12]。将其以冻融法转入农杆菌GV3101[13],用叶脉注射法转化烟草[14],在含0.5 mg/L有IBA和10 mg/mL草胺磷(Basta)的1/2 MS培养基上进行筛选培养。通过PCR 方法检测随同转入的质粒载体上CaMV35S启动子序列片段(上游引物:5′-AATCTTCGTCAACATGGTGGAGC-3′,下游引物:5′-GCTGTCGTCGCCGGAGAATA-3′),鉴定转基因烟草植株[12]。
1.3 基因表达检测
植物总RNA 提取、cDNA 合成及实时定量分析方法参见课题组之前研究[11]。用Primer premier 5软件设计实时定量PCR 引物,以NtActin基因(U60495.1)为内参,用实时荧光定量PCR 方法进行基因检测[11]。检测引物见表1。
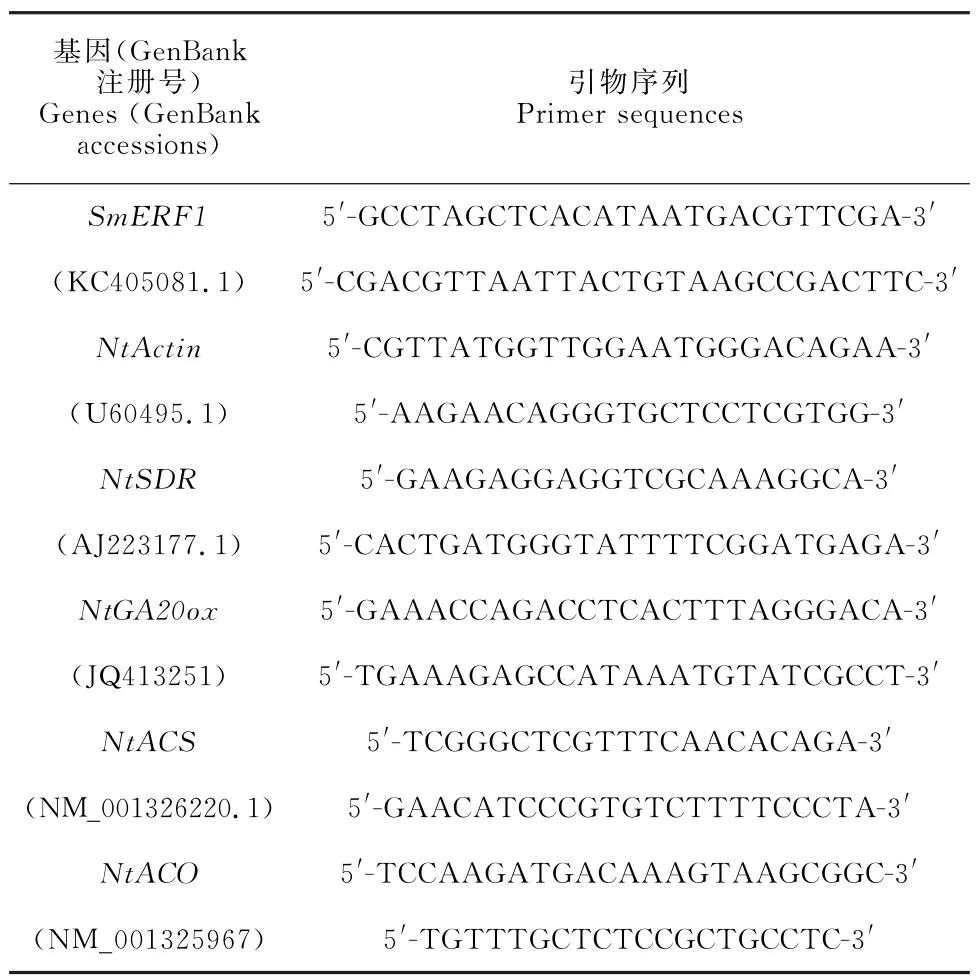
表1 实时定量PCR 引物Table 1 Primers used for the real time quantitative PCR
1.4 T2 代转基因烟草中激素和叶绿素含量检测
T2代转基因烟草种子萌发1个月后的幼苗用于检测ABA 和GA 浓度。取转基因植株及对照株系的新鲜叶片,按照植物脱落酸(ABA)酶联免疫分析试剂盒、植物赤霉素(GA)酶联免疫分析试剂盒(均购自陕西脉元生物技术公司)说明书要求检测相应激素含量。
用T2代烟草种子萌发后2周龄的幼苗进行生物量统计和叶绿素含量测定。叶绿素含量检测参照Frank等的方法[15]:取200 mg新鲜幼苗植株,研磨成粉末状,然后转到10 mL 离心管,加入10 mL 80%丙酮溶液,充分混合后4 ℃提取24 h。4 ℃下12 000g离心3 min,得到的上清液用紫外分光光度计(SHIMADZU UV-2450,Japan)在665 nm 和649 nm 波长下检测OD 值。总叶绿素(a和b)计算按照Ren等[16]的方法进行。
1.5 转基因烟草抗性分析
T2代烟草种子(即野生对照烟草种子)在无菌滤纸上萌发至约1 cm,进行移栽至含有腐殖土的花盆中,在人工气候箱中按照上述条件培养。移栽后2个月的植株用于抗性处理分析。用400 mmol/L NaCl溶液进行盐胁迫处理(约50 mL NaCl溶液/盆),每3 d处理1次。开始处理后第7天观察烟草植株状态,并收集新鲜叶片(5株烟草植株为1个样品),液氮速冻后-80 ℃保存,用于抗性生理指标测定。
分别用南京建成生物科技有限公司的CAT Assay Kit(A007-1)、植物POD Assay Kit(A084-3)和SOD Assay Kit(S0102)检测转基因烟草中过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性,检测方法按照试剂盒说明书进行。转基因烟草中MDA 含量用硫代巴比妥酸试剂提取,通过测定上清液在450 nm、532 nm 和600 nm处的吸光度进行定量[17]。
1.6 数据分析
所有数据用SPSS 19.0 中一维方差分析,用Turkey-Kramer test(P<0.05)分析样品间显著性差异,显著性结果分别用*(P<0.05)、**(P<0.01)和***(P<0.001)表示。
2 结果与分析
2.1 转化株系鉴定及形态观察
将Gateway的方法构建的植物表达载体pOERF用农杆菌叶脉注射法转入烟草后,以草胺磷为抗性筛选条件,筛选得到转基因的烟草株系(T0代)。以过表达载体启动子CaMV 35S序列为检测片段,筛选鉴定得到阳性转基因株系;阳性株系种子成熟后再次种植的T1代植株进行PCR 鉴定,共得到15个确切的阳性转基因株系。经实时定量PCR检测发现,在OE-3、OE-4、OE-7和OE-10 4个转基因烟草株系中,SmERF1表达量比较高(图1)。
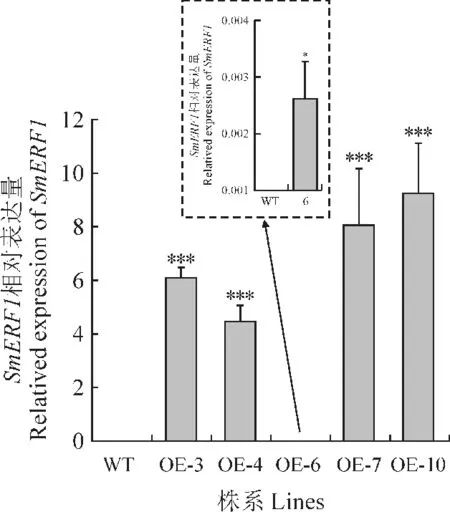
图1 转基因烟草株系中SmERF1 表达量WT 为未转基因烟草株系;OE-3,OE-4,OE-5,OE-6,OE-7,OE-10为过表达SmERF1 的烟草株系。Fig.1 The expression levels of SmERF1 in transgenict obacco plantsWTi ndicates wild type tobacco.OE-3,OE-4,OE-5,OE-6,OE-7,OE-10 indicate the overexpression lines of SmERF1.
在萌发阶段,野生对照烟草种子在播种第7天开始露白,但转基因烟草种子(T2代)在第9天才露白。在发芽后2周内,转基因烟草幼苗的生长速度低于野生对照株系(图2,A),幼苗的生物总量是对照株系的48%~53%(表2)。转基因烟草的幼苗叶片偏黄(图2,A),叶绿素含量是野生型对照的82%~84%,但正常情况下,转基因烟草的种子萌发率与野生对照种子间没有差异(表2)。在其他生长阶段,转基因烟草与对照植株间没有明显的差异。

图2 转基因烟草幼苗的形态(A)和种子大小(B)Fig.2 Growth morphology (A) and seed size (B)of transgenic tobacco

表2 转基因烟草幼苗的形态指标分析Table 2 Analysis of morphological indicators of transgenic tobacco seedlings
2.2 表达SmERF1 影响烟草种子大小分析
在显微镜下可以明显观察到,转基因烟草种子(T2代)比野生型种子小(图2,B)。OE-3、OE-4、OE-7和OE-10 4个转基因烟草株系的T2代种子的千粒重分别是对照的59%、63%、56%和58%(表2)。
2.3 转基因株系耐盐性增强
400 mmol/L NaCl溶液处理7 d后,野生型烟草对照株系的叶片卷曲、萎蔫,老叶变黄,而转基因植株仅部分老叶变黄,表现出较好的抗盐胁迫特性(图3,A)。在正常和盐胁迫处理情况下,对转基因烟草植株中过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性、脯氨酸(Pro)含量和丙二醛(MDA)含量等抗性指标进行检测(图3,B)。发现,盐胁迫下烟草转基因株系中POD 活性显著高于对照株系,非胁迫状态转基因株系中POD 活性高于对照株系,但不显著。转基因株系中SOD 活性在正常状态下与对照没有差异,但在盐胁迫下显著高于对照株系。转基因株系中脯氨酸的含量在正常情况下与对照株系相比也没有明显差异,但在盐胁迫下脯氨酸含量是对照的1.35~1.48倍。MDA 含量则在2种情况下都显著低于对照株系。

图3 盐胁迫下烟草株系形态和抗性生理指标Fig.3 Morphology and physiological indicators of resistance of tobacco lines under salt stress
2.4 表达SmERF1 影响烟草激素含量
ABA 和GA 是一对相互拮抗的植物激素,参与到植物种子萌发、种子成熟、根的发育、开花时间控制等多个生理过程。在转基因的烟草株系中ABA的浓度高于对照株系,为对照株系的1.53~2.51倍;而GA 浓度明显下降,是对照的0.60~0.74倍(图4)。

图4 烟草株系中ABA 和GA 含量及相关基因表达检测Fig.4 ABA and GA contents and related gene expressions in tobacco lines
进一步用实时荧光定量PCR 分析发现,在转基因株系中ABA 合成途径中的关键酶编码基因NtSDR(short-chain dehydrogenase/reductase,Gen-Bank Accession No.AJ223177.1)的表达显著高于对照株系,而烟草中GA 合成途径的关键酶编码基因NtGA20ox(GenBank Accession No.JQ413251)的表达量则明显低于对照株系(图4)。
以上结果表明,在烟草中表达SmERF1调节了植物激素ABA 和GA 表达;同时还发现,乙烯合成途径的关键酶编码基因NtACS(GenBank Accession No.NM_001326220.1)和NtACO(GenBank Accession No.NM_001325967)的表达量在转基因株系中也明显高于对照株系。
3 讨论
随着当今世界极端天气频发,药用植物中抗性基因的研究越来越受重视。因其在植物抗性胁迫中的重要作用,ERF转录家族成员在抗性方面的研究逐渐成为研究的热点[1]。如烟草中NtERF5、TaERF3[18]、GmERF3[19]和GmERF113[3]等在过表达后都能增强对多种病害的抵抗能力,提升转基因植株抗旱、抗盐或抗冻等方面的抗性。前期研究显示,过表达SmERF1可以提高丹参的抗盐性[12]。本研究中,盐胁迫下表达SmERF1的烟草株系的长势明显好于野生型烟草,脯氨酸含量、SOD 活性和POD活性都高于野生型对照,MDA 含量低于对照株系,这些都显示表达SmERF1增强了烟草的抗盐性。
已有研究表明,ERF 蛋白能调节植物激素水平。如苹果MdERF2通过抑制乙烯合成途径关键酶编码基因MdACS1的转录,抑制乙烯的合成[20]。水稻TSRF1激活ABA 合成途径关键酶编码基因SDR的表达,提高ABA 含量[21]。过表达AtERF11可通过激活GA3ox1和GA20ox的表达上调拟南芥中GA 合成[22]。植物激素ABA、GA 和乙烯都在介导植物生物或非生物胁迫的抗性反应中发挥着重要作用[23]。转基因烟草中ABA 合成途径的关键酶编码基因NtSDR表达上调,GA 合成途径关键酶编码基因NtGA20ox的表达下调。进一步分析也显示,转基因烟草中ABA 含量上升而GA 含量下降。这与在丹参中表达SmERF1的结果一致,也与ABA和GA 两者具有相互拮抗作用的结果[23]吻合。推测SmERF1可能通过上调ABA 含量增加植物抗盐性。植物中ABA 含量上升还会刺激乙烯合成[24],在本研究中转基因烟草中乙烯合成途径的关键酶编码基因表达也高于对照植株,预示转基因株系中乙烯含量也呈上升趋势。ABA 在植物幼苗发育期具有一定的抑制功能[25],这也可能是表达SmERF1的烟草幼苗生长缓慢、生物量低的原因。
种子大小是一项重要的农艺性状,解析种子大小的调控机制对粮食生成具有重要意义。虽然研究表明,AP2超家族中的AfAP2-2和SMOS1等转录因子都可以调控种子大小[26-27],但AfAP2-2、SMOS含有2个AP2 结构域,SmERF1 仅含有1 个AP2结构域[12],属于不同的亚家族成员。研究也表明,植物激素ABA[27]和GA[28]的含量变化也影响种子大小,所以SmERF1可能是通过影响上述激素水平而使种子变小、变轻。
综上所述,在烟草中表达SmERF1调节了ABA 和GA 等植物激素合成途径的关键酶基因表达,转基因烟草中ABA 含量升高,而GA 含量降低。正是ABA 含量上升导致烟草幼苗发育缓慢,植株抗盐性增强,而且植物激素含量变化进一步影响了烟草种子发育,导致种子变小、变轻。该研究进一步阐释了SmERF1的功能,为药用植物抗性研究及种子发育奠定了基础。
