盐碱胁迫对‘赤霞珠’葡萄幼苗生长及相关生理指标的影响
2024-03-08陈晓娟
路 妍,李 明,2,3*,陈晓娟
(1 宁夏大学 葡萄酒与园艺学院,银川 750021;2 宁夏大学 葡萄与葡萄酒研究院,银川 750021;3 宁夏大学 葡萄与葡萄酒教育部工程研究中心,银川 750021)
中国的盐碱土总面积约9913.3万hm2,且分布广泛,主要集中分布于西北、华北、东北地区及沿海等地区[1-4],而西部的陕西、甘肃、宁夏、青海、内蒙古、新疆等六省(区)盐渍土地总面积占全国的69.03%[5]。作为重要的土地资源之一,盐碱土具有广阔的治理空间和应用前景。
葡萄是中国重要的经济类果树,不论是鲜食还是酿酒葡萄,其产量在国内的需求量都非常大[6]。而土地盐渍化造成的盐碱胁迫对葡萄生长的危害包括离子毒害、渗透胁迫、活性氧胁迫、高pH 胁迫[7]等多方面,严重降低了自根系葡萄果树的生长发育,导致果实产量下降,品质不佳。‘赤霞珠’(Cabernet Sauvignon)是世界范围内主要的红色酿酒葡萄品种,相比于其他品种,它对于干旱和贫瘠土地有更强的适应性,在世界各地广泛种植[8-9]。宁夏是国内‘赤霞珠’葡萄主产区之一,该区域盐碱地面积大,且分布广泛,严重制约了酿酒葡萄产业可持续发展。据国家统计局不完全统计,宁夏全区现有不同程度盐渍化耕地16.58万hm2,其中轻度盐渍化耕地(土壤含盐量1.5~3 g/kg)占总面积的56%,中度盐渍化耕地(土壤含盐量3~6 g/kg)占总面积的30%,重度盐渍化耕地(土壤含盐量在6 g/kg以上)占总面积的14%。因此,改善盐碱化土壤和加强盐碱地综合利用是‘赤霞珠’葡萄栽培中亟待解决的问题[10],而深入了解‘赤霞珠’葡萄对土壤盐碱胁迫的耐受性以及响应特征是解决这一问题的基础之一。
目前,国内外关于葡萄砧木耐盐碱研究主要集中在耐中性盐方面,关于复合盐碱胁迫的研究较少[11-12],并且较少关注不同盐分配比和不同浓度梯度盐碱胁迫对‘赤霞珠’幼苗生长的影响,而实际生产中土壤盐分组成及其浓度配比往往较为复杂,单一盐胁迫或碱胁迫的研究不能最大程度地体现原位大田土壤盐碱环境对植株影响的真实状况。因此,本试验以‘赤霞珠’幼苗为供试材料,模拟进行4种盐碱配比胁迫处理,通过测定不同时期不同胁迫下幼苗生长形态、生理指标的变化规律,确认‘赤霞珠’葡萄的耐盐碱性范围及其耐盐碱能力,为进一步完善优化‘赤霞珠’葡萄大田栽培措施提供理论依据。
1 材料和方法
1.1 试验地概况
试验地位于宁夏贺兰园艺产业园,地理位置为东经105°45′-106°27′,北纬27°43′-39°05′。年有效积温达到3 000 ℃,病害少,年降水量180~200 mm,光照充足,全年日照时间达3 100 h。
1.2 材料及处理
试验以1年生‘赤霞珠’葡萄幼苗进行盆栽试验。种植基质由草炭、珍珠岩、蛭石按照3∶1∶1体积配比拌匀而成,采用4.79 g/L的SM 培养液作补肥,将其分装至花盆中。
由于土壤盐碱毒害不可能为单一胁迫,往往是复合盐碱,且通过前期试验明确了复合盐碱成分高低与植物受到毒害大小的关系。在此基础上,依据贺兰山东麓葡萄产区土壤的盐碱组成,选用2种中性盐NaCl、Na2SO4和2种碱性盐NaHCO3、Na2CO3模拟不同盐碱混合环境条件,将4种盐分按不同的摩尔比例混合,并按碱性盐比例逐步增大顺序分为Ⅰ(NaCl∶Na2SO4=1∶1)、Ⅱ(NaCl∶Na2SO4∶NaHCO3=1∶2∶1)、Ⅲ(NaCl∶Na2SO4∶NaHCO3∶Na2CO3=1∶1∶1∶1)3个处理组,分别为中性盐胁迫、弱碱性盐胁迫及强碱性盐胁迫。每组盐处理各设置50(T50)、100(T100)和150(T150)mmol/L 3个浓度梯度,模拟不同盐渍化程度的盐碱环境,并以常规培养不添加任何盐处理为共同对照(CK),共计10个处理。
盐碱处理液和SM 培养液于‘赤霞珠’幼苗培育10 d后统一依次施用,每隔10 d重新浇灌目标浓度处理溶液,以保持盐分浓度恒定,共施用7次。每盆盐溶液用量按照100 mL 计算。由于试验操作误差、温度和土壤基质的影响,各处理梯度溶液浇灌后采用pH 计进行实测,确定最终pH 值,Ⅰ、Ⅱ、Ⅲ组各浓度梯度盐处理pH 值实测值分别在7.2~7.8、8.3~8.6、9.5~9.6之间。每处理组每个浓度梯度设置6个重复(株)。
1.3 测定指标及方法
盆栽植株地上部分用于测定不同时期葡萄幼苗的生长形态、生理指标及光合指标。生长形态指标测定时,随机选取3 株幼苗,定期(盐处理10,20,30,40,50,60 d)测定各项指标,并定期采集叶片测定生理生化指标:按不同时期(处理30,40,50,60,70 d)采集若干叶片,将各发育期低温处理后的叶片剪成2~3 mm 小段,用液氮冷冻后迅速用药品粉碎机粉碎,置于-80 ℃超低温冰箱保存,用于测定叶片的抗逆性指标,每个处理3个重复。
其中,形态指标株高、茎粗(距离土表1 cm)、叶面积采用游标卡尺、卷尺测定;生理指标过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性和丙二醛含量分别采用愈创木酚法[13]、氮蓝四唑法(NBT)[14]和双组分光光度计法[15]测定;光合相关指标叶片叶绿素相对含量(SPAD 值)使用便携式叶绿素仪器于处理10,20,30,40,50,60 d测定,叶片净光合速率(Pn)、蒸腾速率(Tr)和胞间二氧化碳浓度(Ci)于处理45,60,75 d的晴天选取功能叶采用便携式光合仪活体测定,每个处理选5株,每株6个重复,最后取平均值。
1.4 数据分析
采用Microsoft Excel 2013对数据进行整理,利用SPSS 19.0和Origin 2018进行数据分析和制图。
2 结果与分析
2.1 盐碱胁迫对‘赤霞珠’幼苗生长的影响
2.1.1 株 高
图1显示,随着胁迫时间延长,各处理‘赤霞珠’幼苗株高均呈现出逐渐增加的趋势,但处理间的增长变化存在明显差异,各组盐碱浓度处理的增长量均显著低于CK,并以中性盐组(Ⅰ组)T50处理下表现更为突出,增长量显著低于CK 组24%。
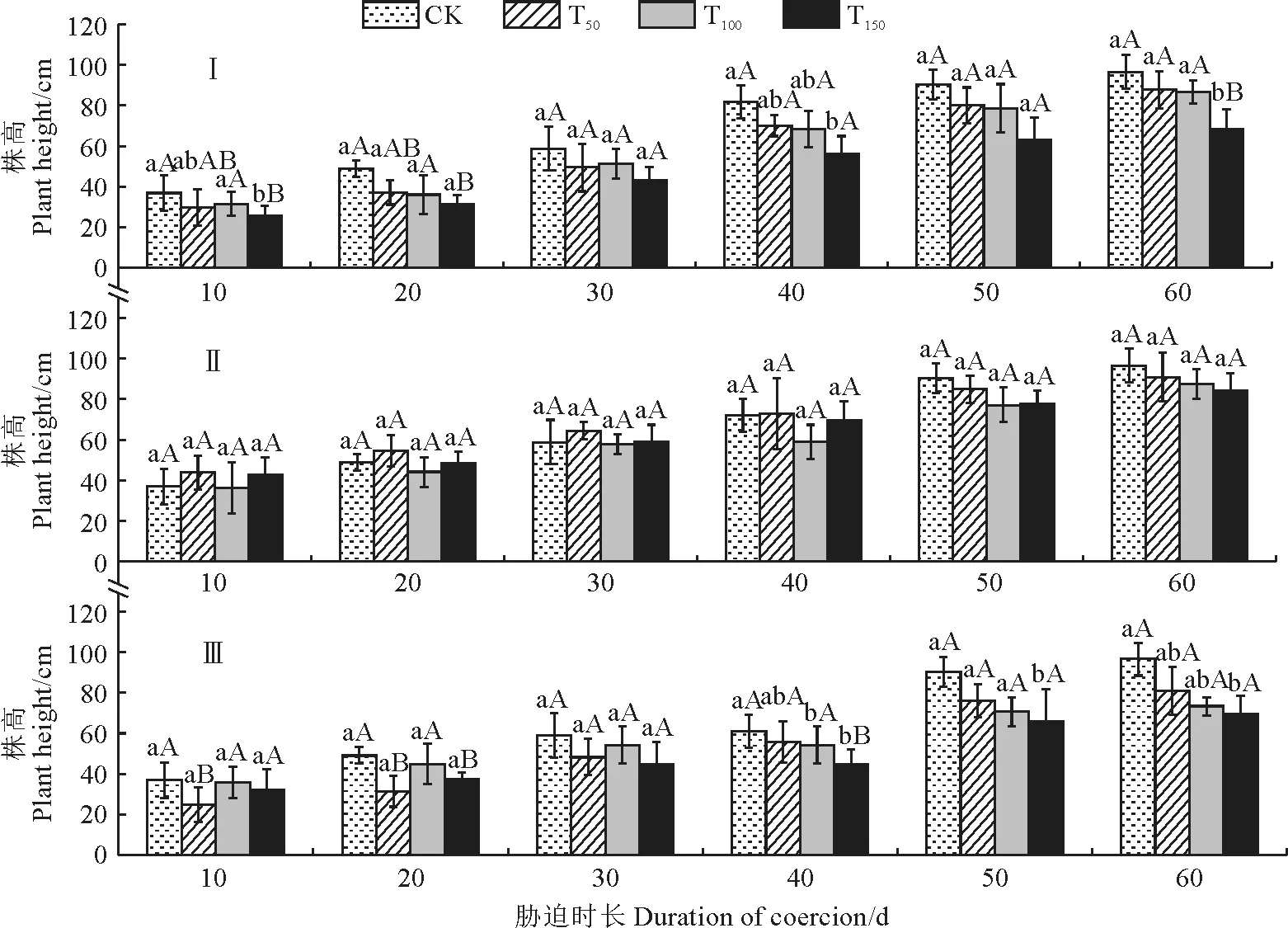
图1 不同时期不同盐碱胁迫处理‘赤霞珠’葡萄幼苗株高变化Ⅰ、Ⅱ、Ⅲ分别表示中性盐、弱碱性盐及强碱性盐胁迫处理组,CK、T50、T100、T150 分别表示0,50,100,150 mmol/L盐浓度处理;同期组内不同小写字母表示浓度间存在显著性差异(P<0.05),同期浓度内不同大写字母表示处理组间存在显著性差异(P<0.05)。下同。Fig.1 Change of plant height of ‘Cabernet Sauvignon’ grape seedlings under salt-alkali stress at different stagesⅠ,Ⅱ,and Ⅲ represent salt-alkali stress groups with neutral salt,weak alkaline salt,and strong alkaline salt,while CK,T50,T100,and T150 stand for 0,50,100,and 150 mmol/L salt treatments,respectively.The different lowercase letters represent the significant difference among concentrations within the same group and stage (P<0.05),and different uppercase letters represent the significant difference between the groups within the same concentration and stage (P<0.05).The same as below.
同时,在相同盐碱处理组(Ⅰ、Ⅱ、Ⅲ)内,‘赤霞珠’幼苗株高均随盐碱胁迫浓度的增大基本呈下降的趋势,且幼苗长势在Ⅰ、Ⅱ组内均以T50处理较好,在Ⅲ组内T50处理自40 d后逐渐优于相应的T100处理。Ⅰ、Ⅱ、Ⅲ组间相比,‘赤霞珠’幼苗株高除在Ⅲ组T50处理10 d、T150处理40 d都较同期Ⅰ、Ⅱ组相应浓度显著降低外,其他浓度下3组间均无显著差异。
2.1.2 茎 粗
葡萄幼苗茎粗在各处理下的变化规律性不明显,其受盐碱胁迫的影响较小(图2)。其中,在处理30 d和40 d 2个时期,3个处理组‘赤霞珠’幼苗茎粗均随盐碱浓度增加主要呈现先增大后减小趋势,并以T50、T100浓度下较大,但仅Ⅱ组T50处理下显著高于对照;同时,在相同盐碱浓度下,幼苗茎粗在同期Ⅰ、Ⅱ、Ⅲ组之间无显著性差异。

图2 不同时期不同盐碱胁迫处理‘赤霞珠’葡萄幼苗茎粗变化Fig.2 Change of stem diameter of ‘Cabernet Sauvignon’ grape seedlings under salt-alkali stress at different stages
与处理10 d相比,盐碱胁迫处理60 d时,葡萄幼苗茎粗增长量在CK 组为26.6%,在Ⅰ组(T50、T100、T150)分别为43.9%、13%、30%,Ⅱ组分别为53%、15%、30%,Ⅲ组处理下分别为31%、49%、21%,即弱碱性盐组T50胁迫处理的增长值最大。
2.1.3 最大叶面积
如图3所示,在Ⅰ组中,‘赤霞珠’幼苗最大叶面积在不同时期随盐碱胁迫浓度的增高大多呈先增后减的趋势,且各个时期大多在T50处理下最大,但多与同期对照无显著性差异,其在处理60 d时较CK提高3.38%。在Ⅱ组中,各浓度处理幼苗最大叶面积在胁迫10~40 d时多高于对照并达到显著水平,在胁迫50~60 d时均稍低于对照。在Ⅲ组中,各浓度处理最大叶面积在胁迫10~40 d时与对照均无显著差异,在胁迫50~60 d时随着浓度的增加而减小,且多差异显著。在相同盐碱浓度处理下,‘赤霞珠’幼苗最大叶面积增长幅度表现为中性和弱碱性盐胁迫组高于强碱性盐胁迫组。
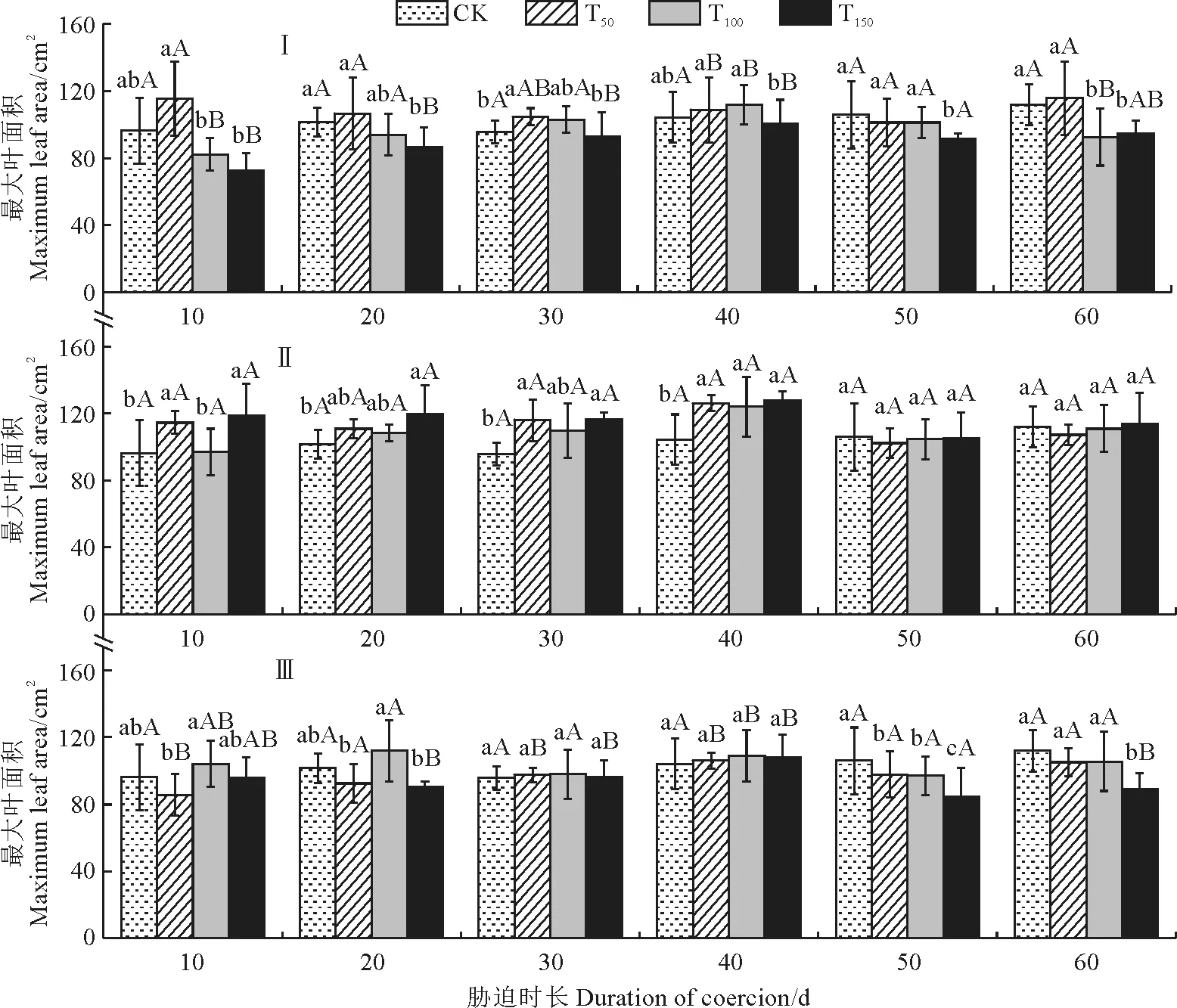
图3 不同时期不同盐碱胁迫处理‘赤霞珠’葡萄幼苗最大叶面积变化Fig.3 Changes of maximum leaf area of ‘Cabernet Sauvignon’ grape seedlings under salt-alkali stress at different stages
2.2 盐碱胁迫对‘赤霞珠’幼苗叶片抗氧化酶活性和丙二醛含量的影响
2.2.1 过氧化物酶(POD)活性
由图4可知,各组盐碱处理‘赤霞珠’幼苗的叶片POD 活性随着盐碱胁迫时间的增加基本呈先减弱后增强再减弱的趋势。与对照相比,各组幼苗POD 活性在不同浓度盐碱胁迫下大多不同程度升高,基本都在浓度T150时达到最大值,Ⅰ、Ⅱ、Ⅲ组POD 活性在T150浓度处理50 d时分别比CK 提高13%、3.1%、42%,且Ⅰ、Ⅲ组增幅达显著水平。处理组间相比较,Ⅲ组叶片POD 活性在处理30~50 d时均高于相同浓度的Ⅰ、Ⅱ组,但随着时间处理延长,到处理60 d后逐渐低于同浓度Ⅰ、Ⅱ组,其中T150浓度表现得更明显。由此可见,‘赤霞珠’幼苗叶片中POD 活性在盐碱胁迫下升高,且在高浓度处理下活性仍显著高于对照,说明它在一定范围内能够有效抵抗盐碱胁迫引起的氧化胁迫。
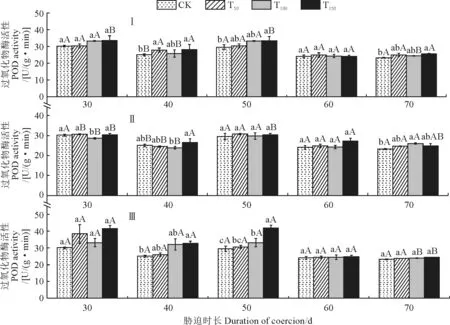
图4 不同时期不同盐碱胁迫处理‘赤霞珠’葡萄幼苗叶片过氧化物酶活性变化Fig.4 Changes of peroxidase activity in leaves of ‘Cabernet Sauvignon’ grape seedlings under salt-alkali stress at different stages
2.2.2 超氧化物歧化酶(SOD)活性
图5显示,Ⅰ、Ⅱ、Ⅲ组‘赤霞珠’幼苗的叶片SOD活性在胁迫30~60 d期间整体随着盐碱浓度的增加而变化不明显,各浓度处理及CK 之间多无显著差异,此时同期相同浓度的处理组间也均无显著差异。
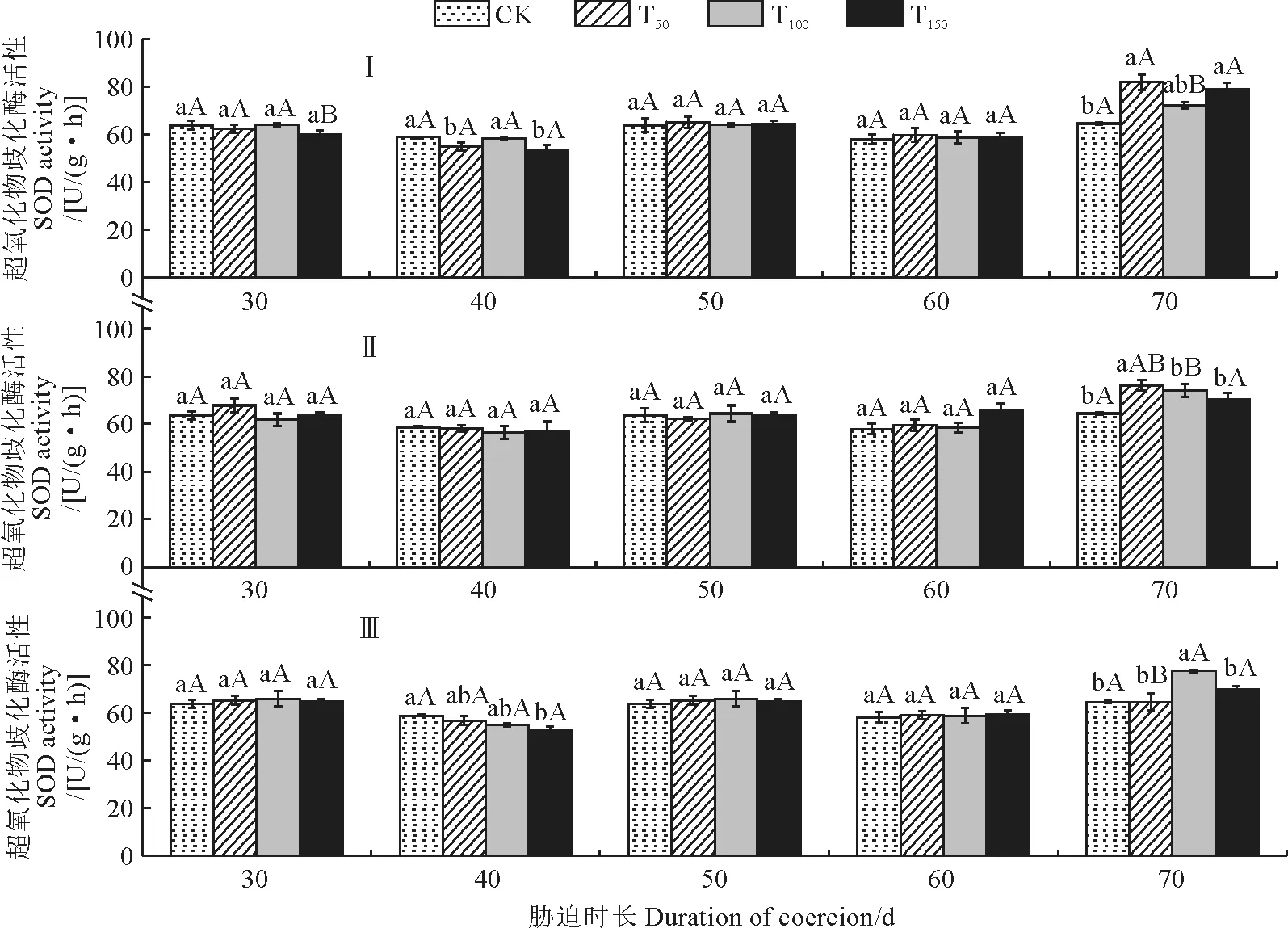
图5 不同时期不同盐碱胁迫处理‘赤霞珠’葡萄幼苗叶片超氧化物歧化酶活性变化Fig.5 Changes of superoxide dismutase activity in leaves of ‘Cabernet Sauvignon’ grape seedlings under salt-alkali stress at different stages
在盐碱胁迫处理70 d时,各组叶片SOD 活性随盐碱浓度增加呈现先增大后减小的趋势,但均不同程度高于对照,其中 Ⅰ 和 Ⅱ 处理组均在T50浓度下达到最高值,比相应CK 分别显著提高27%和18%,而Ⅲ组在T100浓度时达到最大值,并显著高于其他浓度处理;处理组间相比,Ⅰ 组SOD 活性在T50浓度下与 Ⅱ 组相近,而显著高于Ⅲ组;Ⅰ 组在T100浓度时仍与 Ⅱ 组相近,但两者均显著低于Ⅲ组;3组处理间在T150浓度时无显著差异。可见,‘赤霞珠’幼苗叶片SOD 活性在不同组、不同浓度盐碱胁迫下变化不如POD 活性明显。
2.2.3 丙二醛(MDA)含量
由图6 可知,3 个处理组‘赤霞珠’幼苗叶片MDA 含量随着盐碱浓度的增加主要呈先升再降趋势,且均不同程度高于相应对照,同期Ⅰ组多在盐碱浓度T100时达到峰值,Ⅱ、Ⅲ组多在T50时最高。

图6 不同时期不同盐碱胁迫处理‘赤霞珠’葡萄幼苗叶片丙二醛含量变化Fig.6 Changes of malondialdehyde content in leaves of ‘Cabernet Sauvignon’ grape seedlings under salt-alkali stress at different stages
在处理70 d时,Ⅰ组叶片MDA 含量在T100时达到峰值,而Ⅱ、Ⅲ组均在T50时最高,分别为4.60,4.55,4.06 mmol/g,且此时MDA 含量在T100浓度下表现为Ⅱ组显著高于Ⅰ、Ⅲ组,在T150浓度下则表现为Ⅰ、Ⅱ组显著高于Ⅲ组。
由此可见,在盐碱胁迫下,‘赤霞珠’幼苗叶片中SOD、POD 的活性升高,减轻了活性氧自由基的伤害,并且它们活性在高盐碱混合胁迫处理下仍显著高于对照,说明在一定盐碱胁迫范围内,‘赤霞珠’幼苗能够有效抵抗盐胁迫引起的氧化胁迫;而在高浓度盐碱胁迫下,‘赤霞珠’幼苗叶片中MDA 积累增多,其细胞膜脂质的氧化程度增高,幼苗受到的损伤更严重。
2.3 盐碱胁迫对‘赤霞珠’葡萄幼苗叶片光合指标的影
2.3.1 叶绿素相对含量
从图7可以看出,‘赤霞珠’葡萄叶片不同时期叶绿素相对含量(SPAD)在不同组、不同浓度盐碱胁迫下基本保持不变,在盐碱浓度间、盐碱组之间均无显著差异。
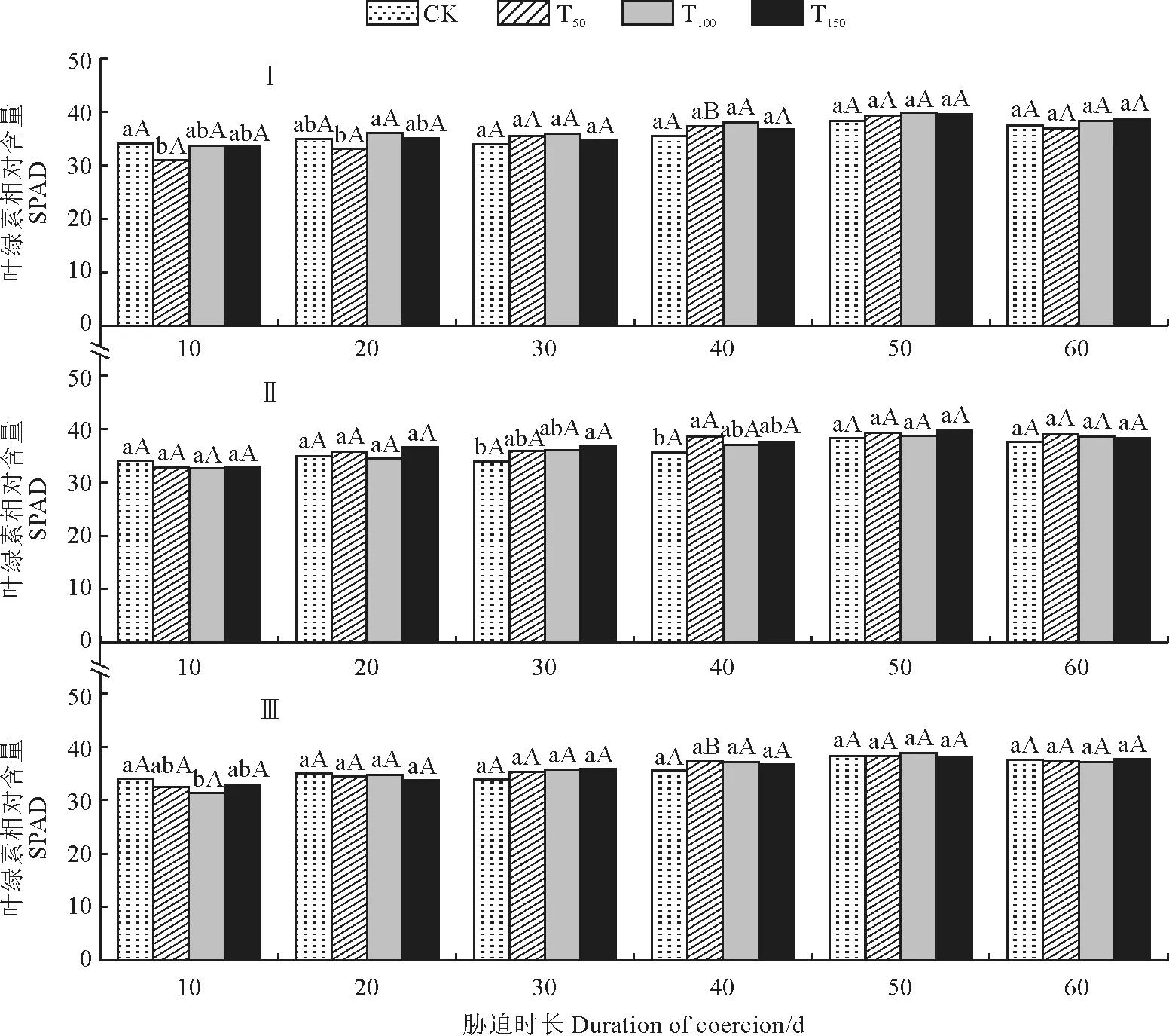
图7 不同时期不同盐碱胁迫处理‘赤霞珠’葡萄幼苗叶片的SPAD 变化Fig.7 Changes of SPAD in leaves of ‘Cabernet Sauvignon’ grape seedling under salt-alkali stress at different stages
2.3.2 净光合速率(Pn)
如表1所示,在盐碱胁迫处理45 d时,各组‘赤霞珠’葡萄幼苗叶片Pn随着盐碱浓度增加呈先上升后下降的趋势,且均在T50浓度下达到最高,但各浓度处理均与对照无显著差异;在盐碱胁迫60 d时,各组盐处理叶片Pn均随着浓度的上升整体呈下降趋势,在各浓度处理下均低于对照,但仅Ⅱ组T150浓度和Ⅲ组T50、T150浓度降幅达到显著水平;在胁迫75 d时,各组盐碱处理叶片Pn与对照相比均无显著变化。同时,在同期相同盐碱浓度处理下,叶片Pn在3个盐碱处理组间多无显著差异,仅Ⅲ组T50浓度处理75 d 时显著低于同期Ⅰ、Ⅱ处理组。
2.3.3 蒸腾速率(Tr)
由表1可知,各组‘赤霞珠’幼苗叶片Tr随着胁迫处理时间的延长有先增后减的趋势,而随盐碱浓度的增加有逐渐下降趋势,但叶片Tr在同期盐碱浓度及对照之间、同浓度处理组之间均无显著差异。
2.3.4 胞间CO2 浓度(Ci)
胞间CO2浓度常用来判断光合速率变化的主要原因是否为气孔因素导致的一个必不可少的依据。如表1所示,各盐碱胁迫组‘赤霞珠’幼苗叶片Ci随着盐碱浓度的上升主要呈下降趋势。在胁迫45 d时,Ⅰ组各浓度处理叶片Ci均与CK 无显著差异,Ⅱ和Ⅲ组叶片Ci均仅在T150浓度下显著低于CK(P<0.05),而相同盐碱浓度下叶片Ci在3组处理之间均差异不显著;在盐碱胁迫处理60 和75 d时,‘赤霞珠’幼苗叶片Ci在同期组内不同浓度之间、相同浓度3组盐碱处理之间均差异不显著。

3 讨论
植物耐盐碱性是对逆境响应和植物生长状况的综合反映。通常在盐碱胁迫下植株会通过调节根际的渗透压,从而改变细胞膜脂结构,以此影响根系对水分和养分的吸收,进而影响植株的生长[16]。在植物遭受盐碱胁迫时,植物的形态指标[17]、生理代谢[18]和光合作用[19]等均会随着盐碱胁迫浓度的提高而受到不同程度的影响。形态变化和生长指标是反映植物受盐害程度的重要指标[20],在盐胁迫下植物的株高、茎粗和单株叶面积等均会发生变化[21]。
本研究发现,‘赤霞珠’葡萄的株高随盐碱胁迫程度不同而发生变化,但各处理均显著低于对照,并以T150处理表现最为明显,这与于天一等[22-23]的研究结果一致。植物受混合盐碱胁迫后会导致生长发育缓慢,也有研究表明一些植物耐盐碱指数呈正态分布,低浓度盐碱胁迫促进其生长,而高浓度抑制生长[24-25],本研究中‘赤霞珠’幼苗茎粗的表现基本与之一致,即其茎粗随盐碱胁迫浓度增大整体呈现先增大后减小趋势。
同时,本研究结果表明各组盐碱胁迫浓度对‘赤霞珠’葡萄叶片叶绿素相对含量无显著影响,在发育前期叶面积对盐碱浓度的响应与叶绿素较为相似,其可能原因为盐碱胁迫对植物的抑制作用与盐碱组成、浓度及植物受盐碱环境胁迫时间等密切相关[26]。而在处理后期,‘赤霞珠’叶面积随着盐碱浓度的增长呈减小趋势,与秦景等[27]的研究结果一致。随着盐碱浓度增加,本研究中‘赤霞珠’单株总叶面积显著下降,这可能是混合盐碱胁迫不仅破坏了植物叶片叶绿体结构,引起光合能力的减弱,同时造成植物生理干旱,引起植物吸水困难,进而导致生理代谢的紊乱。另外,在盐胁迫后期,相同盐碱浓度下Ⅲ组‘赤霞珠’幼苗的叶面积明显较Ⅰ、Ⅱ组低,进一步说明不同盐碱成分配比对幼苗叶面积具有显著的影响。
另外,植物通常通过自身活性氧清除体系来响应非生物胁迫,常伴随着抗氧化酶活性的增加,如SOD、POD 等[28]。SOD、POD 活性和MDA 含量都属于植物抗氧化系统中主要指标,其水平变化反映植物遭受逆境胁迫的过程。葡萄为多年生植物,自身对混合盐碱胁迫承受能力较强,本试验中‘赤霞珠’幼苗叶片POD 活性随着盐碱浓度的增大呈现不同程度升高的趋势,在处理30~50 d时,强碱性盐胁迫T150浓度下叶片的POD 活性显著高于其他浓度处理,而马宝贵等[29]研究发现POD 活性随着盐碱浓度的升高呈先升高后下降的趋势,造成这种差异的原因可能与本试验所设浓度不同及所设置盐碱组成成分相关。此外,本试验还发现在T150浓度处理下,Ⅲ处理组POD 活性在处理30~50 d时显著高于同浓度其他两组处理,但到处理60 d后逐渐低于其他两处理组,说明复杂的盐碱胁迫使‘赤霞珠’幼苗更具抗性,但胁迫时间过长会使‘赤霞珠’葡萄抗逆性有一定的下降。另外,有研究表明,盐碱胁迫下作物的SOD 活性会随NaCl浓度增加而上升[30]。本试验中‘赤霞珠’幼苗叶片SOD 活性在盐碱胁迫处理70 d后呈现先增大后减小的趋势,造成该现象出现的原因除了试验设计中的盐碱组成不同之外,还可能与植物自身的抗氧化能力有关[31]。而‘赤霞珠’幼苗的叶片MDA 含量随着盐碱浓度的升高主要呈先上升再下降趋势,这与李贵吉等[32]的研究结果一致。整体而言,本研究中‘赤霞珠’幼苗表现出较好的耐盐碱胁迫能力,其在中度盐碱胁迫下适应性较强,这与唐榕等[33]的研究结果一致。
此外,本研究中各组盐碱胁迫下‘赤霞珠’葡萄叶片的净光合速率较低,但光合潜能受到的影响不显著。叶片光合速率下降的原因可能有以下几方面:细胞膜脱水降低了对CO2的渗透性,盐毒害,气孔主动关闭引起的CO2供应量减少,盐分引起衰老叶片增多,细胞质结构改变引起的酶活性发生变化,以及库活力降低引起的负反馈等。
综上所述,本试验通过对盐碱胁迫‘赤霞珠’幼苗生长参数及生理指标的分析,发现随着盐碱浓度的增加,幼苗的生长受到显著抑制,如叶片萎蔫发黄、植株生长受到抑制、生物量积累减少等。同时,赤霞珠幼苗的SOD、POD 的活性随盐碱浓度的增加呈现先增加后降低的趋势,叶片的光合作用也随盐碱胁迫浓度的增加受到不同程度的影响。本试验虽以模拟贺兰山东麓土壤环境来设计浓度梯度,盆栽试验与大田试验相比,外界的影响因素较少,但‘赤霞珠’葡萄的耐盐碱性是由多个基因共同表达或拮抗所综合展示的结果,其耐盐碱机理也尚未完全明了,今后应该从更多的方面综合分析耐盐性,并对‘赤霞珠’葡萄耐盐碱机理进行更深入研究,以便对酿酒葡萄耐盐碱性在实践中应用提供一定的理论参考。
4 结论
通过盆栽试验测定不同时期、类型、浓度盐碱胁迫下‘赤霞珠’葡萄的形态指标、叶片抗逆生理指标和光合指标。
(1)‘赤霞珠’幼苗株高随处理时间不断增长,盐胁迫处理的增长量显著低于对照,且株高随胁迫浓度的增大基本呈下降趋势,茎粗随盐碱浓度增长主要呈现先增大后减小趋势。
(2)‘赤霞珠’幼苗的叶片POD 活性随着盐碱浓度的增大呈现先缓慢增长继而减弱的趋势,SOD活性在处理70 d后随盐碱浓度的增加呈现先增大后减小的趋势,叶片MDA 含量随着盐碱浓度的升高主要呈先上升再下降趋势。
(3)胞间CO2浓度亦随着盐碱浓度的上升呈下降趋势并主要以T50浓度较高,净光合速率、蒸腾速率随着盐碱浓度的上升主要呈先上升后下降趋势。
(4)在T50浓度处理下,‘赤霞珠’幼苗的株高、最大叶面积、胞间CO2浓度、净光合速率、蒸腾速率均呈现较好的增长趋势。
