基于转录组测序的油菜花粉BpFLS 基因克隆与分析
2024-03-08刘晓宁郭宇锦蒋雨萱王一凡陆玉晴徐全乐
刘晓宁,郭宇锦,蒋雨萱,王一凡,陆玉晴,徐全乐
(1 黄河科技学院,郑州 450006;2 西北农林科技大学 生命科学学院,陕西杨凌 712100)
油菜属于十字花科芸薹属植物,其栽培品种主要包括甘蓝型油菜(BrassicanapusL.)[1],白菜型油菜(BrassicarapaL.)[2]和芥菜型油菜(Brassica junceaL.)[3]。甘蓝型油菜具有较高的营养价值,农业产量和观赏价值,目前是世界上广泛种植的第二大油料作物[4-6]。白菜型油菜具有抗寒、耐瘠薄、生育期短等优良特性,且种植历史悠久,遗传变异丰富,是油菜育种的重要资源库[7]。油菜花粉是中国最富产的花粉,黄酮类物质是油菜花粉中重要的活性物质,不仅具有抗氧化和预防多种疾病等作用[8],而且在植物生长发育和抵御逆境胁迫中发挥着重要作用[9-13]。
黄酮醇是植物中最丰富的类黄酮,根据苯环(B环)的羟基化模式分为山萘酚和槲皮素[14-16]。黄酮醇来自于苯丙烷类代谢途径,黄酮醇合成酶(flavonoid synthase,FLS)、黄烷酮-3-羟化酶(flavonoid 3-hydroxylase,F3H)在黄酮醇生物合成及积累中发挥关键作用[17]。FLS包含2个高度保守的蛋白结构域 DIOX_N(Pfam:PF14226)和 2OC-Fell_Oxy(Pfam:PF03171),因此与F3H 都属于2-酮戊二酸依赖性双加氧酶(2-oxoglutaratedependent dioxygenase,2-ODD)家族[18]。FLS基因在拟南芥(ArabidopsisthalianaL.)[19-20]、苦荞(FagopyrumtataricumL.)[21]、罗布麻(ApocynumvenetumL.)[22]、玉米(ZeamaysL.)[23]、葡萄(VitisviniferaL.)[24-25]和水稻(OryzasativaL.)[26]等植物中已有诸多报道,近年来,油菜FLS基因也被分离并对其开展了广泛研究,Vu 等[27]从Hanla油菜幼苗中克隆BnFLS基因,过表达BnFLS转基因油菜表现出明显高的黄酮醇含量,ROS水平降低引起植株抗氧化能力显著增加。Schilbert等[28]研究了13 个BnaFLS基因在甘蓝型油菜Express 617中的基因结构、基因组定位和表达模式,发现BnaFLS1-1_express617和BnaFLS1-2_express617 可以恢复拟南芥ans/fls1和f3h突变体中山萘酚和槲皮素的含量,表明FLSs在生成二氢山萘酚和山萘酚中发挥了双功能酶的作用。BnFLSs基因启动子都含有MYB 识别序 列(5′-AcCTACCa-3′/5′-tGGTAGgT-3′),表 明油菜黄酮醇的合成途径在转录水平上主要受R2R3-MYB转录因子的调控[29]。
门源油菜是青海省油料主产区之一,其花粉是前列康牌普乐安片的主要原料。门源油菜性阴凉、耐寒冷、生长期短、抗性强。然而,门源油菜花粉积累丰富的类黄酮物质含量和油菜抗逆性在分子水平上的研究少有报道,且FLS基因在门源油菜中还鲜见报道。因此,该研究依据门源油菜花粉与郑州油菜花粉差异转录组测序数据,筛选BpFLS(BrassicapollenFLS)基因并进行生物信息学分析和基因克隆,为进一步分析BpFLS基因功能提供一定参考依据。
1 材料和方法
1.1 材 料
供试材料来源于青海门源油菜青油241,河南郑州油菜豫油1号。
1.2 候选基因筛选
随机采集若干株油菜花粉混合,3次平行取样。用Trizol试剂提取花粉总RNA,由北京诺禾致源科技股份有限公司构建测序文库,用Illumina NovaSeq 6000测序平台进行转录组双末端测序。经过原始数据过滤、测序错误率检查、GC 含量分布检查,获得后续分析使用的有效数据(clean reads)。用HISAT2软件将有效数据与甘蓝型油菜参考基因组(ensemblplants_brassica_napus_ ast_ prjeb5043_v1 _gca_000751015_1)进行快速精确比对,获取clean reads在参考基因组上的定位信息,用String-Tie软件进行新转录本组装,通过PFam、GO 和KEGG 等数据库注释新转录本,用subread软件统计每个基因从起始到终止范围内覆盖的测序序列数(reads count),通过FPKM 计算基因的表达值,DESeq筛选差异表达基因,筛选标准为|log2αFC|≥1,且P≤0.05。
1.3 生物信息学分析
通过在线软件ExPASy-ProtParam 对候选基因的基本理化性质进行分析;用ExPASy-PortScale、TMHMM server 2.0、SignalP 5.0 server和Plant-mPLoc v.2.0进行亲/疏水性预测、蛋白质跨膜结构域预测、信号肽预测和亚细胞定位分析;用SWISS-MODLE进行蛋白质的三级结构预测。
1.4 系统进化树构建和多序列比对分析
下载拟南芥和油菜中已报道的FLS氨基酸序列[19-20,27-28],用Clustal W 进行多序列比对,MEGA 11.0 软件构建进化树,Bootstrap method 设置为2 000,通过iTOL v3美化进化树。
用EMBL-EBI网站的Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)分析工具,对BpFLSs基因和其他已知FLS的氨基酸序列进行多重序列比对,并用Jalview 进行多序列比对可视化,分析与FLS功能相关的保守结构域。
1.5 RACE扩增
按照天根RNAprep Pure 多糖多酚植物总RNA 提取试剂盒(DP441)操作说明提取总RNA,使用全式金EasyScript® All-in-One First-Strand cDNA Synthesis SuperMix for qPCR(one-step gDNA removal,N20415)获得油菜各组织cDNA。根据转录组数据设计BpFLSs基因的荧光定量PCR引物P1/P2(表1),参照全式金PerfectStart® Green qPCR SuperMix说明书,以Actin基因为内参进行实时荧光定量PCR分析。设置3个重复,采用2-ΔΔCT计算基因相对表达量。目的基因编码区扩增条件:94 ℃预变性60 s,98 ℃变性10 s,55 ℃退火15 s,68 ℃延伸60 s,35个循环,最后72 ℃延伸10 min。
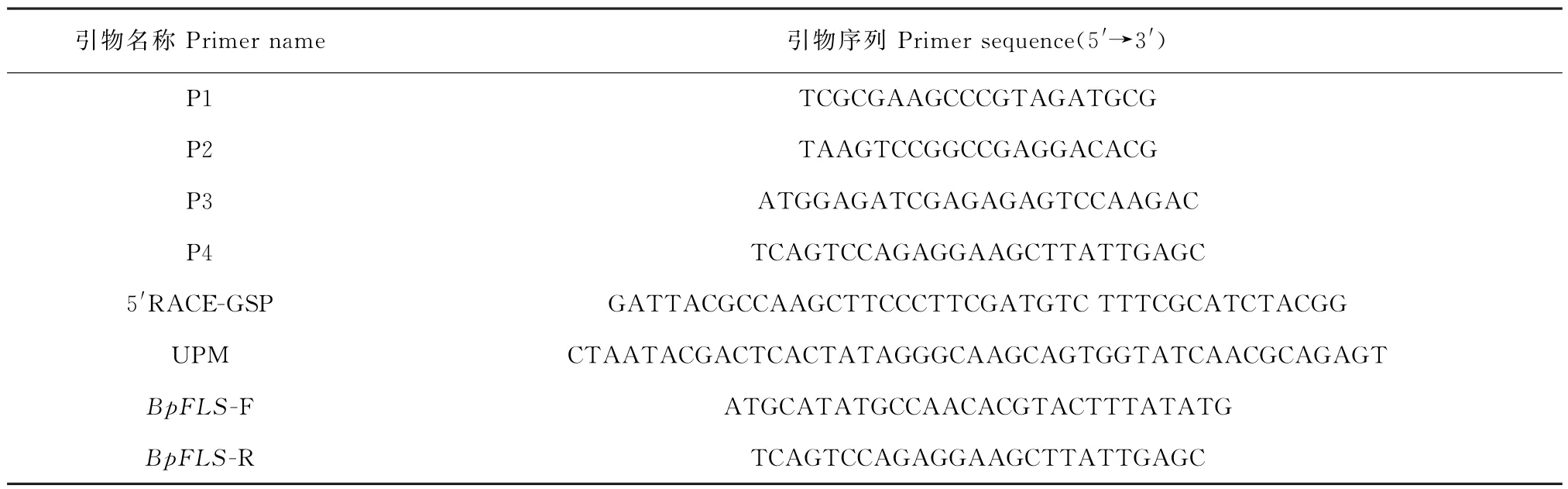
表1 PCR 所用引物Table 1 Primers for PCR analyses
根据InvitrogenTMTRIzolMT试剂说明书提取青海门源油菜花粉RNA,按照SMARTer® RACE 5′/3′Kit制备cDNA。根据转录组数据设计Bp-FLS1-1编码区引物P3/P4(表1),PCR 反应体系含10×Ex Taq Buffer 2 μL,10 μmol/L dNTPs mixture 2 μL,10 μmol/L FLS-F 1 μL,10 μmol/L FLS-R 1 μL,5 U/μL Ex Taq DNA 聚合酶0.5 μL,cDNA 1 μL,并用灭菌蒸馏水补充至20 μL。PCR 反应条件:94 ℃预变性2 min,94 ℃变性30 s,55 ℃退火30 s,72℃延伸60 s,35个循环,最后72 ℃延伸5 min。
根据所得的已知编码区设计5′端特异引物,以5′RACE-GSP/UPM 为引物建立RACE-PCR 反 应体系,扩增程序:94 ℃变性30 s,72 ℃延伸3 min,5个循环;94 ℃变性30 s,70 ℃退火30 s,72 ℃延伸3 min,5个循环;94 ℃变性30 s,68 ℃退火30 s,72℃延伸3 min,25个循环。回收PCR 产物,连接到pRACE载体,转化感受态细胞,阳性克隆送至生工测序。用Vector NTI软件将测序得到的片段拼接得到BpFLS 的完整CDS 序列,设计全长引物Bp-FLS-F/BpFLS-R(表1),通过PCR 扩增得到目的条带,用M13载体通用引物对阳性重组子进行测序。
2 结果与分析
2.1 差异表达基因BpFLS 筛选
油菜花粉转录组测序后,获得原始数据量在42.95~52.20 M 之间,原始测序量在6.44~7.83 G 之间;过滤后的平均数据量为45.06 M,平均测序量为6.76 G,Q30均值为93.72%,GC 含量均值为47.12%,表明测序质量良好,有效数据(clean reads)质量合格可用于后期数据分析。使用HISAT2和StringTie软件对有效数据进行比对和组装,获得基因83 013个,KEGG 数据库中注释的为46 339个,其中,有92个基因参与类黄酮生物合成代谢通路。以|log2αFC|≥1且P≤0.05为标准进行青海门源油菜花粉和河南郑州油菜花粉的差异转录组分析(图1),结果显示48个基因在不同来源的花粉中显著差异表达,BpFLS基因家族成员被鉴定6个(表2),BpFLS1-1、BpFLS2、BpFLS3-1和BpFLS3-2基因在青海油菜花粉中显著上调,Bp-FLS1-2和BpFLS4显著下调,差异表达增强最大的为BpFLS1-1。

图1 油菜花粉类黄酮生物合成通路的差异表达基因Hz.河南郑州;Qm.青海门源。Fig.1 The differentially expressed genes in flavonoid biosynthesis pathways in rape pollenHz,Zhengzhou,He'nan;Qm,Menyuan,Qinghai.

表2 筛选的BpFLS 基因Table 2 Selected BpFLS genes
2.2 BpFLS 基因的生物信息学分析
2.2.1 BpFLS 基因编码产物的基本性质分析
用ExPASy ProtParam 在线软件对BpFLSs蛋白进行理化性质的分析,预测结果(图2)显示,BpFLS1-1蛋白由336个氨基酸组成,相对分子质量38 273.75 D,理论等电点为5.48,属于酸性蛋白;含C、H、O、N、S共5种元素,分子式为C1737H2702N458O503S7,总原子数为5 407;有20种组成氨基酸,含量由大到小分别为亮氨酸(Leu)9.8%、谷氨酸(Glu)9.5%、脯氨酸(Pro)8.9%、缬氨酸(Val)8.0%、赖氨酸(Lys)6.5%、丝氨酸(Glu)6.2%、天冬氨酸(Asp)6.0%、异亮氨酸(Ile)6.0%、精氨酸(Arg)5.7%、甘氨酸(Gly)5.7%、丙氨酸(Ala)5.1%、苯丙氨酸(Phe)3.6%、苏氨酸(Thr)3.6%、酪氨酸(Tyr)3.6%、天冬酰胺(Asn)3.0%、组氨酸(His)3.0%、谷氨酰胺(Gln)2.1%、色氨酸(Trp)1.8%、蛋氨酸(Met)1.5%、半胱氨酸(Cys)0.6%;精氨酸和赖氨酸共带41个正电荷,谷氨酸和天门冬氨酸共带52个负电荷;半衰期在大肠杆菌体内大于10 h,在酵母菌体内大于20 h,在哺乳动物体外网状红细胞为30 h;该蛋白为不稳定蛋白,其稳定系数为44.91;脂肪系数为89.88。BpFLS1-2、BpFLS2、BpFLS3-1、Bp-FLS3-2和BpFLS4均为酸性蛋白,氨基酸组成中占比最高的氨基酸为谷氨酸(Glu)、亮氨酸(Leu)和缬氨酸(Val),最低为半胱氨酸(Cys);与BpFLS1-1蛋白一样,BpFLS1-2 属于不稳定蛋白,BpFLS2、Bp-FLS3-1、BpFLS3-2和BpFLS4均为稳定蛋白。

图2 BpFLS1-1为代表的亲水性、跨膜结构、信号肽和三级结构的预测分析Fig.2 Analysis of hydrophilicity,transmembrane structure,signal peptide,and tertiary structure of BpFLS1-1
2.2.2 BpFLS蛋白的亲/疏水性和跨膜域分析
用ExPASy K-D 法对BpFLSs蛋白进行亲/疏水性的分析,预测结果(图2)显示,BpFLS1-1蛋白亲水性最低值为-2.778,位于第153位氨基酸,疏水性最高值为2.011,位于第256位氨基酸。从整条肽链的氨基酸预测值来看,大部分为负值,没有明显的疏水区域,且平均疏水性为-0.414,表明该蛋白是一种亲水性蛋白。与BpFLS1-1一样,BpFLS1-2、BpFLS2、BpFLS3-1、BpFLS3-2 和BpFLS4 蛋 白的亲水性平均系数均为负值,表明油菜花粉FLS蛋白都是亲水性蛋白。
通过在线软件TMHMM 2.0对BpFLSs蛋白进行跨膜结构的分析,预测结果(图2)显示,Bp-FLS1-1、BpFLS2、BpFLS3-1、BpFLS3-2和BpFLS4蛋白不存在跨膜结构域,因此,油菜花粉FLS蛋白均为非跨膜蛋白。
2.2.3 BpFLS蛋白信号肽、亚细胞定位和三级结构分析
用Signal P 5.0在线分析软件对油菜花粉FLS基因所编码的蛋白质进行信号肽预测。预测结果(图2)显示,这6个BpFLS蛋白质的氨基酸残基平均信号肽最大得分值小于0.5,均无信号肽。因此,油菜花粉FLS蛋白均为非分泌型蛋白。
用Plant-mPLoc 2.0在线软件对油菜花粉的黄酮醇合酶进行亚细胞定位预测。与上述通过Signal P 5.0 平台对信号肽的预测结果吻合,油菜花粉FLS蛋白定位在细胞质中的可能性最大。
用SWISS-MODEL在线工具,对FLS蛋白进行三级结构预测(图2)。油菜花粉FLS蛋白主要以α螺旋为主,其次是无规则卷曲,延伸链占的比重最小。
2.3 BpFLSs系统进化分析
拟南芥与油菜同为十字花科植物,其基因组包含6个FLS基因,迄今为止甘蓝型油菜中已报道了14个FLS基因,在FLS氨基酸序列的系统进化树中,18个FLS聚为4个分支,BpFLS1-1_pollen、Bp-FLS1-2_pollen 与AthFLS1、BnFLS、BnaFLS1-1_express617、BnaFLS1-2_express617 聚类到第1 个分支FLS1 家族,BpFLS2_pollen 与AthFLS2、BnaFLS2-1_express617聚类到第2个分支FLS2家族,BpFLS3-1_pollen、BpFLS3-2_pollen 与Ath-FLS3、BnaFLS3-3_express617、BnaFLS3-4_express617聚类到第3 个分支FLS3 家族,BpFLS4_pollen与AthFLS4 聚类到第4 个分支FLS4 家族(图3)。
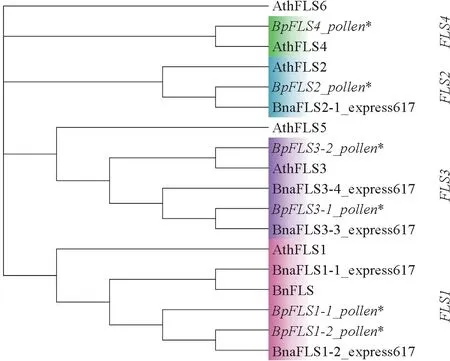
图3 BpFLS 基因和拟南芥、油菜FLS 基因的系统发育分析Fig.3 Phylogenetic analysis of BpFLS candidates and FLS genes from Arabidopsis thaliana and Brassica napus
2.4 BpFLS氨基酸序列分析
多序列比对分析发现BpFLSs蛋白与拟南芥AthFLS、Express617 油 菜BnaFLS 和Hanla 油 菜BnFLS具有较高的同源性,BpFLS1-1与AthFLS1、BnFLS和BnaFLS1-1 的相似性分别为91.96%,98.81%和98.81%,BpFLS1-2与AthFLS1、BnFLS和BnaFLS1-2的相似性分别为91.37%,97.92%和99.70%,BpFLS2与AthFLS2、BnFLS和BnaFLS2-1的相似性分别为70.85%,61.11%和100.00%,Bp-FLS3-1与AthFLS3、BnFLS和BnaFLS3-3的相似性分别为67.65%,60.91%和100.00%,BpFLS3-2与AthFLS3、BnFLS 和BnaFLS3-3 的相似性分别为82.49%,65.20%和71.86%,BpFLS4与AthFLS4和BnFLS的相似性分别为58.69%和56.54%(表3)。

表3 油菜花粉BpFLS与其他成员的序列同源性Table 3 Sequence identity of BpFLS and other members %
BpFLSs蛋白序列中存在多个高度保守的氨基酸和基序,6个BpFLSs蛋白质结构中都包含与Fe2+结合的组氨酸、苏氨酸和天冬氨酸共3个保守氨基酸,以及与2-酮戊二酸结合的精氨酸、苏氨酸共2个保守氨基酸,然而,与底物结合的保守氨基酸分析显示BpFLS2和BpFLS4蛋白质有多个位点的氨基酸变化。Bp-FLS2、BpFLS3-2、BpFLS4缺少与FLS活性相关的重要基序——“P***IR***EQP”,“CPQ/RP*LAL”,“S**T*LVP”,但是保留了F3H 活性相关的A、G、H、P、P、P、H、D、G、H、R、S等12个氨基酸。与BnaFLS1s相似,BpFLS1-1和BpFLS1-2为双功能酶,含有与F3H和FLS活性相关的所有氨基酸和基序(图4)。

图4 油菜花粉BpFLS与其他FLS的多重比较分析“P***IR***EQP”(紫色),“CPQ/RP*LAL”(蓝色),“S**T*LVP”(橙色)是FLS活性必需的保守基序;绿色代表与底物结合的氨基酸,粉色代表与Fe2+结合的氨基酸,黄绿色代表与2-酮戊二酸结合的保守氨基酸;黑框代表与F3H 活性相关的氨基酸;紫蓝色和黄色表示其他高度保守序列。Fig.4 Multiple comparison analysis of BpFLS with other FLSThe “PxxxIRxxxEQP”,“CPQ/RPxLAL”,and “SxxTxLVP” motifs are shown in purple,blue and orange,while residuesi nvolved in substrate-,ferrous iron-,and 2-oxoglutarate-binding are marked in green,pink,and chartreuse,respectively.Residues relevant for F3H activity are marked with a black box.Other highly conserved amino acids are labeledi n violet and yellow.
2.5 BpFLS1-1 基因克隆
以青海门源油菜花粉cDNA 为模板,RT-PCR扩增出1 011 bp产物(图5),根据此片段设计特异性引物扩增出约500 bp 的5′端RACE-PCR 产物(图6)。将测得的序列进行拼接,获得1 170 bp的BpFLS1-1基因编码序列。在获得的完整编码序列基础上,设计用于扩增BpFLS1-1基因编码区的引物并进行扩增,将该编码区产物克隆至T 载体并筛选阳性重组子进行测序。

图5 BpFLS1-1 基因RT-PCR 扩增产物Fig.5 RT-PCR products of BpFLS1-1

图6 5′RACE扩增产物Fig.6 Products of 5′ RACE-PCR
2.6 BpFLS1-1 基因表达检测
分别提取青海门源油菜的花粉和叶片总RNA,利用实时荧光定量PCR 进行BpFLS1-1基因表达水平分析,结果表明,花粉中的BpFLS1-1基因相对表达量是叶片组织的6倍,呈显著差异(图7)。

图7 BpFLS1-1基因的qRT-PCR 检测不同小写字母表示不同样本之间差异显著(P<0.05)。Fig.7 Expression analysis of BpFLS1-1 gene by qRT-PCRDifferent lowercase letters indicate significant differences among tissues (P<0.05).
3 讨论
黄酮醇广泛存在于各种植物,其水平与花粉活力、萌发和花粉管生长密切相关[30]。研究表明,BnaFLSs基因在花药组织中的表达水平较其他组织高[28],银杏花粉总黄酮含量显著高于叶片[31]。本研究中,BpFLS1-1基因在青海门源油菜花粉中的表达量较高,表明该基因在门源油菜花粉发育和黄酮积累中可能发挥关键作用。
提高黄酮醇含量的基因工程育种具有重要的农学意义。过表达EkFLS拟南芥通过提高类黄酮合成及ROS清除通路的关键酶转录表达水平,增加总黄酮及黄酮醇含量的积累,增强抗氧化酶活性以增强植物的抗氧化性,从而提高了植物MeJA 的耐受性以及耐盐耐旱性[32]。拟南芥中过量表达AvFLS基因,能够提高拟南芥的黄酮类化合物含量、光合速率,降低MDA 含量,从而显著提高转基因拟南芥的耐盐能力[33]。已有研究从不同油菜品种的叶片组织中克隆 到BnFLS、BnaFLS1-1和BnaFLS1-2基 因,其cDNA长度均为1 011 bp,编码336个氨基酸[27-28]。而本研究在门源油菜花粉中先后克隆了BpFLS1-1基因的2 个不同cDNA 序列,分别为1 011 bp 和1 170 bp,但是否在逆境胁迫应答中发挥作用,还需要后续进行体外酶活检测[34]和功能验证[35]。
综上所述,该研究通过油菜花粉转录组测序,在黄酮类生物合成通路中筛选了6个差异表达的Bp-FLSs基因,BpFLS1-1基因在门源油菜花粉积累丰富的类黄酮物质和门源油菜抗逆性方面起关键作用。
