二氢乳清酸脱氢酶抑制剂ASLAN003抗戊型肝炎病毒的研究
2024-03-08张继凯丁晓慧郭虹波王文世
刘 丹,张继凯,丁晓慧,郭虹波,王文世
(徐州医科大学病原生物学与免疫学教研室,江苏省免疫与代谢重点实验室,江苏徐州 221004)
戊型肝炎病毒(Hepatitis E virus,HEV)通过粪-口途径在人和动物之间传播的RNA病毒,HEV是一种人兽共患病原体[1]。HEV为单股正链RNA类囊膜病毒,呈20面体对称结构,其基因组由1个5′甲基化帽,1个3′polyA多聚尾,至少3个部分重叠的开放阅读框(ORFs)ORF1、ORF2和ORF3组成[2]。ORF1主要编码病毒复制相关的非结构蛋白,ORF2负责编码病毒衣壳蛋白包裹着病毒RNA,ORF3编码一种促进病毒从宿主释放的磷蛋白,已有研究认为HEV编码蛋白与HEV跨种属传播有关[3]。
HEV属于肝炎病毒科(Hepeviridae),包括引起哺乳动物和禽类感染的正戊肝病毒属(Orthohepevirus)以及感染鱼类的鱼戊肝病毒属(Piscihepevirus)[4]。正戊肝病毒属又分为A、B、C、D 4个种[5],HEV-A宿主包括人、家猪、野猪、鹿、兔和骆驼等;HEV-B仅来自禽类,宿主主要是家禽和野生鸟类;HEV-C1来自大鼠、HEV-C2来自雪貂;HEV-D在蝙蝠中发现。已知来自许多动物物种的HEV毒株会跨越物种障碍并感染人类。近几年,在中国香港、西班牙等地陆续发现了人感染大鼠HEV-C1的病例[6]。也有研究报道,在韩国有猪HEV传播给人类的风险[7]。近年来人感染HEV的发病率也呈迅速上升趋势,因此HEV的跨种传播和抗病毒研究也受到广泛的重视。
HEV一般情况下导致急性自限性感染,不需要特殊治疗。但对孕妇和免疫功能低下的患者有发展成慢性肝炎、肝硬化和肝癌的风险[8]。对于HEV感染目前还没有公认的治疗方法。利巴韦林和α干扰素是治疗HEV感染最常用的广谱药物。但是利巴韦林有致畸性,禁用于妊娠患者;并且α干扰素会导致器官移植受者的移植排斥反应,不能用于大多数移植受者[9]。因此,迫切需要开发安全且有效的新型抗HEV的药物。
二氢乳清酸脱氢酶(dihydroorotate dehydrogenase,DHODH)抑制剂能够抑制多种RNA病毒的复制,如新冠病毒[10]、登革病毒等。ASLAN003是一种新型的高效的口服DHODH抑制剂,正在进行临床Ⅱ期的研究,并获FDA孤儿药的认定资格。在急性髓样白血病(AML)异种移植小鼠中延长其存活时间[11]。但是ASLAN003是否能够抑制HEV的复制尚不清楚。因此,本研究通过高斯荧光素酶的HEV复制子系统和野生型的HEV复制模型,研究ASLAN003对HEV复制的影响,为临床治疗慢性HEV患者提供了潜在的新型抗病毒药物。
1 材料与方法
1.1 材料
1.1.1 细胞 Huh7细胞,HEK 293T细胞,HEV复制子细胞模型和HEV复制细胞模型,徐州医科大学免疫与代谢重点实验室保存。
1.1.2 主要试剂 ASLAN003抑制剂,Cayman公司产品;高糖DMEM培养基和胎牛血清,Bio-Channel公司产品;高斯荧光素酶报告基因检测试剂盒,上海碧云天公司产品;WST-1细胞增殖及细胞毒性检测试剂盒,KeyGen公司产品;First-Strand cDNA Synthesis Kit,SYBR Green qPCR Master Mix(2X),APEx Bio公司产品;FITC山羊抗兔IgG,Jackson公司产品;Hoechst,赛默飞公司产品;兔源抗HEV ORF2 pAb抗体,徐州医科大学免疫与代谢重点实验室保存。
1.1.3 主要仪器 多功能检测酶标仪,美国伯乐公司产品;实时荧光定量PCR检测仪,美国罗氏公司产品;细胞培养箱,中国赛默飞世尔科技有限公司产品;倒置荧光显微镜,日本奥林巴斯公司产品。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中HEV基因(JQ679013.1)序列,用DNAman软件设计实时荧光定量PCR(RT-qPCR)检测引物,在苏州金唯智生物科技有限公司合成。GAPDH-F/R引物由徐州医科大学免疫代谢实验室提供,试验设GAPDH基因作为对照基因,引物序列见表1。

表1 引物序列
1.2.2 细胞培养 从-80℃冰箱中取出冻存的细胞,快速将其放入37℃水浴锅中解冻,待细胞解冻后,将细胞转移到3 mL完全培养基中,1 000 r/min离心5 min后弃去培养基,加入10% FBS的DMEM培养基,置于37℃、5% CO2培养箱培养,待细胞长满后进行传代。细胞传代,首先弃去培养皿内的培养基,用无菌PBS清洗2遍,加入1 mL胰酶进行消化,待细胞回缩变圆后弃去胰酶,按照1∶4比例加入完全培养基传代。
1.2.3 高斯荧光素酶检测 将ASLAN003抑制剂进行倍比稀释,浓度设置为0.2、1、5、10、50 μmol/L。分别将稀释后的药物加入到HEK 293T和Huh7中的HEV复制子(带有高斯荧光素酶基因)模型中。将每个稀释度设置3个复孔,并设置0.1% DMSO作为空白对照组,置于37℃、5% CO2培养箱中培养,72 h后收集上清备用,按照产品说明书配制高斯荧光素酶反应工作液,取80 μL工作液加入到20 μL上清中,用多功能检测酶标仪采集荧光信号,通过检测上清中高斯荧光素酶分泌量从而确定HEV的复制效率。
1.2.4 ASLAN003半数细胞毒性CC50检测 将Huh7细胞铺到96孔板中,使用不同浓度的ASLAN003抑制剂(0.2、1、5、10、50、200 μmol/L)加入到Huh7细胞中,72 h后弃去上清,收集细胞检测细胞的增殖活性。按照96孔板每孔110 μL的量配制适量的WST-1检测工作液,即100 μL DMEM培养基与10 μL的凯基四唑盐混合。向各孔中加入110 μL的凯基四唑盐工作液(包括未加细胞的空白孔),于37℃、5%的CO2培养箱中孵育3 h,用多功能酶标仪在450 nm波长处检测每孔的光密度OD450 nm。将各孔的OD值减去空白孔OD值,各重复孔的OD值取平均值。细胞存活率以加药组的OD值/对照组的OD值百分率表示。用Graphpad Prism 9计算出其半数毒性浓度(CC50)。
1.2.5 RT-qPCR检测HEV RNA 将ASLAN003抑制剂稀释为0.1 μmol/L和1 μmol/L,将0.1% DMSO作为对照,与HEV复制模型37℃共同孵育72 h后。收集细胞,利用Trizol法提取总RNA,反转录为cDNA后作为模版,然后用引物HEV-genome-F/R和GAPDH-F/R分别检测HEV RNA和GAPDH基因的转录水平,分析结果。
1.2.6 间接免疫荧光检测HEV ORF2蛋白 将0.016、0.08、0.4、2、10 μmol/L ASLAN003抑制剂与HEV复制模型37℃共同孵育72 h后,弃去细胞培养上清。用4%多聚甲醛固定细胞30 min后,用0.3% Triton对细胞打孔15 min。然后用50 g/L脱脂牛奶封闭细胞1 h,以兔源抗HEV ORF2蛋白的pAb(1∶3 000)为一抗,4℃孵育过夜,FITC标记山羊抗兔IgG(1∶500)为二抗,室温孵育1 h,并用Hoechst(1∶500)染核15 min,经间接免疫荧光(IFA)检测HEV ORF2蛋白的荧光水平。根据免疫荧光结果计算ASLAN003抑制HEV的IC50。
1.2.7 数据统计分析 用GraphPad Prism 9和Image J软件作图和统计学分析。单因素多组比较采用单因素方差分析,*P<0.05表示差异显著。**P<0.01表示差异极显著,***P<0.000 1表示差异极显著。
2 结果
2.1 ASLAN003抑制HEV复制子的复制效率
将0.2、1、5、10、50 μmol/L的ASLAN003抑制剂与转入HEV报告基因复制子的HEK 293T和Huh7细胞共同孵育后,收集上清,检测高斯荧光素酶活性。结果显示,与0 μmol/L(0.1% DMSO)对照组相比,ASLAN003在0.2 μmol/L~50 μmol/L范围内均能显著抑制HEV复制(P<0.000 1)(图1A、图1B)。
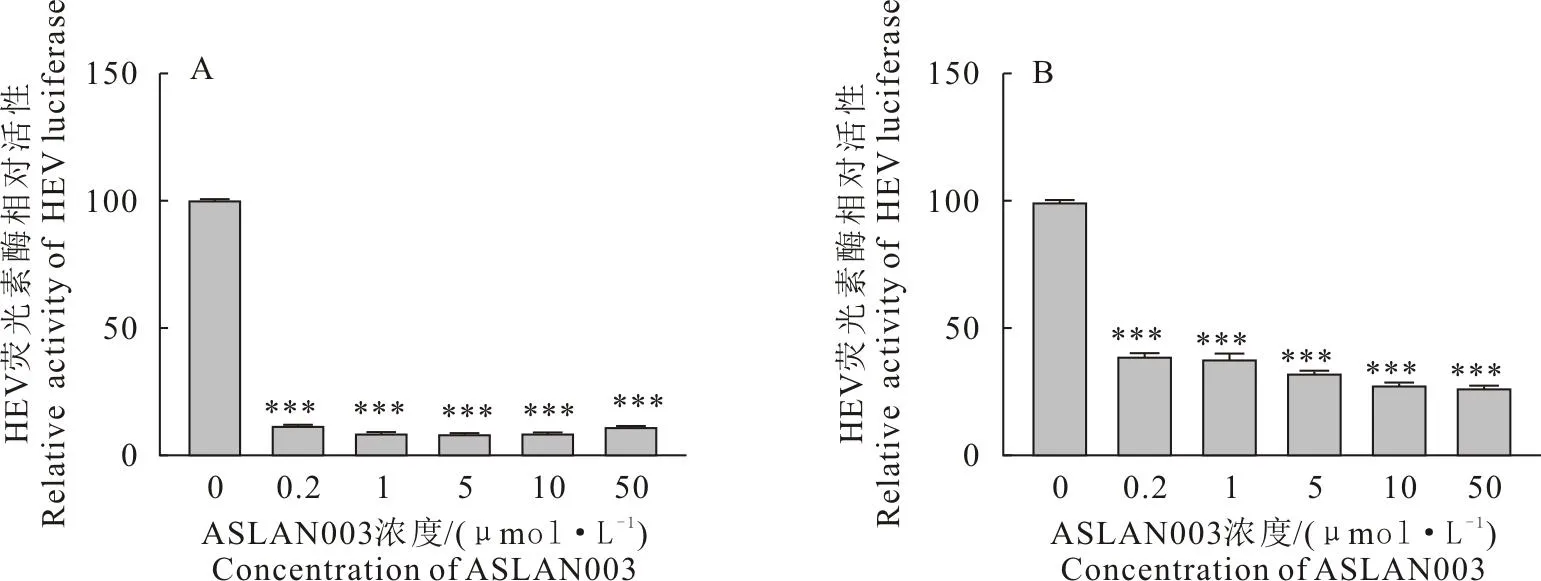
A.在HEK 293T细胞上,ASLAN003对HEV复制子模型的抑制作用;B.在Huh7细胞上,ASLAN003对HEV复制子模型的抑制作用
2.2 ASLAN003抑制HEV RNA复制
将ASLAN003抑制剂分别以0.1 μmol/L和1 μmol/L处理野生型HEV复制模型后,经72 h后收取细胞样本。经RT-qPCR检测HEV RNA复制水平,结果与0 μmol/L(0.1% DMSO)对照组相比,1 μmol/L ASLAN003可以将HEV RNA水平降低到50%左右(n=8,P<0.000 1)(图2),说明ASLAN003能有效抑制HEV的复制。
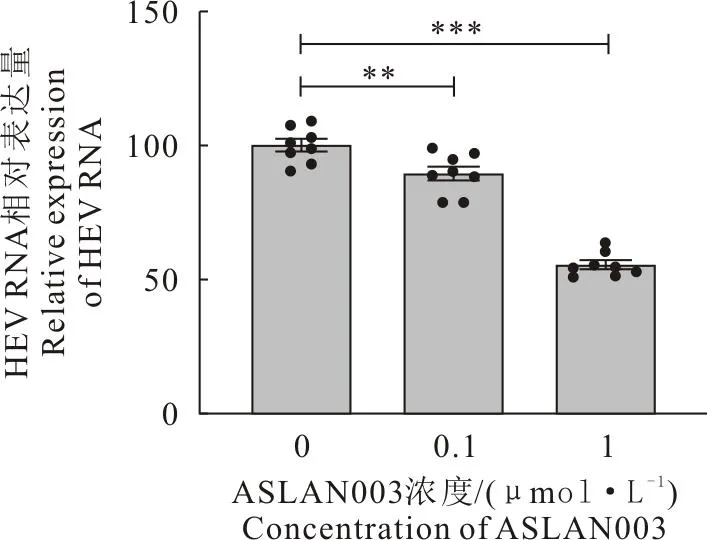
图2 RT-qPCR检测ASLAN003对HEV的复制效果
2.3 ASLAN003抑制HEV ORF2蛋白表达
将0.016、0.08、0.4、2、10 μmol/L的ASLAN003处理野生型HEV复制模型,72 h后用IFA检测HEV ORF2蛋白的表达水平。结果显示,与0 μmol/L(0.1% DMSO)对照组相比,0.4 μmol/L的ASLAN003能够抑制HEV ORF2蛋白表达(图3),升高药物浓度后,ORF2蛋白的表达进一步下降。以上结果说明ASLAN003能够抑制HEV复制。
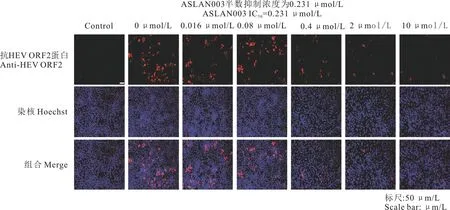
图3 IFA检测ASLAN003对HEV的抑制作用
2.4 ASLAN003的细胞毒性CC50和对HEV抑制作用IC50的计算
利用0.2、1、5、10、50、200 μmol/L的ASLAN003处理Huh7细胞,72 h后通过WST-1试剂盒检测其细胞毒性,结果发现,ASLAN003的CC50为294 μmol/L。将0.016、0.08、0.4、2、10 μmol/L的ASLAN003处理野生型HEV复制模型,72 h后通过IFA检测HEV ORF2蛋白的表达。利用ORF2蛋白的表达量计算ASLAN003抑制HEV复制的IC50。通过Image J软件对其ORF2阳性细胞进行计算发现,ASLAN003的IC50为0.231 μmol/L。以上结果表明,ASLAN003抑制HEV复制浓度远低于其对细胞的毒性作用,利用现有浓度抑制HEV复制是安全的。
3 讨论
HEV可感染禽类和哺乳动物,除了人源HEV以外,大鼠HEV和兔HEV也能跨宿主传播到人[12]。但是由于人源HEV和动物源HEV基因组同源性较低[13],现有人源HEV疫苗是否能够保护人免受动物源HEV的感染尚不可知。因此,用抗HEV抑制剂阻断HEV的复制,从而达到治疗HEV感染的效果。
目前,利巴韦林和α干扰素是治疗HEV感染最常用的广谱药物。但是大量的副作用和禁忌症限制了利巴韦林和α干扰素的应用。对于孕妇和器官移植受者等特殊患者寻找安全且有效的新型抗HEV药物具有重要意义。DHODH是嘧啶从头合成的关键限速酶,是一种经过验证的治疗靶点,可用于治疗自身免疫性疾病,包括类风湿性关节炎和多发性硬化症[14]。目前DHODH是一种新型的抗病毒治疗靶点。本文用带有高斯荧光素酶的HEV复制子模型和野生型HEV复制模型对DHODH抑制剂ASLAN003进行了抗病毒作用的研究。结果显示ASLAN003不仅能显著抑制HEV RNA复制,也能显著抑制HEV ORF2蛋白的表达。说明ASLAN003通过阻断HEV生命周期中的复制和表达发挥其抗HEV作用。通过检测ASLAN003的CC50和IC50发现其为有效且安全的抑制剂,这为临床治疗慢性HEV患者提供了安全且有效的新型候选药物。
基因3型HEV具有人兽共患的特性,可以感染猪、鹿等哺乳动物[15]。本文用基因3型HEV的野生型病毒和复制子体外培养模型,说明ASLAN003可以作为潜在抑制人HEV和猪HEV复制的药物。虽然有研究建立了大鼠HEV体外模型[16],但是其复制效率较人源HEV体外复制模型较低,对筛选抗大鼠HEV复制的抑制剂具有一定的局限性。需要建立不同基因型的HEV体外复制模型,从而进一步验证ASLAN003是否抑制其他动物来源HEV的复制。
ASLAN003通过激活AP-1转录因子抑制蛋白质合成,通过诱导细胞凋亡,促进细胞分化,可用于急性骨髓性白血病的治疗[11]。但ASLAN003作为嘧啶核苷酸合成途径的DHODH抑制剂,其发挥抗HEV作用机制还未曾研究。有研究报道,对于嘌呤核苷酸合成途径抑制剂,通过补充外源性鸟嘌呤可以逆转其抗病毒作用,说明嘌呤合成途径抑制剂通过阻断鸟嘌呤的合成抑制病毒复制[17]。因此,推测ASLAN003嘧啶合成途径抑制剂是通过阻断尿嘧啶的合成发挥抗病毒作用,其抑制HEV复制的具体作用机制还有待进一步的研究。
本研究首次证实了DHODH抑制剂ASLAN003阻断HEV复制的效果,研究结果为进一步揭示ASLAN003的抗病毒机理奠定了基础,ASLAN003可以作为潜在的抗HEV感染的新型药物。
