新疆奇台地区某猪场猪链球菌耐药性分析
2024-03-08吴海潮陈万昭吴慧敏夏盼盼刘泽鹏夏利宁
吴海潮,陈万昭,吴慧敏,夏盼盼,刘泽鹏,夏利宁,2*
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.新疆草食动物新药研究与创制重点实验室,新疆乌鲁木齐 830052)
猪链球菌(Streptococcussuis,SS)定植在猪的上呼吸道,有荚膜,属于革兰氏阳性球菌,也是一种人兽共患病病原体。该菌可引起猪发生败血症、脑膜炎、关节炎、肺炎、心内膜炎和淋巴肿胀等临床症状,病猪表现精神沉郁、呼吸困难、发热、采食量下降等[1]。猪链球菌感染人可引起脑膜炎、败血症、关节炎、眼内炎和心肌内膜炎等疾病,还会导致听力受损和前庭功能障碍[2]。我国规定猪链球菌病属三类动物疫病。近年来,随着我国养猪业集约化、规模化发展,猪链球菌病的发生逐渐增多,而且经常作为主要病原继发于猪伪狂犬病、猪圆环病毒病、猪繁殖与呼吸综合征等病毒性疾病,对养猪业及公共卫生安全构成了威胁,给养猪企业造成巨大的经济损失[3]。猪链球菌的致病性主要与所携带的毒力基因及不同组合有关,不同地区分离株毒力差异较大,近年来主要毒力基因有溶血素(hemolysin suilysin,sly)、胞外因子(extracellular protein factor,epf)和溶菌酶释放蛋白(muramidase-released protein,mrp),这3个毒力基因常作为猪链球菌致病性的指示蛋白基因[4]。
近年来,猪链球菌对各类抗菌药物的耐药性逐渐增强,致病菌的耐药问题日益严重[5]。我国猪链球菌耐药性的相关报道很多,其耐药情况较为严重[6-8],但新疆地区的猪链球菌耐药性报道较少,本研究对新疆奇台地区某规模化猪场猪链球菌进行耐药性调查以及相关耐药基因检测,为临床用药提供依据。
1 材料与方法
1.1 材料
1.1.1 样品来源 2021年11月在新疆奇台地区某规模化猪场采集健康猪鼻拭子(25份)、病猪鼻拭子(60份)、病死猪脏器(23份)和组织液(27份)共135份。
1.1.2 试剂 胰蛋白胨大豆琼脂培养基(tryptic soy agar,TSA)、胰蛋白胨大豆肉汤培养基(tryptic soy broth,TSB)、胎牛血清、MH(mueller hinton)培养基,青岛海博生物技术有限公司产品;1×TE缓冲液、50×TAE,上海生工生物工程有限公司产品;DNA Maker DL 2 000 ,2×TaqPCR Master Mix、dd H2O,天根生化科技(北京)有限公司产品。
1.1.3 试验仪器 电子天平,梅特勒-托利多仪器有限公司产品;超净工作台,苏州净化设备有限公司产品;电热恒温培养箱,成都红星电燃厂产品;台式空气恒温摇床,北京桑望实验仪器研究所生产;脉冲场凝胶电泳仪,美国Bio-Rad公司产品;PCR扩增仪,伯乐生命医学产品有限公司产品;凝胶成像系统,培清科技有限公司产品;核酸蛋白测定仪和高速冷冻离心机,Eppendorf公司产品;立式高压蒸汽灭菌锅,上海博讯实业有限公司产品;电泳成套设备,北京六一生物科技有限公司产品;超纯水仪,成都超纯水科技有限公司产品。
1.2 方法
1.2.1 细菌分离鉴定 将健康猪与病猪鼻拭子样品分别装入含有1 mL TSB(含5%胎牛血清)肉汤的2 mL EP管中,用接种环将样液在TSA(含5%胎牛血清)培养基上划线,37℃恒温培养18~24 h。
在超净台中,将脏器表面用酒精灯灼烧灭菌,用无菌手术刀在内脏表面上切口,用灼烧灭菌并冷却的接种环于内脏深部组织取样并划线于无菌TSA(含5%胎牛血清)培养基上,37℃恒温培养18~24 h。推注1~3滴关节液样品于TSA(含5%胎牛血清)培养基上,用灭菌接种环划线,37℃恒温培养18~24 h。对初筛为猪链球菌的菌株进行基因gdh扩增[9],检出gdh基因的菌株进行测序比对,相似性>96.0%判定为猪链球菌,并保存备用。
1.2.2 药物敏感性试验 采用琼脂稀释法对分离菌株进行9种抗菌药物最小抑菌浓度(minimal inhibitory concentrations,MICs)的测定,测试所用抗菌药物敏感性判断标准及具体操作按照文献[10]进行。选择临床上常用的6大类9种药物对分离的猪链球菌进行药敏试验,所选抗菌药物分别为红霉素、恩诺沙星、四环素、氨苄西林、青霉素、庆大霉素、阿米卡星及氟苯尼考。金黄色葡萄球菌ATCC 29213作为标准质控菌。
1.2.3 耐药基因检测 参照文献[7,9,11-14]已有序列合成引物(表1),由上海生工生物工程有限公司合成。

表1 猪链球菌鉴定及耐药基因PCR引物
1.2.4 毒力基因检测 参照文献[15-16]已有序列合成6种主要毒力因子引物(表2),由上海生工生物工程有限公司合成。
2 结果
2.1 猪链球菌的分离鉴定
从135份不同来源样品中共分离到猪链球菌19株,分离率为14.1%。其中病猪鼻拭子样品的分离率为11.7%(7/60),病死猪脏器样品的分离率为26.1%(6/23),病死猪组织液样品的分离率为22.2%(6/27),健康猪鼻拭子样品中未检出猪链球菌。
2.2 猪链球菌耐药性试验结果
分离菌株对青霉素最敏感,耐药率为21.1%;其次为氟苯尼考,耐药率为26.3%;对氨苄西林、庆大霉素的耐药率均为94.7%,对恩诺沙星、红霉素、四环素、阿米卡星和替米考星耐药率均为100%(表3)。分离的猪链球菌均为多药耐药菌株,耐药谱分布在6~9耐,共有6种耐药谱型,以7耐为主(57.9%,11/19),其中ENR-ERY-TET-AMP-AMK-TMS-GEN谱型最多(表4)。

表4 猪链球菌耐药谱型
2.3 耐药基因检测结果
tetM和ermB基因检出率均达90%以上,msrD基因检出率为68.4%,tetO和lsa(E)基因检出率均为21.1%,optrA基因检出率为15.8%,tetL基因检出率为10.5%,未检出ermA、mefA和cfr基因(表5)。
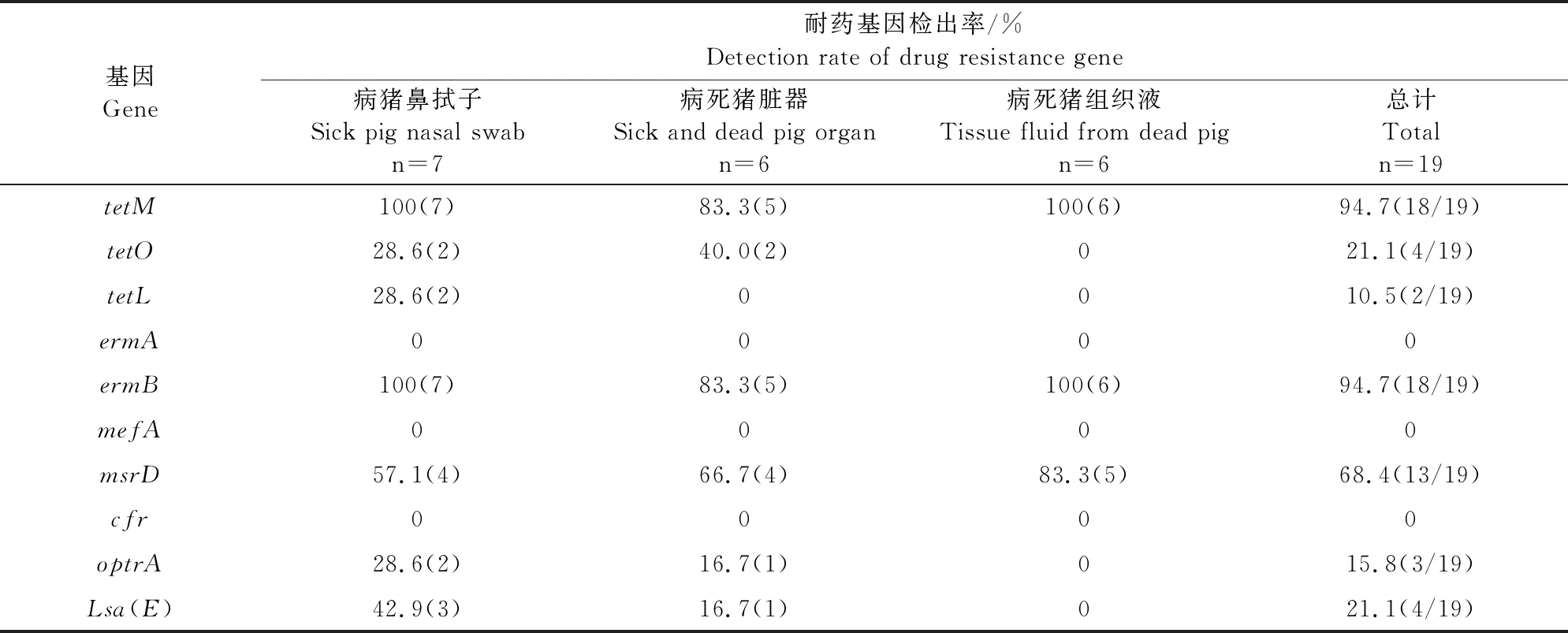
表5 猪链球菌耐药基因检测结果
2.4 毒力基因检测结果
6种毒力基因均被检出,其中orf2基因检出率最高,为52.6%,mrp基因检出率为42.1%,epf基因检出率为36.8%,gapdh基因检出率为18.8%,sly基因检出率为15.8%,fbps基因检出率为5.2%(表6)。
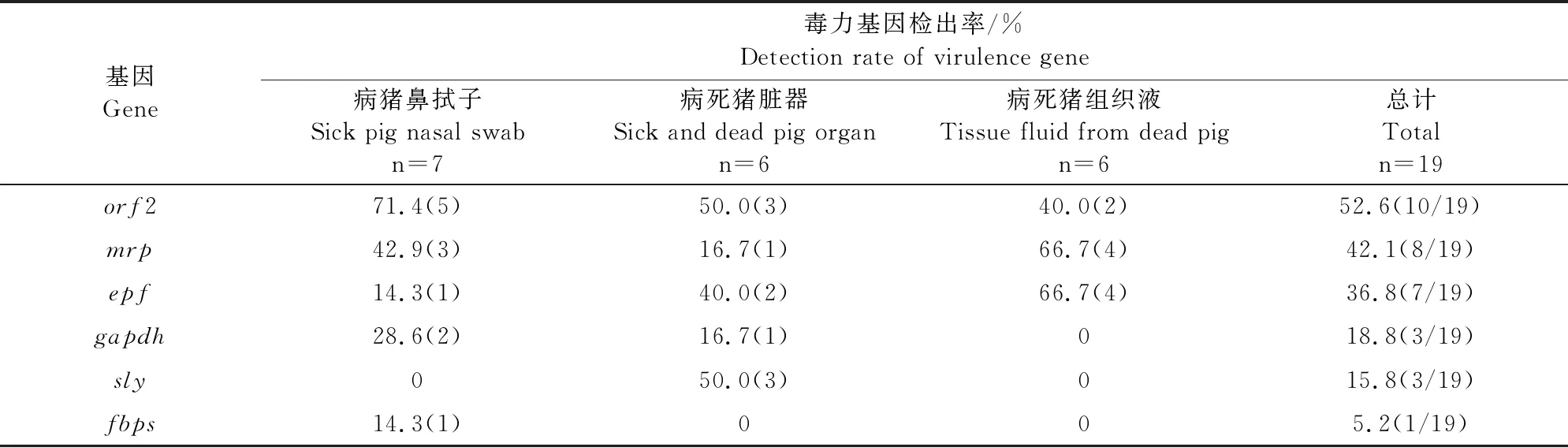
表6 猪链球菌毒力基因检测结果
3 讨论
猪链球菌是一种人兽共患病原体,在世界范围内广泛流行,是导致断奶后仔猪死亡的原因之一,对养殖场造成巨大的经济损失,也是影响保育猪到育肥猪健康的疾病之一[17]。该猪场属于集约化管理,定期消杀猪舍及周边化境,母猪存栏量约2 200头,年产合格健仔数约67 000头,采样时疑似符合该病症发病猪约87头,养殖场常用四环素类,大环内酯类,氨基糖苷类,青霉素类,头孢菌素类和酰胺醇类抗菌药物。本研究共分离出19株猪链球菌,分离率为14.1%。猪链球菌均从病死猪样本中分离得到,说明该猪场可能不存在隐形感染的情况,也可能是样本量较少的原因导致。
本研究中分离的猪链球菌对恩诺沙星、红霉素、四环素、阿米卡星、替米考星5种抗菌药物耐药率高达100.0%,猪链球菌对常用抗菌药物耐药现象如此严重,可能是因为这些药物研发时间早、口碑较好、经济实惠,导致抗菌药物存在滥用现象,提示当地有关部门应当建立一定的耐药监测体系,对耐药性的发展做出应对措施。本试验中分离株对青霉素和氟苯尼考药物的耐药性较低,故仍可以作为治疗猪链球菌的备选药物。
分离株均为多药耐药菌株,耐药谱分布在6~9耐,以7耐为主(57.9%,11/19),多耐菌株的大量出现给临床猪链球菌感染的防治带来困难,会使原有的多药联用产生的协同作用消失。建议兽医临床用药时根据药敏试验结果,针对性地使用抗菌药物,且经常更换抗菌药物的种类,加强对抗菌药物的合理使用和指导。
tetM(97.4%)、tetO(21.1%)和tetL(10.5%)四环素类耐药基因的检出结果说明,该猪场分离的猪链球菌主要通过主动核糖体保护机制造成对四环素类药物耐药。ermB(94.7%)、msrD(68.4%)、ermA(0%)和mefA(0%)大环内酯类耐药基因的检出结果暗示:猪链球菌对大环内酯类药物耐药可能是由ermB和msrD基因传播导致的。上述基因检出率与已经报道的数据有差异,可能与样品的来源、地区不同,及不同养殖场用药习惯和治疗方式不同有关。本研究中19株猪链球菌中orf2、mrp、epf、gapdh、sly、fbps6种基因的携带率分别为52.6%、42.1%、36.8%、18.8%、15.8%和5.2%。不同地区的猪链球菌的优势毒力基因有差异,且不同的毒力基因检出率也有差异。
奇台地区某猪场猪链球菌分离率较低,但耐药情况严峻,且耐药基因携带率高,临床用药时应选用敏感性较高的药物。该养殖场应加强抗菌药物的合理使用,尽量减少耐药菌株的产生。此外,该猪场猪链球菌具有携带毒力基因种类多、检出率高的特点,由于致病性与其所携带的毒力基因密切相关,在后续的研究中还需加强毒力因子方面的相关研究。
