4株不同基因型新城疫病毒毒力测定及与商品疫苗株抗原性比较
2024-03-08黄青红谢丽基谢芝勋曾婷婷罗思思谢志勤
黄青红,华 俊,谢丽基,谢芝勋,曾婷婷,李 孟,罗思思,李 丹,谢志勤
(1.广西大学动物科学技术学院,广西南宁 530001;2.广西壮族自治区兽医研究所农业农村部中国(广西)-东盟跨境动物疫病防控重点实验室,广西兽医生物技术重点实验室,广西南宁 530001)
我国常用的新城疫(Newcastle disease virus,NDV)商品疫苗毒为基因Ⅱ型La Sota株和基因Ⅶ型重组毒株A-Ⅶ。商品疫苗可降低ND的发病率,但无法控制NDV毒株的复制[1-3]。随着NDV不同基因型的发现,需要对NDV疫苗株的预防能力进行重新评估[4-7]。疫苗保护力与抗原同源性有关。为了研究不同基因型NDV疫苗及与现有商品疫苗株之间的抗原性差异,本研究从广西活禽市场、野鸟和病禽分离到数十株不同基因型NDV,包括基因Ⅵ、Ⅶ、Ⅸ和Ⅻ型。用4种不同基因型NDV代表毒株制作成油乳苗和2种商品油乳苗分别免疫SPF鸡,采血收集单因子血清,进行HI交叉试验和细胞交叉中和试验,分析抗原性差异,为后续筛选NDV疫苗株提供参考。
1 材料与方法
1.1 材料
1.1.1 毒株及疫苗 基因Ⅵ型NDV B27、基因Ⅶ型NDV B9、基因Ⅸ型NDV B14、基因Ⅻ型NDV GX01由广西兽医生物技术重点实验室分离纯化,分别来自鸽、鸡、鹅、鹧鸪;La Sota毒株购自中国兽医药品监察所,未获得重组毒株A-Ⅶ活病毒;La Sota灭活抗原和商品疫苗La Sota灭活油乳苗购自法国诗华动物保健公司;重组毒株A-Ⅶ灭活油乳苗和A-Ⅶ灭活抗原购自乾元浩生物股份有限公司。
1.1.2 鸡胚及试验用动物 SPF鸡胚购自北京梅里亚公司;自行孵化至9~10日龄SPF鸡胚和雏鸡,雏鸡孵化后于隔离器中饲养。
1.1.3 主要试剂和仪器 Tween-80,上海高维化学有限责任公司产品;Span-80,上海生工生物工程股份有限公司产品;白油,中国石化集团杭州炼油厂产品;β-丙内酯病毒灭活剂,宝柏(香港)贸易有限公司产品;DF-1细胞,由广西兽医生物技术重点实验室保存;胎牛血清和DMEM/F12细胞培养液,Gibco公司产品;抗生素和胰酶,碧云天试剂公司产品;ATS高压均质机,上海ATS工业系统有限公司产品;负压SPF鸡隔离器,江苏冯氏动物设备有限公司产品。
1.2 方法
1.2.1 4株不同基因型NDV毒株的致病指数测定 参照文献[8]推荐的方法,进行1日龄雏鸡脑内注射致病指数(ICPI)和最小致死量致死鸡胚的平均时间(MDT)的测定。
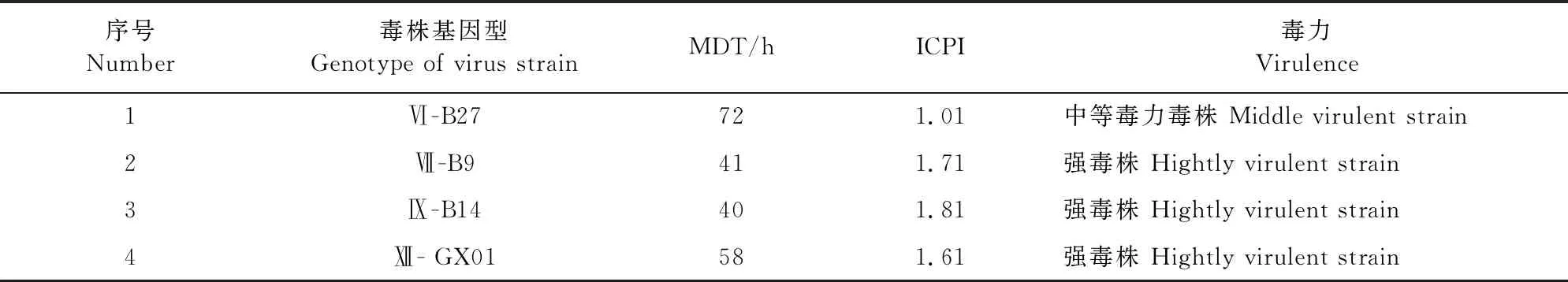
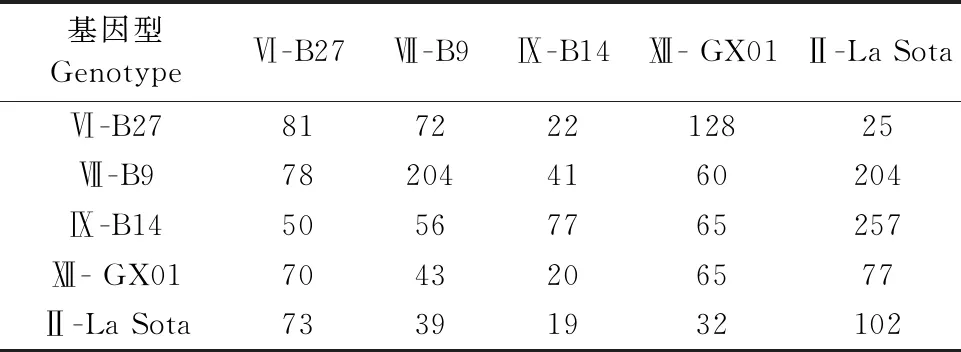
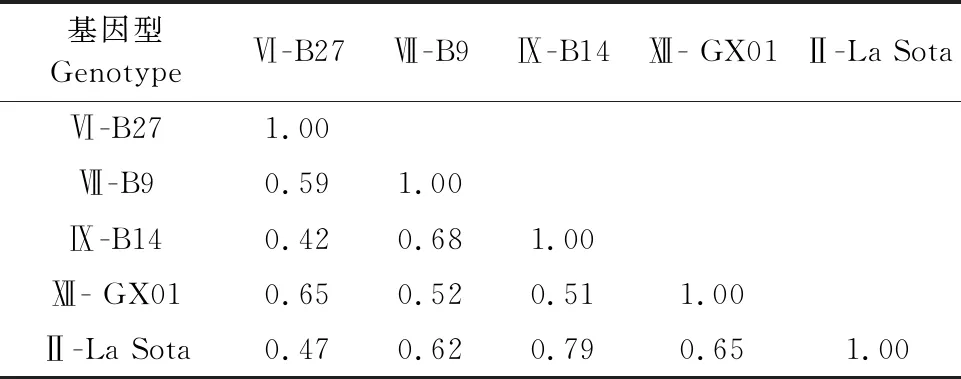
1.2.1.1 ICPI测定 用无菌生理盐水对分离提纯化后的新鲜尿囊液(滴度大于1/16,不超过1~2 d,细菌检测为阴性)进行10倍稀释;脑内接种10只刚出壳24~40 h的SPF雏鸡,每只0.05 mL;每天1次,总共观察8 d,每天观察并给鸡打分,无异常鸡记0分,发病鸡记1分,死鸡记2分(鸡死后每天仍记2分)。ICPI是每只鸡8 d内观察数值的平均数。计算公式ICPI=(8 d累计发病数×1+8 d累计死亡数×2)/8 d累计观察鸡的总数。1.6 1.2.1.2 MDT测定 用无菌生理盐水连续10倍稀释新鲜尿囊液至10-6~10-9共4个浓度梯度,每个梯度接种5枚鸡胚,每枚接种0.1 mL,置于37℃恒温培养;每日照蛋2次,连续观察1周,并记录鸡胚死亡时间;MDT指最小致死量引起所有鸡胚死亡的平均时间;计算公式MDT=(X胚死亡时间×X小时死亡胚数+Y胚死亡时间×Y小时死亡胚数+ ……)/死亡总鸡胚,X、Y单位为小时(h)。40 h 1.2.2 4种不同基因型NDV油乳苗制备及免疫后抗体检测 1.2.2.1 油乳疫苗的制备 先把毒株的病毒浓度调整为HA滴度28;按照1∶2 000加入β-丙内酯灭活病毒,置4℃作用48 h;灭活完成后37℃作用2 h使β-丙内酯水解。灭活病毒连续接种鸡胚验证灭活效果,每个毒株接种5枚鸡胚,0.2 mL/枚;37℃孵育并每天照胚观察,连续观察4 d。如不死胚,则收取尿囊液检测HA和继续传代。连续传代3次不死胚及HA滴度为0则证明灭活成功;参照文献[9],试验使用油相∶水相为4∶1,乳化剂是油相的1/10,Span-80与Tween-80的体积配比为3∶1,亲水亲油平衡值为7;每个毒株油乳疫苗制备量为100 mL。配置之前,先将白油、Span-80和Tween-80高压灭菌;然后分别配置水相和油相。水相配置方法为:按配比将灭活后的尿囊液与Tween-80混合;油相配置方法为:将白油与Span-80混为油相;最后用均质器把油相与水相进行3次切割混合。 1.2.2.2 分组与免疫 将鸡分成7组,分别编号为1~7组,第1组疫苗用Ⅵ型NDV B27,第2组疫苗用Ⅶ型NDV B9,第3组疫苗用Ⅸ型NDV B14,第4组疫苗用Ⅻ型NDV GX01,第5号组疫苗用Ⅱ型NDV La Sota,第6组疫苗用Ⅱ型NDV重组毒株疫苗A-Ⅶ,第7组为PBS替代病毒液制成油乳苗对照,所有组SPF鸡分别在4周龄和6周龄颈部皮下各免疫1次,每次0.3 mL。第1~4组为试验组,第5~6组为商品疫苗组,第7组为空白对照组。 1.2.2.3 抗体监测 SPF鸡从第4周开始每周无菌采集翅静脉血,静置血液待凝固析出血清后,抽取上层血清,即得到6个NDV毒株的单因子阳性血清,于-20℃保存。参照文献[8]的方法进行抗原检测,根据HA试验结果配置4单位病毒;再将4单位病毒与本试验采集的单因子阳性血清进行HI试验,以被检血清出现完全不凝集的血清最高稀释度为血清HI效价。 1.2.3 4株不同基因型NDV分离株和疫苗株的抗原性分析 1.2.3.1 HI交叉抑制试验 参照文献[10],把6种四单位病毒分别与6种单因子阳性血清进行交叉HI试验,重复做5个平行试验,最后取平均值;同时设对照,即SPF鸡阴性血清对照组。HI抗原同源性用抗原相关系数R表示,计算方法参照文献[11]进行,计算公式为R=(r1×r2)-1/2×100%(r1=异源血清效价1/同源血清效价1,r2=异源血清效价2/同源血清效价2)。R的结果判定:0.67≤R≤1.5,抗原性差异不大;0.5≤R≤0.67,抗原差异微小;R<0.5,抗原性存在较大差异。 1.2.3.2 细胞中和试验 ①DF-1单层细胞的制备。将DF-1单层细胞在培养瓶中培养至密度达到100%时,用胰酶消化直到细胞与培养瓶壁分离,再加入含10%胎牛血清的DMEM/F12培养液终止消化。轻柔吹打混匀后加入15 mL离心管,4 000 r/min离心1 min后弃去上清液。加入10%胎牛血清的DMEM/F12培养液重悬细胞,分装到48孔细胞培养板每孔0.3 mL。每天观察2次,细胞生长至铺满培养板底部95%~100%时用于TCID50和细胞交叉中和试验。②细胞半数感染量(TCID50)测定。取5个毒株新鲜病毒液(由于未获得A-Ⅶ活病毒,故TCID50和细胞交叉中和试验用5个毒株),分别连续10倍稀释,取10-1~10-8共8个稀释度。再分别接种细胞,由最高稀释度开始,每稀释度接种48孔细胞板的5孔,每孔0.05 mL。于37℃培养箱中作用60 min。作用完毕后,再加DMEM/F12维持液,每孔0.25 mL,培养5 d后观察细胞病变,并测定HA效价,计算各稀释度HA效价≥2log2的百分率。按Reed和Mchen法计算TCID50,距离比=(高于50%病变的百分数-50%)/(高于50%病变率百分数-低于50%病变率的百分数),lgTCID50=高于50%血清稀释度的对数+距离比例×稀释系数的对数。 ③细胞交叉中和试验。本试验采用的是固定病毒稀释血清的方法。操作方法如下:将病毒稀释成每0.05 mL含200 TCID50;将待测血清等量稀释成1∶2,1∶4,1∶8,1∶16,1∶32,1∶64;1∶128;1∶256共8个稀释度,再将待检血清和病毒悬液等量混合,37℃孵育60 min;每稀释度血清和病毒混合接种48孔板5孔,同时设置SPF鸡血清对照、空白细胞对照各5孔。最后每孔添加维持液0.2 mL,CO2培养箱37℃培养5 d,每天观察2次CPE,8 d后测定HA效价,计算各稀释度HA效价≥2log2的百分率。按Reed和Mchen法计算半数保护量能使半数细胞孔保护的最高血清稀释度即为该血清的中和效价。 结果显示,基因Ⅵ型NDV B27 MDT为60~90 h,ICPI为0.6~1.5,属于中等毒力毒株。基因Ⅶ型NDV B9、Ⅸ型NDVB 14、Ⅻ型NDV GX01 MDT为40~60 h,ICPI为1.6~2.0(表1),属于强毒株。 表1 4株NDV的致病指数测定结果 病毒经灭活后接种鸡胚,鸡胚孵育4 d未死亡,检测尿囊液HA效价为0。连续传代2代鸡胚仍不死亡,检测尿囊液HA效价为0。病毒灭活成功,可进行下一步油乳苗制备。制备完成的油乳苗用血平板检测细菌,无细菌生长。 随着免疫后时间延长,每组鸡抗体水平逐渐上升,但上升幅度不同。免疫后第5周,免疫Ⅵ-B27、Ⅻ-GX01、Ⅱ-LaSoTa、Ⅶ-A-Ⅶ组抗体水平均值达到28以上,而免疫Ⅶ-B9和Ⅸ-B14组抗体水平均为24~25(表2)。 表2 免疫SPF鸡抗体监测结果[平均值(log2)] 6株NDV HI交叉试验平均结果见表3,根据公式计算出抗原同源性(表4)。根据HI交叉试验结果显示,不同毒株之间的抗原同源性除基因Ⅵ型的B27和基因Ⅸ型的B14为0.64,抗原差异微小,其他毒株抗原同源性为0.69~0.99,抗原性差异不大。 表3 不同毒株之间的HI交叉试验结果(log2) 表4 不同NDV毒株间的HI同源性 5个毒株的TCID50见表5,计算5个毒株之间血清的中和效价后,再计算细胞交叉中和的抗原同源性(表6和表7),5个毒株的抗原同源性为0.42~0.79。其中基因Ⅵ型NDV B27与基因Ⅸ型NDV B14的抗原同源性为0.42,基因Ⅵ型NDV B27与基因Ⅱ型NDV La Sota的抗原同源性为0.47,抗原相关性存在较大差异;基因Ⅶ型NDV B9与基因Ⅸ型NDV B14的抗原相关性为0.68,基因Ⅸ型NDV B14与基因Ⅱ型NDV La Sota的抗原同源性为0.79,抗原相关性差异不大;其余抗原相关性存在微小差异。 表5 5株NDV的TCID50 表6 不同NDV毒株之间的细胞中和试验的中和指数 表7 不同NDV的毒株之间的细胞交叉中和抗原同源性 不同NDV毒株之间的毒力强弱不一致,早期通过ICPI、MDT、IVPI等指数来确定NDV毒力,但研究发现仅凭其中一个指数去判定一个毒株的毒力不准确,需要测定2个或2个以上指数作为毒株毒力的凭据[12]。本研究测定了分离株的MDT和ICPI,结果显示MDT与ICPI结果一致。 4个分离株制备油乳苗免疫SPF鸡后第5周Ⅵ-B27、Ⅻ-GX01、La SoTa、A-Ⅶ组抗体水平均值达到28以上,而Ⅶ-B9和Ⅸ-B14组抗体水平均值为24~25。表明基因Ⅵ型B27和基因Ⅻ型GX01免疫原性较好,抗体水平和2个商品疫苗相当,而基因Ⅶ型B9和基因Ⅸ型B14的免疫原性相对较差。 4个毒株分属不同的基因型,其中B27属于基因Ⅵ型,分离自免疫了La Sota株的病鸽,证明La Sota株对基因Ⅵ型NDV的免疫保护能力不足。因此,即使B27对鸡致病性仅为中等毒力,仍然有必要研究它和疫苗毒株的抗原性差异,以便为筛选针对鸽新城疫的疫苗株提供依据。基因Ⅻ型GX01为本实验室从表现健康的鹧鸪分离得到,致病性试验表明为强毒株。此基因型在我国南方地区的出现,是否会演变出对鸡致病的毒株是未知数。需要对其与疫苗毒株的抗原性差异进行研究,为开发对应基因型疫苗提供参考。 近年来,由于广泛使用基因Ⅶ重组毒株疫苗,我国的家禽新城疫发病率大大降低。而以基因Ⅵ型NDV为主的鸽新城疫日渐多发[13-14]。本研究的HI交叉试验表明,不同基因型NDV之间以及和商品疫苗株之间,除基因Ⅵ型NDV B27和基因Ⅸ型NDV B14为0.64,抗原差异微小,其他毒株之间的抗原相关性均为0.69~0.99,抗原差异性不大。而细胞交叉中和试验结果表明,基因Ⅵ型NDV B27和基因Ⅸ型NDV B14、基因Ⅱ型NDV La Sota疫苗株之间存在较大差异,其余基因型之间以及和基因Ⅱ型疫苗株La Sota之间存在微小差异。可能是鸽子用传统弱毒疫苗La Sota,鸽新城疫仍然时有发生的原因。 实际生产中,HI抗体水平经常作为判定禽群ND保护力的标准。但是在近几年这种方法受到了巨大挑战:平均抗体水平高到滴度大于29的鸡群仍然受到新城疫的危害。但由于流行株和疫苗株存在抗原差异,即使抗体达到一定水平,也不能准确预判对流行株的保护力。因此,在实际生产中,可考虑用近期流行毒株制备4单位抗原,进行HI试验作为参考。 我国在防控新城疫方面具有复杂性,采取免疫措施为主,隔离消毒为辅,国外更倾向于直接扑杀消灭。对NDV抗原性变异的研究也刻不容缓,研制出针对性更强、保护性更好的疫苗,本研究结果为NDV疫苗株筛选提供了参考。2 结果
2.1 病毒致病指数测定结果
2.2 病毒灭活及油乳苗制备
2.3 抗体检测结果

2.4 HI交叉试验结果和HI抗原同源性


2.5 细胞交叉中和试验

3 讨论
