弓形虫多表位PLGA纳米疫苗的研究
2024-03-08张飞跃伍孟琛吴海燕马光旭杜爱芳
张飞跃,伍孟琛,吴海燕,马光旭,吴 飞,杜爱芳,杨 怡
(浙江大学动物科学学院,浙江省动物预防医学重点实验室,浙江杭州 310058)
刚地弓形虫(Toxoplasmagondii)是一种专性胞内寄生虫,其感染包括速殖子、缓殖子和子孢子3个时期[1],严重感染者可引起死亡[2]。疫苗对先天性感染的阻断及获得性感染的预防具有重要意义[3]。目前只有减毒活S48菌株疫苗被批准用于预防绵羊流产,但其预防效果有限且存在返毒的可能[4]。随着免疫学的发展,用保守性高和免疫原性强的弓形虫抗原表位来研制多表位疫苗,已成为开发新型疫苗的有效手段[5]。多表位疫苗具有稳定性强,无致癌潜力,是减毒活疫苗的安全替代品;可通过生物信息学工具模拟,实现疫苗制备的高效性[6-7]。但多表位疫苗通常免疫原性较低,因此在引发保护性免疫方面效果较差[8]。纳米材料为开发新型疫苗开辟了新的途径,相比于传统的弗氏佐剂、铝盐佐剂等,PLGA纳米材料作为输送系统具有巨大的潜力[9]。抗原包封在PLGA颗粒内可免受酶降解,延长其体循环时间并增加向免疫细胞呈递的可能性[10]。PLGA颗粒可降低抗原和佐剂的使用量,从而降低毒副作用。用PLGA纳米颗粒递送疫苗可有效解决多表位肽免疫原性低的问题,为开发新型疫苗提供新的方向。本研究将TgSAG1、TgGRA7和TgMIC3中的优势抗原表位通过柔性连接肽串联构建一种新型多表位肽,用大肠埃希氏菌表达系统制备并鉴定多表位重组蛋白,搭载MEP-PLGA纳米递送体系,提高多表位重组蛋白的递送效率,为弓形虫多表位纳米疫苗的研制奠定基础。
1 材料与方法
1.1 材料
1.1.1 载体、菌株和主要试剂 克隆载体pET-28a(+)Vector,上海捷瑞生物工程有限公司产品;大肠埃希氏菌BL 21(DE3)感受态菌株,日本Takara公司产品;Ni-NTA亲和层析柱,北京韦氏博慧科技有限公司产品;HRP标记的山羊抗小鼠IgG抗体和考马斯亮蓝染液,杭州弗德生物科技有限公司产品;双组份TMB显色液,北京索莱宝科技有限公司产品;IPTG和抗His标签鼠源单克隆抗体,美国Sigma公司产品;PLGA,山东岱罡生物有限公司产品;BCA蛋白浓度测定试剂盒,上海碧云天生物技术有限公司产品;DNA marker,日本TaKaRa公司产品;蛋白纯化柱外柱、5×SDS、牛血清蛋白,生工生物工程(上海)股份有限公司产品;司盘-80、二氯甲烷、聚乙烯醇,国药集团化学试剂有限公司产品。
1.1.2 主要仪器 SCIENTZ-II D超声波细胞粉碎机,宁波新芝科技公司产品;立式冷冻干燥机,美国LABCONCO公司产品;JEM-1230透射电子显微镜,日本JEOL公司产品;S3000N扫描式电子显微镜,日本日立公司产品;ZCEC纳米粒度电位分析仪,英国Malvern公司产品。
1.2 方法
1.2.1 优势抗原表位的预测 通过ToxoDB(https://toxodb.org/toxo/app/user/registration)检索mic3(TGME49-319560)基因序列,用蛋白结构数据库RCSB PDB网站(https://www.rcsb.org/)检索蛋白结构;用BCPREDS(http://ailab.ist.psu.edu/bcpred/predict.html)分析TgMIC3蛋白的B细胞线性表位;IEBD(http://tools.iedb.org/mhci/)分析TgMIC3蛋白的CD8+T细胞表位,选择MHCⅠ分子类型为H-2-Kd、H-2-Dd、H-2-Ld;IEBD服务器分析TgMIC3蛋白的CD4+T细胞表位,选择MHCⅡ分子类型为H-2-I。
1.2.2 嵌合多表位肽的生物信息学预测 利用ProtParam(https://web.expasy.org/protparam/)预测多表位肽的理化性质,VaxiJen v2.0 (http://www.ddg-pharmfac.net/vaxijen/VaxiJen/VaxiJen.html)预测抗原性,AlgPred2(https://webs.iiitd.edu.in/raghava/algpred2/)预测致敏性,PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred)预测二级结构,AlphaFold 2预测多表位肽的三级结构,ZDOCK服务器(http://zdock.umassmed.edu/)进行分子对接,PyMOL软件进行可视化分析,PyRAMA服务器验证二面角合理性,HawkDock服务器(http://cadd.zju.edu.cn/hawkdock/)预测结合自由能。
1.2.3 多表位重组蛋白的表达与纯化 目的DNA片段由捷瑞生物公司合成,并将其连接在pET-28a(+)载体上;取重组质粒转化到BL21(DE3)感受态大肠埃希氏菌中,于含卡那抗性的LB平板上过夜培养;挑取单个菌落于在LB液体培养基中,在37℃、220 r/min的环境下培养;待菌液OD450达到0.7左右时,加入IPTG至终浓度为0.8 mmol/L,在220 r/min、37℃环境下分别于0 h、2 h、4 h、6 h取出500 μL样品;诱导菌液离心后弃去上清,将沉淀重悬于预制的PBS中,使用SCIENTZ-II D超声波细胞粉碎机冰浴超声破碎(180 W、40%功率、4 s超声、2 s间隔),离心后分离出上清样品和沉淀样品,制样后进行SDS-PAGE检测;将扩大培养后的菌液,冰浴超声破碎(180 W、40%功率、4 s超声、2 s间隔),取上清液过Ni离子亲和层析柱,用60、80、120、250、500 mmol/L咪唑的缓冲液洗脱;收集洗脱液,经SDS-PAGE检测纯化效果。
1.2.4 Western blot检测多表位重组蛋白的纯化效果 蛋白透析后经SDS-PAGE后转膜,用5%脱脂奶粉封闭1.5 h;用鼠源His单抗作为一抗,过夜孵育,用TBST清洗5次,5 min/次;加入羊抗鼠IgG-HRP作为二抗,室温孵育2 h,用TBST洗涤,滴加显色液进行显色并拍照。
1.2.5 双乳液挥发法制备PLGA纳米颗粒 称取100 mg的PLGA溶于10 mL二氯甲烷作为油相,加入司盘-80至终浓度为10 mL/L,用注射器将500 μL目的蛋白液加入油相中,立即冰浴超声破碎(180 W、20%功率、1 s超声、1 s间隔)5 min,直至形成白色的初乳;将初乳加入到50 mL 2%聚乙烯醇中,再次于冰上超声破碎(180 W、50%功率、1 s超声、1 s间隔)20 min,得到复乳;将液体倒入到200 mL 5%聚乙烯醇中,磁力搅拌器过夜搅拌,挥干有机溶剂;成品于30 mL超纯水中洗涤5次,再加入10 mL超纯水并混匀,得到PLGA纳米悬液。使用立式冷冻干燥机减压干燥,即可得PLGA纳米颗粒。
1.2.6 MEP-PLGA纳米颗粒的表征 取数滴PLGA纳米悬液在透射电镜专用铜网孵育3 min,通过JEM-1230透射电子显微镜观察颗粒形态;取适量PLGA纳米颗粒喷金处理后通过S3000N扫描式电子显微镜观察形态;取适量PLGA纳米粒用水稀释,使用ZCEC纳米粒度电位分析仪测量乳液参数;精密称取减压干燥后MEP-PLGA纳米颗粒质量,将MEP-PLGA纳米颗粒溶于0.1 mol/L NaOH和10 g/L SDS溶液中,振荡后离心,取上清液,用BCA法测定蛋白总量;按公式测定包封率(Encapsulation rate,EE),公式为EE=(M包/M药)×100%,M包为纳米粒中包裹的药物质量(mg),M药为投入的总药质量(mg)。
2 结果
2.1 优势抗原表位的预测结果
通过BCPREDS服务器筛选到TgMIC3的B细胞表位,预测分数最高的序列为“SKTMCGPGGCGEFCSSNWIF”。IEDB软件预测TgMIC3蛋白的T细胞MHCⅠ、MHCⅡ表位,预测分数最高的序列为“LPIQKSVQL”和“HDTTTYVARRRYPA”。
2.2 多表位肽的设计
将多肽SAG1(238-256)、MIC3(109-128)、GRA7(20-28)、MIC3(27-35)、AS15和MIC3(368-381)按照顺序连接(表1),基因片段之间通过柔性连接肽“SAPGTP”连接各抗原表位(图1)。

表1 表位序列与类型

图1 多表位肽构建示意图
2.3 多表位肽的生物信息学分析结果
用ProtParam服务器分析多表位肽理化特性,其分子质量为12.043 61 ku,理论等电点(Isoelectric point,PI)为8.83;在紫外280 nm光吸收下,当所有的Cys均配对成胱氨酸,消光系数为14 230 L/(mol·cm);当N端为半胱氨酸时,估计在哺乳动物网织红细胞内半衰期为1.2 h,在酵母细胞中半衰期超过20 h,在大肠埃希氏菌内半衰期超过10 h;脂肪系数为50.60;亲水性平均值为-0.424。用VaxiJenv 2.0分析多表位肽的抗原性,发现当以大肠埃希氏菌为表达系统时,多表位肽抗原性总体评分为0.468 0(抗原阈值为0.4)。用AlgPred 2.0服务器分析多表位肽的致敏性,预测多表位肽为非过敏原。用PSIPRED服务器预测二级结构,其局部空间结构为13个氨基酸构成α螺旋、18个氨基酸构成β折叠和85个氨基酸构成无规则卷曲。用AlphaFold 2软件预测多表位肽的三级结构,PyMOL软件进行可视化分析,发现嵌合的抗原表位均呈现在多肽表面(图2)。用ZDOOCK服务器将多表位肽与H-2-Dd进行分子对接,PyMOL软件进行可视化分析,发现多表位肽和H-2-Dd可以稳定结合(图3A)。PyRAMA服务器绘制拉式图,发现其氨基酸构象几乎均在合理范围内(图3B);HawkDock服务器分析MEP-H-2-Dd复合物,得到结合自由能为-34.69 kcal/mol。
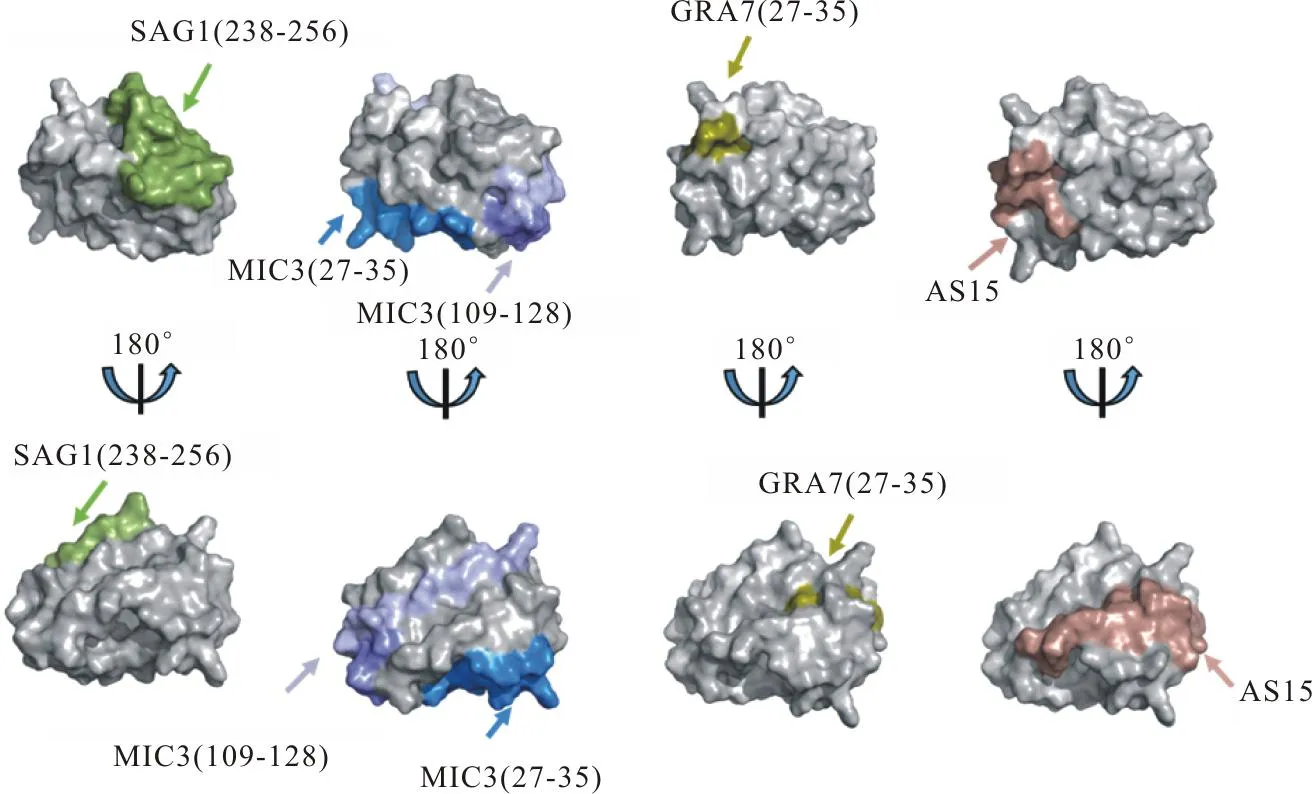
图2 多表位肽的三级结构
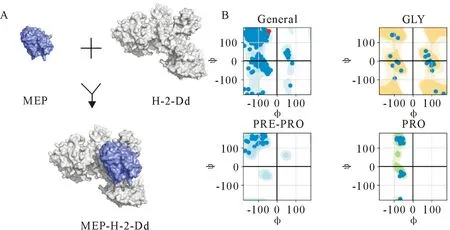
A.MEP和H-2-Dd分子对接示意图;B.General为多表位肽总体拉氏图,GLY为甘氨酸拉氏图,PRE-PRO为脯氨酸前残基拉式图,PRO为脯氨酸拉式图
2.4 多表位重组蛋白的表达与纯化结果
多表位重组蛋白成功在大肠埃希氏菌中诱导表达,且在加入IPTG诱导表达6 h时,菌液蛋白含量达到最高水平;超声裂解后重组蛋白出现在上清样品中,表明多表位重组蛋白为水溶性蛋白(图4);咪唑洗脱液浓度为250 mmol/L时,在分子质量为20 ku处出现单一条带,表明通过Ni离子亲和柱可获得高纯度多表位重组蛋白(图5)。

M.蛋白分子质量标准;1~4.诱导后0,2,4,6 h蛋白表达水平;5.超裂后上清;6.超裂后沉淀
2.5 Western blot检测多表位重组蛋白的纯化效果
Western blot结果表明,带有His标签的多表位重组蛋白可以被相应的单克隆抗体特异性识别(图6)。
2.6 MEP-PLGA纳米颗粒的表征
取3批MEP-PLGA纳米颗粒冻干粉,测得其平均包封率为54.42%;通过扫描电子显微镜和透射电子显微镜观察纳米颗粒呈圆球状,表面光滑,大小均一,未出现大面积团聚(图7A、图7B);通过DLS得到多分散系数(Polymer dispersity index,PDI)平均值为0.203,低于阈值0.3,表明其粒径大小分布均匀(图7C)。构建的MEP-PLGA体系稳定,颗粒不易发生聚集,能有效包封多表位肽。

A.透射电镜显微镜观察;B.扫描电子显微镜观察;C.DLS粒径分布图
3 讨论
已鉴定出不同时期弓形虫生活史中多种稳定表达的蛋白。其中TgSAG1稳定表达于速殖子期,对宿主细胞的黏附和侵袭过程很重要[11]。其优势抗原表位序列为TgSAG1(238-256)。TgGRA7在速殖子和缓殖子阶段均有表达,能刺激宿主产生细胞免疫和体液免疫,是良好的疫苗候选抗原[12],TgGRA7(20-28)作为CD8+T细胞表位可提高小鼠机体TNF-γ含量,并降低感染小鼠脑包囊的数量。TgMIC3表达于弓形虫的各个阶段,免疫后能刺激宿主产生持久的免疫保护,是MIC家族中最常用的疫苗候选抗原[13]。AS15肽是弓形虫CD4+T细胞表位,可发挥重要的免疫调节作用,免疫后保护动物免受弓形虫感染。
本研究将弓形虫不同时期抗原优势表位组合在一起形成嵌合多表位肽,有望对机体形成多层次、多特异性免疫保护[14]。为保证多表位设计的有效性,用生物信息学方法评估多表位肽疫苗潜力。多表位肽一级结构显示,构建的多表位肽为亲水性蛋白,具有抗原性,无过敏性,说明构建的多表位肽具备安全性和有效性。多表位肽二级结构表明,β折叠和无规则卷曲占多表位肽的总氨基酸比重较多。由于β折叠和无规则卷曲多突出在蛋白的表面,且具有较强的表面可及性,说明多表位肽的抗原表位很可能呈现在蛋白表面,有利于被抗原递呈细胞识别[15]。对多表位肽的三维结构分析,抗原表位均呈现在蛋白表面,与二级结构的预测结果一致。因此,多表位肽的结构特性预测结果符合预期。分子对接模拟结果显示,多表位肽可与MHC分子H-2-Dd稳定结合。MEP-H-2-Dd复合物拉氏图表明,有超过90%氨基酸残基构象位于合理区间,该模型构象符合立体化学的规则[16]。HawkDock模拟得到结合自由能为-34.69 kcal/mol,说明多表位肽与MHC分子结合后处于低能量的稳定状态[17]。
PLGA纳米颗粒制备工艺的重要评价指标包括形状、粒径和多分散系数[18]。纳米粒形状可通过改变纳米粒和细胞膜接触后形成的角度,影响抗原递呈细胞(antigen presenting cells,APCs)的摄取效率[18]。相比于棒状或橄榄球状纳米颗粒,圆球状更容易被APCs摄取。粒径的大小可改变免疫反应类型和免疫反应强弱。20~100 nm的纳米粒可直接通过淋巴管或细胞间隙进入淋巴结,产生强烈的免疫反应[19];200~600 nm的纳米粒可诱导机体分泌高水平的IFN-γ,免疫反应类型偏向Th1型免疫反应;2 000~8 000 nm的纳米粒可诱导机体分泌高水平的IL-4,免疫反应类型偏向Th2型免疫反应。多分散系数的大小可以反映纳米粒外观尺寸的均匀性,数值越小表明颗粒的粒径越均匀[20]。本研究采用双乳液挥发法制备MEP-PLGA纳米颗粒,结果发现,制备初乳的超声功率和时间对纳米粒的性质有重要影响。超声功率过低或超声时间不足,难以形成纳米级颗粒;超声功率过高或超声时间过长,形成的纳米粒多分散系数偏高。因此,通过合理设置超声参数,本研究制备的纳米粒颗粒饱满、粒径适宜且大小均一,为递送多表位肽奠定了坚实基础。
本研究充分用AlphaFold 2、HawkDock等前沿生物信息学工具,分析多表位肽的疫苗潜力,并构建MEP-PLGA纳米递送体系。后续可通过小鼠模型接种MEP-PLGA纳米颗粒,评估疫苗的免疫保护效果。本研究设计的多表位肽具备弓形虫疫苗的潜力,为后续弓形虫多表位纳米疫苗的研发奠定了基础。
