基于高通量测序的营养不良儿童肠道菌群多样性研究
2024-03-08吴慧丹黄峥阳丽君江美花李扬帆梅桂斌
吴慧丹 黄峥 阳丽君 江美花 李扬帆 梅桂斌
营养不足是当各种营养素由于摄食过度或摄入量不够或消化吸收障碍等各种因素引起产生的某种营养素失调症状[1]。营养不足是一种全球性的普遍性问题,在欧盟和美洲等发达国家以超重为主, 非洲及东南亚等发达国家以身材矮小及生长发育迟缓为主, 而南亚和东非等区域主要为出现5 岁内的低体重儿, 其中有多达33%的儿童发生营养素不足和肠道的通透性显著提高, 出现腹泻及吸收障碍等一系列问题, 导致儿童的生长发育减缓[2]。就目前来说, 营养素干预及相应的饮食调整方法无法切实可行的治疗营养不良对身体正常生长、发育产生阻碍作用, 提升疾病发生几率。近期研究成果表明, 微生物群落作为人类第二基因组, 在很多层面影响了人类健康水平[3]。以肠道菌群为例,其共生在肠道中, 能够提取食物中的营养物质, 增强食物消化和吸收能力, 尤其对肠道功能尚不健全的儿童来说, 肠道菌群的完整性和丰富性, 对其生长发育有着最为直接的影响。结合以往经验, 人体内的肠道菌群结构组成和数量分布总体上处于动态平衡的状态, 如果倡导微生态的平衡出现一定程度的紊乱, 出现菌群失调等问题, 对人体肠道运动能力、营养吸收能力和能量换化能力产生消极影响[4]。本文就主要使用高通量测序方法和模式, 对比研究营养不良患儿和正常儿童中肠道菌群物种的多样性及差异情况, 分析儿童营养不良和肠道微生物群落的具体联系性。
1 资料与方法
1.1 一般资料 本研究选择2022 年1~6 月在本院门诊就诊中出现营养不良的患儿共20 例作为A 组, 其中男8 例, 女12 例。纳入标准:由于喂养不当、饮食搭配不合理等原因出现营养不良的情况, 如挑食、偏食及没有科学的喂食方法等;排除标准:近半年出现传染性腹泻及抗生素应用。选取20 例健康儿童视为B 组,其中男9 例, 女11 例。
1.2 诊断标准 按照国际通用标准判定儿童营养不足有关情况, 并在此基础上开展有效估测和预算。
①根据患儿体重判定。根据同年龄段孩子的体重标准作为参考, 如果较正常体重低15%~25%之间, 属于轻度营养不良;较正常体重低26%~40%则为中度营养不良;较正常体重低40%以上为重度营养不良[5]。②根据皮下脂肪厚度情况判定:腹壁皮下脂肪厚度为0.4~0.8 cm为轻度营养不良, 腹壁皮下脂肪厚度<0.4 cm为中度营养不良, 全身皮下脂肪几乎消失为重度营养不良[6]。
1.3 方法
1.3.1 样本采集 研究过程中严格按照规定的采样流程, 使用采集盒开展采集工作。为防范样本污染情况,采集环节应当科学运用采集勺, 采集重量为5 g 左右的粪便, 并放入到具有保存液的保存管中, 并马上转入到-80℃的环境保存[7]。
1.3.2 DNA 的提取和测序 采集和使用QLAAMP 试剂盒进行粪便样本的抽取提炼, 使用浓度为12%的琼脂凝胶进行抽取, 得到基因组的DNA, 通过PCR 的模式实现文档构建, 利用525 和926 引物进行扩增, 之后使用相关检测平台, 将接头、测序引物和其他标签列加入到两端位置, 使用美国AXYGEN 公司生产的凝胶回收试剂盒进行回收, 使用实时荧光定量PCR 仪FTC-3000 技术进行荧光的定量分析, 在均一化混合完成后通过文库进行构建研究, 使用ILLUMIAN 进行文库的测序。
1.3.3 稀释性曲线 对研究过程中获得的系列数据,借助TRIMMOMATIC 软件对低质量序列进行去除, 对去除后的序列使用FLASH 软件开展序列的二次拼接,在此基础上, 借助MOTHUR 对序列开展质量控制, 从而获得最优化的序列[8]。从实际效果来看, MOTHUR软件对数据的处理可以有效排除冗余数据、干扰数据的影响, 形成最具代表性的OTU 稀释性曲线, 以更加真实地反映出质量系列变化情况, 最大程度地保证测序数据的丰富程度, 为后续研究工作高质量开展提供便利[9]。如果曲线最终达到平稳后表明测序科学合理,对优化的序列通过97%的相似性进行对比分析, 并进行相应的信息标注处理。
1.3.4 多样性分析 本研究借助MOTHUR 软件, 对ALOHA 开展多样性分析和计算, 从最终研究获得的ALPHA 指标中, 评估分析CHAO 和ACE 的指数变化情况[10]。结合过往经验, CHAO 和ACE 指数越大, 表明SIMPSON 实际数值越小, 检测样本中的微生物种类越多、类型越丰富。使用R 语言进行分析, 箱线图实现展示样品组中存在的多样化分布, 实现数据的分布情况, 具体差异使用P 值进行表示, 箱体中也就证明该组数据中50%的分布区间和中间线都确定为中位数,如果范围<1.5 箱体则为最大值或最小值[11]。
1.4 统计学方法 采用SPSS20.0 统计学软件对研究数据进行统计分析。计量资料以均数±标准差(±s)表示, 采用t 检验;计数资料以率(%)表示, 采用χ2、q、w 检验或Fisher 确切概率法。P<0.05 为差异有统计学意义。
2 结果
2.1 两组基本情况比较 两组一般资料比较差异无统计学意义(P>0.05), 具有可比性。见表1。
表1 两组一般资料比较[n, ±s, n(%)]
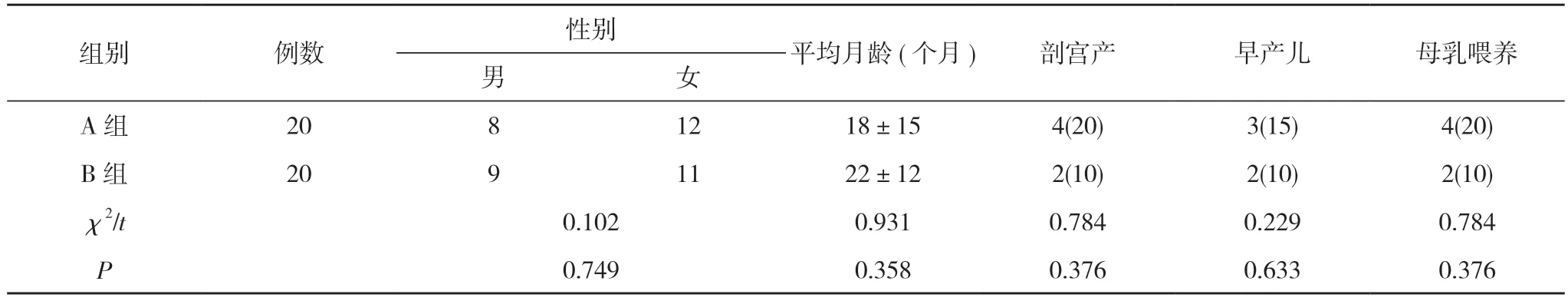
表1 两组一般资料比较[n, ±s, n(%)]
注:两组比较, P>0.05
组别 例数 性别 平均月龄(个月) 剖宫产 早产儿 母乳喂养男女A 组 20 8 12 18±15 4(20) 3(15) 4(20)B 组 20 9 11 22±12 2(10) 2(10) 2(10)χ2/t 0.102 0.931 0.784 0.229 0.784 P 0.749 0.358 0.376 0.633 0.376
2.2 两组物种丰度及生物多样性分析 两组粪便中共得到1394074个有效序列, 优化序列数量为1268032个,平均长度410。通过对上述序列分析, 实现序列数当代表的OTU 进行稀释性的结构曲线分析, 可见大部分样本呈平坦趋势达到饱和, 但部分样本曲线没有达到平坦, 证明两组微生物种类都较为丰度。通过箱线图像进行显示, 两组生物多样性比较差异无统计学意义(P>0.05)。证明两组肠道菌群的丰度和均匀度无显著差异。见图1。

图1 OTU 水平系数曲线和Shannon 指数图
2.3 两组肠道菌群物种分析 两组样本中共发现微生物154 种。A 组肠道菌群的OTU 为320, B 组大肠产甲烷菌群的OTU 为348, 以及其共同OTU 为290, 两组肠细菌群门的细菌中共检出14 个。为更好地展现检测结果, 本研究依托柱状图优势, 将各个样品进行分类学层面的比较和研究。A 组硬壁菌门(Firmicutes)及未分级菌(乳酸菌)的OTU 少于B 组, 拟杆菌(Bacteroidetes)(多形状杆菌、罗斯菌)的OTU 多于B 组, 差异有统计学意义(P<0.05)。见表2。

表2 两组属水平肠道菌群OTU 比较
2.4 两组属水平肠道菌群比较 除A 组含有的菌群外, B 组还独有厌氧弧菌属、厌氧螺菌属等19 种, 远超A 组体内的菌群种类和丰度。两组体内多形杆状菌、隐秘杆菌属等5 种菌群丰度相同, 差异无统计学意义(P>0.05), 其他菌群丰度比较差异有统计学意义(P<0.05)。见表3。

表3 两组属水平肠道菌群比较(n, %)
2.5 聚类分析 通过研究不同样本OTU(97%相似性)组成反映样本之间的差别与距离, 主成分分析(PCA)通过方差分析, 将各组样本差别表示在二维坐标图上, 坐标轴为可以最大地表示方数差的两个特征值,如样品成分越是接近, 反映到PCA 曲线上的时间越近[12]。不同条件中的样品可以显示出离散与集中的分布关系[13]。对两个样品的主要组分进行PCA 研究, 根据样品聚集现象, 两组尽管高度接近, 但仍可发现两组聚集。根据《国民营养计划(2017-2030 年)》等相关政策文件, 为最大程度地保障人体生命健康, 在生命开始最早的100 d 就应当开展保健活动, 通过营养充分供给, 稳步增强孕妇、婴幼儿的营养供给水平。“生命早期1000 d”是指280 d胎期, 在婴儿出生后2周岁(720 d)。这1000 d 是新生儿神经系统等人体组织的关键发育期,也是肠道菌群形成的关键时期。这一时期的肠道菌群极易受到营养状况、病情变化等因素影响[14,15]。为更好地应对上述问题, 需要加强身体健康状况监测, 一旦发现问题要及时进行应急处理, 使得肠道菌群活性、丰度达到预期, 更好地服务于婴幼儿生长发育[16]。
从本次研究过程中获得数据来看, 借助高通量的16S rDNA 测序技术, 对肠道菌群进行系统分析, 开展多样性研究, 能够准确发现营养不足儿童和营养正常儿童体内肠道菌群状况, 为后续研究活动有序开展提供数据支持[17]。本研究中, 在门水平上, A 组含有较多的拟球菌, B 组含有较多硬壁菌门;在属水平上,两组24 个菌株比较差异有统计学意义(P<0.05), 其中A 组特有菌8 种, B 组特有菌21 种。人体小肠中生存着数量庞大的细菌群体, 协助人类消化、吸收、分解各类营养物质。将正常小鼠的肠道细菌组迁移到无菌敷料小鼠受体中, 在相同食物供应条件下, 可以增加后者体脂的浓度, 说明改善宿主的小肠微生物细菌群组成和丰富程度, 可以改善饮食中养分的使用率, 进而实现增加营养物质的目的。据资料显示, 与消瘦人群相比, 肥胖人群的肠菌群硬壁菌较多, 拟杆菌更多。孟加拉国的一个营养不足儿童肠道菌群调查表明, 硬壁菌在正常儿童肠内的浓度约为营养不足儿童的9.6 倍, 这一结果与本研究中正常儿童肠道硬壁菌浓度约为营养不足儿童的1.4 倍一致, 并考虑可能与硬壁菌促进热卡和各种营养元素消化吸收的作用密切相关。因此, 对营养不良儿童的治疗, 可以通过提高硬壁菌的比例达到提高热卡吸收, 提高体重的目的[18]。多形杆状菌是人类消化道内种类最大的细菌类群之一, 主要功能是使较大分子的糖类先经过一系列生化过程, 再溶解为一些较易消化的小分子糖类, 还能够对谷氨酸盐的分解代谢。谷氨酸也是蛋白质和肽类的主要组成氨基酸,谷氨酸含量很丰富, 既可以提高肌肉蛋白质的生成和降低脂肪酸氧化, 也可以增加肌肉积累, 从而提高身体增长速度[19]。超重人员中谷氨酸的含量显然超过一般体重人员, 且其含量还和多形拟杆菌数量成反比, 将多形拟杆菌定植到动物肠道中, 小鼠血清中谷氨酸含量减少, 可以加快脂肪酸氧化过程和肌肉溶解的进程,进而减少脂肪积累, 起到减轻体重的作用。本研究中,A 组大肠菌群中的多形杆状菌浓度为48.87%, B 组为37.74%, 前者明显高于后者, 可见营养不良儿童由于多形杆状菌的硬性, 其体脂浓度下降明显。有必要对营养不良儿童体内谷氨酸和多形杆状细菌之间的相互关系进行论证。2 型糖尿病患者肠道内的罗斯菌丰度明显低于身体健康的儿童, 大致可以判定罗斯菌对血糖有着一定的调节能力。相关研究人员将罗斯菌作为饲料, 用于饲养超重实验鼠, 将其同正常饲养的超重实验鼠进行横向对比发现, 使用罗斯菌饲养的实验鼠体体重下降明显, 血糖恢复正常状态。研究过程中, 肠道内罗斯菌的增多会影响碳水化合物的合成, 使得体脂控制效果不佳。
本次研究发现, A 组肠道内的韦荣球菌丰度明显低于B 组, 这类菌群在人体内深度参与碳水合成物的分解、发酵等过程, 并促进维生素B 产生。维生素B对胆碱酯酶的活力有着较强的抑制能力, 在维生素B缺乏时, 胆碱酯酶活力增加, 引起神经递质乙酰胆碱大量破坏, 使自主神经传递受限, 导致胃肠道平滑肌舒张运动降低, 各类消化系统吸引酶生成下降, 胃口下降、消化不良等现象, 增加对营养素不足的影响。本研究中,A 组小肠微生物菌群中韦荣球菌胆固醇含量低于B 组,表明营养不足儿童小肠菌组中韦荣球菌属胆固醇含量比健康儿童少[20]。该菌主要参与小肠内碳水化合物分解和发酵过程, 也可以作为维生素B 的生物合成;维生素B 则对胆碱酯酶活力有抑制作用, 缺少维生素B则增加胆碱酯酶活力, 进而引起自主神经递质中乙酰胆碱的分解, 使自主神经信息传递受限, 导致胃肠不随意肌运动能力降低, 以及各种营养酶的产生量下降, 食欲减退、消化不良等现象, 从而增加营养不足的危害。
3 讨论
本研究中A 组肠菌群的韦荣球菌丰度低于B 组,但差异无统计学意义(P>0.05), 考虑可能与样本数量低有关, 但仍有深入探讨的价值。高通量16S rDNA 的主要优点在于为研究生物组织多样性和研究生命系统发育分类信息学资源, 主成分PCA 研究结果显示A 组与B 组尽管距离较接近, 但仍可发现两组聚集, 表明两组间在物质结构方面仍存在着相当的差异, 具有进一步深入研究探索的重要意义。但对16S rDNA 的基因组研究, 对推断生物的结构仍具有一定局限性。因为对肠道菌群的功能串扰及对数据的冗余处理, 仅通过测定产甲烷菌的胆固醇含量就很难合理、精确地推测其生理机制, 因此目前尚无法确定与营养不足患儿的相关致病微生物。本研究方法不足就是对缺乏儿童疾病机理的研究, 为进一步认识营养不足儿童肠道产甲烷菌与疾病之间的相互关联和发生机理, 本研究进一步对儿童肠道细菌中的基因组、蛋白质组和代谢组成等方面进行相应的研究和探索。系统化分析儿童肠道内甲烷菌与食物消化、人体代谢、免疫作用发挥等方面的作用, 更加明确关键性菌群在营养不良患儿治疗中的作用和意义。结合过往经验, 对营养不良患儿整个治疗过程中可以采取菌群治疗方案, 通过采取有效举措,平衡菌群关系, 在体内形成良好的微生物环境。
本次研究选择2022 年1~6 月在本院儿童营养门诊的20 例营养不良患儿作为A 组, 选择20 例身体正常的儿童作为B 组, 采集分析粪便样本, 提取细菌中的RDNA, 通过两组PCR 的模式和方法, 增加V4~V5区域实现高通量的测序设计, 且进行生物信息学的分析研究, 构建相应的稀释曲线, 使用MOTHUR 软件实现APLHA 的多样化的计算分析, 通过R 语言实现HEATMAP 分析研究, 实现典型关联分析CCA, 之后分别在样本的门和属两个列表中实现数据的整合和归纳,进行统计分析。两组年龄、性别、分娩方式等一般资料比较, 差异无统计学意义(P>0.05)。两组肠道菌群的丰度和均匀度比较差异无统计学意义(P>0.05)。两组肠道菌群共检测到14 种, 但A 组硬壁菌门和未分级菌的OTU 明显低于B 组, 且拟杆菌中的OTU 数量超过B 组, 差异有统计学意义(P<0.05)。两组肠道菌群共检测出154 种微生物, 具体分析后发现, 乳酸菌、罗斯菌等24 个菌群的OTU 差异明显, 其中A 组杆状菌和罗斯菌的OTU 超过B 组, 乳酸菌OTU 低于B 组。两组样本成分进行PCA 分析, 根据具体样本聚合情况, 两组虽然较为接近, 但也具有差异。出现营养不良的儿童肠道菌群中硬壁菌的数量较低, 其中多形杆状菌和罗斯菌的含量较高, 为保证菌群的稳定和平衡, 需要利用不同菌属的实际特点进行菌落的调整, 保证儿童具有良好的吸收和体格发育。
肠道菌群深刻地关系着宿主的营养加工、能量平衡、免疫活动、胃肠道发育和其他许多关键的生命行为。人体肠道菌群的形成在婴幼儿阶段就开始进行训练, 和健康青少年一样, 婴幼儿的消化道内微生物菌群形成方式截然不同, 婴幼儿消化道菌群定植和成长都是系统的动态变化, 因此消化道菌群对婴幼儿生长发育和免疫形成很重要, 婴幼儿时期消化道菌群失衡除患正常的代谢类疾病外, 也可罹患一些细菌类疾病, 如流感、肺炎等。研究证实, 在婴幼儿阶段, 营养素的正常摄入量对保证肠道产甲烷菌的生长平衡有重要影响, 而矿物质(如钙、铁、镁、锌)的正常营养利用率则对宿主肠道产甲烷菌的形成起重要作用, 肠道产甲烷菌与维生素代谢相互作用, 提高了机体的身心健康度。而营养包是促进中国贫困地区6~24 月龄婴幼儿健康成长重要的营养补充品, 含有蛋白质、脂肪、矿物质、微量元素等营养素, 因此本文将运用高通量测序方法研究营养包对婴幼儿阶段肠道产甲烷菌的作用。
肠道菌群多样性指肠道中的一些微生物, 如肠道中有乳酸杆菌、双歧杆菌等, 这些微生物都能够促进肠道的蠕动, 能够防止出现便秘的情况。这些益生菌还能增强抵抗能力, 出现肠道菌群失调后, 患者可能会出现腹泻及便秘情况, 对患者身体造成的影响是较大的。因此, 平时一定要做好相关防护措施与调整, 防止出现肠道疾病。患上肠道疾病后应当及时采取对症治疗, 才有助于病情控制。对人体肠道中具有数以亿计大量的共生菌群, 其自身的种类数量较多, 可以达到上千种, 且自身数量甚至达到人体细胞总量的10 倍以上,至今为止, 科学发展至今还有超过80%的微生物没有检测到, 对此类肠道微生物其自身和人体存在互利共生的情况和关系, 可以维持和保证人体健康的发展具有积极作用, 肠道菌群在肠道中一直保证这动态化的平衡, 可以实现微生物的合成, 帮助人体更好地吸收营养情况, 维持肠道免疫功能得到更好的维持, 可以抵抗有害微生物的具体侵害问题, 对此类平衡也会因为一部分因素导致动态平衡紊乱, 进而可能出现肥胖与和肠炎等一系列疾病, 为可以更好地强化和加深人类疾病的发生原因和药理学认知, 自从人类基因组计划后,科学化开始了大量的原基因组计划体系, 让肠道菌群研究取得更好的发展。在传统肠道微生物群落多样性研究的过程中, 科学家主要使用DGGE 之类的分子生物法实现对肠道菌群的研究分析, 但对此类的方法其自身都存在一定缺陷, 如DGGE 只能简单地检测环境样品中存在的10 多种优势菌群, 但对弱势的微生物检测不够精确, 且电泳条带中存在着多种16DNA 的排列序列。为更好地了解到具体菌种的详细信息还需要进行克隆检测、实验室实验等多种方法, 且随着科学技术的不断提高, 对微生物检测的精准性要求不断提高,无法实现对微生物丰度的检测。但生物芯片其自身可以实现通过固定的探针得到微生物的多样性信息, 通过信号的情况了解到微生物的丰度, 但准确性依然不足, 高通量测序技术最早发布于2005 年, 具有稳定性强、检测率高等一系列优势, 当下被大量使用在肠道菌群的检测中, 学术界中大量学者开展了详细的研究,其中大部分研究结果都是在国际顶尖杂志刊登, 是当下进行微生物多样性研究最好的科学方法。
