经皮冠状动脉介入术后患者氯吡格雷相关基因多态性的临床特点
2024-03-08胡著涛刘子龙孙礼玲
胡著涛 刘子龙 孙礼玲
目前氯吡格雷作为心脑血管缺血性疾病的基石用药, 在临床上已得到了广泛的应用。氯吡格雷可选择性抑制二磷酸腺苷(adenosine diphosphate, ADP)与血小板受体的结合及继发的ADP 介导的糖蛋白GPⅡb/Ⅲa复合物的活化, 除ADP 外, 氯吡格雷还能通过阻断由ADP 释放后引起的血小板活化的扩增, 从而抑制其他激动剂诱导的血小板聚集。氯吡格雷不可逆地修饰了与其结合的血小板ADP 受体, 进而影响了暴露于其的血小板的寿命。氯吡格雷作为一种前体药物, 在体外无活性, 在口服后必须经过肝脏细胞色素P450 代谢才能成为有效活性的产物, 从而发挥其抗血小板聚集的作用, 其在体内吸收和代谢过程中所需的酶会受到相关基因的调节影响, 携带无功能等位基因的患者在接受氯吡格雷治疗时其活性代谢物水平明显降低, 可能导致心脑血管疾病不良事件的增加[1-3], 美国食品药品监督管理局(FDA)为此还发出黑框警告。因此本文通过对PCI 患者氯吡格雷相关基因的分析可进一步了解其临床的特点, 进而为临床提供帮助。
1 资料与方法
1.1 一般资料 入选对象为2019 年1 月~2021 年12 月在本院心内科行PCI 术的318 例患者。排除标准:①对阿司匹林、氯吡格雷有禁忌或过敏;②凝血酶原时间超过正常1.5 倍;③血小板计数(PLT)<100×109/L;④有出血病史;⑤贫血[血红蛋白(Hb)<100 g/L];⑥有肾功能不全, 肌酐>221 μmol/L;⑦有严重免疫系统疾病。所选患者多为中老年患者, 男女比例相差不大, 多数为汉族人群。见表1。
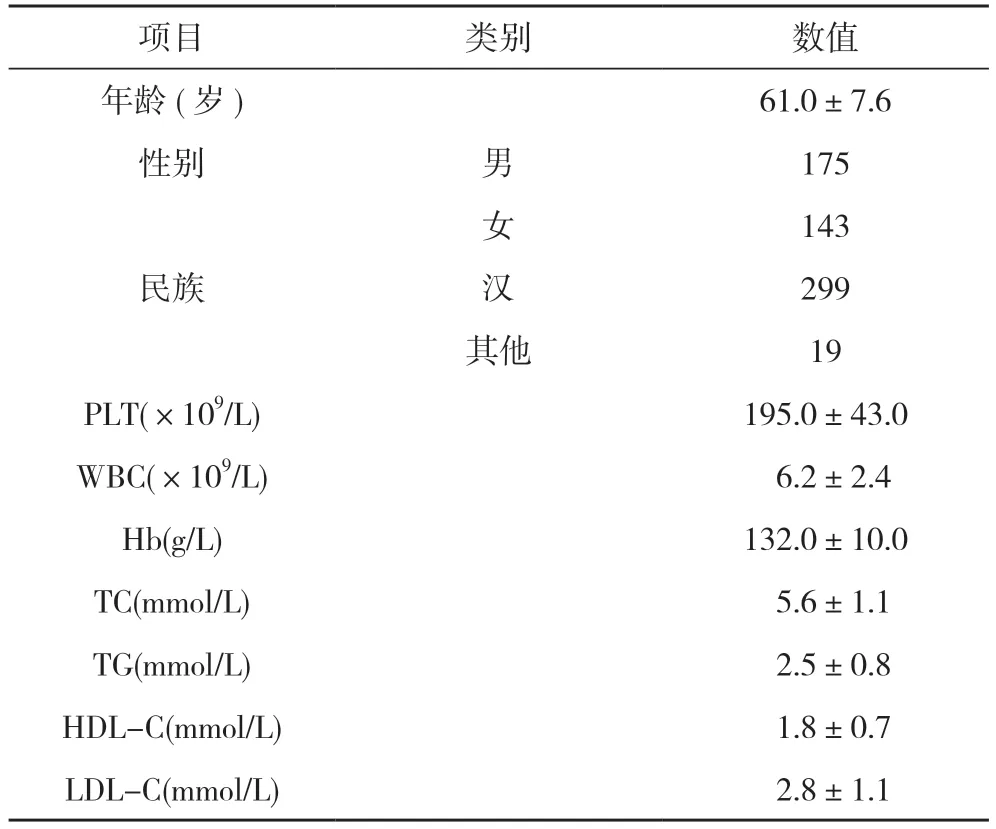
表1 318 例患者的一般资料分析( x-±s, n)
1.2 研究方法
1.2.1 仪器和试剂 PHARM-GENE01SNP 分析保存液(商品名:耀金保, 北京华夏时代基因科技发展有限公司), PHARM-GENE200SNP 分析样品处理试剂(商品名:耀金分, 北京华夏时代基因科技发展有限公司),预处理溶液(北京华夏时代基因科技发展有限公司),TL998A-基因扩增荧光检测仪(西安天隆科技有限公司)。
1.2.2 样本的处理及核酸的提出 抽取患者外周静脉血液2 ml 置于乙二胺四乙酸(EDTA)抗凝管中, 待血液标本混匀数次后, 将稀释好的预处理液和待检血液标本加入离心管中充分混匀后, 置入离心机中离心。离心后弃用上清, 加入耀金保后彻底混匀至块状物溶解消失。取相应的耀金分基因分析检测液, 标注好对应的编号。最后将处理好的血液样本加入耀金分基因分析检测液, 上机运行检测程序后, 得到基因检测结果。
1.2.3 相应基因的位点的检测 采用荧光染色原位杂交技术, 对其CYP2C19*2 和CYP2C19*3、CYP2C19*17、ABCB1 和PON1 共5 个基因位点进行检测。CYP2C19*2染色体定位码为chr 10:q23.33-q23.33;94781859, 其染色体核苷酸编号为rs4244285。CYP2C19*3 染色体定位码为chr 10:q23.33-q23.33;94780653, 其染色体核苷酸编号rs4986893。CYP2C19*17 染色体定位码为chr 10:q23.33-q23.33;94761900, 其染色体核苷酸编号rs12248560。PON1 染色体定位码为chr7:q21.3-q21.3; 95308, 其染色体核苷酸编号rs662。ABCB1 染色体定位码为chr7:q21.12-q21.12; 87509329,其染色体核苷酸编号rs1045642。ABCB1 染色体定位码为chr7:q21.12-q21.12; 87509329, 其染色体核苷酸编号rs1045642。根据CYP2C19 携带等位基因的情况将患者进行分类:①正常代谢型:未携带任何LOF 等位基因或GOF 等位基因, 即*1/*1;②中间代谢型:携带有1 个 LOF 等位基因, 即*1/*2, *1/*3,*2/*17, *3/*17;③慢代谢型:携带有2 个LOF 等位基因, 即*2/*2,*3/*3,*2/*3;④超快代谢型:携带有1 或2 个GOF 等位基因, 即*1/*17, *17/*17。
1.2.4 ADP 抑制率的测定及患者随访 患者于术后1 个月后晨起抽取肘静脉血, 分别置入枸橼酸钠抗凝真空采血管和肝素钠抗凝真空采血管中,2 h 内完成血小板抑制率的检测。应用美国Haemoscope 公司生产的TEG 分析仪(型号TEG5000),以ADP 为激活物测定氯吡格雷的血小板抑制率。ADP 血小板抑制率小于30%的患者考虑为氯吡格雷抵抗患者。所有患者术后6 个月进行随访, 记录患者的出血情况。
2 结果
2.1 318 例患者氯吡格雷相关基因的分型及所占比例 318 例患者PCI 术后患者的氯吡格雷相关基因分型:CYP2C19*2 基 因 的AA 突 变 型10.06%,AG 杂 合型30.81%;CYP2C19*3 基因无突变型, AG 杂合型30.81%;CYP2C19*17 基因无突变型, CT 杂合型6.29%;ABCB1 基因突变型约占9.74%,CT 杂合型52.52%;PON1 基因AA 突 变 型10.06%,AG 杂合型占65.41%。见表2。

表2 318 例患者氯吡格雷相关基因的分型及所占比例[n(%)]
2.2 318 例患者氯吡格雷不同代谢情况的CYP2C19基因频率比较 氯吡格雷抵抗的患者共63 例, 氯吡格雷正常255 例;氯吡格雷抵抗组携带两个LOF 等位基因的发生率显著大于氯吡格雷正常组(P<0.05)。见表3。

表3 318 例患者氯吡格雷不同代谢情况的CYP2C19 基因频率比较[n(%)]
2.3 随访患者出血病例的情况 患者6 个月随访时共发生出血病例28 例(8.80%)。其出血表现主要为皮肤淤血, 牙龈出血, 鼻衄等出血学术研究会(Bleeding Academic Research Consortium, BARC)定义的1 型出血,均未出现BARC>2 型的严重消化道出血、脑出血等致命性大出血, 均未出现因出血而停用双抗的病例。出血病例中, 携带有GOF 等位基因组共19 例(67.86%),非携带有GOF 等位基因组*1/*2, *1/*3 有2 例(7.14%),*1/*1 有7 例(25.0%), 28 例出血病例多为携带有GOF等位基因。见表4。
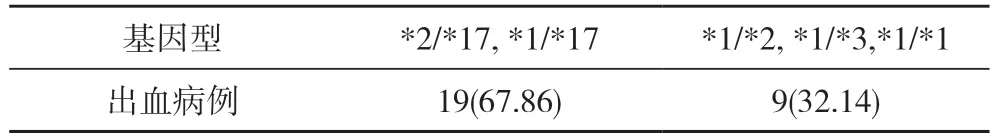
表4 28 例出血病例氯吡格雷CYP2C19 基因分型的比较[n(%)]
3 讨论
氯吡格雷是前体药物, 其需要通过转运体ABCB1吸收入血, 再通过CYP2C19 和PON1 两步代谢转化为有活性的代谢产物后再发挥药理效应, 因此其吸收、转化过程受多个基因的表达影响[4]。等位基因编码的代谢酶具有不同的代谢能力, 正常野生型表现为快代谢型;绝大多数突变型等位基因, 因碱基的突变、插入或缺失而造成酶代谢能力降低, 表现为慢代谢型。CYP2C19 基因存在多态性, 不同性别、年龄和体质量指数患者的发生率无差异[5], 其至少有14 种突变基因和18 种等位基因突变。在亚洲健康人群中, 发现CYP2C19*2、CYP2C19*3 的等位基因的总发生率分别为28.4%和5.5%[6]。CYP2C19*1 是编码正常活性酶的基因, CYP2C19*2、CYP2C19*3 是其等位基因, 编码的酶没有活性, 可导致氯吡格雷的代谢减慢, 其突变型是氯吡格雷抵抗的危险因素, 此类患者PCI 术后主要心脏不良事件明显增高[7,8]。在急性心肌梗死患者中,CYP2C19 基因突变型可能与超敏C 反应蛋白(hs-CRP)和白细胞介素-6(IL-6)具有相关性, 其心血管疾病主要不良事件发生率较高[9]。CYP2C19*17 等位基因编码的酶可导致氯吡格雷的超快代谢, 其突变型有出血的风险性。有荟萃分析研究发现, 与非携带者相比CYP2C19*17 变异体携带者对冠状动脉疾病患者的复发性心血管事件具有显著的保护作用, 主要心血管疾病不良事件的发生率降低了16%, 但CYP2C19*17 变异体携带者发生出血的风险也同样是增加的[10]。另有研究显示中国人中冠心病患者CYP2C19*2 和CYP2C19*3基因携带率约为56.4%[11], 与本文所得数据大致相仿。但本研究病例数有限, 其基因形态可能只符合于本地区的人群特点, 如果想得到更全面的详细资料, 需要多个地区及更大规模病例数进一步证实。我们发现氯吡格雷抵抗患者共63 例, 其中携带两个LOF 等位基因的患者37 例, 携带一个LOF 等位基因患者23 例, 而且未携带LOF 等位基因的患者中有3 例也存在氯吡格雷抵抗现象, 这可能与其基因型相同的生物表现型不尽相同相关, 可能受外界环境如其他药物、基础疾病或接受其他治疗手段等因素的影响。而且携带一个GOF等位基因较非携带GOF 等位基因组的出血病例明显增多, 携带两个LOF 等位基因的患者其出血发生非常罕见。同样说明尽管有表现型的差异, 但基因型绝大多数还是能反应出其表现形式。对于携带两个LOF 或GOF 等位基因的患者我们临床应引起注意。
ABCB1 基因C3435T 影响氯吡格雷被吸收入血的效率, 其突变型(TT)吸收效率明显降低, 可影响氯吡格雷的血药浓度[12]。有研究发现PCI 前后CYP2C19的中间代谢型与快速代谢型中氯吡格雷的非活性代谢产物浓度相比没有显著差异, 而快速代谢型对血小板聚集的抑制作用明显优于中间代谢型。存在ABCB1 基因2677 位A 等位基因的患者与PCI 前相比, 氯吡格雷的非活性代谢产物浓度显著降低[13]。本文中其突变型和杂合型高达62.58%, 所以, ABCB1 基因多态性对氯吡格雷的影响应引起临床重视。
PON1 是氯吡格雷体内代谢中的一环, 目前PON1基因的多态性对氯吡格雷代谢的影响有一定的争议[14-16]。有研究发现尽管不能排除与其他遗传多态性相关的替代结果, 与非携带者相比, 携带≥1 个PON1 192R 等位基因的患者更容易出现氯吡格雷的高血小板反应性[17]。另有研究[18,19]表明, PON1 Q192R 基因型多态性与心血管事件之间没有相关性, 没有证据表明PON1 基因型与氯吡格雷之间存在任何相互作用, 也没有证据表明基因型与心血管事件之间存在关联。本文发现PON1 基因的突变型和杂合型较高, 可达75.47%, 其远期可能再发生冠状动脉血栓的风险性也不能忽视, 还需要具体结合临床, 根据患者的高危因素和冠状动脉血管及支架具体情况而进行综合评估。
综上所述, 基于CYP2C19 基因型对于氯吡格雷活性代谢产物的影响, 其慢代谢和中间代谢型的发生可导致此类患者应用氯吡格雷时其抗血小板作用显著降低, 进而发生重大心脑血管不良事件的风险增加。因此CYP2C19 基因型和氯吡格雷治疗临床药物遗传学实施联合会指南:2022 年更新版本对2013 年关于CYP2C19 基因型的氯吡格雷使用指南的进行了更新,扩大了CYP2C19 的基因型指导抗血小板治疗的适应证。尽管我国指南尚不推荐患者常规行氯吡格雷相关基因的检测, 但在急重症和特殊病种患者, 必要时可行CYP2C19 基因型指导下的氯吡格雷使用, 并结合患者的临床其他情况进行综合评估, 给患者以最优的治疗方案。期望以后有更多的实验数据, 来为患者的精准化治疗提供依据。
