脂肪甘油三酯脂肪酶在肿瘤中的研究进展
2024-03-07洪子强苟云久
赵 静,洪子强,苟云久
脂肪甘油三酯脂肪酶(adipose triglyceride lipase, ATGL)是一种脂肪组织分泌的细胞因子,是甘油三酯水解释放脂肪酸的限速酶[1]。缺氧存在于大多数恶性肿瘤中,为了适应缺氧,肿瘤细胞将其代谢从氧化磷酸化(正常细胞中的主要能量供应方式)转变为糖酵解,称为沃伯格效应[2]。氧化磷酸化的减弱也抑制细胞内脂肪酸β氧化以减少氧气消耗。因此,理论上ATGL在肿瘤细胞中的活性和表达应与肿瘤细胞的活性呈负相关。在非小细胞肺癌和胰腺癌等中可以观察到ATGL水平降低[3],而在一些癌症中[4]ATGL对肿瘤进展具有促进作用。因此,ATGL在肿瘤细胞中的作用是不确定的,其可能取决于肿瘤类型和肿瘤发生的环境。本文综述了ATGL在不同肿瘤中的作用和机制,以期为肿瘤的治疗提供新的研究思路。
1 ATGL的结构及功能
细胞内磷酸化脂肪酶分解脂滴中储存的甘油三酯,释放游离脂肪酸,参与细胞内的能量代谢和信号转导[5-6]。这些脂肪酶包括ATGL、激素敏感脂肪酶(hormone-sensitive triglyceride lipase, HSL)和单酰基甘油脂肪酶(monoacylglycerol lipase, MGL)[7]。其中,ATGL是甘油三酯降解的限速酶,其负责将一分子甘油三酯分解成一分子甘油二酯和一分子游离脂肪酸。同时,HSL和MGL分别负责甘油二酯和甘油一酯的分解。ATGL由人体内的Pnpla2基因编码,对甘油三酯具有非常高的底物特异性[4]。ATGL的N端是α/β/α结构域,该片段包含Patatin样结构域、α-螺旋结构和催化丝氨酸天冬氨酸双链体(丝氨酸47和天冬氨酸166),它们对甘油三酯的底物结合和甘油三酸酯水解至关重要[4]。ATGL在其C端含有疏水性脂质结合片段以及2个潜在的AMP活化蛋白激酶(AMPK)磷酸化位点(丝氨酸404和丝氨酸428),它们负责ATGL在脂滴上的定位[7]。
2 ATGL与不同信号轴
2.1 PPAR-γ/G0S2/ATGL轴G0/G1期开关基因2(G0/G1switch2,G0S2)最早在诱导细胞周期进展后的血液单核细胞中发现,与细胞周期从G0期过渡到G1期有关[8-9]。其已被证明是ATGL的细胞内抑制剂,并且在代谢活跃的组织中大量表达,如脂肪组织、骨骼肌和心脏等[10]。G0S2通过与ATGL结合以抑制其甘油三酯的水解来实现甘油三酯调节。
首先,G0S2通过直接结合ATGL抑制其活性,参与调节细胞脂质代谢。其次,G0S2的表达也受PPAR(PPAR-α、PPAR-β/δ和PPAR-γ)的调控。Zandbergen等[11]的研究结果证明G0S2是PPAR的靶基因。在肿瘤微环境中的缺氧诱导下,肿瘤细胞增加PPAR-α和PPAR-γ的表达,从而促进其靶基因G0S2的表达,避免所需的脂肪酸发生氧化。作为ATGL的直接抑制剂,G0S2的高表达使ATGL在肿瘤细胞中功能失活,最终导致甘油三酯和脂滴在肿瘤细胞中的积累。
2.2 HIF-1α/HIG-2/ATGL轴在正常氧浓度下,HIF-1α中的脯氨酸残基被HIF脯氨酸羟化酶(prolyl hydroxylase, PHD)羟基化,然后通过pVHL的泛素化降解[12]。在缺氧条件下,PHD活性受到抑制,因此HIF-1α能够稳定转移到细胞核中与特定的DNA缺氧反应元件结合,并激活大量基因的转录[12]。肿瘤组织所暴露的缺氧环境导致肿瘤细胞中HIF-a表达上调[13]。此外,除了缺氧诱导,原癌基因和抑癌基因的突变也可以导致HIF-1α表达上调。
HIG-2是缺氧诱导基因2,位于7号染色体上,由两个外显子和一个内含子组成[14]。在功能上,HIG-2调节脂肪储存,以响应细胞外供氧不足或细胞内脂肪酸含量过高。该蛋白的功能部分依赖于ATGL和二脂酰甘油酰基转移酶(diacylglycerol acyltransferase, DGAT)。Zhang等[14]通过免疫沉淀实验证实HIG-2可以与ATGL物理结合。上述结果表明肿瘤细胞中存在缺氧诱导的HIF-1α/HIG-2/ATGL轴。因此,肿瘤细胞可能通过该轴减少脂肪酸β氧化,以减少缺氧条件下的耗氧量。
2.3 FSP-27/EGR-1/ATGL轴FSP-27是一种脂滴表面结合蛋白,是调控脂滴发育和脂质沉积的关键因子。Singh等[15]研究发现,在脂肪细胞中,FSP-27可与EGR-1或神经生长因子诱导蛋白-A(NGFI-A)协同抑制ATGL的表达。此外,FSP-27还可以直接抑制ATGL蛋白活性减少脂滴中脂肪酸的释放。
在细胞中,FSP-27主要参与脂滴的形态调节[16]。脂肪细胞中FSP-27的缺失导致脂滴的碎片化。相反,当FSP-27过表达时,可以促进脂滴的融合和脂滴之间的脂质交换,导致脂滴数量减少和脂滴体积增加[17]。FSP-27已被证明具有抗脂解活性,在肿瘤细胞中,FSP-27也随脂质代谢的变化而改变,并且是肺癌和胰腺癌的预后指标[18]。未来需要更多的研究来探索缺氧是否诱导改变FSP-27表达,HIF-1α和HIG-2在FSP-27表达中所起的作用,以及肿瘤细胞中FSP-27的表达是否与肿瘤细胞对脂质的可用性相关。
3 ATGL和自噬
自噬也是脂质同质化的关键调节因子,自噬介导的脂质降解为亲脂性[19]。ATGL在亲脂性调节中发挥积极作用,ATGL蛋白序列含有微管相关蛋白1的轻链3(microtubule-associated-proteinlight-chain 3, LC3)相互作用区,这是一个介导自噬受体和LC3包被的自噬体之间关联的基序。Sathyanarayan等[20]的研究结果表明,ATGL通过肝脏中的SIRT1信号刺激自噬和脂噬。肝脏中的脂质同质化在较大程度上依赖于脂噬,其损害会促进肝脂肪变性,这是肝细胞癌发展的主要危险因素之一[20]。ATGL溶脂和噬脂活性的失调对肝脏同质化是有害的,具有潜在的致瘤作用。目前仍需深入探索,并将其扩展到脂质积聚的其他组织,如胰腺等。
4 ATGL和肿瘤免疫微环境
目前,人类15%~25%的癌症是由慢性炎症引起[21]。肿瘤相关巨噬细胞(tumor-associated macrophage, TAM)在慢性炎症和癌症之间发挥重要作用。越来越多的证据表明脂质对巨噬细胞的功能和分化有显著影响。在TAM中也发现HIG-2表达上调和脂滴累积。脂质代谢改变巨噬细胞中脂质的积累并进一步影响其功能和分化。脂肪酸代谢对TAM的影响主要取决于脂肪酸种类,饱和脂肪酸的代谢增加具有致瘤活性,而不饱和脂肪酸的代谢增加具有肿瘤抑制活性[22]。这可能是由于在细胞中不饱和脂肪酸比饱和脂肪酸产生更多的脂质过氧化物,从而诱导细胞凋亡。总之,TAM中甘油三酯的脂解过程在TAM和ATGL的功能和分化过程中起至关重要的作用。然而,未来仍需积累更多的研究进一步阐明ATGL在TAM中的具体机制。
5 不同肿瘤中ATGL的作用
对于不同类型的肿瘤细胞,ATGL具有不同的作用,并可以与各种细胞内因子相互作用。因此,本文总结了ATGL在不同肿瘤细胞中的作用(表1)。
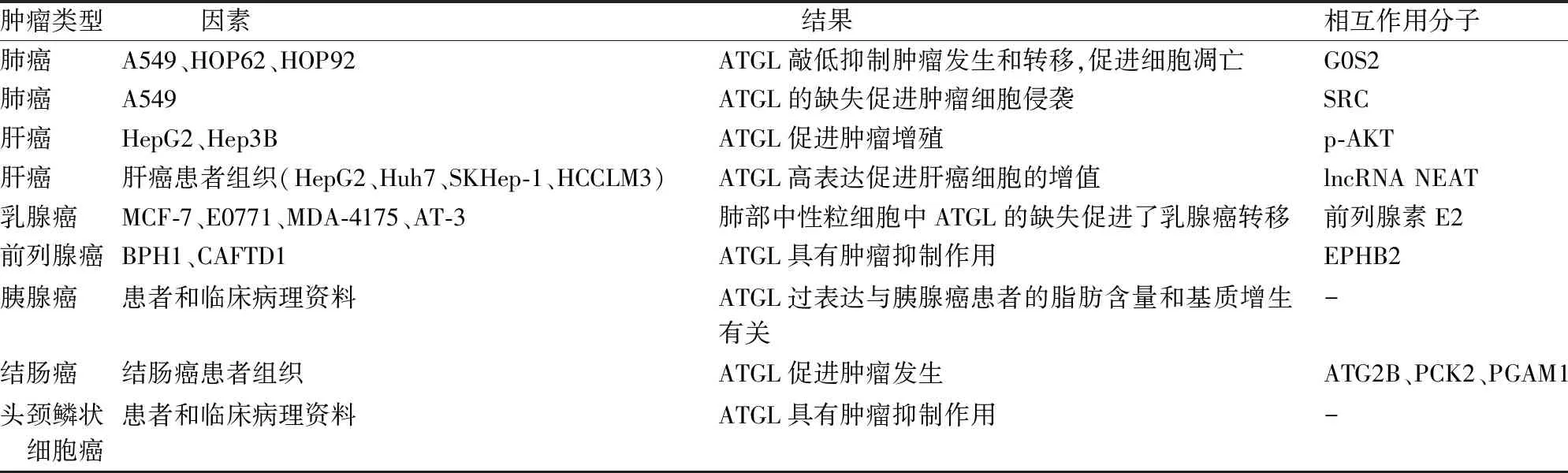
表1 不同肿瘤中ATGL的作用
5.1 肺癌中ATGL的作用ATGL在肺癌中的作用尚不明确。在ATGL基因敲低的A549肺癌细胞中发现脂滴中的甘油三酯积累以及较高水平的细胞磷脂和生物活性脂质(溶血磷脂和乙醚磷脂)[23]。ATGL基因敲低的A549肺癌细胞具有更强的迁移能力,这与磷酸化Src原癌基因水平升高相关。在肺癌小鼠模型中,ATGL过表达可以促进肿瘤发展[24]。在细胞和动物水平上产生不一致的结果,可能与肿瘤细胞所在微环境差异有关。
5.2 肝癌中ATGL的作用肝癌细胞中的ATGL更多地参与肿瘤细胞增殖而非转移。ATGL在肝癌细胞中过表达促进p-AKT磷酸化,也促进肿瘤细胞增殖,但不影响肿瘤细胞的转移能力[25]。长链非编码RNA NEAT1通过在原位肝癌小鼠模型中诱导ATGL表达来脂解驱动肿瘤细胞增殖[26]。然而,Di等[27]研究发现在人源性肝癌细胞样品和诱导小鼠肝癌模型中,ATGL的表达低于对照组。肝癌细胞的增殖速率与ATGL表达呈负相关。这种现象归因于由PPAR-α/p300轴介导的ATGL上调引起的肿瘤抑制因子p53的上调。
5.3 乳腺癌中ATGL的作用低氧微环境中肿瘤细胞ATGL的表达通常降低,以减少细胞内游离脂肪酸。相比之下,人类正常细胞内低游离脂肪酸通常与脂肪酸氧化降低有关。
因此,细胞可能以这种方式对缺氧环境作出反应。脂肪酸氧化和ATGL对乳腺癌有促进作用。脂肪酸氧化的促癌作用表明乳腺癌细胞需要更多的脂肪酸。此外,脂肪酸氧化的激活通常与乳腺癌细胞转移能力的增加有关[28]。乳腺癌细胞可诱导附近脂肪细胞释放大量脂肪酸,以甘油三酯的形式储存,随后通过ATGL的过表达促进非偶联脂肪酸氧化的发生,最终增加其转移能力[28]。在乳腺癌扩散部位,通常会为即将到来的肿瘤细胞准备大量脂质。储存在中性粒细胞中的脂质被转移到乳腺癌细胞中,乳腺癌细胞通过胞饮溶酶体途径扩散,促进其增殖和存活。
5.4 前列腺癌中ATGL的作用ATGL在前列腺癌细胞中的作用受肾上腺素B2受体(EPHB2)的调节。EPHB2作为前列腺癌细胞的抑制剂,能够通过抑制DGAT1、DGAT2的活性和促进脂解因子ATGL和PEDF发挥抑制肿瘤的作用[29]。Nardi等[30]研究发现,与正常前列腺成纤维细胞相比,前列腺癌相关成纤维细胞中ATGL和PEDF的表达较低,这表明在前列腺癌相关成纤维细胞中可能储存了更多的脂质,以促进前列腺癌细胞的生长。
5.5 胰腺癌中ATGL的作用Grace等[5]对44例胰腺癌组织样本进行免疫组化分析,结果显示肥胖患者的肿瘤基质中ATGL表达升高。然而,ATGL的含量与肿瘤大小和组织学分级无相关性,因此ATGL的增加可能是肥胖诱导的胰腺癌的关键因素[5]。在EL-KrasG12D/色素上皮衍生因子(PEDF)缺陷小鼠中还发现了胰腺中脂肪细胞浸润增加和脂肪细胞肥大、肿瘤组织脂滴形成相关蛋白甘露糖-6-磷酸受体结合蛋白1(TIP-47)和脂肪分化相关蛋白(ADRP)水平升高[31]。同时,EL-KrasG12D/PEDF缺陷小鼠发展为更具侵袭性的胰腺癌表型。然而,随着PEDF的敲低,ATGL水平降低,表明胰腺癌中的ATGL可能不具有与乳腺癌相同的促转移能力。同样,在另一个胰腺癌小鼠模型中,ATGL的抑制并未改变Hilpda野生型和敲低细胞之间甘油三酯丰度的差异[32]。因此,在胰腺癌中,ATGL可能不是肿瘤增殖和转移的关键因素,但可能是肿瘤形成的关键因素。
5.6 结直肠癌和头颈鳞状细胞癌中ATGL的作用在结肠癌细胞和结肠癌干细胞中,ATGL介导的脂滴用于肿瘤的发展[33]。Yin等[33]研究发现,ATGL对结直肠癌的促进作用是通过降解甘油三酯和促进与鞘脂代谢、辅酶A生物合成相关基因的表达来实现的。虽然ATGL与鞘脂代谢相关,但ATGL不调节与鞘脂代谢相关蛋白的表达。肖雪等[34]的研究结果显示,头颈鳞状细胞癌中ATGL的表达与B淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞、巨噬细胞、中性粒细胞及树突状细胞等免疫细胞的浸润程度呈正相关(P<0.05)。这提示头颈鳞状细胞癌可能通过下调ATGL来抑制免疫细胞的防御功能,从而发生免疫逃避,导致患者预后不良[34]。
6 结语
本文综述了近年来肿瘤细胞调控ATGL介导的脂质代谢途径,以及ATGL对不同肿瘤的影响。ATGL是细胞中脂质代谢的关键酶,其表达和活性直接影响细胞内能量来源是葡萄糖还是脂肪酸。ATGL的促肿瘤作用通常与肿瘤发生的位置是否能够获得大量脂质有关,而内源性和外源性脂肪酸可能对肿瘤细胞产生不同甚至相反的影响。因此,未来需要更多的研究来探索外源性脂质对ATGL在肿瘤中作用的影响。此外,未来也需要更多的研究来探索与正常细胞相比,肿瘤细胞中ATGL表达和降解的改变,从而有助于开发针对相关蛋白的抗肿瘤药物。