阿霉素预处理联合GNPs-siPD-L1通过激活抗肿瘤免疫反应抑制肺癌进展
2024-03-07姜伟华高永山王贵刚杨燕君董跃华张振明
姜伟华 高永山 王贵刚 杨燕君 董跃华 张振明
(河北北方学院附属第一医院胸外科,河北 张家口 075000)
最常见的肺癌类型是非小细胞肺癌,约占肺癌病例的 84%〔1~3〕。尽管多学科抗癌策略不断发展,但肺癌仍是全球癌症的首要死因,因此仍需探索新的治疗方案〔4〕。免疫检查点抑制剂在肺癌治疗中表现出惊人的疗效,程序性细胞死亡蛋白(PD)-1/PD配体(PD-L)1抗体已广泛用于肺癌的二线治疗中〔5,6〕。然而肿瘤抗原突变或表达下调往往会造成抗体治疗失败〔7〕,因此基于 siRNA 在基因层面敲低目标基因的含量在癌症治疗中具有巨大潜力〔8〕。此外,先前的一项研究发现,低剂量的阿霉素会增加小鼠肿瘤中内源性CD8+T细胞的浸润,可能对局部抗肿瘤免疫反应产生帮助〔9〕。本研究设计针对PD-L1的小干扰RNA(siRNA),并且利用金纳米粒(GNPs-siPD-L1)作为siRNA载体,探索这种包含PD-L1 siRNA的金纳米粒是否可以激活抗肿瘤免疫反应,并采用低剂量阿霉素对荷瘤小鼠进行预处理,探讨这种联合治疗策略是否可以进一步增强GNPs-siPD-L1对肺癌的抑制活性。
1 材料和方法
1.1细胞系 小鼠LLC细胞系购自武汉普诺赛生物科技有限公司,使用DMEM+10%胎牛血清的完全培养基对其进行培养。
1.2主要试剂 十六烷基三甲基氯化铵(CTAC)、左旋维生素C(AA)、聚4-苯乙烯磺酸钠(PSS)、聚二烯丙基二甲基氯化铵(PDADMAC)及胶原酶Ⅰ购自美国Sigma公司;放射免疫沉淀(RIPA)裂解液、苯甲基磺酰氟(PMSF)、二氨基联苯胺(DAB)显色液及苏木素染液购自上海碧云天生物科技有限公司;兔抗PD-L1抗体、兔抗CD4抗体及兔抗CD8抗体购自美国CST公司;膜联蛋白(Annexin)Ⅴ/7-AAD 凋亡检测试剂盒购自北京义翘神州生物科技有限公司;TUNEL染色试剂盒购自上海翌圣生物科技有限公司;山羊抗兔二抗购自杭州联科生物科技有限公司;盐酸阿霉素购自上海懋康生物;荧光标记的PD-L1 siRNA-羧基荧光素(FAM),由上海吉玛生物进行合成。
1.3GNPs和GNPs-siPD-L1的合成 将1.6 ml CTAC(0.1 mol/L)溶液加入8 ml超纯水中,然后加入 75 μl碘化钾(KI,0.01 mol/L)和80 μl HAuCl4(25.4 mmol/L)。然后将 20.3 μl NaOH(0.1 mol/L)快速加入混合物中。之后,将 80 μl AA(64 mmol/L) 快速加入溶液中,同时适度摇动。最后,将 10 μl NaOH(0.1 mol/L) 快速加入混合物中,并快速摇动瓶子。反应结束后,10 000 r/min离心10 min收集GNP,并重悬在超纯水中。将4 ml聚苯乙烯磺酸钠(PSS)溶液(10 mg/ml)和2 ml NaCl溶液(10 mmol/L) 添加到20 ml GNPs中,并在室温下搅拌1 h。10 000 r/min离心10 min收集沉积,使用超纯水重悬。同样的,将4 ml聚二烯丙基二甲基氯化铵(PDADMAC)溶液(10 mg/ml)和2 ml NaCl溶液(10 mmol/L) 添加到20 ml刚刚收集的沉淀中,并在室温下搅拌1 h。10 000 r/min离心10 min收集沉积,使用超纯水重悬。将制备的金纳米粒与2 μg siRNA轻轻混合,室温孵育30 min,通过静电吸附获得GNPs-siPD-L1。之后,将溶液以10 000 r/min离心10 min。收集颗粒并储存于4 ℃备用。通过透射电子显微镜(JEM-2100F)观测GNPs 和GNPs-siPD-L1样品。
1.4Western印迹检测PD-L1的表达 1×105个细胞分别与磷酸盐缓冲液(PBS)、siPD-L1(5 nmol/L)及GNPs-siPD-L1(5 nmol/L siRNA)共孵育24 h,收集细胞提取总蛋白,经过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)及转膜后,聚偏氟乙烯(PVDF)膜在脱脂奶粉中室温封闭1 h,使用兔抗PD-L1抗体(1∶1 500)4 ℃过夜孵育,次日使用山羊抗兔二抗(1∶10 000)室温孵育1 h,之后通过凝胶成像仪(Tanno-3500)进行曝光。
1.5流式细胞术检测细胞对GNPs-siPD-L1摄取及肿瘤细胞的凋亡 3×105个细胞分别与荧光标记的siPD-L1-FAM(5 nmol/L)、GNPs-siPD-L1-FAM(5 nmol/L siRNA)及Lipo-siPD-L1-FAM(5 nmol/L siRNA)共孵育24 h,收集细胞,PBS清洗3次后使用流式细胞仪(BD FACSCanto Ⅱ)进行检测。对于细胞凋亡,取20 mg新鲜的肿瘤,剪碎后使用胶原酶Ⅰ溶液37 ℃消化1 h,使用100 μm滤网过滤后形成单细胞悬液,按照Annexin Ⅴ/7-AAD 凋亡检测试剂盒的说明对细胞进行处理,最后使用流式细胞仪(BD FACSCanto Ⅱ)进行检测。
1.6小鼠移植瘤模型检测GNPs-siPD-L1的肿瘤抑制能力 5周龄大小的C57BL小鼠购自河北省实验动物中心,所有体内实验均满足医院伦理委员会的要求。取1×105个LLC细胞重悬于100 μl PBS中,注射入小鼠背部皮下,7 d后待肿瘤大小为70 mm3左右时,随机分为3组(GNPs、GNPs-siPD-L1、GNPs-siPD-L1+Dox组),对于阿霉素预处理组,通过腹腔注射1 mg/kg盐酸阿霉素,在第8天和第10天,通过尾静脉分别注射100 μl GNPs或GNPs-siPD-L1(1 mg/ml),之后在第30天时对小鼠进行安乐死,解剖肿瘤,拍照并称量瘤重。瘤体积计算公式为:体积=长×宽2/2。
1.7免疫组化检测肿瘤浸润T细胞的数目及TUNEL染色检测细胞凋亡情况 取新鲜的肿瘤组织,使用4%多聚甲醛固定48 h,经过脱水包埋切片后制成组织切片,使用柠檬酸盐缓冲进行抗原修复,使用5%山羊血清室温封闭1 h后,加入兔抗CD4抗体(1∶100)及兔抗CD8抗体(1∶100)4 ℃孵育过夜,次日使用山羊抗兔二抗(1∶1 000)室温孵育1 h,之后经过DAB溶液显色、苏木素溶液染色,封片后在倒置显微镜下进行观察并拍照。对于TUNEL染色,将制成的石蜡切片按照TUNEL染色试剂盒的说明进行操作。阳性染色的细胞数目使用ImageJ软件进行统计。
1.8统计学分析 采用SPSS19.0软件进行非配对t检验及方差分析。
2 结 果
2.1构建GNPs-siPD-L1并验证其对PD-L1表达的影响 电镜检测结果显示,GNPs-siPD-L1的粒径大小在130 nm左右,形态均一,且GNPs-siPD-L1与空的金纳米粒GNPs无显著差异(图1)。Western印迹结果表明,GNPs-siPD-L1与LLC细胞共孵育后PD-L1蛋白表达(0.800 0±0.100 0)较siPD-L1和PBS(1.380 0±0.393 6)、(1.463 0±0.209 8)表达显著降低(P<0.05)。见图2。

图1 GNPs-siPD-L1(透射电镜,×50 000)

图2 GNPs-siPD-L1与LLC细胞共孵育后的PD-L1蛋白表达
2.2GNPs-siPD-L1增强肿瘤细胞对siRNA的摄取 与LLC细胞共孵育后的流式检测结果显示,裸露的PD-L1 siRNA几乎不能穿透肿瘤细胞膜,siPD-1组荧光强度为〔(12.00±1.000)%〕,而GNPs-siPD-L1显著增强了LLC细胞对PD-L1 siRNA的摄取,效率与Lipo-siRNA相当,即GNPs-siPD-L1组、Lipo-siPD-L1组荧光强度〔(75.670±2.517)%、(77.670±5.132)%〕较siPD-L1组显著升高(P<0.05),Blank组为空白细胞,作为阴性对照。见图3。

图3 GNPs-siPD-L1的细胞摄取
2.3阿霉素预处理联合GNPs-siPD-L1抑制肺癌细胞的体内生长 对荷瘤小鼠进行治疗30 d后发现,GNPs-siPD-L1对肿瘤的生长产生轻微的抑制,相反,经过阿霉素预处理,GNPs-siPD-L1组的肿瘤生长被显著抑制,肿瘤质量明显降低(P<0.05)。见图4、表1。
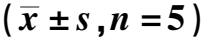
表1 各组肿瘤质量及肿瘤体积比较

图4 各组第30天肿瘤大小
2.4阿霉素预处理联合GNPs-siPD-L1增强T细胞的肿瘤浸润 免疫组化结果显示,GNPs-siPD-L1组与GNPs组相比,肿瘤组织中CD4+和CD8+T细胞数目明显增多(P<0.05),而阿霉素预处理联合GNPs-siPD-L1组相比于GNPs-siPD-L1组,肿瘤组织中CD4+细胞和CD8+T细胞的浸润程度进一步提升(P<0.001,P<0.000 1)。见图5、表2。

表2 各组T细胞浸润

图5 各组T细胞浸润(免疫组化染色,×200)
2.5阿霉素预处理联合GNPs-siPD-L1增加肿瘤细胞凋亡 流式检测结果表明,阿霉素预处理联合GNPs-siPD-L1组肿瘤组织中凋亡细胞比例较GNPs-siPD-L1组明显增多,同时,TUNEL染色结果发现,阿霉素预处理联合GNPs-siPD-L1组肿瘤组织中TUNEL阳性细胞数目显著多于GNPs-siPD-L1组(P<0.000 1)。见图6、图7、表3。
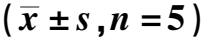
表3 各组肿瘤组织中细胞凋亡

图7 各组肿瘤组织细胞凋亡(TUNEL染色,×100)
3 讨 论
近年来,siRNA已成为一种非常有前景的抗癌治疗策略〔10〕。双链 siRNA 可以通过特异性靶向相应的 mRNA,诱导形成沉默复合物,从而导致特定基因表达沉默〔11〕。然而,在正常生理条件下,siRNA通常会被相关酶降解,这仍然是目前siRNA技术面临的最大障碍〔12,13〕。此外,siRNA固有的负电荷成为其穿过细胞膜的不利因素〔14〕。因此,使用经过适当修饰的生物相容性载体包裹 siRNA 来克服这些固有障碍,对于保证这种治疗方式的成功应用至关重要。纳米粒子是具有多种功能的强大载体,利用肿瘤的高渗透长滞留(EPR)效应,其具有天然的肿瘤靶向功能,是siRNA的理想载体〔15〕。金纳米粒是一种常用的纳米粒子,其具有易于制造、粒径可调节、天然无毒和生物相容性好的特点〔16,17〕。同时,有研究表明,siRNAs与金纳米粒结合后,可显著促进细胞摄取,从而提高体外或体内基因敲除效率〔18〕。本研究构建了PD-L1 siRNA金纳米粒复合物GNPs-siPD-L1,其可以有效促进PD-L1 siRNA的内化,降低肿瘤细胞PD-L1表达。但本研究尚未探讨GNPs-siPD-L1的体内代谢情况,后续的研究中将对GNPs-siPD-L1在荷瘤小鼠的体内分布进行检测。
PD-L1是一种与肿瘤进展相关的细胞膜蛋白。先前的研究结果表明,肿瘤细胞中PD-L1 表达使这些细胞对 T 细胞诱导靶细胞裂解功能丧失,从而加剧了肿瘤进展〔19〕。阻断 PD-1/PD-L1 配受体相互作用可有效抑制 PD-1/PD-L1 信号通路的激活,逆转 T 细胞耗竭,避免肿瘤微环境中的免疫抑制反应〔20〕。一些针对 PD-L1 的抗体药物已被美国食品药品监督管理局(FDA) 批准用于多种癌症患者的治疗〔21〕。除了先前聚焦的PD-1或PD-L1抗体诱发的抗肿瘤免疫反应外,一些报道也表明,PD-L1触发的抗凋亡信号可以提高肿瘤细胞的生存。这些发现说明癌细胞的 PD-L1 内生信号对肿瘤发展也至关重要,因此,下调PD-L1表达可能对肿瘤的治疗产生积极影响〔22〕。本研究发现,GNPs-siPD-L1可以成功诱导肺癌细胞PD-L1表达下调,同时增加肿瘤组织中T细胞的浸润及组织中细胞的凋亡。
已有大量研究表明,免疫检查点抑制剂治疗的响应率与肿瘤组织中CD8+T 细胞的浸润息息相关〔23〕。Hu等〔24〕发现,低剂量的阿霉素处理后诱发了小鼠纤维肉瘤中T 细胞依赖性的肿瘤消除,同时这种治疗在肿瘤中产生了高比例的共刺激受体,并减少了 Treg 细胞的数量,创造了一个对T 细胞浸润十分友好的肿瘤微环境。本研究发现,联合方案显著增加了肿瘤组织中CD4+和CD8+T细胞数量,同时增强了肿瘤细胞凋亡,有效抑制了肺癌细胞在体内的进展。
综上,GNPs-siPD-L1 可以有效下调肿瘤细胞中PD-L1的表达,同时该系统联合低剂量阿霉素预处理可以显著增强T细胞的肿瘤浸润,激发肿瘤部位的抗肿瘤免疫反应,增强肿瘤细胞凋亡,是一种非常有希望的肺癌治疗策略。
