氨磷汀通过调节肠道菌群对急性辐射损伤的防护作用机制Δ
2024-03-04丛悦李莉赵艺萌徐媛媛拱健婷关佳莉首都医科大学附属北京中医医院北京市中医药研究所北京100010
丛悦,李莉,赵艺萌,徐媛媛,拱健婷,关佳莉(首都医科大学附属北京中医医院北京市中医药研究所,北京 100010)
X射线是一种具有极短波长的电磁辐射,已被广泛用于医学成像诊断和肿瘤治疗中。然而X射线的电离辐射会对患者的正常组织产生巨大持久的损伤,引发放射性口腔炎、放射性肺炎、放射性直肠炎等副反应,极大地影响患者的生存质量,因此辐射前后及时给予辐射防护药物是减轻患者正常组织辐射损伤的必要措施。
氨磷汀是目前已知防护效果最好的辐射防护剂,对造血系统和胃肠辐射损伤防护的剂量降低系数分别为2.7和1.8[1],并已作为细胞保护剂被美国FDA批准用于减轻卵巢癌或肺癌患者使用顺铂后引起的肾脏毒性和头颈癌患者放疗导致的口干症[2]。已有研究证实,氨磷汀经转化后可形成活性物质WR-1065及WR-33278,其辐射防护机制主要是清除射线产生的氧自由基,增强DNA保护和修复功能,消耗细胞内氧分子[3]。
人体肠道微生物菌群可以影响宿主发育、代谢、免疫等多方面生理功能,微生物菌群稳态平衡与肠炎、肥胖、神经系统疾病等密切相关[4]。肠道微生物还可以影响宿主对电离辐射的敏感性和病理反应,大剂量急性辐射损伤和低剂量慢性辐射损伤时均可见肠道菌群组成发生明显变化[5]。同时,电离辐射亦会导致肠道菌群的衍生物发生改变,而这些衍生物往往参与了辐射损伤引起的多种细胞功能的调节[6]。因此,调节肠道微生态平衡有望成为一种新的减轻机体辐射损伤的治疗策略。本研究拟采用16S rRNA扩增子测序技术探究氨磷汀对急性辐射损伤小鼠肠道菌群的影响,从肠道微生物菌群调节角度研究氨磷汀的辐射防护作用机制。
1 材料
1.1 主要仪器
本研究所用主要仪器包括NanodropTM2000型超微量分光光度计(美国Thermo Fisher Scientific公司)、QuantiFluorTM-ST微型荧光计(美国Promega公司)、GeneAMP® 9700型聚合酶链式反应(PCR)仪(美国ABI公司)、BC-2800vet型兽用全自动血液细胞分析仪(深圳迈瑞动物医疗科技股份有限公司)、RS2000 Pro225型生物学X射线辐照仪(美国Rad Source公司)。
1.2 主要药品与试剂
氨磷汀对照品(批号A6493,纯度98%)购自上海士锋生物科技有限公司;TIANamp Stool DNA Kit试剂盒(批号DP328)购自天根生化科技(北京)有限公司;Phusion高保真DNA聚合酶(批号F630L)购自美国Thermo Fisher Scientific公司;AxyPrep DNA凝胶回收试剂盒(批号AP-GX-50)购自美国Axygen公司;Nextera XT DNA Sample Preparation Kit 建库试剂盒(批号FC-131-1024)购自美国Illumina公司。
1.3 动物
SPF级C57BL/6J小鼠30只,雄性,体重(20±2)g,购自湖北省实验动物研究中心,实验动物生产许可证号SCXK(鄂)2020-0018。小鼠在SPF环境中饲养,室温20~26 ℃,相对湿度40%~70%,昼夜明暗交替12 h;所有动物均自由食用灭菌饲料、饮用灭菌水。本实验方案经首都医科大学附属北京中医医院实验动物福利伦理委员会批准(批准文号BJTCM-M-2022-10-02)。
2 方法
2.1 分组、造模与给药
将30只小鼠在SPF环境中适应性喂养7 d后,于照射前24 h称重并随机分为正常对照组、模型组和氨磷汀组,每组10只。氨磷汀组小鼠腹腔注射氨磷汀150 mg/kg(参考前期氨磷汀的毒理研究和辐射防护效果、临床应用剂量等因素,选择毒性反应较低的剂量),正常对照组和模型组小鼠腹腔注射等体积生理盐水。给药30 min后,将模型组和氨磷汀组小鼠置于生物学X射线辐照仪中进行一次性全身照射,照射剂量4 Gy,照射剂量率1 Gy/min,辐照距离180 mm。照射后尽快将小鼠送回SPF环境中。
2.2 一般情况观察和外周血象检测
观察并记录小鼠照射后14 d内的死亡情况。各组小鼠分别于照射前2 h和照射后第1、4、7、10、14天取血10 μL,加兽用全自动血液细胞分析仪稀释液10 μL后,检测小鼠外周血中白细胞、血小板和红细胞计数,分析照射后第7天各类白细胞(中性粒细胞、淋巴细胞、单核细胞)的比例变化。
2.3 小鼠粪便标本采集和肠道菌群基因测序
照射后第7天,采用应激性排便法收集每组3只小鼠的新鲜粪便,并置于灭菌冻存管中,-80 ℃保存、备用。采用DNA Kit试剂盒提取粪便样本的总DNA,用超微量分光光度计测定DNA浓度和纯度,对提取所得细菌DNA的16SrRNA基因V3~V4区进行PCR扩增。扩增引物序列为:正向引物5′-CCTACGGGNGGCWGCAG-3′,反向引物5′-GGACTACHVGGGTWTCTAAT-3′;产物大小为465 bp。利用含2%溴化乙锭的琼脂糖进行凝胶电泳检验PCR扩增产物,用AxyPrep DNA凝胶回收试剂盒切胶回收DNA产物并纯化,产物使用QuantiFluorTM-ST微型荧光计进行DNA定量测定。使用Nextera XT DNA Sample Preparation Kit建库试剂盒构建测序文库并经质检后,用Illumina NovaSeq 6000测序平台对文库进行PE250双端测序。原始序列数据经质控、去噪、拼接、去嵌合等处理后进行DADA2方法聚类,默认以100%相似度将序列聚类成为操作分类单元(operational taxonomic units,OTUs)。根据聚类结果对OTUs进行单样本的多样性分析(α多样性分析)和基于UniFrac算法的各组样本之间的多样性分析[β多样性分析,利用主坐标分析(principal co-ordinates analysis,PCoA)显示样本微生物组模式]。根据分类学信息,在各分类水平上完成群落结构的统计分析,利用线性判别分析法(linear discriminant analysis effect size,LEfSe)分析在丰度上有显著差异的物种。
2.4 统计学方法
采用SPSS 19.0软件对数据进行统计分析。外周血象检测数据用单因素方差分析比较组间差异,存在组间差异的时间点采用LSD-t检验进行两两比较。检验水准α=0.05。采用R语言绘制小鼠肠道菌群在门、属分类水平的群落结构热图。采用Pearson检验进行相关性分析。
3 结果
3.1 氨磷汀对小鼠外周血象的影响
各组小鼠经4 Gy X射线全身照射后,14 d内无死亡。与正常对照组小鼠比较,模型组和氨磷汀组小鼠外周血中白细胞计数在X射线照射后第1天急剧下降至最低,第4天时逐渐恢复;氨磷汀组在照射后第1、4、7、10天均显著高于模型组(P<0.05或P<0.01,图1A)。模型组和氨磷汀组小鼠照射后血小板计数均先下降,并于第10天降至最低,但氨磷汀组显著高于模型组(P<0.05);随后两组小鼠血小板数逐渐升高(图1B)。模型组小鼠红细胞计数从照射后第1天开始逐步下降,而氨磷汀组则在照射后第1天轻微升高,且显著高于模型组(P<0.05),随后逐渐降低;模型组和氨磷汀组小鼠红细胞计数在14 d观察期内未见恢复(图1C)。

图1 各组小鼠外周血象变化(n=10)
3.2 氨磷汀对小鼠肠道菌群的影响
3.2.1 各组小鼠高通量测序数据统计及α/β多样性分析经高通量测序分析,3组样本共获得有效序列25 764~379 035条,采用稀疏方法对每组样本测序数据量进行抽平,抽平后数据量为25 735条序列。对所有抽平后数据进行OTUs聚类,共获得15个门、24个纲、42个目、97个科、209个属、386个种的菌群信息。3组共有OTUs 1 629个,正常对照组、模型组和氨磷汀组独有的OTUs分别为320、283、366个(图2A)。α多样性可反映样品内微生物菌群的丰度和多样性,本研究分别用Chao1指数和Shannon指数表征丰度和多样性。X射线照射后第7天,正常对照组、模型组和氨磷汀组小鼠肠道菌群丰度和多样性无显著差异(图2B、C)。β多样性能反映不同组间的菌群多样性,主要用于比较样本的组间差异。PCoA结果显示,正常对照组和模型组分离良好,PCoA1轴解释度为22.4%,PCoA2轴解释度为17.0%(图2D)。与正常对照组比较,模型组小鼠肠道微生物结构发生了明显变化,说明辐射显著改变了小鼠的肠道微生物结构。氨磷汀组也与模型组产生分离,说明氨磷汀能改变辐射引起的肠道菌群结构改变。
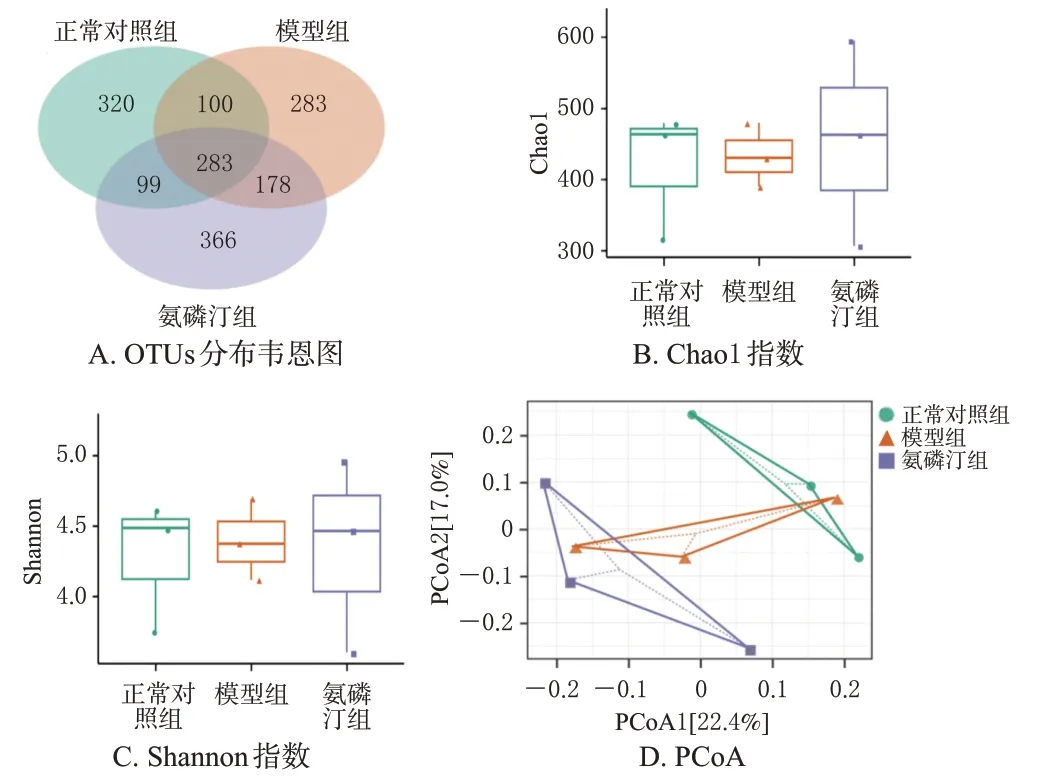
图2 各组小鼠肠道菌群OTUs数量及α/β多样性分析结果(n=3)
3.2.2 不同水平的肠道菌群物种组成分析
在门水平上,拟杆菌门Bacteroidetes、厚壁菌门Firmicutes、放线菌门Actinobacteria和变形菌门Proteobacteria是优势菌门。与正常对照组比较,模型组拟杆菌门Bacteroidetes相对丰度降低,厚壁菌门Firmicutes相对丰度增加,拟杆菌门Bacteroidetes与厚壁菌门Firmicutes相对丰度(B/F)比值降低。与模型组比较,氨磷汀组拟杆菌门Bacteroidetes相对丰度增加,厚壁菌门Firmicutes相对丰度降低,B/F比值增加,且二者相对丰度与正常对照组相对丰度接近(图3A)。
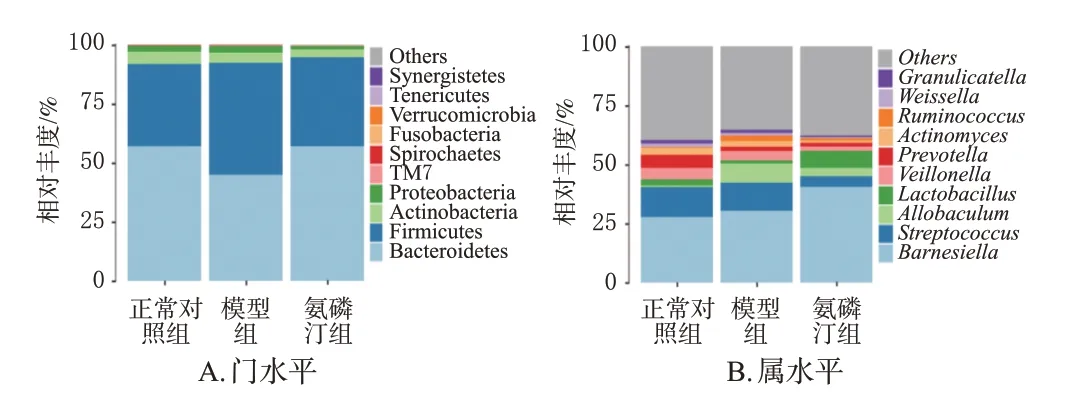
图3 各组小鼠肠道菌群在门和属水平的物种组成分布
在属水平上,正常对照组占比最高的5种菌属分别为巴恩斯氏菌属Barnesiella(27.74%)、链球菌属Streptococcus(12.61%)、普雷沃菌属Prevotella(5.42%)、韦荣氏球菌属Veillonella(4.97%)和乳杆菌属Lactobacillus(2.52%);模型组分别为巴恩斯氏菌属Barnesiella(30.41%)、链球菌属Streptococcus(11.86%)、异芽孢杆菌属Allobaculum(8.14%)、韦荣氏球菌属Veillonella(3.99%)和普雷沃菌属Prevotella(1.77%);氨磷汀组分别为巴恩斯氏菌属Barnesiella(40.49%)、乳杆菌属Lactobacillus(7.25%)、链球菌属Streptococcus(4.57%)、异芽孢杆菌属Allobaculum(3.46%)和韦荣氏球菌属Veillonella(1.83%)(图3B)。
3.2.3 组间群落差异性分析
LEfSe结果显示,模型组有异芽孢杆菌属Allobaculum、丹毒丝菌纲Erysipelotrichia、丹毒丝菌目Erysipelotrichales和丹毒丝菌科Erysipelotrichaceae 4个差异性物种,氨磷汀组有小鼠乳杆菌Lactobacillusmurinus和卷曲乳杆菌L.crispatus2个差异性物种(图4)。
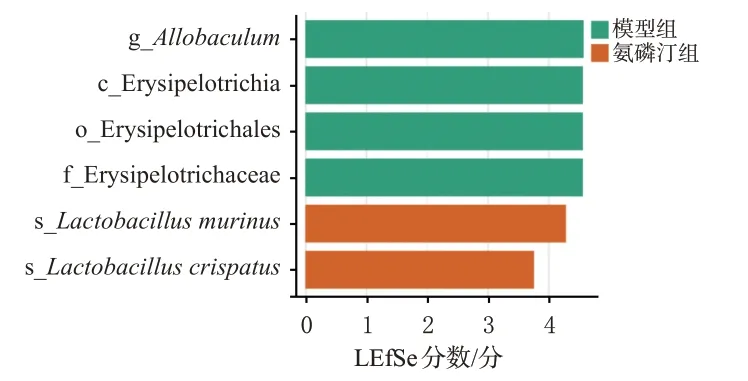
图4 各组小鼠肠道菌群LEfSe分析
3.3 肠道菌群变化与各类白细胞比例的相关性分析
与正常对照组比较,模型组小鼠淋巴细胞比例显著降低,单核细胞比例显著升高(P<0.05,图5A、B)。与模型组比较,氨磷汀组小鼠淋巴细胞比例显著升高,单核细胞比例显著降低(P<0.05,图5A、B)。3组小鼠中性粒细胞比例比较,差异均无统计学意义(P>0.05,图5C)。

图5 各组小鼠肠道菌群丰度与各类白细胞比例相关性分析结果(n=3)
在LEfSe基础上,将筛选出的6个差异性物种与各类白细胞进行Pearson相关性分析。小鼠乳杆菌L.murinus和卷曲乳杆菌L.crispatus的丰度与中性粒细胞比例呈显著负相关(P<0.05);异芽孢杆菌属Allobaculum、丹毒丝菌纲Erysipelotrichia、丹毒丝菌目Erysipelotrichales和丹毒丝菌科Erysipelotrichaceae的丰度与淋巴细胞比例均呈显著负相关(P<0.01);6个差异性物种与单核细胞比例无明显相关性(P>0.05)。结果见图5D。
4 讨论
正常情况下,肠道内的微生物可在肠道发挥共生功能,肠道菌群和肠道屏障之间处于稳态平衡。研究显示,辐射会破坏肠道屏障,使致病菌过度繁殖,释放大量内源性毒素,引起炎症反应,如盆腔或腹部放疗可导致约50%的患者发生胃肠道黏膜炎,而氨磷汀可使放疗所致胃肠道黏膜炎的发生风险降低50%~70%[7]。为探讨氨磷汀对机体的辐射损伤保护机制是否与肠道菌群变化相关,本研究采用16S rRNA扩增子测序技术探讨了氨磷汀对急性辐射损伤小鼠肠道菌群的影响。结果显示,X射线照射后第7天,正常对照组、模型组和氨磷汀组小鼠肠道菌群丰度和多样性均无显著差异,与Zheng等[8]研究结果一致。但Zhao等[9]对不同剂量γ射线照射小鼠肠道菌群的多样性分析显示,照射后6 h和3.5 d时,不同照射剂量组小鼠肠道菌群的α多样性无显著差异;照射后7 d时,4 Gy和8 Gy辐射组的Chao1指数和Shannon指数较对照组显著下降。本研究中各组小鼠肠道菌群α多样性无显著变化可能与动物品系、射线类型及照射剂量等因素相关。
拟杆菌门Bacteroidetes在宿主肠道中起着益生菌的作用,该门下多种细菌能产生短链脂肪酸,如丁酸盐、戊酸等,有助于减少炎症反应和维持肠道健康。B/F比值的降低能在一定程度上反映肠道微生物菌群失调和肠道损伤的典型特征[10]。Li等[11]对小鼠放射性肠炎模型进行测序发现,局部照射可导致B/F比值下降,鼠乳酸菌属丰度降低。本研究结果显示,与正常对照组比较,模型组小鼠肠道内B/F比值降低,与文献报道结果[11]一致。LEfSe结果显示,模型组有异芽孢杆菌属Allobaculum、丹毒丝菌纲Erysipelotrichia、丹毒丝菌目Erysipelotrichales和丹毒丝菌科Erysipelotrichaceae 4个差异性物种。异芽孢杆菌属Allobaculum是丹毒丝菌科Erysipelotrichaceae的下属分级,丹毒丝菌纲Erysipelotrichia及其下属分级属于厚壁菌门Firmicutes。已有研究显示,丹毒丝菌科与炎症相关,如Dinh等[12]在对慢性人类免疫缺陷病毒感染患者的肠道菌群研究中发现,丹毒丝菌科Erysipelotrichaceae的相对丰度与肿瘤坏死因子α水平呈正相关;Schaubeck等[13]在小鼠克隆氏肠炎模型中发现,丹毒丝菌科Erysipelotrichaceae相对丰度显著升高。本研究结果显示,与正常对照组比较,模型组小鼠肠道菌群紊乱,与炎症相关的菌群显著增多;氨磷汀干预后,小鼠肠道B/F比值增加,与模型组比较,氨磷汀组小鼠乳杆菌属Lactobacillus相对丰度升高,条件致病菌属如链球菌属Streptococcus、韦荣氏球菌属Veillonella相对丰度均降低。乳酸杆菌定植于胃肠道,可以提高营养物质的消化吸收,促进肠上皮细胞的再生,抑制肠道内腐败菌、致病菌的繁殖,被公认为是一种益生菌[14]。上述结果表明,氨磷汀可改善辐射引起的肠道条件致病菌和益生菌比例失调。
机体造血系统受到辐射损伤后,由于各类细胞对辐射敏感性不同,白细胞最早出现数量减少,随后血小板和红细胞减少。白细胞数量减少的程度和最低值出现时间与损伤程度密切相关,白细胞数量最低值越低并且出现越早,表明损伤程度越重[15]。本研究结果显示,氨磷汀可减缓小鼠辐射后全血细胞的减少,有效促进照射后14 d内白细胞计数和血小板计数的尽快恢复。肠道微生物菌群可通过促进造血细胞增殖、减少细胞死亡等机制发挥辐射保护作用,如Cui等[16]研究发现,6.5 Gy全身照射小鼠进行粪便微生物菌群移植后外周血白细胞计数有所升高,造血损伤减轻。因此,本研究进一步将组间菌群差异性物种丰度与各类白细胞比例进行相关性分析,结果显示,模型组差异性物种丰度与淋巴细胞比例呈显著负相关,氨磷汀组差异性物种丰度与中性粒细胞比例呈显著负相关。以上结果提示,氨磷汀可通过抑制致炎肠道菌群、增加益生菌群,来减缓辐射导致的白细胞急剧下降。
综上所述,氨磷汀可通过维持肠道微生物菌群平衡来减轻辐射造成的急性损伤。
