川芎挥发油对雷公藤甲素体外透皮性能及细胞毒性的影响Δ
2024-03-04蒋成臧振中陈丽华朱海婷傅世华朱卫丰吴文婷施韡管咏梅江西中医药大学现代中药制剂教育部重点实验室南昌0004江西中医药大学药学院南昌0004福建中医药大学附属康复医院药学部福州5000
蒋成 ,臧振中 ,陈丽华 ,朱海婷 ,傅世华 ,朱卫丰 ,吴文婷 ,施韡 ,管咏梅 #(.江西中医药大学现代中药制剂教育部重点实验室,南昌 0004;.江西中医药大学药学院,南昌 0004;.福建中医药大学附属康复医院药学部,福州 5000)
雷公藤别名黄藤、断肠草,为卫矛科植物雷公藤TripterygiumwilfordiiHook.f.的根、叶及花,始载于《神农本草经》,具有祛风除湿、通络止痛、解毒杀虫的功效[1]。现代临床研究表明,雷公藤可用于治疗类风湿性关节炎、紫癜性肾炎、系统性红斑狼疮等自身免疫性疾病,疗效显著[2-4]。雷公藤甲素是雷公藤的主要活性成分和毒性成分,其活性强、毒性大、生物利用度低、难溶于水、药物吸收性差,长期服用不仅会刺激胃肠道,引起中枢神经损伤,还会造成严重的肝肾毒性[5-6],因此雷公藤甲素是目前所有雷公藤制剂质量控制和安全标准的主要指标性成分[7]。有研究显示,雷公藤制剂经皮给药可以在发挥药效的同时很好地降低雷公藤甲素的毒性[1]。配伍减毒增效是中医药特色之一,通过配伍可促进毒性药物代谢、拮抗毒性药物的峻烈之性并协同发挥疗效,起到增效减毒的作用。本课题组前期通过数据挖掘雷公藤外用治疗类风湿性关节炎的用药规律发现,雷公藤外用时常与乳香、没药、川芎等配伍发挥增效减毒作用[8]。川芎挥发油是川芎的主要成分之一,由苯酞类、烯萜醇类、脂肪酸类等成分组成,具有较好的抗炎、抗氧化、调节细胞凋亡与细胞自噬等作用[9],同时其还可以作为一种透皮促渗剂来促进药物的透皮吸收[10]。基于此,本研究探讨了川芎挥发油对雷公藤甲素体外透皮性能和细胞毒性的影响,以期为后续川芎挥发油配伍雷公藤甲素的体内实验和配伍减毒作用机制研究,以及相关外用制剂的开发奠定基础。
1 材料
1.1 主要仪器
本研究所用主要仪器包括1260型高效液相色谱仪、6890N-5973N型气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)联用仪(美国Agilent公司),XD-202型倒置显微镜(南京江南永新光学有限公司),Incubator型CO2培养箱(上海力申科学仪器有限公司),TECAN Spark型多功能酶标仪(西安昊兴生物科技有限公司),TT-6D Franz型扩散池(天津正通科技有限公司)等。
1.2 主要药品与试剂
川芎挥发油(批号20220711)购自颇黎芳香医药科技(上海)有限公司;雷公藤甲素对照品(批号20150813,纯度≥98%)购自成都普菲德生物技术有限公司;单硬脂酸甘油酯(批号0210220)购自福晨(天津)化学试剂有限公司;轻质液体石蜡购自西安天正药用辅料有限公司;羊毛脂(批号1902172)、三乙醇胺(批号21090101)、无水乙醇(批号161217)均购自西陇科学股份有限公司;硬脂酸(批号RH252437)购自上海易恩化学技术有限公司;DMEM高糖培养基(批号20220726)购自北京索莱宝生物科技有限公司。
1.3 实验动物与细胞
雄性KM小鼠30只,体重(23±2)g,由斯贝福(北京)生物技术有限公司提供,生产许可证号为SCXK(京)2019-0010;所有动物实验遵循江西中医药大学动物实验伦理委员会有关实验动物管理和使用的规定,符合3R原则。人永生化角质形成细胞(HaCat)购自中国科学院典型培养物保藏委员会细胞库,目录号为SCSP-5091。
2 方法与结果
2.1 川芎挥发油主要成分的鉴定
采用GC-MS法。参照文献[11-12]中川芎挥发油的GC-MS鉴定方法,精密量取川芎挥发油50 μL,置于10 mL容量瓶中,用正己烷定容,充分混匀后过0.22 μm微孔滤膜,待测。GC-MS条件如下:Agilent HP-5 MS色谱柱(0.25 mm×30 m,0.25 μm);程序升温(60 ℃保持3 min;以4 ℃/min升至120 ℃,保持5 min;以6 ℃/min升至210 ℃,保持5 min;以8 ℃/min升至280 ℃,保持5 min);载气为高纯氮气;流速为1 mL/min;分流比为20∶1;进样口温度为200 ℃;火焰离子化检测器温度为250 ℃;进样量为1 μL。质谱条件如下:离子源为电子轰击离子源;电子能量为70 eV;接口温度为280 ℃;离子源温度为230 ℃;质量扫描范围为29~550 mAU。
结果,本研究共鉴定出川芎挥发油中的62个化学成分,通过美国国家标准与技术研究所数据库20.L(https://www.sisweb.com/software/ms/nist.htm)匹配化合物,并采用峰面积归一化法计算各化合物的相对百分含量。川芎挥发油中相对百分含量排前10位的化学成分及其相关信息见表1。
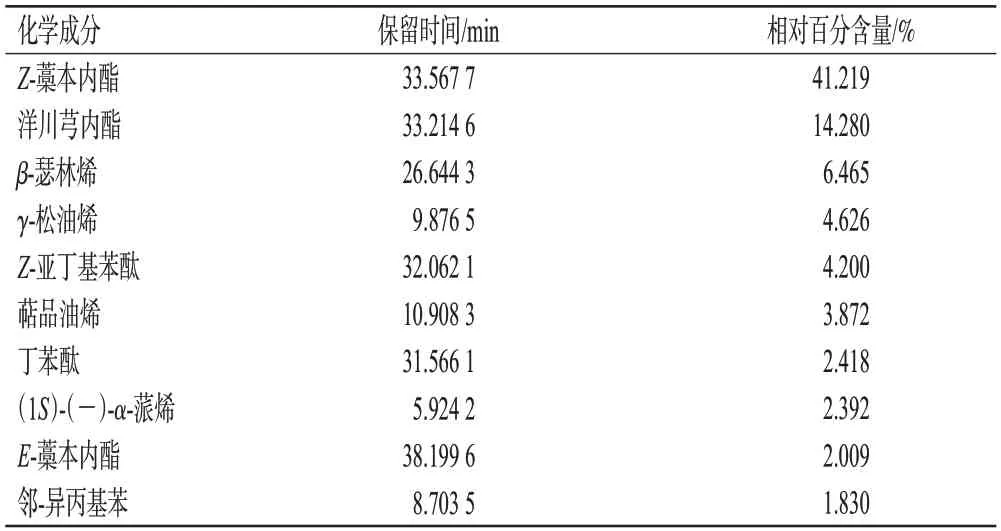
表1 川芎挥发油中相对百分含量排前10位的化学成分及其相关信息
2.2 雷公藤甲素透皮接收液的含量测定方法
含量测定采用高效液相色谱法。
2.2.1 对照品、供试品溶液的制备
取雷公藤甲素对照品适量,精密称定,置于棕色瓶中,加甲醇溶解并定容,制成每1 mL含雷公藤甲素0.25 mg的溶液,过0.22 μm微孔滤膜,即得对照品溶液。
按“2.3.1”项下方法制备乳膏,再按“2.4”项下方法进行体外透皮实验,取各组Franz扩散池中的透皮接收液1 mL,过0.22 μm微孔滤膜,即得供试品溶液。
2.2.2 色谱条件
采用Symmetry C18(250 mm×4.6 mm,5 μm)色谱柱,流动相为乙腈-水(42∶58,V/V),流速为0.8 mL/min,检测波长为218 nm,柱温为30 ℃,进样量为10 μL。
2.2.3 方法学考察
(1)专属性考察:取“2.2.1”项下对照品、供试品溶液及20%乙醇生理盐水(空白透皮接收液)各适量,按“2.2.2”项下色谱条件进样测定。结果显示,相同时间下对照品与供试品溶液存在相同色谱峰,空白透皮接收液不干扰雷公藤甲素的检测(图1)。(2)线性关系考察:取“2.2.1”项下对照品溶液,以甲醇稀释,配制质量浓度为30.75、20.5、12.3、6.15、0.82、0.615 μg/mL的雷公藤甲素对照品系列溶液,按“2.2.2”项下色谱条件进样测定,记录峰面积。以雷公藤甲素峰面积为纵坐标(A)、质量浓度为横坐标(C)进行回归分析,得回归方程为A=26.615C+13.300,R2=0.999 8(n=6)。结果表明,雷公藤甲素质量浓度在0.615~30.75 μg/mL线性范围内与峰面积呈良好线性关系。(3)精密度考察:取“2.2.1”项下对照品溶液,按“2.2.2”项下色谱条件连续进样6次,记录峰面积。结果显示,雷公藤甲素峰面积的RSD为0.51%(n=6),表明仪器精密度良好。(4)重复性考察:取雷公藤甲素组扩散24 h后的透皮接收液6份,按“2.2.1”项下方法制备供试品溶液,再按“2.2.2”项下色谱条件进样检测,记录峰面积。结果显示,雷公藤甲素峰面积的RSD为0.73%(n=6),表明该方法重复性良好。(5)稳定性考察:取雷公藤甲素组扩散24 h后的透皮接收液,分别于放置0、2、4、6、8、10、12、24 h时按“2.2.2”项下色谱条件进样测定,记录峰面积。结果显示,峰面积的RSD值为1.08%(n=8),表明该样品在24 h内稳定。(6)加样回收率试验:取雷公藤甲素组扩散24 h后的透皮接收液,测定其质量浓度,然后分别加入0.8、1、1.2倍该质量浓度的雷公藤甲素对照品,按“2.2.2”项下色谱条件进样测定,计算其加样回收率。结果显示,雷公藤甲素的平均加样回收率为102.3%,RSD为4.05%(n=3),表明该方法准确度良好。
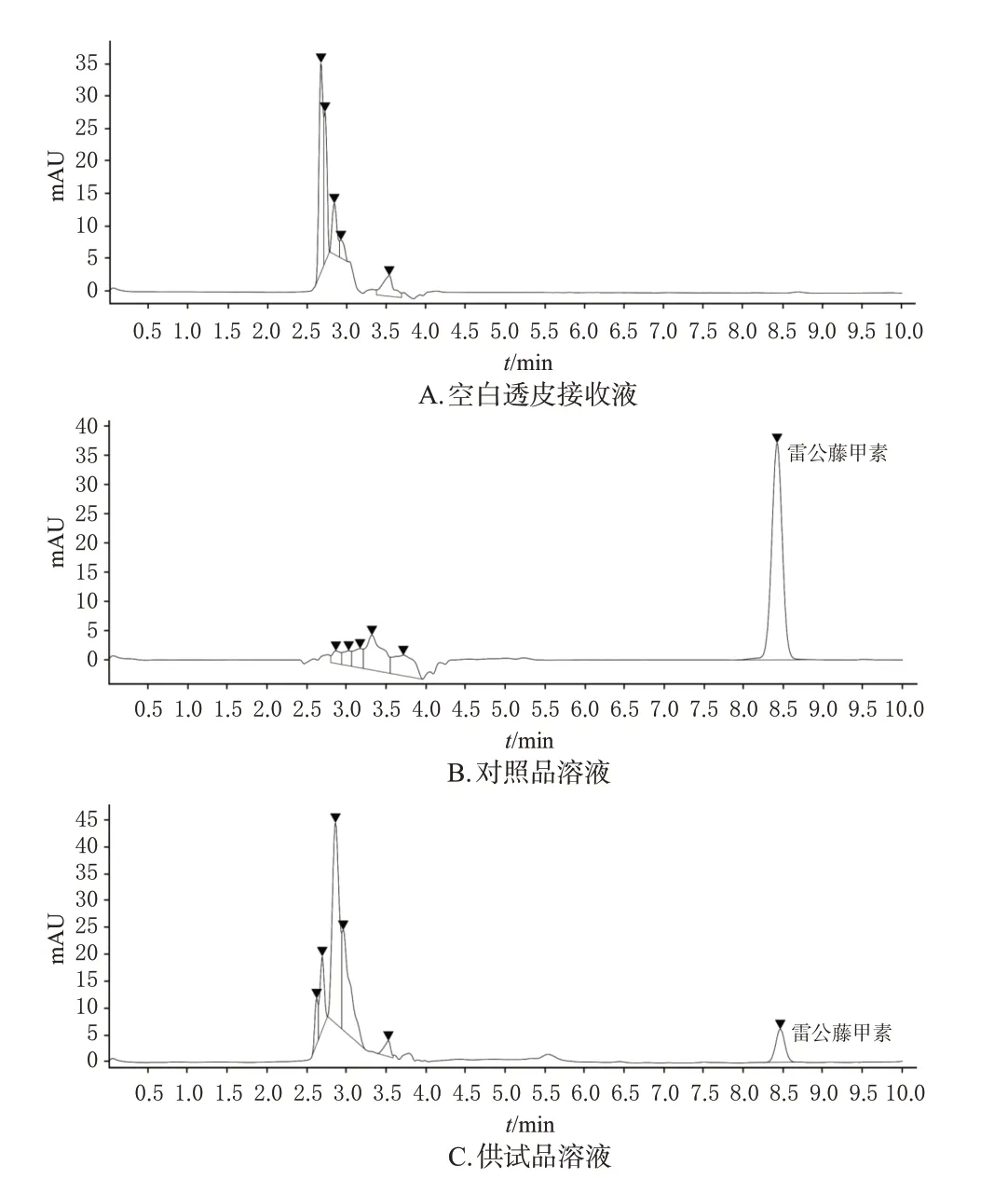
图1 专属性考察的高效液相色谱图
2.3 乳膏的制备及质量评价
2.3.1 乳膏的制备
根据本课题组前期研究结果[13-14]及制备乳膏的经验,并结合预实验结果,分别制备空白乳膏、雷公藤甲素乳膏、雷公藤甲素配伍川芎挥发油质量比为1∶10、1∶50、1∶100(以下分别简称“配伍1∶10”“配伍1∶50”“配伍1∶100”)的乳膏。
2.3.2 乳膏质量评价
(1)离心稳定性:称取空白乳膏和雷公藤甲素乳膏及配伍乳膏各1 g,以3 500 r/min离心30 min,结果显示,该条件下空白乳膏和雷公藤甲素乳膏及配伍乳膏均未见分层破乳现象。(2)耐寒、耐热性评价:分别称取空白乳膏和雷公藤甲素乳膏及配伍乳膏各1 g,置于EP管中,分别在45、4、-20 ℃的条件下放置24 h,结果显示,上述寒热条件均不会对乳膏产生影响。(3)含药量:称取雷公藤甲素乳膏和配伍1∶10、配伍1∶50、配伍1∶100乳膏各1 g,置于10 mL容量瓶中,加甲醇定容后涡旋、超声使溶解,过0.22 μm微孔滤膜后按“2.2.2”项下色谱条件进行含量测定,每份样品平行制样3份。结果显示,雷公藤甲素乳膏和配伍1∶10、配伍1∶50、配伍1∶100乳膏中雷公藤甲素的含药量分别为(211.0±9.2)、(209.8±7.8)、(213.6±6.8)、(217.5±10.3)μg/g(n=3)。
2.4 川芎挥发油对雷公藤甲素体外透皮性能的影响
2.4.1 小鼠离体皮肤的制备
取雄性KM小鼠30只,适应性喂养3 d,腹腔注射50 mg/kg戊巴比妥钠溶液麻醉,脱毛后取下腹皮,用生理盐水和棉球去除皮肤上多余的脂肪和淋巴组织,用螺旋测微仪测量皮肤厚度后迅速放入-20 ℃冰箱中保存备用。
2.4.2 乳膏体外透皮实验
从-20 ℃冰箱中取出小鼠离体皮肤,置于37 ℃生理盐水中解冻10 min,冲洗干净后用滤纸吸干水分,将小鼠皮肤固定于Franz扩散池中的供给池和接收池之间,再向接收池中注入20%乙醇生理盐水作为接收液,排尽气泡后用封口膜密封,调节扩散池温度为(37.0±0.2)℃,以350 r/min平衡30 min。将小鼠皮肤分为雷公藤甲素组和配伍1∶10、配伍1∶50、配伍1∶100组,分别取雷公藤甲素乳膏和配伍1∶10、配伍1∶50、配伍1∶100乳膏各0.2 g置于供给池中并确保乳膏和各组皮肤充分接触(每组平行6份),分别于4、6、8、10、12、24 h时抽取接收液1 mL,并补充同体积同温度的空白接收液。将取出的接收液按“2.2.1”项下方法制备供试品溶液,再按“2.2.2”项下色谱条件进样测定,并按照如下公式计算各时间点的单位面积累计透皮量(Qn):Qn=,式中,A为扩散池的有效扩散面积,V为接收液总体积,Cn为第n次取样时接收液中的药物浓度,Ci为第i次取样时接收液中的药物浓度,Vi为第i次取样体积。以Qn对时间(t)作线性回归,所得斜率即为雷公藤甲素的透皮吸收速率(Jss)。分别采用零级动力学、一级动力学、Higuchi方程对释放过程进行拟合,并计算决定系数(R2)。采用Graph Pad Prism 5.0和SPSS 22.0软件进行数据分析,计量数据以±s表示;多组间比较采用单因素方差分析,组间进一步两两比较时采用LSD-t检验,检验水准α=0.05。
结果显示,24 h内雷公藤甲素组和配伍1∶10、配伍1∶50、配伍1∶100组雷公藤甲素的Qn分别为(21.98±0.13)、(26.87±0.36)、(31.46±1.08)、(18.51±1.95)μg/cm2(n=6),Jss分别为1.058、1.171、2.950、0.748/[μg/(cm2·h)]。与雷公藤甲素组比较,配伍1∶10组和配伍1∶50组24 h内雷公藤甲素的Qn(P<0.01)和Jss有所升高;配伍1∶100组的Qn(P<0.05)和Jss有所下降。各组雷公藤甲素的24 h累计渗透曲线见图2。以Q24h对t进行拟合,结果显示雷公藤甲素组的体外透皮释放过程符合零级方程和Higuchi方程,配伍1∶10组和配伍1∶100组的体外透皮释放过程更符合一级动力方程,而配伍1∶50组中雷公藤甲素的体外透皮释放过程则更符合Higuchi方程。拟合结果见表2。
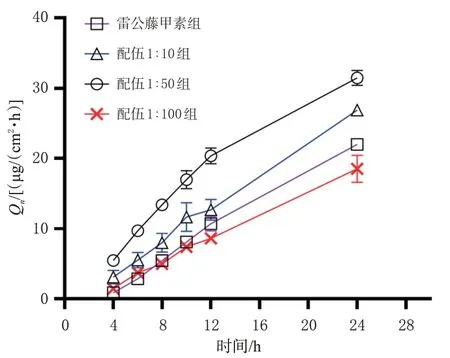
图2 各组雷公藤甲素24 h累计渗透曲线
表2 各组经皮渗透实验数据拟合结果(±s,n=6)
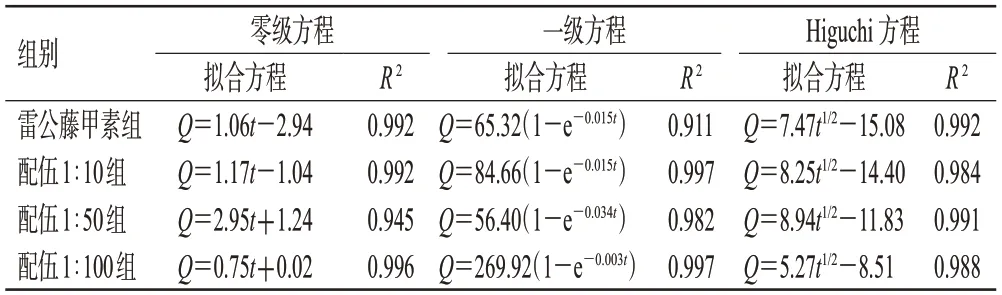
表2 各组经皮渗透实验数据拟合结果(±s,n=6)
组别雷公藤甲素组配伍1∶10组配伍1∶50组配伍1∶100组零级方程拟合方程Q=1.06t-2.94 Q=1.17t-1.04 Q=2.95t+1.24 Q=0.75t+0.02 R 2 R 2 R 2 0.992 0.992 0.945 0.996一级方程拟合方程Q=65.32(1-e-0.015t)Q=84.66(1-e-0.015t)Q=56.40(1-e-0.034t)Q=269.92(1-e-0.003t)0.911 0.997 0.982 0.997 Higuchi 方程拟合方程Q=7.47t1/2-15.08 Q=8.25t1/2-14.40 Q=8.94t1/2-11.83 Q=5.27t1/2-8.51 0.992 0.984 0.991 0.988
2.5 川芎挥发油配伍雷公藤甲素对HaCat细胞毒性的影响
2.5.1 细胞培养
用含10%胎牛血清和含青霉素、链霉素的DMEM高糖培养基在37 ℃含5% CO2的培养箱中培养,待细胞生长至状态稳定后,取对数生长期、生长状态稳定的细胞进行后续实验。
2.5.2 细胞毒性实验
细胞毒性采用CCK-8法进行检测。
(1)川芎挥发油和雷公藤甲素对HaCat细胞毒性的影响:取生长状态稳定的对数生长期HaCat细胞,制备成密度为9×104个/mL的悬液,以S型接种于96孔板中,每孔200 μL,待细胞融合至80%~90%,弃去完全培养液,用不含钙镁的Hanks’平衡盐溶液清洗2遍,根据课题组前期实验和预实验结果,分别用质量浓度为10、18、20、36、72、144、272、544 ng/mL的雷公藤甲素和1.155、5.75、11.55、115.5、1 150 μg/mL的川芎挥发油溶液处理细胞24 h,每个浓度设置6个复孔,另设不加药物但加细胞的对照组和不加药物、不加细胞的空白组。处理24 h后,吸去96孔板中的药物,用不含钙镁的Hanks’平衡盐溶液清洗,加入含10%CCK-8的基础培养基溶液,每孔100 μL,将细胞置培养箱中孵育2 h后,置于酶标仪中检测其在450 nm波长处的光密度(OD)值,并按公式计算细胞存活率:细胞存活率=(给药组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。结果显示,当雷公藤甲素质量浓度为20 ng/mL时、川芎挥发油质量浓度为11.55 μg/mL时,细胞存活率均大于90%,说明该浓度下二者单独给药均不会对HaCat细胞产生毒副作用,但随着给药浓度增大,HaCat细胞的存活率逐渐降低,结果见图3。
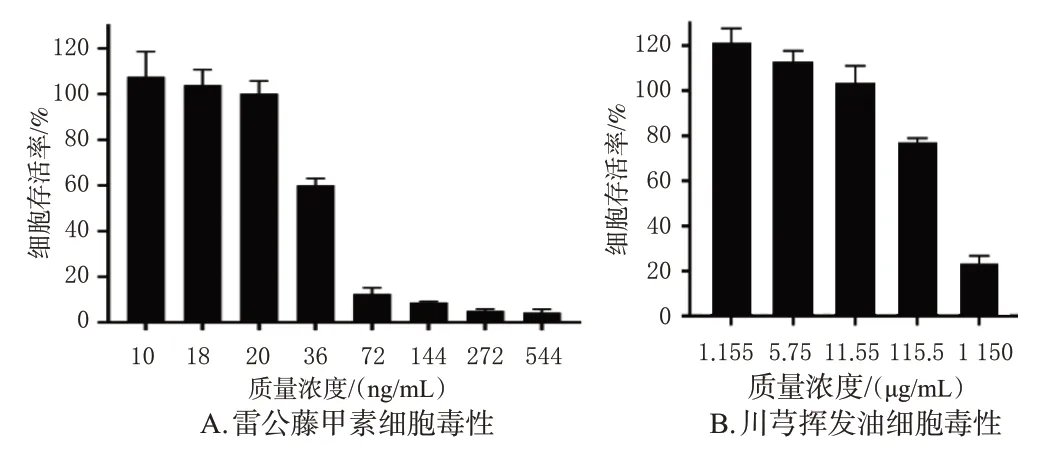
图3 雷公藤甲素和川芎挥发油对HaCat细胞毒性的影响
(2)川芎挥发油和雷公藤甲素配伍对HaCat细胞毒性的影响:按“2.5.2”(1)项下方法铺板及培养细胞,再以雷公藤甲素质量浓度为18、36、72、144 ng/mL分别配伍川芎挥发油1∶10、1∶50、1∶100处理细胞并测定OD值后计算细胞存活率。结果,与雷公藤甲素组比较,雷公藤甲素质量浓度在36、72、144 ng/mL时,配伍1∶10组和配伍1∶50组可以显著提高HaCat细胞的存活率(P<0.05或P<0.01),而配伍1∶100组细胞的存活率反而降低,但差异无统计学意义(P>0.05)。结果见图4。
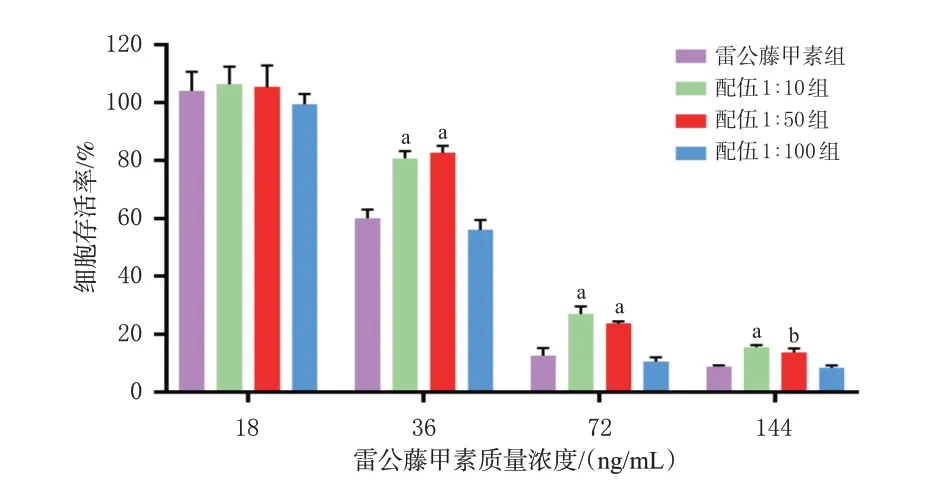
图4 川芎挥发油和雷公藤甲素配伍前后对HaCat细胞毒性的影响
3 讨论
雷公藤甲素作为雷公藤的主要活性成分,虽然临床口服治疗疾病的效果确切、疗效显著,但严重的肝肾毒性使其开发利用受到了极大的限制。本课题组前期制备雷公藤甲素外用制剂时发现,采用经皮给药方式可以在发挥疗效的同时显著降低雷公藤甲素的肝肾毒性,但用于大鼠时出现了一定的皮肤毒性和皮肤屏障问题[15]。为进一步开发雷公藤甲素外用制剂并降低皮肤毒性,本课题组通过制备不同的载雷公藤甲素纳米制剂进行经皮渗透性和皮肤毒性研究,结果发现,纳米制剂虽然可以促进雷公藤甲素的透皮吸收,但外用给药时会造成一定的皮肤损伤[16-17]。川芎挥发油作为川芎的主要活性成分,其不仅可以提高皮肤抗氧化能力,减少皮肤氧化损伤,还常作为药物促渗剂与药物协同发挥疗效[18]。本次体外透皮实验研究显示,配伍1∶10和1∶ 50组的雷公藤甲素的Jss和Qn均高于雷公藤甲素组,表明配伍川芎挥发油可以显著提高雷公藤甲素的经皮渗透性,其原因可能是川芎挥发油通过改变皮肤角质层有序致密的结构和角质层脂质来增加其流动性,进而降低皮肤屏障功能。但当配伍比例提高至1∶100时,川芎挥发油又会对雷公藤甲素的透皮吸收产生一定的抑制作用,原因可能是雷公藤甲素在高剂量川芎挥发油中的亲和性增加,使药物在皮肤的接触界面(角质层)和药物进入角质层后的活性表皮界面的分配系数发生改变,使皮肤表面浓度下降,导致Jss和Qn下降。
本研究在细胞毒性研究中发现,随着药物浓度的增加,单独给予川芎挥发油和雷公藤甲素均会使HaCat细胞的存活率降低;而与雷公藤甲素比较,配伍1∶10和1∶50可以显著提高HaCat细胞的存活率(P<0.05),原因可能是川芎挥发油可通过介导内质网和线粒体功能来发挥氧化损伤保护作用;当配伍比例达到1∶100时,细胞存活率略低于单独给予雷公藤甲素组,推测原因可能是当川芎挥发油和雷公藤甲素同时达到一定浓度后,二者会协同损伤细胞。
本实验仍存在诸多不足,例如只参考了文献和课题组前期经验,选择小鼠下腹皮和20%乙醇生理盐水作为透皮接收介质来进行实验,并未对其他动物皮肤进行比较研究,也没有系统地进行接收介质的筛选[19-20]。同时,在乳膏的制备及评价中,本研究只参考了前期的制备经验,并未进行系统的理化性质评价,后续本课题组将重点进行在体皮肤刺激性研究。
综上所述,雷公藤甲素与川芎挥发油的配伍比例为1∶10和1∶50时可以促进雷公藤甲素的透皮吸收,降低雷公藤甲素对HaCat细胞的毒性。
