山茱萸新苷对糖尿病肾病模型小鼠的保护作用及机制Δ
2024-03-04王威甘啸阳许惠琴朱逸晖束安梅富莹雪喻斌吕高虹南京中医药大学药学院江苏省中药药效与安全性评价重点实验室南京210023
王威,甘啸阳,许惠琴 ,朱逸晖,束安梅,富莹雪,喻斌,吕高虹(南京中医药大学药学院/江苏省中药药效与安全性评价重点实验室,南京 210023)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病严重的微血管并发症之一,也是许多患者进展至终末期肾病(end-stage renal disease,ESRD)的主要原因。DN由多种因素相互作用所致,其中高血糖、高血压和遗传因素是关键[1]。DN的主要特征包括肾小球肥大、超滤,基底膜增宽,肾小管间质纤维化和肾小球硬化等,临床主要表现为不同程度的蛋白尿[2]。近年来,我国DN发病率大幅上升,常规疗法虽然有效,但仍有大部分患者会进展为ESRD,给其家庭和社会带来了巨大的医疗负担。因此,提高对DN发病机制的认识并开发有效的治疗药物十分必要。
肾脏功能障碍和炎症反应是DN的2个主要发病机制,蛋白尿及肾小球间质纤维化是DN的重要标志[3]。晚期糖基化终末产物(advanced glycation end products,AGEs)在DN的病理生理过程中具有重要作用[4]。研究指出,AGEs与其受体(the receptor of advanced glycation end products,RAGE)结合而引发的氧化应激和炎症反应最终会导致肾功能丧失[5]。由于肾脏是一种生物能量需求较高的器官,高血糖可使其小动脉和微血管发生玻璃样变性和纤维蛋白样变性,从而导致肾线粒体受损、肾小管上皮细胞生物能量缺失,最终造成间质纤维化伴肾小管萎缩和肾小球硬化[6];同时,单核-巨噬细胞浸润及活化产生的炎症因子又可进一步引起肾脏固有细胞损伤,进而加速DN的进展[7-8]。
山茱萸新苷(cornuside,分子式C24H30O14)是一种山茱萸环烯醚萜苷类化合物,可抑制大鼠辅助性T细胞17(T helper cell 17,Th17)浸润中枢神经系统,从而改善自身免疫性脑脊髓炎[9];同时,该化合物可抑制核因子κB(nuclear factor kappa-B,NF-κB)向核内转移,降低其转录活性,并减少其下游炎症因子[如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)]分泌,从而抑制肥大细胞参与的炎症变态反应[10]。本课题组前期实验发现,山茱萸新苷可抑制AGEs诱导的小鼠肾系膜细胞增殖,但其能否改善DN尚不明确。基于此,本研究以DN模型小鼠为对象,基于AGEs/RAGE信号通路初步探讨山茱萸新苷对DN模型小鼠的保护作用及潜在机制,以期为山茱萸新苷在DN治疗中的应用提供参考。
1 材料
1.1 主要仪器
Contour TS型血糖仪购自拜耳医药保健有限公司;Bio-Rad 164-5050型凝胶电泳仪购自美国Bio-Rad公司;Image Quant LAS 4000 mini型凝胶成像仪购自美国GE公司;BX41型显微镜购自日本OLYMPUS公司;BioTek Synergy-HT型酶标仪购自美国BioTek公司;Direct-Q型超纯水仪购自美国Millipore公司。
1.2 主要药品与试剂
山茱萸新苷对照品(批号S-125-190404,纯度>98%)购自成都瑞芬思生物科技有限公司;氨基胍原料药(阳性对照,批号079K1734V,纯度100%)购自美国Sigma公司;小鼠尿蛋白检测试剂盒(批号20190619)、小鼠血清肌酐(serum creatinine,Scr)检测试剂盒(批号20191008)均购自南京建成生物工程研究所;血糖试纸购自拜耳医药保健有限公司;小鼠血清尿素氮(blood urea nitrogen,BUN)、IL-12和IL-10酶联免疫吸附测定(ELISA)试剂盒(批号均为201909)均购自上海酶联生物科技有限公司;兔源RAGE、Ⅳ型胶原(collagen typeⅣ,COL-Ⅳ)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)多克隆抗体(批号分别为GR316801-2、GR269410-2、GR3174950-9)均购自英国Abcam公司;兔源β-肌动蛋白(β-actin)多克隆抗体(批号AA1217B8088 ZJ2)购自美国BioWorld公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗(批号7074P2)购自美国CST公司;ECL发光液(批号1819702)购自美国Millipore公司;RIPA组织/细胞裂解液、2.5%Gluta固定液、10%中性福尔马林固定液(批号分别为R0020、20190820、20190822)均购自北京索莱宝科技有限公司;免疫组化检测试剂盒(批号PH1698)购自上海迈新生物技术有限公司;二甲苯(批号CB0130912)购自南京化学试剂有限公司。
1.3 实验动物与饲料
SPF级雄性KK-Ay小鼠18只[8~10周龄,体重(28±2)g]、SPF级雄性C57BL/6J小鼠6只[8~10周龄,体重(22±2)g]和高脂高糖饲料均购自北京华阜康生物科技股份有限公司,实验动物生产许可证号为SCXK(京)2019-0008。普通饲料购自南京青龙山动物繁殖场。本实验方案经南京中医药大学实验动物伦理委员会审批(申请号201903A019)。
2 方法
2.1 动物分组与给药
取KK-Ay小鼠,用高脂高糖饲料喂养2周,以空腹血糖(fasting blood glucose,FBG)≥10 mmol/L、24 h尿蛋白较C57BL/6J小鼠升高超过10倍为DN模型建立成功的判定标准[11]。将造模成功的小鼠随机分为模型组、氨基胍组(阳性对照,100 mg/kg)、山茱萸新苷组(100 mg/kg),并以C57BL/6J小鼠作为正常组,每组6只。各药物组剂量参考本课题组前期研究结果设置,并以10 mL/kg的容积灌胃[12];正常组和模型组灌胃等体积生理盐水;每天1次,连续8周。
2.2 小鼠FBG和24 h尿蛋白水平检测
分别在给药后第0、4、8周,禁食12 h后采集各组小鼠尾静脉血适量,使用血糖仪检测其FBG;通过代谢笼收集其24 h尿液,离心,取上清液,参照尿蛋白试剂盒说明书方法以酶标仪检测其24 h尿蛋白水平。
2.3 小鼠血清中IL-12、IL-10、BUN、Scr水平检测
在给药后第8周,于小鼠眼眶取血,静置0.5 h后,以3 000 r/min离心15 min,分离上层血清,参照相应试剂盒说明书方法以酶标仪检测小鼠血清中炎症因子(IL-12、IL-10)和肾功能指标(BUN、Scr)水平。
2.4 小鼠肾脏病理损伤形态学和纤维化水平观察
于眼眶取血后,脱颈椎处死各组小鼠,分离肾脏并横切左侧肾皮质适量,置于10%中性福尔马林固定液中固定,脱水,用石蜡常规包埋后切片,分别进行苏木精-伊红(HE)、Masson染色,置于显微镜下观察其肾皮质的病理损伤和纤维化改变。
2.5 小鼠肾小球微观结构观察
采用透射电镜进行观察。取各组小鼠左侧肾皮质适量,在2.5%Gluta固定液中固定,分别用50%、70%、80%、90%、100%丙酮梯度脱水,用环氧树脂包埋后切片,再进行枸橼酸铅-醋酸铀染色,置于透射电镜下观察其肾小球微观结构。
2.6 小鼠肾皮质中RAGE蛋白阳性表达检测
采用免疫组化法进行检测。取“2.4”项下各组小鼠的肾皮质切片,置于二甲苯中固定20 min×2次以脱蜡,再依次用无水乙醇、95%乙醇、85%乙醇、70%乙醇脱水,每次5 min;用水冲洗,采用柠檬酸钠缓冲液进行抗原修复;用磷酸盐缓冲液(PBS)清洗5 min×3次,用3%过氧化氢溶液覆盖切片20 min进行内源性过氧化物酶灭活,再以牛血清白蛋白室温封闭1 h;加入RAGE一抗(稀释度1∶100),于4 ℃下孵育过夜;用PBS清洗2 min×3次,加入相应二抗(稀释度1∶100),于室温下孵育1 h;用PBS清洗5 min×3次,加入DAB显色;用水冲洗,苏木精复染2 min;用水冲洗,经乙醇脱水、二甲苯透明后,使用中性树脂封片,置于显微镜下观察RAGE蛋白阳性表达(呈棕黄色)情况,利用Image J软件对其荧光强度进行定量分析。
2.7 小鼠肾皮质中RAGE、COL-Ⅳ、iNOS蛋白表达检测
采用Western blot法进行检测。在冰上剪取各组小鼠的肾皮质适量,置于10 mL离心管中,加入裂解液1 mL,匀浆裂解多次后,于4 ℃下以12 000 r/min离心10 min,收集上清液,以BCA法进行定量;将上清液与5×蛋白上样缓冲液以体积比4∶1混合后,于95 ℃煮沸变性5 min;取变性蛋白适量,进行聚丙烯酰胺凝胶电泳后转移至聚偏二氟乙烯膜上,以含5%牛血清白蛋白的封闭液室温封闭2 h;加入RAGE、COL-Ⅳ、iNOS、β-actin一抗(稀释度1∶1 000),于4 ℃下孵育过夜;用PBST缓冲液清洗3次,加入相应二抗(稀释度1∶2 000),室温孵育2 h;以ECL发光液显色后,置于凝胶成像仪下成像。以β-actin为内参,利用Image J软件分析各目标蛋白的表达量。
2.8 统计学方法
采用SPSS 22.0软件对数据进行统计分析。数据以±s表示,多组间采用单因素方差分析,进一步两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 山茱萸新苷对DN模型小鼠FBG和24 h尿蛋白水平的影响
与正常组比较,模型组小鼠给药后第0、4、8周的FBG和24 h尿蛋白水平均显著升高(P<0.01)。与模型组小鼠比较,各药物组小鼠给药后第4、8周的FBG(氨基胍组给药后第4周除外)、24 h尿蛋白均显著下降(P<0.05或P<0.01)。结果见表1。
表1 山茱萸新苷对DN模型小鼠FBG和24 h尿蛋白水平的影响(±s,n=6)
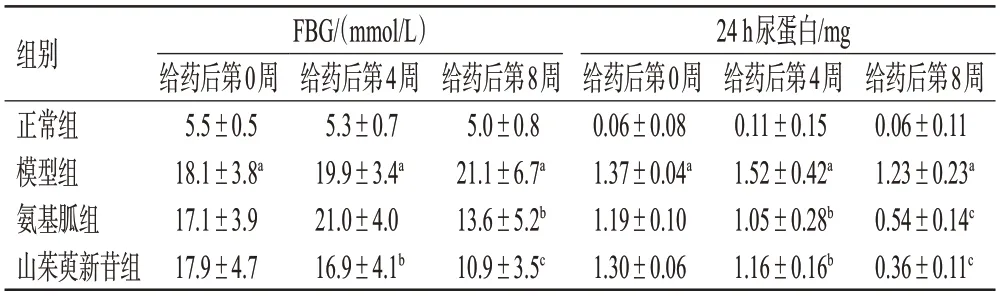
表1 山茱萸新苷对DN模型小鼠FBG和24 h尿蛋白水平的影响(±s,n=6)
a:与正常组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01。
组别正常组模型组氨基胍组山茱萸新苷组FBG/(mmol/L)24 h尿蛋白/mg给药后第8周0.06±0.11 1.23±0.23a 0.54±0.14c 0.36±0.11c给药后第0周5.5±0.5 18.1±3.8a 17.1±3.9 17.9±4.7给药后第4周5.3±0.7 19.9±3.4a 21.0±4.0 16.9±4.1b给药后第8周5.0±0.8 21.1±6.7a 13.6±5.2b 10.9±3.5c给药后第0周0.06±0.08 1.37±0.04a 1.19±0.10 1.30±0.06给药后第4周0.11±0.15 1.52±0.42a 1.05±0.28b 1.16±0.16b
3.2 山茱萸新苷对DN模型小鼠血清中IL-12、IL-10、BUN、Scr水平的影响
与正常组比较,模型组小鼠血清促炎因子IL-12、BUN、Scr水平均显著升高,抗炎因子IL-10水平显著降低(P<0.01);与模型组比较,各药物组小鼠血清IL-12、BUN、Scr水平均显著降低,IL-10水平均显著升高(P<0.01)。结果见表2。
表2 山茱萸新苷对DN模型小鼠血清中IL-12、IL-10、BUN、Scr水平的影响(±s,n=6)
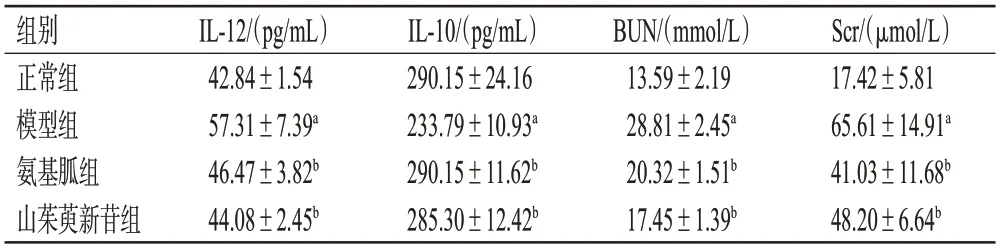
表2 山茱萸新苷对DN模型小鼠血清中IL-12、IL-10、BUN、Scr水平的影响(±s,n=6)
a:与正常组比较,P<0.01;b:与模型组比较,P<0.01。
组别正常组模型组氨基胍组山茱萸新苷组IL-12/(pg/mL)42.84±1.54 57.31±7.39a 46.47±3.82b 44.08±2.45b IL-10/(pg/mL)290.15±24.16 233.79±10.93a 290.15±11.62b 285.30±12.42b BUN/(mmol/L)13.59±2.19 28.81±2.45a 20.32±1.51b 17.45±1.39b Scr/(μmol/L)17.42±5.81 65.61±14.91a 41.03±11.68b 48.20±6.64b
3.3 山茱萸新苷对DN模型小鼠肾皮质病理损伤和纤维化改变的影响
与正常组比较,模型组小鼠肾皮质中肾小球系膜基质明显增厚并出现空泡变性,部分间质区域可见明显的炎症细胞浸润。与模型组比较,各药物组小鼠肾皮质中肾小球结构较为完整,肾小球系膜基质增生程度减轻,间质内炎症细胞浸润有所减少。结果见图1。
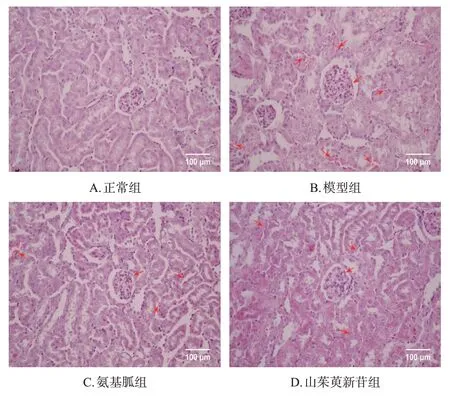
图1 山茱萸新苷对DN模型小鼠肾皮质病理损伤影响的显微图(HE染色)
与正常组比较,模型组小鼠肾皮质纤维阳性染色细胞明显增加,提示小鼠肾皮质胶原沉积增多,间质纤维化水平升高。与模型组比较,各药物组小鼠肾皮质纤维阳性染色细胞有所减少,表明小鼠肾皮质胶原沉积减少,间质纤维化水平降低。结果见图2。
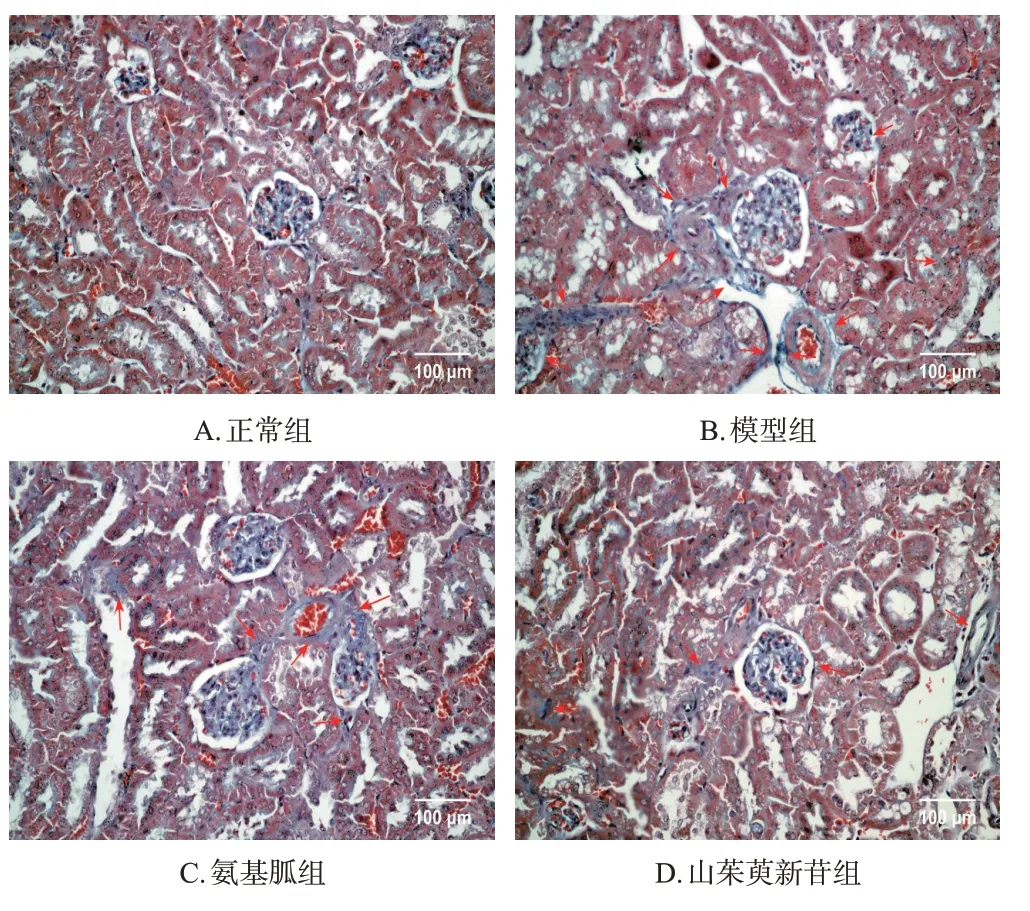
图2 山茱萸新苷对DN模型小鼠肾皮质纤维化改变影响的显微图(Masson染色)
3.4 山茱萸新苷对DN模型小鼠肾小球微观结构的影响
与正常组比较,模型组小鼠肾小球系膜增生严重且基质增多,基底膜增厚并可见大量不规则块状暗色致密物沉积。与模型组比较,各药物组小鼠肾小球系膜细胞增生减少,基底膜增厚现象有所缓解,不规则块状致密物沉积有所减少。结果见图3。
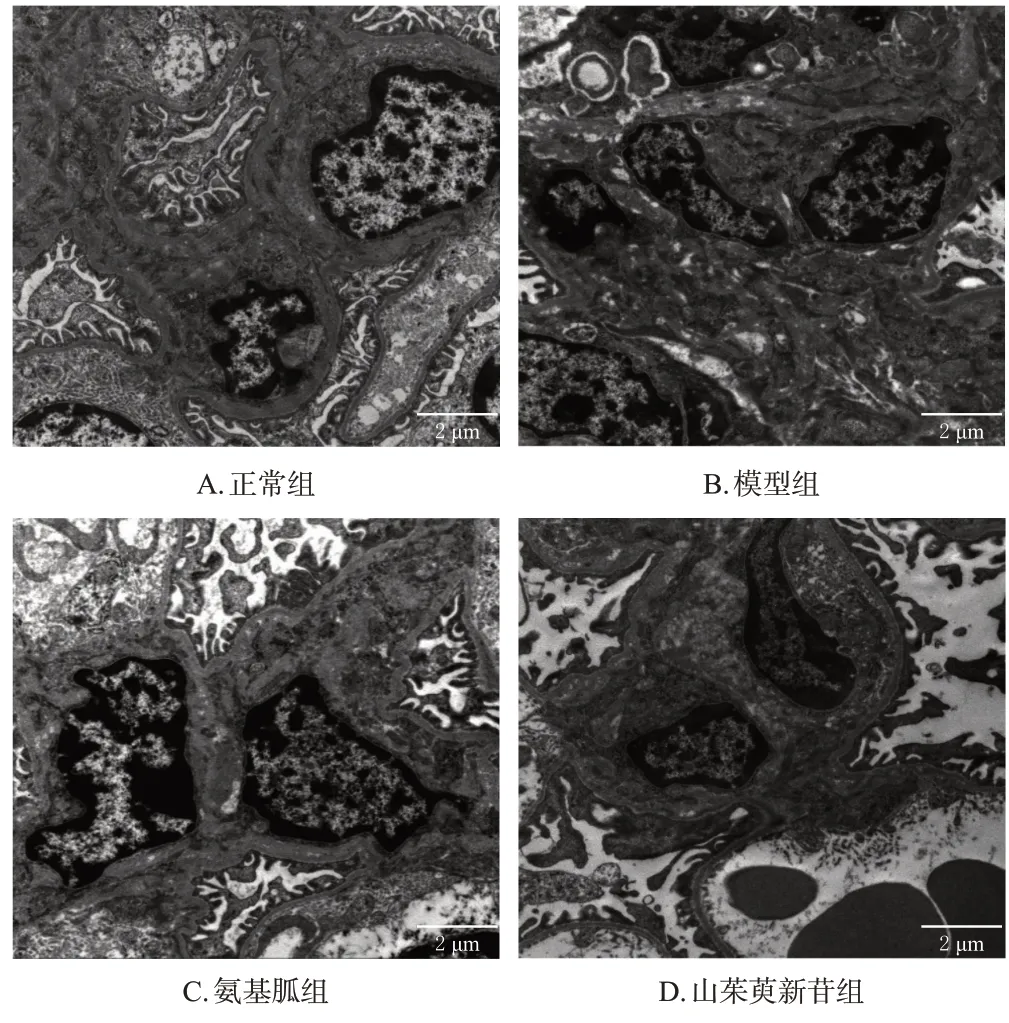
图3 山茱萸新苷对DN模型小鼠肾小球微观结构影响的显微图(透射电镜)
3.5 山茱萸新苷对DN模型小鼠肾皮质中RAGE蛋白阳性表达的影响
与正常组比较,模型组小鼠肾皮质中RAGE蛋白阳性表达明显增多,其荧光强度显著增强(P<0.01)。与模型组比较,各药物组小鼠肾皮质中RAGE蛋白阳性表达明显减少,其荧光强度均显著减弱(P<0.05)。结果见图4、表3。
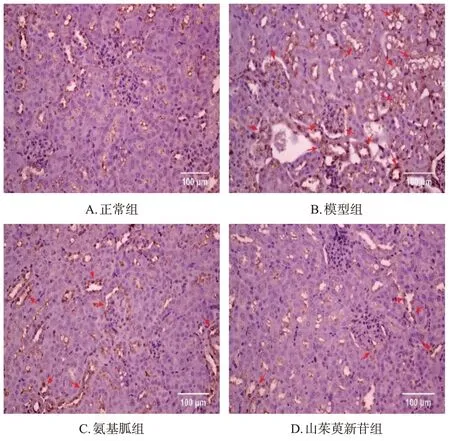
图4 山茱萸新苷对DN模型小鼠肾皮质中RAGE蛋白阳性表达影响的显微图(免疫组化法)
表3 山茱萸新苷对DN模型小鼠肾皮质中RAGE、COL-Ⅳ、iNOS蛋白表达的影响(±s,n=6)
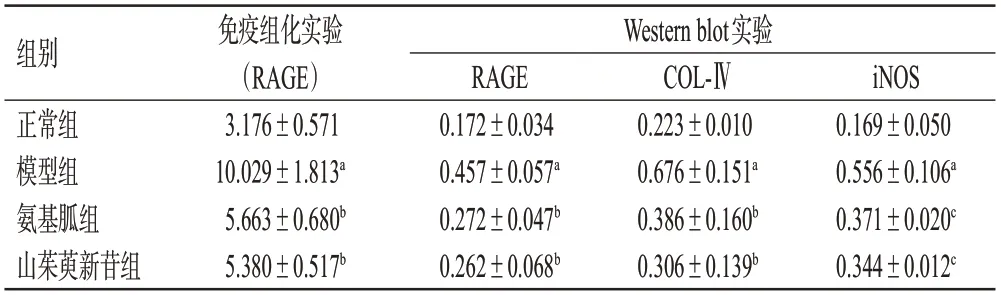
表3 山茱萸新苷对DN模型小鼠肾皮质中RAGE、COL-Ⅳ、iNOS蛋白表达的影响(±s,n=6)
a:与正常组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01。
组别正常组模型组氨基胍组山茱萸新苷组免疫组化实验(RAGE)3.176±0.571 10.029±1.813a 5.663±0.680b 5.380±0.517b Western blot实验iNOS 0.169±0.050 0.556±0.106a 0.371±0.020c 0.344±0.012c RAGE 0.172±0.034 0.457±0.057a 0.272±0.047b 0.262±0.068b COL-Ⅳ0.223±0.010 0.676±0.151a 0.386±0.160b 0.306±0.139b
3.6 山茱萸新苷对DN模型小鼠肾皮质中RAGE、COL-Ⅳ、iNOS蛋白表达的影响
与正常组比较,模型组小鼠肾皮质中RAGE、COL-Ⅳ、iNOS蛋白的表达量均显著升高(P<0.01)。与模型组比较,各药物组小鼠肾皮质中RAGE、COL-Ⅳ、iNOS蛋白的表达量均显著降低(P<0.05或P<0.01)。结果见图5、表3。

图5 山茱萸新苷对DN模型小鼠肾皮质中RAGE、COL-Ⅳ、iNOS蛋白表达影响的电泳图
4 讨论
随着生活水平的提高和饮食结构的改变,DN的发病率逐年增高。DN的典型病理特征是蛋白尿,其发生、发展与肾小球滤过屏障的结构完整性和肾功能的改变密切相关[13]。COL-Ⅳ是一种主要分布在基底膜区域内的胶原蛋白,其在肾小球和系膜沉积中表达增加所导致的细胞外基质(extracellular matrix,ECM)堆积可能与肾损伤程度呈正相关[14-15]。长期高血糖环境会引起肾小管细胞、肾小球内皮细胞等发生炎症反应,其表现包括分泌单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1),激活、促进巨噬细胞向肾脏募集,分泌IL-12、TNF-α、iNOS等炎症因子,最终诱发DN炎症损伤;同时,肾功能受损与炎症反应共同作用,进一步加速了DN的进展[16-17]。
中医药在DN的治疗中具有悠久的历史和显著的疗效,以滋阴清热、补肾健脾、益气养阴为主要治则。山茱萸味酸涩、性微温,具有平补肾阴阳、涩精固脱的功效,在《金匮要略》“肾气丸”、《医学衷中参西录》“滋膵饮”等方中均有使用,可主治“消渴证”。本课题组前期研究发现,山茱萸环烯醚萜苷类成分马钱苷可通过抑制AGEs/RAGE信号通路来保护肾功能,并可减少ECM堆积和糖原沉积,抑制足细胞凋亡[18];同时,本课题组前期也初步证实了另一山茱萸环烯醚萜苷类成分山茱萸新苷对AGEs的抑制作用。氨基胍是一种非酶糖基化AGEs抑制剂,可通过阻碍AGEs的形成来延缓DN进展,可改善DN模型大鼠肾脏炎症反应和纤维化水平[19],故本研究将其作为阳性对照药物。基于对DN发病机制和山茱萸新苷抗炎特性的认识,本研究以C57BL/6J小鼠为对照,以KK-Ay小鼠(C57BL/6J小鼠与KK轻度肥胖型2型糖尿病小鼠杂交并近亲繁殖所得)构建DN小鼠模型,评价该成分对小鼠的保护作用。结果显示,山茱萸新苷可下调模型小鼠体内促炎因子IL-12的分泌和iNOS的表达,上调抗炎因子IL-10的分泌,减轻其肾脏炎症反应;除发挥抗炎作用外,山茱萸新苷还可显著减少模型小鼠的尿蛋白水平和COL-Ⅳ在肾皮质中的沉积,下调Scr、BUN水平,缓解肾纤维化,减轻肾病理损伤。
AGEs/RAGE信号通路在DN的发病机制中具有核心作用[20]。其中,RAGE蛋白参与多条通路(磷脂酰肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素、丝裂原激活蛋白激酶/细胞外信号调节激酶等通路)的信号转导,可通过刺激各种信号级联而促进促炎因子的产生,继而造成肾小球肥大、系膜基质积聚、足细胞丢失和蛋白尿发生,促进肾脏炎症和纤维化的发生发展,导致肾结构扭曲,最终导致肾功能丧失[21]。为了进一步探讨山茱萸新苷能否通过影响AGEs/RAGE信号通路干预DN,本研究检测了DN模型小鼠肾皮质中RAGE蛋白的表达情况。结果显示,山茱萸新苷可下调DN模型小鼠肾皮质中RAGE蛋白的表达,初步验证其对DN模型小鼠的保护作用可能是通过抑制AGEs/RAGE信号通路激活实现的。
综上所述,山茱萸新苷对DN模型小鼠具有一定的保护作用,可抑制其体内炎症反应,降低小鼠尿蛋白水平,缓解肾脏纤维化;上述作用可能与抑制AGEs/RAGE信号通路有关。
